I. 서 론
지방간이란 간 조직에 중성 지방이 간 무게의 5% 이상 과다하게 축적된 경우를 말하며, 유발 원인 중 당뇨, 비만, 고지혈증 등의 대사 이상에 의해 발병된 경우를 비알코올성 지방간 질환(Non-alcoholic fatty liver disease)이라고 한다1,2. 비알코올성 지방간 질환은 단순 지방간증(hepatic steatosis)과 함께 지방간염(steatohepatitis), 간섬유화(hepatic fibrosis), 간경변증(liver cirrhosis)에 이르는 보다 넓은 의미의 개념으로 사용되고 있다3.
2004년 우리나라의 비알코올성 지방간 질환 유병률은 11.5%였으나, 2010년 23.6%로 대략 2배 정도로 증가하였다4. 간 조직에 비가역적인 손상을 유발할 수 있다는 점과 더불어 우리나라에서의 유병률도 급증하고 있어 비알코올성 지방간 질환 치료의 중요성이 점차 대두되고 있다.
이러한 상황에서 인슐린 감작제, 지질 저하제, 항산화제 등 다양한 약물이 비알코올성 지방간 질환 치료제로 활용되고 있으나, 표준 치료로 공인된 것은 아직까지 없다5. 다만 비만, 고지혈증 및 인슐린 저항성이 비알코올성 지방간 질환의 발병 원인으로 작용하므로2, 치료를 위해서는 식이조절과 운동 등을 통한 생활습관 개선이 요구된다6.
비알코올성 지방간 질환은 한의학적으로 濕痰의 대사 장애로 기인된다고 보고 있으며, 그에 따라 淸熱利濕, 健脾消導 或 消痰除濕의 치법을 활용한다7.
중만분소환은 元代 李杲의 ≪蘭室祕藏≫8에 최초로 수록된 처방으로, 그 뒤 ≪醫學入門≫9을 비롯한 여러 후세 의서10-14에서 中滿, 鼓脹, 氣脹, 水脹, 熱脹의 치료에 활용되었다. 중만분소환은 의서마다 본초 구성에 약간의 차이는 있지만 黃芩(酒炒), 厚朴, 黃連, 枳實, 半夏(薑製) 澤瀉 陳皮 知母 人蔘 白朮 薑黃 砂仁 乾薑 茯苓 豬苓 甘草 등의 본초로 구성되어 있다8-14. 즉, 補氣健脾 및 祛痰의 효능이 있는 육군자탕, 滲濕利水의 효능이 있는 사령산, 淸熱和胃降逆의 효능이 있는 사심탕, 理氣化濕和胃의 효능이 있는 평위산이 합하여진 것으로15 체내의 濕熱 및 痰濁을 제거하는 작용을 한다. 중만분소환에 대한 국내의 연구는 중만분소환이 생쥐의 肝損傷에 미치는 영향15이 전부로 활용 가능성에 대한 조사가 부족한 상황이다.
이에 저자는 체내의 濕熱 및 痰濁 제거에 효능이 있는 중만분소환의 비알코올성 지방간 질환에 대한 효능과 작용 기전을 연구하고자 HepG2 cell에 Palmitate 처리로 지방증을 유도한 후, 중만분소환 추출물을 투여하여 세포 내 지방량 및 SREBP-1c (sterol regulatory element-binding transcription factor-1c), ACC(acetyl-CoA carboxylase), FAS(fatty acid synthase), SCD-1(stearoyl-CoA desaturase-1), AMPK(AMP-activated protein kinase)에 미치는 영향을 관찰하여 유의한 결과를 얻었기에 보고하는 바이다.
II. 재료 및 방법
1. 재 료
1) 세포주
Human hepatocellular carcinoma 세포주인 HepG2 cell은 American Type Culture Collection(Manassas, VA, USA)에서 구입하였다.
2) 약 재
본 실험에 사용한 중만분소환(Jungmanbunso-hwan)은 ≪醫學入門≫9에 수록된 처방으로, 약재들의 비율은 동일하게 하되 그 용량은 1/2로 줄여 구성하였다(Table 1). 약재는 동신대학교 부속 순천한방병원에서 구입하여 사용하였다.
Table 1
Composition of Jungmanbunso-hwan
3) 시약 및 기기
3(4,5-dimethylthiazol-2-yl)-2,5-diphenyltetrazolium bromide(MTT), Nile Red, Palmitate는 Sigma-Aldrich Co.(St. Louis, MO, USA)에서 구입하였다. β-Actin antibody, SREBP-1 antibody, AMPK antibody, horseradish peroxidase(HRP)-conjugated goat anti-rabbit IgG는 Santa Cruz Biotechnology Inc.(Santa Cruz, CA, USA)에서 구입하였다. Phospho-AMPK antibody는 Cell Signaling Technology Inc.(Danvers, MA, USA)에서 구입하였다. 그 외 Olympus FV-1000 confocal laser scanning microscope(Tokyo, Japan), NE-PER™ nuclear extraction kit(Thermo Scientific, IL, USA), SuperSignal® chemiluminescence detection kit(Thermo Scientific, IL, USA), RNeasy Mini Kit (Qiagen, Hilden, Germany) 등이 본 연구를 위해 사용되었다.
2. 방 법
1) 중만분소환 추출물(JMBSH) 제작
중만분소환 총량 101 g에 2.0 L 물을 넣고 100 °C에서 1시간 동안 추출 후 여과하였다. 여과액을 모아 감압 농축하고 동결 건조하여 10 g(수율 10%)의 건조추출물을 얻었다.
2) 세포 배양
Human hepatocellular carcinoma 세포주인 HepG2 cell을 100 U/mL penicillin, 100 μg/mL streptomycin 및 10% heat inactivated fetal bovine serum을 함유한 Dulbecco’s modified Eagle’s medium(DMEM)을 이용하여, 37 °C, 5% CO2 환경에서 배양하였다.
3) 세포 활성도의 측정
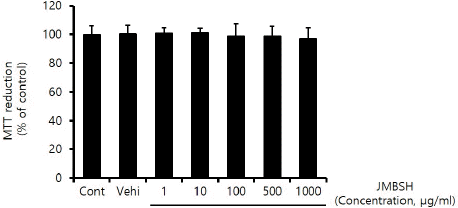
세포 활성도를 측정하기 위해 MTT assay를 시행하였다. HepG2 Cell을 96-well plate에 104 cells/well의 밀도로 seeding하였다. 하룻밤 경과 후 준비된 JMBSH 1, 10, 100, 500, 1,000 μg/mL를 투약하고 16시간 배양하였다. 각 well에 MTT 500 μg/mL를 처리한 뒤, 세포들이 MTT를 환원하여 생성한 formazan crystal을 DMSO를 사용하여 용해하였다. Background subtraction 630 nm로 하고 570 nm에서의 흡광도를 측정하였다
4) 지방산 처리
지방증을 유도하기 위해 HepG2 cell에 Palmitate를 처리하였다. Palmitate를 isopropanol에 50 mM 농도가 되도록 용해시킨 후 최종 투약 농도 0.5 mM으로 투여하였다. 1% bovine serum albumin을 함유한 DMEM을 배양액으로 사용하여 24시간 배양하였다.
5) 세포 내 지방량 측정
Palmitate 0.5 mM을 함유한 배지에서 24시간 동안 HepG2 cell을 배양하고, JMBSH 처리군에는 Nile Red staining 16시간 전 추출물 1,000 μg/mL 을 투여하였다. Palmitate 및 JMBSH 처리된 HepG2 cell을 15분간 상온에서 4% paraformaldehyde로 고정하였다. PBS로 세척한 뒤, 5분간 상온에서 Nile Red(100 ng/mL)로 처리하여 세포 내 중성 지방을 염색하였다. Olympus FV-1000 confocal laser scanning microscope(Tokyo, Japan)로 촬영했으며, Image J 1.48b software로 정량화하였다.
6) SREBP-1c, AMPK에 대한 Western blot 분석
JMBSH 투여에 따른 SREBP-1c와 AMPK의 변화를 관찰하고자 Western blot 분석을 시행하였다. Palmitate 0.5 mM을 함유한 배지에서 HepG2 cell을 24시간 배양하였고, JMBSH 투여군에는 검사 16시간 전 각각 추출물 700, 1,000 μg/mL을 처리한 후 Western blot으로 SREBP-1c 및 pAMPK protein level을 측정하였다. Total cell lysate는 protease inhibitor Cocktail(Roche, Indianapolis, IN, USA)를 포함한 radioimmunoprecipitation assay(RIPA) buffer(50 mM Tris-HCl(pH 8.0), 150 mM NaCl, 2 mM EDTA, 1% sodium orthovanadate, 1% Triton X-100, 0.5% deoxycholate, 0.1% SDS)를 사용하여 추출하였다. Nuclear protein은 NE-PER™ nuclear extraction kit(Thermo Scientific, IL, USA)를 이용하여 추출하였다. Bradford assay로 단백량을 정량한 후 sodium dodecyl sulfate polyacrylamide gel electrophoresis(SDS-PAGE)로 전개하였고, Polyvinylidene fluoride(PVDF) membrane에 전사하였다. 5% skim milk가 들어 있는 Tris-buffered saline(TBS)로 1시간 동안 상온에서 blocking하였다. 각각의 specific primary antibody와 4 °C에서 하룻밤 동안 반응시킨 후 horseradish peroxidase(HRP)가 결합되어 있는 2차 항체와 1시간 동안 상온에서 반응시켰다. SuperSignal® chemiluminescence detection kit(Thermo Scientific, IL, USA)를 사용하여 band를 검출했으며, Lamin A/C 와 Actin을 control로 사용했다.
7) ACC, FAS, SCD-1에 대한 semi-quantitative RT-PCR
JMBSH 투여에 따른 ACC, FAS, SCD-1의 발현을 확인하기 위해 semi-quantitative RT-PCR을 시행하였다. Palmitate 0.5 mM을 함유한 배지에서 HepG2 cell을 24시간 배양하였으며, JMBSH 투여군에는 검사 16시간 전 각각 추출물 700, 1,000 μg/mL을 처리한 후 semi-quantitative RT-PCR로 ACC, FAS, SCD-1의 mRNA level을 측정하였다. total RNA를 추출하기 위해 RNeasy Mini Kit(Qiagen, Hilden, Germany)를 사용했고, M-MLV Reverse Transcriptase(Promega, Madison, WI, USA)를 사용하여 추출된 total RNA를 역전사하여 cDNA를 합성하였다. TaqPCRx DNA Polymerase(Invitrogen, Carlsbad, CA, USA)와 각각의 primer(Bioneer)를 사용하여 합성된 cDNA를 증폭하였으며, 사용된 각 primer는 다음과 같다(Table 2). 증폭된 DNA는 1.2% agarose gel에 전기영동 및 ethidium bromide로 염색한 후 자외선으로 band를 확인하였으며 GAPDH를 control로 사용했다.
Table 2
Primer Sequences Used in Semi-quantitative RT-PCR
III. 결 과
1. 세포 활성도에 미치는 영향
JMBSH이 세포 활성도에 미치는 영향을 확인하기 위해 MTT Assay를 시행한 결과, 대조군의 MTT 환원율 100±6.09에 대해 JMBSH 1 μg/mL의 농도에서 100.76±3.93%, 10 μg/mL에서 101.09±3.09%, 100 μg/mL에서 98.87±8.75%, 500 μg/mL에서 98.74± 6.92%, 1,000 μg/mL에서 97.19±7.36%가 측정되어 1,000 μg/mL 이하의 농도에서는 HepG2 cell에 세포 독성을 유발하지 않는 것으로 나타났다(Fig. 1).
2. 세포 내 지질 축적에 미치는 영향
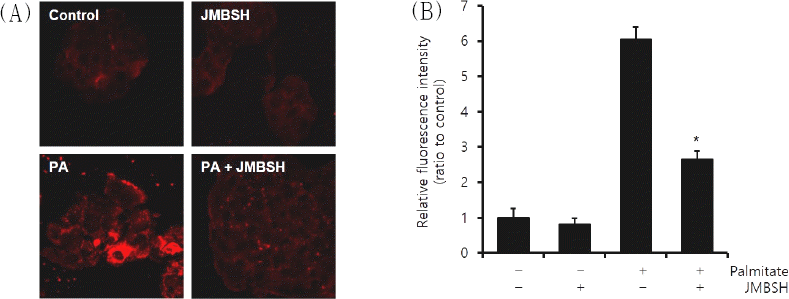
세포 내 지방은 Nile Red에 의해 붉게 염색되어 관찰되었다. 세포 내 지질 축적을 관찰한 결과, 대조군의 형광강도 1±0.27에 대해 JMBSH 1,000 μg/mL만 투여한 경우에는 0.82±0.17, Palmitate만 처리한 경우에는 6.06±0.34, JMBSH 1,000 μg/mL와 Palmitate를 함께 처리한 경우에는 2.65±0.24가 측정되어, Palmitate와 JMBSH을 함께 투여한 군이 Palmitate 처리군에 비하여 세포 내 지질 축적을 유의하게 감소시켰다(Fig. 2).
Fig. 2
Effect of JMBSH on intracellular lipid accumulation in HepG2 cells.
HepG2 cells were treated with palmitate (0.5 mM, for 24h) and/or JMBSH (1,000 μg/mL for 16h). After incubation, the cells were stained with Nile red. (A) Intracellular lipid component were visualized by fluorescence microscopy (original magnification ×400). (B) Cellular steatosis was quantified by measuring three random fields of view with image J 1.48b software and expressed as the mean±SEM (n=3). *mark indicates significant difference compared to PA cells (P<0.05).
3. SREBP-1c에 미치는 영향
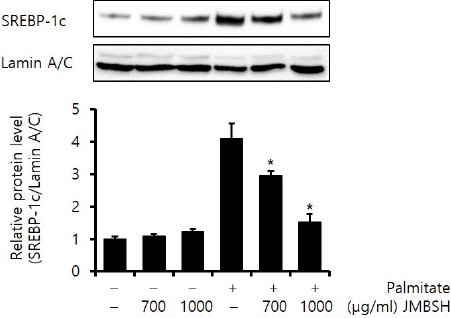
SREBP-1c는 지질 합성 관련 유전자들을 조절하는 주요 전사 인자이다16. Lamin A/C에 대한 SREBP-1c의 protein 비율을 분석한 결과, 대조군이 1±0.09, JMBSH 700 μg/mL을 투여한 경우는 1.09±0.07, JMBSH 1,000 μg/mL을 투여한 경우는 1.24±0.08, Palmitate만 처리한 경우는 4.12±0.46, Palmitate와 JMBSH 700 μg/mL을 함께 투여한 경우는 2.97±0.12, Palmitate와 JMBSH 1,000 μg/mL을 함께 투여한 경우는 1.53±0.24로 측정되어, Palmitate와 JMBSH을 함께 투여한 군이 Palmitate 처리군에 비하여 SREBP-1c protein을 유의하게(P<0.05) 감소시켰다(Fig. 3).
Fig. 3
Effect of JMBSH on SREBP-1c expression in HepG2 cells.
The expression level of SREBP-1c protein was measured by western blot analysis. The intensity of each band was measured with image J 1.48b software, and the relative quantity was calculated over lamin A/C. Data are presented as the mean± SEM (n=3). *mark indicates significant difference compared to only palmitate treated cells (P<0.05).
4. ACC, FAS, SCD-1에 미치는 영향
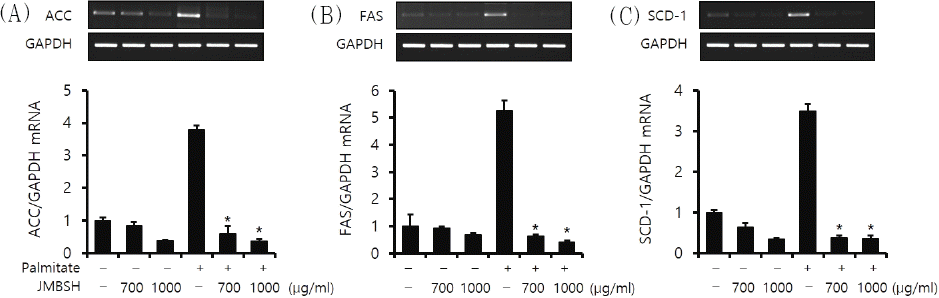
Lipogenesis에 관여하는 효소들인 ACC, FAS, SCD-1은 SREBP-1c에 의해 발현이 증가하여 지방 합성에 영향을 미친다16. GAPDH에 대한 ACC의 mRNA 비율은 대조군이 1±0.08, JMBSH 700 μg/mL을 투여한 경우는 0.83±0.12, JMBSH 1,000 μg/mL을 투여한 경우는 0.38±0.02, Palmitate만 투여한 경우는 3.78±0.13, Palmitate와 JMBSH 700 μg/mL을 투여한 경우는 0.59±0.24, Palmitate와 JMBSH 1,000 μg/mL을 투여한 경우는 0.36±0.08이었다.
GAPDH에 대한 FAS의 mRNA의 비율은 대조군이 1±0.44, JMBSH 700 μg/mL을 투여한 경우는 0.94±0.06, JMBSH 1,000 μg/mL을 투여한 경우는 0.69±0.06, Palmitate만 투여한 경우는 5.27±0.38, Palmitate와 JMBSH 700 μg/mL을 투여한 경우는 0.63±0.06, Palmitate와 JMBSH 1,000 μg/mL을 투여한 경우는 0.41±0.07이었다.
GAPDH에 대한 SCD-1의 mRNA의 비율은 대조군이 1±0.05, JMBSH 700 μg/mL을 투여한 경우는 0.63±0.12, JMBSH 1,000 μg/mL을 투여한 경우는 0.35±0.02, Palmitate만 투여한 경우는 3.49±0.16, Palmitate와 JMBSH 700 μg/mL을 투여한 경우는 0.38±0.06, Palmitate와 JMBSH 1,000 μg/mL을 투여한 경우는 0.36±0.08이었다.
위의 결과 Palmitate와 JMBSH을 함께 투여한 군은 Palmitate 처리군에 비하여 ACC, FAS, SCD-1 mRNA level을 유의하게(P<0.05) 감소시켰다(Fig. 4).
Fig. 4
Effect of JMBSH on expression of lipogenic genes in HepG2 cells.
Expression of lipogenic genes, ACC, FAS, SCD-1 was determined by semi-quantitative RT-PCR. The intensity of each band was measured with image J 1.48b software, and the relative quantity was calculated over GAPDH, a housekeeping gene. Data are presented as the mean±SEM (n=3). *mark indicates significant difference compared to only palmitate treated cells (P<0.05).
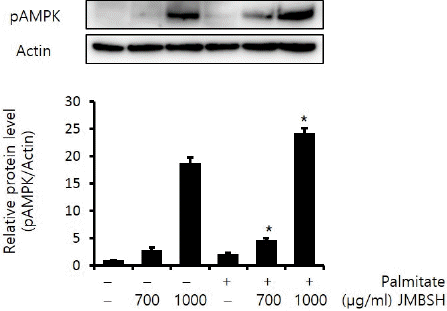
5. AMPK 활성화에 미치는 영향
AMP-activated protein kinase(AMPK)는 활성화되면 인산화 형태로 존재하게 되어 phospho-AMPK가 증가하게 되며, pAMPK는 SREBP-1c의 발현을 감소시킨다고 알려져 있다17,18. Actin에 대한 pAMPK의 protein 비율을 분석한 결과, 대조군이 1±0.03, JMBSH 700 μg/mL을 투여한 경우는 2.86±0.48, JMBSH 1,000 μg/mL을 투여한 경우는 18.82±0.97, Palmitate만 처리한 경우는 2.12±0.22, Palmitate와 JMBSH 700 μg/mL을 함께 투여한 경우는 4.73±0.35, Palmitate와 JMBSH 1,000 μg/mL을 함께 투여한 경우는 24.26±0.87로 측정되어, Palmitate와 JMBSH을 함께 투여한 군이 Palmitate 처리군에 비해 pAMPK protein level을 유의하게(P<0.05) 증가시켰다(Fig. 5).
Fig. 5
Effect of JMBSH on AMPK activation in HepG2 cells.
The expression level of pAMPK protein was measured by western blot analysis. The intensity of each band was measured with image J 1.48b software, and the relative quantity was calculated over Actin. Data are presented as the mean± SEM (n=3). *mark indicates significant difference compared to only palmitate treated cells (P<0.05).
IV. 고 찰
비알코올성 지방간 질환은 임상적으로 무증상이거나, 비특이적 소화기 증상 및 피로감, 우상복부 불쾌감이 동반되기도 한다19. 비알코올성 지방간 질환은 염증이 동반되지 않는 경우는 비교적 양호한 예후를 갖지만20 지방간염이 발생하면 환자의 절반에서 간섬유화, 15%에서 간경변이 발생하였고, 3%에서 간부전으로 진행되거나 간이식을 필요로 하였다21.
현재 비알코올성 지방간 질환의 공인된 치료법은 없으며 운동, 식이, 체중감량 등 생활 습관의 개선과 함께 당뇨, 고지혈증 등의 연관 질환 치료를 중심으로 하면서 간보호제 등을 사용하고 있다22. 이에 비알코올성 지방간 질환의 새로운 치료제 개발이 절실히 요구되는 상황이다. 최근 한의학계에서도 비알코올성 지방간 질환에 단미제23-26 혹은 복합 처방27-29을 이용한 동물 실험 및 세포 연구가 진행되고 있다.
비알코올성 지방간 질환의 발생과 연관된 원인 중 하나인 당뇨는 한방의 消渴에 해당되며30 ≪素問·奇病論≫, ≪素問·通評虛實篇≫, ≪靈樞·逆順肥瘦論≫31 등에서 비만과 식이를 원인으로 꼽았다. 한의학적으로 비만은 膏梁厚味로 인한 脾胃 기능실조 등의 원인으로 濕痰이 생성되어 수액대사 장애를 야기하여 발생한다32. 고지혈증은 한의학적으로 嗜食肥甘厚味의 外因 및 肝脾腎機能失調의 內因으로 인해 痰濁, 濕熱, 瘀血이 생성되어 발병한다33. 이렇듯 비알코올성 지방간 질환의 발생과 관계된 것으로 알려져 있는 원인 질환들 모두 체내의 濕痰과 유의한 관계가 있다. 이에 저자는 체내의 濕熱 및 痰濁을 제거하는 효능을 갖고 있는 중만분소환이 비알코올성 지방간 질환 치료에 활용될 수 있을 것이라 생각하고 본 연구를 시행하였다.
본 실험에서는 HepG2 cell에 palmitate를 처리하여 비알코올성 지방간 질환 세포를 배양하였다. JMBSH이 간세포 내 지방 축적을 줄이는지 확인하기 위해 palmitate와 함께 JMBSH을 처리하였다. Nile red staining을 통해 JMBSH을 함께 처리한 경우 지방 축적이 유의하게 감소하는 것을 확인하였다. JMBSH이 간 내 지질 축적을 감소시키는 기전을 확인하기 위해 Western blot을 통해 JMBSH이 SREBP-1c에 미치는 영향을 관찰하였다. SREBP-1c는 간에서 지질의 합성을 유도하는 주요 전사 활성 인자로 ACC, FAS, 및 SCD-1과 같은 유전자들의 발현을 유도시켜 간 내 지방 합성을 촉진한다16. JMBSH을 함께 처리한 경우 SREBP-1c가 유의하게 감소하였음을 확인하였다. 또한 semi-quantitative RT-PCR을 통해 JMBSH을 함께 처리한 경우 SREBP-1c에 의해 발현이 유도되는 ACC, FAS, SCD-1 역시 유의하게 감소하였음을 확인하였다. 따라서 JMBSH이 간세포 내 지방 축적을 완화시키는 작용은 SREBP-1c 억제를 통한 ACC, FAS, SCD-1의 발현 감소로 인해 나타난다는 것을 알 수 있었다.
AMPK는 세포 내 에너지가 부족해지면 활성화되어 해당 작용을 일으켜 에너지 균형을 회복시키게 하는 효소로서 지방 및 탄수화물 대사를 조절하는데 있어 중요한 역할을 한다34,35. AMPK는 활성화되면 인산화 형태로 존재하므로 phospho-AMPK가 증가하고, 이는 SREBP-1c의 발현을 감소시키며 ACC의 활성을 저해시켜 지방산 합성을 감소시킨다17,18,36. 또한 carbohydrate responsive element-binding protein(ChREBP), sn-glycerol-3-phosphate acyltransferase (GPAT), 3-hydroxy-3-methyl-glutaryl-CoA reductase (HMG-CoA reductase)의 활성을 저해하여 anti-lipogenic effect를 갖는다37-39. 본 연구에서는 JMBSH의 anti-lipogenic effect가 AMPK와 관계가 있는지 확인하고자 HepG2 cell에 JMBSH을 투여하고 pAMPK의 변화를 관찰하였다. 그 결과 JMBSH은 pAMPK 단백을 증가시킨다는 점을 확인할 수 있었다. 따라서 JMBSH은 AMPK를 활성화시켜 anti-lipogenic effect를 나타내는 것으로 생각된다(Fig. 6).
Fig. 6
Possible pharmacological mechanism of JMBSH.
It seems that antilipogenic effect of JMBSH is mediated through activation of AMPK at least in part.

이를 종합하면 JMBSH은 AMPK를 활성화시켜 SREBP-1c의 억제를 유발하고, 그에 따라 ACC, FAS, SCD-1의 발현을 감소시켜 anti-lipogenic effect를 나타내는 것으로 사료된다. 본 연구는 세포 단위 실험이므로 향후 비알코올성 지방간 질환 치료제로서의 중만분소환 활용 가능성에 대한 지속적인 동물 실험 및 임상 연구가 필요할 것으로 생각된다.