I. 서 론
천식은 다양한 임상양상을 보이는 기도의 만성염증질환으로 가변적인 기류제한과 시간에 따라 중증도가 변하는 천명, 호흡곤란, 기침 등 호흡기 증상의 병력이 있는 것으로 정의된다1. 천식에서 만성 기도염증의 발생과 지속에는 비만세포, 호산구, T림프구, 수지상세포, 대식세포, 호중구 등 다양한 염증세포와 기도상피세포, 기도평활근세포, 내피세포, 섬유모세포 등의 기도를 구성하는 세포가 관여한다2. 이러한 염증세포와 기도 구성 세포들은 chemokine, leukotrien, cytokine, histamine, nitric oxide, prostaglandin D2 등의 염증매개체를 생성하며, 다양한 기전에 의해 염증을 지속시킨다3.
천식의 병태생리의 가장 주요한 특징은 기도폐쇄와 기도과민성으로 구분할 수 있다4. 기도과민성은 정상인에게는 무해한 정도의 자극에도 기도평활근 수축으로 인해 기도가 좁아지는 기능장애로 기도의 염증 및 복구와 연관되어 있고 치료에 의해 부분적으로 호전될 수 있다1. 기도폐쇄는 천식에서 증상과 생리적 변화를 일으키는 최종 경로로서 기도평활근 수축, 기도부종, 기도 비후, 점액 과분비로 인해 발생한다5. 특히 기도 비후는 반복되는 질환 경과에 따라 염증 반응이 만성적이고 재발성으로 일어나게 되면 기도상피세포 이하의 섬유화, 기도평활근 증가, 기도벽 혈관 증가, 탄성 성분의 증가를 통해 기도개형(airway remodeling)이라고 하는 기도의 구조적 변화가 발생하는 것으로 비가역적인 기도협착을 초래하여 폐기능의 지속적인 저하와 기도과민성의 증가를 가져온다6. 기도개형은 현재까지 사용되는 약제로는 완전히 정상화될 수 없으며 특히 중증 천식의 발생에서 중요한 역할을 한다7.
천식 치료의 목표는 적절한 증상조절과 정상적인 활동수준을 유지하고, 천식에 의한 사망, 급성악화, 지속적인 기류제한 및 치료 부작용 발생 위험성을 최소화하는 것이다8. 천식에 사용되는 주요 약물치료 중 흡입스테로이드는 피부 멍, 부신억제, 골밀도 감소에 주의해야 하고, 베타작용제는 심혈관 자극, 골격근 진전 등의 부작용이 있을 수 있으며, 항류코트리엔제는 단독사용으로는 효과가 크지 않다는 제한이 있다9-11. 따라서 천식의 안정적인 관리를 위해서는 기도염증을 조절하고 기도과민성을 감소시키며 기도개형을 예방하면서 부작용의 가능성이 적은 제제를 개발하는 것이 필요하다.
천식에 대한 한약제 연구로는 청상보하탕12, 소청룡탕13, 맥문동탕14, 가미진해탕15 등 임상에 다용되는 처방을 중심으로 이루어지고 있다. 실험에 사용된 GGX는 방약합편(方藥合編)16에서 소음객한(少陰客寒)으로 인한 인통(咽痛)을 치료하는 감길탕(甘桔湯)에 금은화와 상백피가 추가된 처방으로 구성 약물 중 길경17은 선폐리인(宣肺利咽), 거담배농(祛痰排膿)하고, 감초17는 윤폐(潤肺), 조화제약(調和諸藥)하며, 금은화17는 청열해독(淸熱解毒), 양산풍열(凉散風熱)하고, 상백피17는 사폐평천(瀉肺平喘), 이수소종(利水消腫)한다. GGX는 동물실험에서 미세먼지로 인한 폐손상 억제 및 진해거담 효과18와 COPD에 대한 폐손상 억제 효과를 확인하였고19, 임상에서 급만성호흡기질환 전반에 진해거담 및 호흡기보호 목적으로 다용하고 있다. 천식과 COPD는 기도의 폐쇄, 만성염증의 다양성, 병변의 분포 등에서 매우 유사한 특징을 공유하고 있어20 COPD와 미세먼지 폐손상에서 유의한 효과가 확인된 GGX가 천식에도 유효할 가능성이 높다고 생각하여 연구를 진행하였다.
이에 저자는 천식에 대한 GGX의 효과를 확인하고자 ovalbumin(OVA)으로 유발한 동물모델을 이용하여 기관지폐포세척액(Bronchoalveolar lavage fluid, BALF)과 폐조직에서 관련 면역세포 및 cytokines에 대한 영항 및 조직학적 폐손상 보호효과를 평가하여 유의한 결과를 확인하였기에 보고하는 바이다.
II. 재료 및 방법
1. 재 료
1) 약 재
본 실험에 사용한 GGX의 구성약물은 ㈜휴먼허브(Gyeongbuk, Korea)에서 구입하였다. 1첩의 용량과 처방의 내용은 Table 1과 같다. GGX 40 g에 10배의 증류수를 가하여 2시간 동안, 2회에 거쳐 환류 추출기에서 얻은 액을 여과하였다. 그 후 감압 증류기(Buchi B-480, Switzerland)로 여과액을 농축하였다. 그리고 나서 동결 건조장치(Eyela FDU-540, Japan)로 건조시킨 후, 냉동(-84 ℃) 보관하여 사용하였다. 최종적으로 14.5 g의 추출물을 얻어 수율은 36.25%로 나타났다.
2) 시약 및 기기
실험에서 사용한 mouse Interleukin-4(IL-4), mouse Interleukin-5(IL-5), mouse Interleukin-13(IL-13), mouse Interferon(IFN-γ)은 R&D systems사(MN, USA) 제품을 사용하였다. Mouse Short-chain Fatty acids(SCFA) ELISA Kit(OM641584)은 Omnimabs사(CA, USA)의 제품을 사용하였다. Dulbecco’s phosphate buffered saline(D-PBS), formaldehyde, Dulbecco’s Modified Eagle Medium(DMEM) 배양액은 Sigma사(MA, USA) 제품을, FBS(Fetal Bovine Serum)는 Serum Source사(NC, USA) 제품을 사용하였고, 이외의 시약은 특급을 사용하였다.
기기는 열탕추출기(Daewoong, Korea), micro-pipet (Gilson, France), CO2 incubator(Forma Scientific, USA), freeze dryer(EYELA, Japan), rotary vacuum evaporator(Bűchi, Switzerland), autoclave(Sanyo, Japan), water bath(Vision scientific, Korea), clean bench(Vision Scientific, Korea), thermocycler system (MWG Biotech, Germany), vortex mixer(Vision scientific, Korea), spectrophotometer(Shimazue, Japan), deep-freezer(Sanyo, Japan), Biosystem XA(Buxco Research System, USA), plate shaker(Lab-Line, USA), centrifuge(Sigma, USA), ice-maker(Vision scientific, Korea), homogenizer(OMNI, USA), ELISA reader (Molecular Devices, USA) 및 chemical balance(Cas, Korea) 등을 사용하였다.
2. 방 법
1) 동 물
수컷 7주령의 SPF(specific pathogen-free) BALB/c 생쥐(18~20 g)는 오리엔트바이오(Gyeonggi, Korea)사에서 공급받았다. 동물은 실험 당일까지 고형사료(항생제 무첨가, 삼양사료 Co.)와 물을 충분히 공급하고 온도 22±2 ℃, 습도 55±15%, 12시간(light- dark cycle)의 환경에서 1주간 적응시킨 후 실험에 사용하였다. 그리고 동물실험의 윤리적, 과학적 타당성 검토 및 효율적인 관리를 위하여 대전대학교 동물실험윤리위원회(승인번호: DJUARB2020-011)가 정한 규정에 따라 시행하였다.
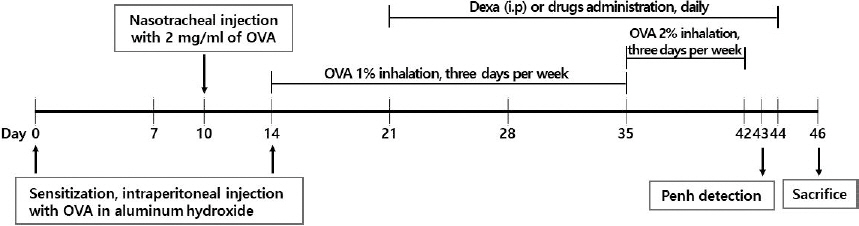
2) OVA 유발 천식 모델21 제작 및 실험 진행
7주령의 BALB/c 생쥐에 실험 첫날에 250 μg/ml 농도의 OVA와 1 mg aluminum hydroxide 혼합액 200 μl를 복강주사하여 전신감작 시키고, 10일에 2 mg/ml 농도의 OVA 100 μl를 비강을 통해 기도로 투입하여 감작시킨 다음, 14일에 다시 250 μg/ml 농도의 OVA와 1 mg aluminum hydroxide 혼합액 200 μl를 복강주사하여 전신감작 시켰다. 전신감작 후 14일부터 42일까지 3회/주(1주당 1일차, 3일차, 5일차의 간격)의 빈도로 OVA 분무액 50 ml(전반 3주 1%, 후반 1주 2%)을 30분간 흡입시켜 천식을 유도하였다.
실험군의 구분은 OVA를 처리하지 않은 정상군(Normal, n=8), OVA를 처리한 대조군(Control, n=8), OVA를 처리하고 dexamethasone 3 mg/kg을 경구 투여한 양성대조군(Dexa, n=8), OVA를 처리하고 GGX를 경구 투여한 실험군(GGX 100, 200, 400 mg/kg, 군당 n=8)으로 나누었다. 시험약은 21일부터 44일까지 24일 동안 매일 경구로 투여하였으며, 45일부터 12시간 이상 절식 후 46일에 희생하여 각 실험군의 생쥐에서 폐조직(lung tissue), BALF를 분리하였다(Fig. 1).
3) 기관지폐포세척액(BALF) 분리 및 총 세포수 측정
혈액을 채혈한 다음 해부하여 FBS-free/DMEM 배양액 1 ml을 넣은 주사기를 기관(trachea)에 삽입하고 끈으로 묶어 고정한 후 3회 순환시켜 BALF를 분리하였다. 분리한 BALF에 ACK(8.3 g NH4Cl, 1 g KHCO3, in 1 L of demineralized water+0.1 mM EDTA) 용액을 37 ℃에서 5분 동안 처리하여 적혈구를 용해시키기고 다시 FBS-free/DMEM 배양액으로 세척한 후 0.04% trypan blue로 염색한 다음 총 세포수를 측정하였다. 또한 BAL cell cytospin 후 Diff-Quik stain으로 neutrophils의 수를 측정하였다.
4) 폐세포 분리 및 총 세포수 측정
BALF를 분리하지 않은 생쥐에서 적출한 폐를 잘게 절편한 후 FBS-free/DMEM 3 ml에 넣고, 1 mg/ml의 collagenase IV(C5138, Sigma)를 가하여 37 ℃ shaking 배양기에서 30분 동안 4회 이상 조직을 분해(digestion)시켜 폐세포를 분리하였다. 폐세포를 배지로 세척한 다음 cell strainer(352350, FALCON)에 통과시켜 세포 이외의 분해되지 않은 조직이나 불순물을 제거하고 총폐세포수를 측정하였다.
5) Fluorescence-activated cell sorting(FACS) 분석
분리한 BALF 그리고 폐세포들을 1×106 cells/ml로 조정한 후 4 ℃에서 면역 형광염색(immunofluorescence staining)을 실시하였다. 각각에 PE-anti-CD3e(553064, BD Pharmingen, CA, USA), Fluorescein-5-isothiocyanate (FITC)-anti-CD8(553031, BD Pharmingen, CA, USA), PE-anti-CD4(553047, BD Pharmingen, CA, USA), PE-cy5.5-anti-CD69(555532, BD Pharmingen, CA, USA), PE-anti-Gr-1(553128, BD Pharmingen, CA, USA) 그리고 FITC-anti-neutrophil(ab55453, AbCam, Cambridge, UK)을 넣고 30분간 얼음에서 반응시켰다. 반응 후 3회 이상 인산완충 생리식염수로 세척한 후 flow cytometer의 Cell Quest 프로그램(643274,BD Biosciences, CA, USA)을 이용하여 CD3+CD4+CD69+, CD3+CD8+CD69+, CD3+CD193+, CD4+CD62L-CD44high+, Gr-1+SiglecF+ 세포의 분포를 백분율(%)로 분석한 다음 총 세포수(total cells)를 적용하여 각 조직에서의 절대 총 세포수(absolute number)를 산출하였다.
6) Enzyme-Linked Immunosorbent Assay(ELISA)
생쥐에서 분리한 BALF에서 IL-4, IL-5, IL-13, IFN-γ 수준을 ELISA로 측정하기 위해 각각의 antibody를 coating 완충용액(291195, R&D system)에 희석하여 microwell에 coating한 후 4 ℃에서 하룻밤 둔 다음, washing 완충용액으로 각 well을 3회 세척한 후에 혈청(10배 희석)을 100 μl씩 분주하였다. 1시간 동안 실온에서 방치한 후 washing 완충용액으로 2회 세척한 다음 streptavidin-HRP solution 100 μl를 처리하고 1시간 실온에서 방치한 후 다시 세척하였다. TMB(3,3′,5,5′-Tetramethylbenzidine) 기질을 100 μl씩 분주하고 어두운 곳에 30분간 방치한 다음 50 μl의 stop 용액을 처리한 후 ELISA reader(Emax, Molecular Devices, USA)로 450 nm에서 흡광도를 측정하였다.
7) 폐조직의 mRNA 유전자 발현 측정
생쥐의 폐조직을 적출한 후에 RNAzolB(CS-105B, Tel-Test) 500 ml를 넣고 용해될 때까지 분쇄하였다. 이 혼합 부유액에 chloroform(CHCl3) 50 ml를 첨가한 후 15초간 다시 혼합하였다. 이를 얼음에 15분간 방치한 후 13,000 rpm에서 원심분리한 후 약 200 ml의 상층액을 회수하여 2-propanol 200 ml와 동량 혼합 후 천천히 흔들고 얼음에서 15분간 방치하였다. 이를 다시 13,000 rpm에서 원심 분리한 후 80% EtOH로 세척하고 3분간 vacuum pump에서 건조하여 RNA를 추출하였다. 추출한 RNA는 diethyl pyrocarbonate(DEPC, IBS-BW1004, Intron)를 처리한 20 ml의 증류수에 녹여 heating block(2050, Lab-Line, India) 75 ℃에서 불활성화시킨 후에 first strand cDNA합성에 사용하였다.
준비된 total RNA 2 μg과 DNase I [(M610A, Promega) 10 U/ml] 2 U/tube를 37 ℃ heating block에서 30분간 반응한 후 75 ℃에서 10분 동안 변성시키고, 이에 2.5 ml 10 mM dNTPs mix, 1 ml random sequence hexanucleotides[(11034731001, Roche) 25 pmole/25 ml], RNA inhibitor로서 1 ml RNase inhibitor[(2313A, TaKaRa) 20 U/ml], 1 ml 100 mM DTT, 4.5 ml 5×RT buffer(250 mM Tris-HCl, pH 8.3, 375 mM KCl, 15 mM MgCl2)를 가한 후, 1 ml의 M-MLV RT[200 U/ml(M1705, Promega)]를 다시 가하고 DEPC 처리된 증류수로서 최종 부피가 20 ml가 되도록 하였다. 이 20 ml의 반응 혼합액을 잘 섞은 뒤 2,000 rpm에서 5초간 원심침강하여 37 ℃ heating block에서 60분 동안 반응시켜 first-strand cDNA를 합성한 다음, 95 ℃에서 5분 동안 방치하여 M-MLV RT를 불활성화시킨 후 합성이 완료된 cDNA를 polymerase chain reaction(PCR)에 사용하였다.
Real time quantitative PCR은 7500 Real-Time PCR system(Applied Biosystems, MA, USA)을 이용하여 수행하였다. 대조군으로는 mouse glyceraldehyde -3-phosphate dehydrogenase(GAPDH) cDNA probe (Applied Biosystems, USA)를 사용하였으며, Taqman PCR Master mix(4369016, ABI)를 사용하였고, primer의 최종농도가 200 nM이 되게 반응시켰다. Real time quantitative PCR의 조건으로는 pre-denaturation은 50 ℃에서 2 min, 94 ℃에서 10 min, 그리고 40 cycles을 95 ℃에서 0.15 min, 60 ℃에서 1 min 수행하였다. GGX 투여군과 대조군은 internal standard로 G3PDH를 사용하여 relative quantitative(RQ)를 측정하였다(Table 2).
Table 2
Oligonucleotide Sequence Used for RT-PCR
8) 조직병리검사
폐와 기도(trachea)를 떼어내어 즉시 10% formaldehyde 용액에 고정한 후 세절하여 흐르는 물에 8시간 세척한 다음, epoxy에 포매하고, 이것을 microtome으로 절편을 만들어 표준방법에 의하여 Hematoxylin & Eosin 염색과 collagen deposition 염색인 Masson- Trichrome 염색을 수행하였다. 그리고 goblet 세포를 관찰하기 위하여 PAS 염색을 하고 trachea는 AB-PAS 염색을 하여 광학현미경(333246, NIKON, Japan)으로 400배율에서 관찰하였다. 폐손상의 정도를 평가하는 조직학적 분석은 Lee 등22의 방법을 응용하여 세포 침윤, 혈관 증식, 점액세포와 goblet 세포 증식, 콜라겐 침착, 기도벽 비후, 폐포 확장의 정도를 3점 척도(0점~2점)로 점수화하여 수행하였다.
9) Immunohistofluorosence(IHF)를 이용한 폐조직 유전자 발현 측정
폐조직을 4% paraformaldehyde를 사용하여 4 ℃에서 24시간 동안 fixation한 후, 파라핀에 고정시키고 cryostat(Leica, Wetzlar, Germany)를 이용하여 4 μm 두께로 절편하였다. 폐조직 절편(20μm)을 PBS에 담긴 4% sucrose와 4% paraformaldehyde로 20-25 ℃에서 40분 동안 고정하고 0.5% Nonidet P-40 PBS으로 투과화한 다음 이중면역형광염색을 시행하였다. 각각 STAT3(Santa Cruz Biotechnology, CA, USA)와 GATA3(Santa Cruz Biotechnology, CA, USA)에 대한 항체가 있는 폐조직 절편을 4 ℃에서 overnight을 하고, 이어서 fluorescein-conjugated 2차 항체를 첨가하여 2시간 동안 배양하였다. Hoechst 염색을 이용하여 핵염색을 시행한 다음, Eclipse Ti-E inverted 형광현미경(Zeiss LSM 510, Carl Zeiss, Oberkochen, Germany)을 사용하여 200배율에서 관찰하였다.
III. 결 과
1. BALF 및 폐조직에서 총 세포수에 미치는 영향
천식 동물모델에서 BALF의 총 세포수를 관찰한 결과, 대조군은 74.67±2.90개로 나타나 정상군의 27.00±3.56개보다 유의하게 증가하였고, 양성대조군은 25.33±2.72개, GGX 100, 200 및 400 mg/kg를 각각 투여한 실험군은 48.67±9.70, 59.67±5.48, 29.00±3.94개로 나타나 양성대조군과 GGX 100, 200, 400 mg/kg 투여 실험군 모두에서 대조군과 비교하여 유의성 있게 감소하였다(Fig. 2A).
Fig. 2
Effects of GGX on BALF (A) and lung tissue (B) cell number in OVA-induced asthma mice.
Mice were induced by OVA (Control), and then treated with dexamethasone 3 mg/kg (Dexa) and GGX (100, 200, 400 mg/kg). Data are presented as mean±SE (n=8). †: Significant difference compared with normal group (††† p<0.001), * : Significant difference compared with control group (* p<0.05, ** p<0.01, *** p<0.001).
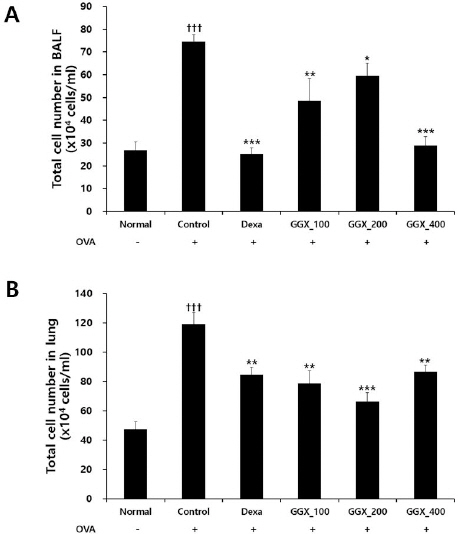
폐조직의 총 세포수를 관찰한 결과, 대조군은 119.33±7.85개로 나타나 정상군의 47.33±5.04개보다 유의하게 증가하였고, 양성대조군은 84.67±5.31개, GGX 100, 200 및 400 mg/kg를 각각 투여한 실험군은 78.67±8.78, 66.33±6.33, 86.67±4.59개로 나타나 양성대조군과 GGX 100, 200, 400 mg/kg 투여 실험군 모두에서 대조군과 비교하여 유의성 있게 감소하였다(Fig. 2B).
2. 면역세포 FACS 분석 결과
1) BALF에서 면역세포 FACS 분석 결과
천식 동물모델의 BALF에서 면역세포를 FACS 분석한 결과, lymphocytes, neutrophils, macrophage, CD4+, CD8+, CD4+CD69+, CD62L-CD44high+, Gr-1+SiglecF- 세포의 절대세포수(absolute No.)는 정상군에 비하여 대조군에서 유의하게 증가하였다. Macrophage, CD4+, CD8+ 세포의 절대세포수는 양성대조군과 GGX 400 mg/kg 투여군에서 유의하게 감소하였고, lymphocyte 절대세포수는 양성대조군, GGX 100, 400 mg/kg 투여군에서 유의하게 감소하였으며, CD62L-CD44high+ 절대세포수는 양성대조군과 GGX 200, 400 mg/kg 투여군에서 유의하게 감소시켰고, neutrophi, CD4+CD69+, Gr-1+SiglecF- 절대세포수는 양성대조군과 GGX를 투여한 모든 농도에서 유의하게 감소하였다(Table 3).
Table 3
Absolute Number of Various Immune Cells in BALF of OVA-induced Asthma Mice Model Treated by GGX
| Cell phenotypes in BALF | Normal | Control | Dexa | GGX_100 | GGX_200 | GGX_400 |
|---|---|---|---|---|---|---|
| Lymphocyte (×104 cells) | 3.78±1.09 | 26.77±3.03††† | 8.57±0.75*** | 16.71±3.13* | 20.91±1.12 | 11.74±3.05** |
| Neutrophils (×104 cells) | 8.82±1.67 | 26.11±4.66†† | 7.25±0.83** | 13.72±3.88* | 14.28±1.15* | 7.89±2.47** |
| Macrophage (×104 cells) | 13.61±2.27 | 18.76±0.84† | 8.72±2.58** | 16.88±6.59 | 22.04±5.52 | 8.39±1.06*** |
| CD4+(×104 cells) | 0.58±0.29 | 24.44±4.10††† | 10.31±2.04** | 17.20±3.91 | 21.62±3.03 | 11.52±2.58** |
| CD8+ (×104 cells) | 0.25±0.06 | 5.31±1.21††† | 1.31±0.19** | 3.05±0.55 | 3.84±0.19 | 2.00±0.33** |
| CD4+CD69+ (×104 cells) | 0.20±0.18 | 10.88±1.25††† | 2.87±0.70*** | 5.64±1.57** | 6.86±0.73** | 2.93±0.54*** |
| CD62L-CD44high+ (×104 cells) | 2.07±1.00 | 55.74±2.99††† | 15.11±3.70*** | 35.42±10.72 | 39.92±5.28** | 18.73±3.25*** |
| Gr-1+SiglecF- (×104 cells) | 0.04±0.01 | 3.06±0.08††† | 0.11±0.05*** | 0.16±0.07*** | 0.14±0.07*** | 0.08±0.03*** |
2) 폐조직에서 면역세포 FACS 분석 결과
천식 동물모델의 폐조직에서 면역세포를 FACS 분석한 결과, lymphocytes, neutrophils, eosinophils/ macrophage, CD3+, CD19+, CD3+CD193+, CD4+, CD8+, CD4+CD69+, CD62L-CD44high+, Gr-1+SiglecF- 세포의 절대세포수(absolute No.)는 정상군에 비하여 대조군에서 유의하게 증가하였다. CD19+ 절대세포스는 양성대조군과 GGX 200 mg/kg 투여군에서 유의하게 감소하였고, neutrophil 절대세포수는 양성대조군과 GGX 100, 200 mg/kg 투여군에서 유의하게 감소하였으며, Gr-1+SiglecF- 절대세포수는 양성대조군과 GGX 200, 400 mg/kg 투여군에서 유의하게 감소하였으며, eosinophil/marcrophage, CD3+, CD3+CD193+, CD4+, CD8+, CD4+CD69+, CD62L-CD44high+ 절대세포수는 양성대조군과 GGX를 투여한 모든 농도에서 유의하게 감소하였다(Table 4).
Table 4
Absolute Number of Various Immune Cells in Lung of OVA-induced Asthma Mice Model Treated by GGX
| Cell phenotypes in lung | Normal | Control | Dexa | GGX_100 | GGX_200 | GGX_400 |
|---|---|---|---|---|---|---|
| Lymphocyte (×1044 cells) | 15.02±2.26 | 31.31±2.22††† | 21.41±4.74 | 23.75±4.77 | 24.09±3.00 | 26.85±1.71 |
| Neutrophils (×104 cells) | 15.33±2.58 | 30.69±4.28†† | 29.42±1.90 | 18.80±2.39* | 15.81±2.27** | 27.83±1.05 |
| Eosinophils/Macrophage (×104 cells) | 14.71±2.27 | 51.98±4.68††† | 30.38±1.01*** | 32.35±5.13** | 23.41±4.24*** | 27.65±3.48*** |
| CD3+(×104 cells) | 27.92±3.96 | 70.21±7.25††† | 43.88±4.80** | 44.95±7.74* | 39.67±5.36** | 50.22±2.81** |
| CD19+ (×104 cells) | 7.06±0.93 | 21.02±2.73††† | 16.98±1.91 | 15.77±3.12 | 11.13±2.11** | 15.03±1.58 |
| CD3+CD193+ (×104 cells) | 2.95±0.98 | 11.23±1.48††† | 6.10±0.85** | 5.61±1.01** | 4.28±0.68*** | 3.98±1.30** |
| CD4+(×104 cells) | 19.79±2.88 | 46.54±4.30††† | 29.36±2.93** | 31.56±4.70* | 26.51±4.03** | 34.06±1.96** |
| CD8+ (×104 cells) | 5.63±0.85 | 14.55±1.82††† | 9.17±1.25* | 6.13±0.93*** | 6.32±1.14** | 7.91±0.47** |
| CD4+CD69+ (×104 cells) | 1.69±0.06 | 10.74±0.77††† | 5.01±0.63*** | 5.77±0.89*** | 4.67±0.83*** | 5.43±0.15*** |
| CD62L-CD44high+(×104 cells) | 6.42±1.01 | 34.23±0.98††† | 16.86±1.66*** | 21.68±3.97** | 16.67±2.25*** | 18.03±0.55*** |
| Gr-1+SiglecF- (×104 cells) | 11.66±2.06 | 26.91±0.77††† | 19.54±0.59*** | 14.46±6.33 | 20.87±2.38* | 22.89±0.90** |
3. BALF 내 cytokines 생성에 미치는 영향
1) IL-4 생성에 미치는 영향
OVA로 천식을 유도한 대조군에서 IL-4는 110.95 ±4.23 pg/ml로 나타나 정상군의 72.95±6.44 pg/ml보다 유의하게 증가하였으며, 양성대조군은 85.21±9.75 pg/ml, GGX 100, 200 및 400 mg/kg를 각각 투여한 실험군은 77.19±7.94, 73.24±5.09, 71.51±7.22 pg/ml로 나타나 양성대조군과 GGX 100, 200, 400 mg/kg 투여군 모두에서 대조군과 비교하여 유의하게 감소하였다(Fig. 3).
Fig. 3
Effect of GGX on IL-4 production in BALF of OVA-induced asthma mice.
Mice were induced by OVA (Control), and then treated with dexamethasone 3 mg/kg (Dexa) and GGX (100, 200, 400 mg/kg). Data are presented as mean±SE (n=8). †: Significant difference compared with normal group (††† p<0.001), * : Significant difference compared with control group (* p<0.05, ** p<0.01, *** p<0.001).

2) IL-5 생성에 미치는 영향
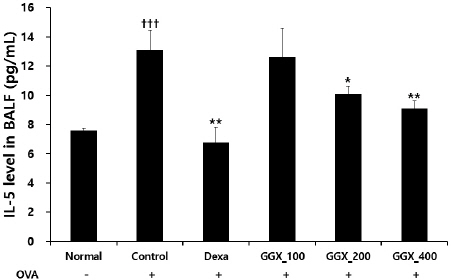
OVA로 천식을 유도한 대조군에서 IL-5는 13.10± 1.35 pg/ml로 나타나 정상군의 7.58±0.18 pg/ml보다 유의하게 증가하였으며, 양성대조군은 6.78±1.05 pg/ml, GGX 100, 200 및 400 mg/kg를 각각 투여한 실험군은 12.60±1.99, 10.09±0.53, 9.10±0.52 pg/ml로 나타나 양성대조군과 GGX 200, 400 mg/kg 투여군에서 대조군과 비교하여 유의하게 감소하였다(Fig. 4).
Fig. 4
Effect of GGX on IL-5 production in BALF of OVA-induced asthma mice.
Mice were induced by OVA (Control), and then treated with dexamethasone 3 mg/kg (Dexa) and GGX (100, 200, 400 mg/kg). Data are presented as mean±SE (n=8). †: Significant difference compared with normal group (††† p<0.01), * : Significant difference compared with control group (* p<0.05, ** p<0.01).
3) IL-13 생성에 미치는 영향
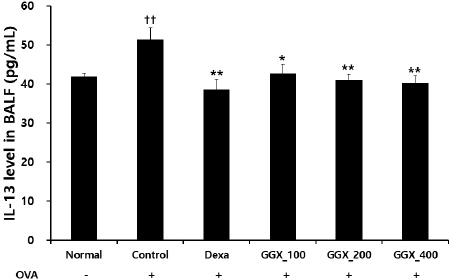
OVA로 천식을 유도한 대조군에서 IL-13은 51.42± 2.90 pg/ml로 나타나 정상군의 41.92±0.89 pg/ml보다 유의하게 증가하였으며, 양성대조군은 38.59±2.64 pg/ml, GGX 100, 200 및 400 mg/kg를 각각 투여한 실험군은 42.76±2.31, 41.07±1.45, 40.28±1.73 pg/ml로 나타나 양성대조군과 GGX 100, 200, 400 mg/kg 투여군 모두에서 대조군과 비교하여 유의하게 감소하였다(Fig. 5).
Fig. 5
Effect of GGX on IL-13 production in BALF of OVA-induced asthma mice.
Mice were induced by OVA (Control), and then treated with dexamethasone 3 mg/kg (Dexa) and GGX (100, 200, 400 mg/kg). Data are presented as mean±SE (n=8). †: Significant difference compared with normal group (†† p<0.01), * : Significant difference compared with control group (* p<0.05, ** p<0.01).
4) IFN-γ 생성에 미치는 영향
OVA로 천식을 유도한 대조군에서 IFN-γ는 7.04± 0.84 pg/ml로 나타나 정상군의 4.73±0.49 pg/ml보다 유의하게 증가하였으며, 양성대조군은 4.44±0.51 pg/ml, GGX 100, 200 및 400 mg/kg를 각각 투여한 실험군은 5.36±0.52, 5.23±0.38, 4.61±0.64 pg/ml로 나타나 양성대조군과 GGX 400 mg/kg 투여군에서 대조군과 비교하여 유의하게 감소하였다(Fig. 6).
Fig. 6
Effect of GGX on IFN-γ production in BALF of OVA-induced asthma mice.
Mice were induced by OVA (Control), and then treated with dexamethasone 3 mg/kg (Dexa) and GGX (100, 200, 400 mg/kg). Data are presented as mean±SE (n=8). †: Significant difference compared with normal group (†† p<0.01), * : Significant difference compared with control group (* p<0.05, ** p<0.01).

4. 폐조직 내 관련 단백질 mRNA 발현에 미치는 영향
1) IL-13 mRNA 생성에 미치는 영향
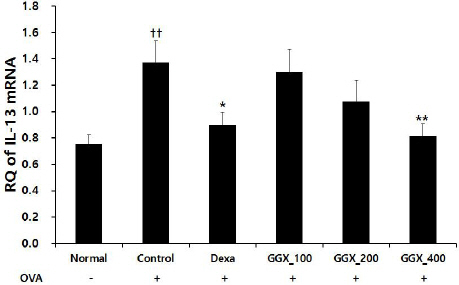
OVA로 천식을 유도한 대조군에서 IL-13 mRNA Relative Quantitive(RQ)는 1.37±0.17로 나타나 정상군의 0.75±0.07보다 유의하게 증가하였으며, 양성대조군은 0.90±0.10, GGX 100, 200 및 400 mg/kg를 각각 투여한 실험군은 1.30±0.17, 1.08±0.16, 0.81±0.09로 나타나 양성대조군과 GGX 400 mg/kg 투여군에서 대조군과 비교하여 유의하게 감소하였다(Fig. 7).
Fig. 7
Effect of GGX on IL-13 mRNA expression in lung of OVA-induced asthma mice.
Mice were induced by OVA (Control), and then treated with dexamethasone 3 mg/kg (Dexa) and GGX (100, 200, 400 mg/kg). Data are presented as mean±SE (n=8). †: Significant difference compared with normal group (†† p<0.01), * : Significant difference compared with control group (* p<0.05, ** p<0.01).
2) TARC mRNA 생성에 미치는 영향
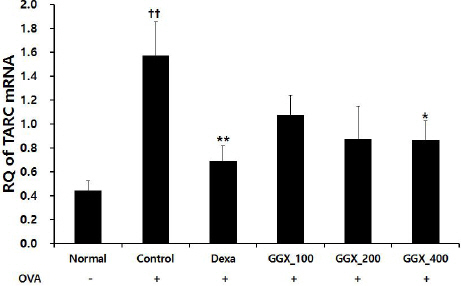
OVA로 천식을 유도한 대조군에서 TARC mRNA Relative Quantitive(RQ)는 1.57±0.28로 나타나 정상군의 0.44±0.08보다 유의하게 증가하였으며, 양성대조군은 0.69±0.13, GGX 100, 200 및 400 mg/kg를 각각 투여한 실험군은 1.08±0.16, 0.88±0.27, 0.87±0.16으로 나타나 양성대조군과 GGX 400 mg/kg 투여군에서 대조군과 비교하여 유의하게 감소하였다(Fig. 8).
Fig. 8
Effect of GGX on TARC mRNA expression in lung of OVA-induced asthma mice.
Mice were induced by OVA (Control), and then treated with dexamethasone 3 mg/kg (Dexa) and GGX (100, 200, 400 mg/kg). Data are presented as mean±SE (n=8). †: Significant difference compared with normal group (†† p<0.01), * : Significant difference compared with control group (* p<0.05, ** p<0.01).
3) MCP-1 mRNA 생성에 미치는 영향
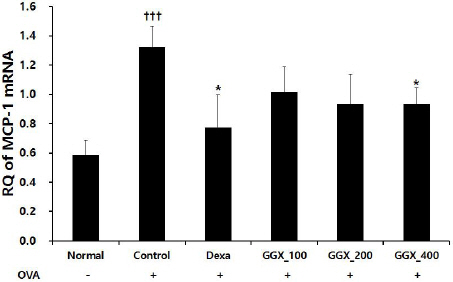
OVA로 천식을 유도한 대조군에서 MCP-1 mRNA Relative Quantitive(RQ)는 1.32±0.14으로 나타나 정상군의 0.59±0.10보다 유의하게 증가하였으며, 양성대조군은 0.77±0.22, GGX 100, 200 및 400 mg/kg를 각각 투여한 실험군은 1.02±0.17, 0.93±0.20, 0.93±0.11로 나타나 양성대조군과 GGX 400 mg/kg 투여군에서 대조군과 비교하여 유의하게 감소하였다(Fig. 9).
Fig. 9
Effect of GGX on MCP-1 mRNA expression in lung of OVA-induced asthma mice.
Mice were induced by OVA (Control), and then treated with dexamethasone 3 mg/kg (Dexa) and GGX (100, 200, 400 mg/kg). Data are presented as mean±SE (n=8). †: Significant difference compared with normal group (††† p<0.001), * : Significant difference compared with control group (* p<0.05).
5. 손상 폐조직의 조직학적 분석 결과
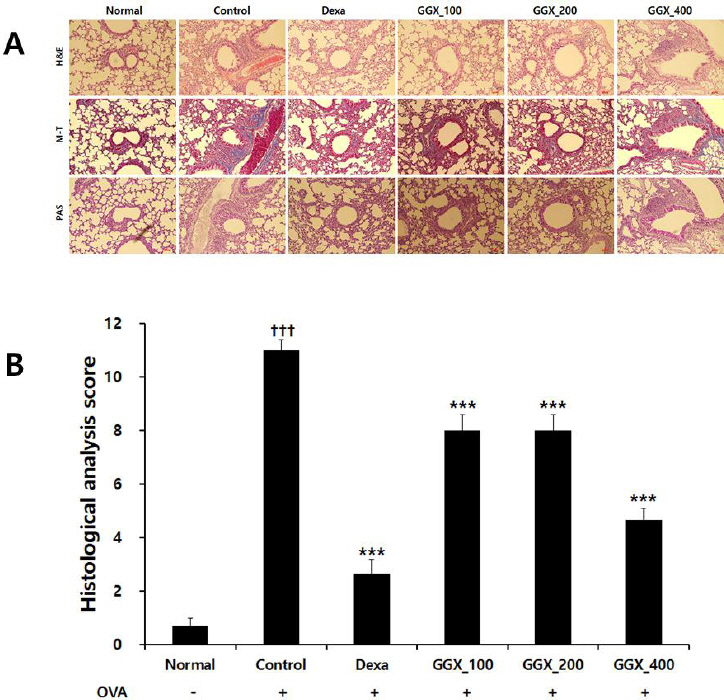
천식 동물모델에서 폐조직과 기관의 H&E, M-T, PAS 염색을 통한 관찰 결과, 대조군에서 기도의 두께가 증가하였고, 기도의 주변으로 콜라겐 침착과 염증세포의 침윤이 관찰되었으며, 점액세포와 goblet 세포가 증가하였고, 폐포의 파괴로 폐포의 크기가 균일하지 않았다. 양성대조군과 GGX를 투여한 실험군에서는 상대적으로 폐포의 크기가 일정하게 유지되었고, 염증세포 침착과 점액세포와 goblet 세포 증식이 감소한 것이 관찰되었다(Fig. 10A). 폐조직의 손상 정도를 정량적으로 평가기 위하여 점수화한 결과, 대조군은 11.00±0.38로 측정되어 정상군의 0.67±0.32보다 유의하게 증가하였으며, 양성대조군은 2.67±0.51로 유의성 있게 감소하였다. GGX 100, 200 및 400 mg/kg를 각각 투여한 실험군은 8.00±0.59, 8.00±0.59, 4.67±0.43으로 나타나 대조군과 비교하여 유의하게 감소하였다(Fig. 10B).
Fig. 10
Effect of GGX on histophathological changes in the lung of OVA-induced asthma mice.
(A) Representative sections of lung stained with H&E stain and M-T stain (Light microscope at 400×magnification). (B) Quantitative evaluation of the degree of lung tissue damage in the sections. Mice were induced by OVA (Control), and then treated with dexamethasone 3 mg/kg (Dexa) and GGX (100, 200, 400 mg/kg). Data are presented as mean±SE (n=8). †: Significant difference compared with normal group (††† p<0.001), * : Significant difference compared with control group (*** p<0.001).
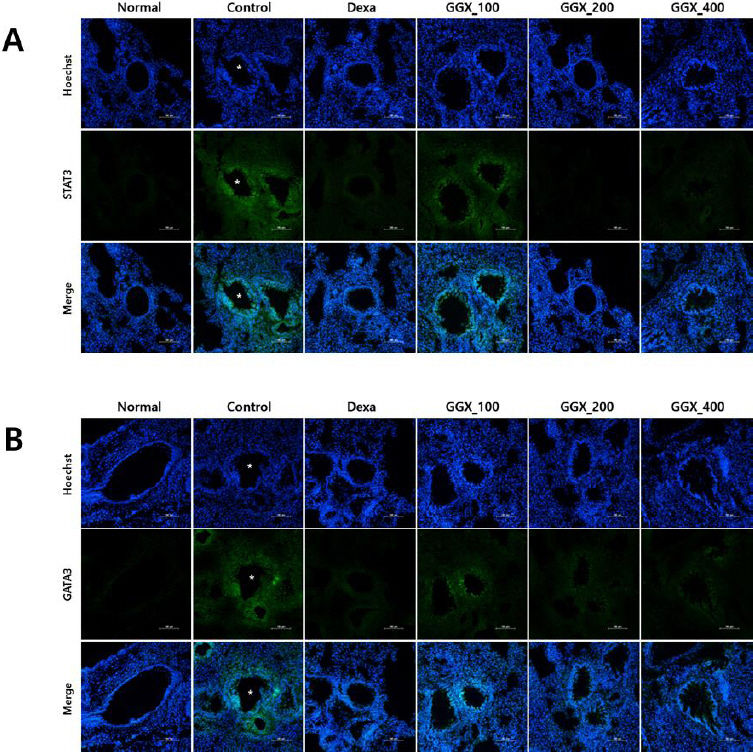
6. IHF로 관찰한 STAT3 및 GATA3 단백질 발현에 미치는 영향
천식 동물모델의 폐조직에서 STAT3 및 GATA3 단백질 발현을 IHF staining으로 관찰한 결과, 대조군에서 기도주변으로 STAT3와 GATA3 단백질 발현이 증가하였고 양성대조군과 GGX를 투여한 실험군에서는 감소하는 것이 관찰되었다(Fig. 11).
Fig. 11
Immunofluorescence staining for STAT3 and GATA3 expression in the lungs of OVA-induced asthma mice model.
STAT3 (A) and GATA3 (B) expressions were potently inhibited by treatment with all GGX extracts and dexamethasone. Mice were induced by OVA (Control), and then treated with dexamethasone 3 mg/kg (Dexa) and GGX (100, 200, 400 mg/kg). * : Asterisks denote bronchiole.
Ⅳ. 고 찰
천식은 전 세계적으로 약 3억 5천 8백만 명 이상이 앓고 있고, 2025년에는 환자 수가 4억 명에 이를 것으로 예상되는 가장 흔한 호흡기계의 만성질환의 하나이다23. 생활습관이 서구화되거나 도시화되면서 우리나라 천식 유병률도 꾸준히 증가하고 있어 의사로부터 진단된 천식 유병률이 1998년 0.7%에서 2019년에는 3.2%로 증가하였다24. 천식 환자는 다른 질환과 비교하여 상대적으로 젊은 연령의 비율이 높기 때문에 직장 결근이나 학교 결석의 주요 원인으로 작용하여 의료비용을 제외한 사회적 손실의 비중이 높다25. 2014년 기준으로 우리나라에서 천식으로 인한 사회⋅경제적 비용은 직접 의료비용 이외에 생산성 손실 및 삶의 질 저하와 관련된 무형의 비용까지 포함시키면 약 6억 4,580만 달러로 추산된다26.
천식은 기도의 만성 염증질환으로 아토피와 같은 유전인자 및 비만 등의 숙주 인자와 알레르기 항원, 감염, 직업적 노출, 흡연, 대기오염, 음식 등의 환경인자가 천식의 위험인자로 알려졌다27. 이러한 숙주인자와 환경인자의 대부분은 천식의 증상을 유발하거나 악화시키는 요인으로 작용한다28. 따라서 적절하지 못한 치료와 치료 순응도, 부작용 여부, 동반 질환, 불안, 우울증, 사회경제적 문제 등을 포함하여 증상과 악화에 영향을 미치는 요인을 체계적으로 검토하고 관리하는 것이 증상 조절을 향상시키고 앞으로의 위험도를 감소시키는 데 있어 중요하다29.
천식의 약물치료는 장기간 꾸준히 사용하여 항염증 효과를 통해 천식 증상이 조절되도록 하는 조절제와 필요할 때만 사용하여 신속히 기도를 확장시켜 증상을 개선시키는 목적으로 하는 증상완화제로 분류한다30. 대표적인 조절제인 흡입스테로이드는 지속성 천식 가장 효과적인 항염증약제이나 구인두 캔디다증, 목소리 변형, 상기도 자극에 의한 간헐적 기침과 같은 국소 부작용이나 용량에 따른 전신 부작용에 주의해야 하고, 흡입스테로이드와 흡입지속성베타작용제 복합제는 천식 조절, 폐기능 개선, 악화 빈도 감소에 효과적이나 심혈관 자극, 골격근 진전, 저칼륨혈증 등의 부작용이 있을 수 있으며, 항류코트리엔제는 기관지 확장 효과, 폐기능 개선, 증상 및 악화 감소의 효과가 있으나 단독 사용은 저용량 흡입스테로이드보다 효과가 적다9-11. 이와 같이 천식의 기존 치료제가 일정한 한계를 가지고 있기 때문에 천식의 장기적인 관리를 위해서는 보다 안전하고 효과적인 제제의 개발이 필요하다.
실험에 사용된 GGX는 길경, 감초, 금은화, 상백피의 4종 약재로 구성된 처방으로 각 구성 약물은 실험적으로 천식에 유효한 효과를 가지고 있는 것으로 보고되고 있다. 길경의 물추출물31, 에탄올 추출물32 및 길경약침33은 OVA로 유발한 천식 동물모델에서 유의한 항천식 효과를 나타냈다. 감초는 OVA로 유발한 천식모델에서 관련 cytokine 발현과 조직 손상을 억제하였고34,35, RBL-2H3 비만세포에서 Th2 cytokine mRNA 발현을 억제하였다36. 금은화는 A549 세포에서 Th2 cytokines과 chemokine 발현을 억제하였고37, 꾸지나무와의 혼합물이 천식모델에서 염증 관련 지표들을 감소시켰다38. 상백피는 천식동물모델에서 histamine, IgE를 감소시키고 Th1/Th2 관련 cytokine을 조절하는 효과를 보였고39, RBL-2H3 세포에서 항산화 효과와 IL-4 및 TNF-α의 감소를 보였다40. 또한 선행연구에서 GGX의 미세먼지로 인한 폐손상 억제 및 진해거담 효과18와 COPD에 대한 폐손상 억제 효과19를 확인하였다. 개별 약물의 항천식 효과를 갖고 있고 기도의 폐쇄, 만성염증의 다양성, 병변의 분포 등에서 천식과 COPD가 매우 유사한 특징을 공유20하고 있다는 사실을 고려할 때 COPD와 미세먼지 폐손상에서 유의한 효과가 확인된 GGX가 천식에도 유효할 가능성이 높다고 판단하였다.
먼저 OVA로 유발한 천식 동물모델에서 분리한 BALF 및 폐조직에서 총 세포수의 증감을 측정한 결과, 대조군에서 총 세포수가 유의하게 증가한 것에 비하여 GGX 투여군에서는 유의하게 감소를 보였다. 천식의 특징인 만성 기도염증에는 다양한 염증세포가 관여하고 있는데41 이러한 결과는 GGX가 OVA로 유도된 염증 반응으로 증가된 염증세포를 전반적으로 감소시키는 것을 시사한다.
천식을 유도한 동물모델의 BALF와 폐조직을 수집하여 FACS 분석을 시행한 결과, BALF에서 lymphocyte, neutrophi, macrophage, CD4+, CD8+, CD62L-CD44high+, CD4+CD69+, Gr-1+SiglecF- 세포의 증가를 감소시켰고, 폐조직에서 lymphocyte, neutrophi, eosinophil/marcrophage, CD3+, CD19+, CD3+CD193+, CD4+, CD8+, CD4+CD69+, CD62L-CD44high+, Gr-1+SiglecF- 세포를 감소시켰다. 천식의 병리에서 주요한 역할을 하는 CD4+ T 세포의 활성화는 중증 천식에서 나타나는 CD62L와 CD44를 발현시켜 염증 부위로 lymphocyte가 이동하는 데 필수적 역할하게 된다42,43. CD19는 모든 단계의 B 세포에서 발현되는데 T 세포 증식을 자극하는 역할을 통해 천식의 증증도를 반영할 수 있는 것으로 알려져 있고44, CD193은 C-C 유형 chemokine에 대한 수용체로 eotaxin-1(CCL11), eotaxin-3(CCL26), MCP-3(CCL7), MCP-4(CCL13) 및 RANTES(CCL5)를 비롯한 다양한 chemokine에 결합하고 반응하며 알레르기성 기도 염증 부위에서 eosinophil 및 기타 염증 세포의 축적 및 활성화에 기여한다45. CD69는 활성화된 lymphocytes에서 분비되어 천식의 기도염증, 점액 과분비, 기도과민성을 증가시키고 anti-CD69 Ab 투여가 이를 억제하는 것으로 나타나 알레르기 유발 호산구성 기도 염증과 과민성의 병인에 중요한 역할을 한다46. Siglec-F는 eosinophil 표면 수용체이고47, Gr-1+는 과립구 특이 세포 표면 단백질로 히스타민과 같은 알레르기 매개인자들의 분비를 유발시키면서 IL-4, IL-5, IL-13 등의 사이토카인 생성에 관여함으로써 기도염증을 악화시키는 요인으로 작용한다48. 따라서 GGX가 BALF 및 폐조직에서 면역세포들의 발현을 억제시키는 것은 GGX가 면역세포들이 관여하는 천식의 염증반응을 감소시키는 작용이 있음을 나타낸다.
천식을 유도한 동물모델의 BALF를 수집하여 ELISA를 시행한 결과, 대조군의 IL-4, IL-5, IL-13 및 IFN-γ는 정상군과 비교하여 유의하게 증가하였으며, GGX를 투여한 실험군에서는 대조군과 비교하여 유의하게 감소하였다. IL-4는 IgE 전환 유도, eosinophil의 이동 촉진, Th2 림프구의 cytokine 방출 유도, 혈관세포부착분자(vascular cell adhesion molecule-1, VCAM-1)의 발현, 점액 분비 등 천식의 중요한 염증유발 기능을 매개한다49,50. IL-5는 eosinophil의 분화, 모집, 생존 및 탈과립화에서 중심이 되는 병리적 역할을 수행하여 IL-5 억제 또는 수용체 차단과 같은 치료적 접근의 표적으로 주목되고 있다51. IL-13은 goblet 세포 분화 증가, fibroblast 활성화, 기관지 과민성 상승, B 세포 항체 생성의 IgM에서 IgE로 전환 등을 초래한다52. IFN-γ는 동물실험에서 Th2 세포에 의해 유발되는 천식에서 보호 역할을 하는 것으로 알려져 왔으나 이와는 대조적으로 천식 급성 악화가 발생한 환자의 BALF와 혈청 내에서 IFN-γ의 상승이 관찰되며, 기도 폐쇄 및 스테로이드 반응성과의 관련성이 밝혀지면서 IFN-γ가 Th2 경로 이외의 면역반응으로 나타나는 천식 염증반응에서 중요한 역할을 하는 것으로 확인되었다53,54. 따라서 GGX는 천식 염증의 가장 중요한 특성인 Th2 면역반응 관련 염증 cytokine들을 조절하고 Th1 면역반응의 대표적 매체인 IFN-γ를 억제하는 결과를 보임으로써 GGX가 천식의 다양한 염증 기전에 작용할 가능성을 보여주고 있다.
천식을 유도한 동물모델의 폐조직을 수집하여 RT-PCR을 시행한 결과, 대조군의 IL-13, TARC 및 MCP-1은 정상군과 비교하여 유의하게 증가하였으며, GGX를 투여한 실험군에서는 대조군과 비교하여 유의하게 감소하였다. IL-13은 eosinophil의 폐 이동 촉진, eotaxin의 합성 증가, eosinophil에 결합하는 adhesion molecule의 상향 조절, 기도 상피세포의 투과성 증가 등 천식의 주요 병리학적 특징에 관여한다52. TARC는 Th2 세포의 선택적 chemokine으로 천식 환자의 기도에서 상향 조절되고, 동물실험에서 TARC의 중화(neutralization)가 폐로 T 세포와 eosinophil이 침윤하는 것을 억제하면서 기도 과민성을 감소시키는 것으로 나타났으며, 천식뿐만 아니라 알레르기 비염과 같은 Th2 매개 질환의 발병에 관련되는 것으로 알려져 있다55. MCP-1은 비만세포 또는 basophil로부터 histamine과 leukotrien 방출을 자극하고, TGF-β 및 pro-collagen의 fibroblast 생성을 유도하고, Th2 세포의 분극화를 촉진한다56. 이러한 결과는 GGX가 점액 과분비와 eosinophil 등 염증세포의 침윤을 억제하여 천식에 효과를 나타낼 수 있음을 시사한다.
천식 동물모델의 폐조직과 기관에 대한 조직학적 관찰에서 대조군에서는 염증세포 침윤, 점액세포와 goblet 세포의 증식, 콜라겐 침착, 기도벽의 비후, 폐포의 확장 및 파괴가 관찰되었고, GGX를 투여한 실험군에서는 이와 같은 병리적 변화를 유의하게 감소시키는 것으로 나타났다. 천식의 만성 기도염증의 결과로 발생하는 기도의 구조적 변화인 기도개형(airway remodeling)은 질환의 중증도와 연관이 있으며 비가역적인 기도협착을 가져온다6. GGX를 투여한 실험군에서 이러한 변화를 감소시키는 것으로 나타나 GGX가 천식의 중증화에 따른 비가역적인 기도의 변화를 억제할 가능성이 있음을 확인하였다.
천식 동물모델의 폐조직을 IHF staining을 통해 관찰한 결과, 대조군에서 기도주변으로 증가된 STAT3 및 GATA3 단백질 발현이 GGX를 투여한 실험군에서 감소하는 것이 관찰되었다. STAT3는 cytokines와 성장인자들에 대한 반응으로 다양한 유전자의 발현을 매개하는 전사인자로서 천식에서는 Th2, Th17 세포 및 M2 macrophage의 분화를 유도하고 내피세포의 기능장애를 초래하여 궁극적으로 기도과민성 및 기도개형을 유발한다57. GATA3는 중립 상태의 CD4+ lymphocytes로부터 Th2 세포가 분화하는데 중요한 역할을 하는 전사 인자로 알레르기 염증을 매개하는 IL-4, IL-5 및 IL-13의 유전자 발현에 필수적이다58. GGX를 투여한 실험군에서 STAT3 및 GATA3 생성을 억제하는 것으로 나타나 GGX가 천식의 중증화에 따른 비가역적인 기도의 변화를 억제할 가능성이 있음을 확인하였다.
결과를 종합하면 GGX는 천식 동물모델에서 염증 cytokine과 면역세포들의 활성을 억제하고, 폐조직 손상에 대한 보호효과를 통해 천식에 대한 치료 효과를 나타낼 것으로 사료된다.
Ⅴ. 결 론
천식에 대한 GGX의 효과를 평가하기 위해 OVA로 유도한 천식 동물모델에서 관련 면역세포, cytokine, 조직학적 변화에 대한 영향을 관찰한 결과 다음과 같은 결론을 얻었다.
1. GGX는 대조군에 비하여 BALF의 총 세포수를 100, 200, 400 mg/kg 투여군에서 유의하게 감소시켰다.
2. GGX는 대조군에 비하여 BALF의 면역세포 FACS 분석에서 macrophage, CD4+, CD8+ 세포를 400 mg/kg 투여군에서 유의하게 감소시켰고, lymphocyte를 100, 400 mg/kg 투여군에서 유의하게 감소시켰으며, CD62L-CD44high+ 세포를 200, 400 mg/kg 투여군에서 유의하게 감소시켰고, neutrophi, CD4+CD69+, Gr-1+SiglecF- 세포를 모든 농도에서 유의하게 감소시켰다.
3. GGX는 대조군에 비하여 폐조직의 면역세포 FACS 분석에서 CD19+ 세포를 200 mg/kg 투여군에서 유의하게 감소시켰고, neutrophil을 100, 200 mg/kg 투여군에서 유의하게 감소시켰으며, Gr-1+SiglecF- 세포를 200, 400 mg/kg 투여군에서 유의하게 감소시켰으며, eosinophil/marcrophage, CD3+, CD3+CD193+, CD4+, CD8+, CD4+CD69+, CD62L-CD44high+ 세포를 모든 농도에서 유의하게 감소시켰다.
4. GGX는 대조군에 비하여 BALF 내 IL-4와 IL-13의 증가를 모든 농도에서 유의하게 억제시켰고, IL-5의 증가를 200, 400 mg/kg 투여군에서 유의하게 억제시켰으며, IFN-γ의 증가를 400 mg/kg 투여군에서 유의하게 억제시켰다.
5. GGX는 대조군에 비하여 폐조직의 IL-13, TARC, MCP-1 mRNA의 발현을 400 mg/kg 투여군에서 유의하게 감소시켰다.
8. GGX는 대조군에 비하여 H&E, M-T, PAS, AB-PAS 염색을 통한 조직학적 관찰에서 폐조직 및 기관의 손상을 100, 200, 400 mg/kg 투여군에서 유의하게 감소시켰다.
9. GGX는 IHF 염색을 통한 관찰에서 STAT3 및 GATA3 단백질 발현을 억제시켰다.
이상으로 GGX가 면역세포와 염증 cytokine에 대한 조절을 통하여 천식에 효과를 나타낼 가능성을 확인하였고, 이러한 효과는 400 mg/kg 농도에서 더 현저하게 나타났다.