I. 서 론
췌장암은 췌장에 생긴 암세포로 이루어진 종괴를 말한다. 조직학적으로는 관선암종(ductal adenocarcinoma)이 가장 흔하고 대표적인 조직학적 유형이며 모든 췌장암의 90%를 차지하며 다른 유형의 종양들도 이 유형에서 기원하는 경우가 많다1.
췌장암은 우리나라에서 8번째로 흔한 암으로, 소화기 암종 중 위암, 간암, 대장암 다음으로 흔한 암이며, 치료 기법이 지속적으로 발전하였음에도 불구하고, 5년 상대 생존율은 10% 이내에 머물고 있어, 지난 40년간 생존율 개선은 크게 나아지지 않은 실정이며, 사망률 또한 꾸준히 증가하고 있으며, 암 사망 원인 중 5번째 순위로 예후가 불량하다1,2.
췌장암은 다른 암과 마찬가지로 수술 여부, 전이 정도 등에 따라 적합한 수술, 항암화학요법이 표준 치료를 행하지만 예후가 불량한 데는 여러 가지 이유가 있다3. 발생 초기 진단 가능한 특이적 증상이나 징후가 없어, 발병 초기부터 매우 악성의 경과를 보이는 경우가 대부분이며, 장기 생존을 기대하기 위해서는 근치적 목적의 외과적 절제술이 필요하나 주변 주요 혈관들이 위치하여 상대적으로 작은 종양임에도 절제술을 시행하기 어려우며, 진단 당시 절제가 가능한 췌장암은 전체 환자의 약 10%-20%에 불과하다. 증상 없이 초기에 발견되더라도 수술 후 미세 전이 및 림프절 전이가 많으며, 수술 후 70%-80% 정도에서 암이 재발하는 만큼 재발률도 높아 항암화학요법과 방사선 치료가 중요한 역할을 하지만 이 또한 한계점들이 있다4-7.
Gemcitabine 항암화학요법이 1990년대 초에 개발된 이후 5-FU(5-fluorouracil)에 비해 생존율 향상에 효과가 있음이 보고된 후 약 20년간 췌장암의 표준치료로 사용되었으나, 항암제 처리 후 암세포의 약재 민감성 및 신호전달기전이 뚜렷하게 밝혀져 있지 않고, 저항성이 강하여 항암제에 대한 암세포의 반응률이 20% 미만 정도로 낮아, gemcitabine 항암화학요법 후의 중앙 생존 기간 및 생존 기간이 크게 개선되지 못하였다. 따라서 이를 극복하고 췌장암 환자의 생존율 향상을 위해 기존 항암 요법의 효과와 안전성을 개선하고자 하는 방향으로 최근 gemcitabine에 capecitabine과의 또는 abraxane(nab-paclitaxel)과의 병합치료, FOLFIRINOX(leucovorin calcium+ fluorouracil+irinotecan hydrochloride+oxaliplatin)로 대표되는 보조 항암 화학요법의 발전은 장기 생존 결과를 개선하였고, 현재 NCCN(National Comprehensive Cancer Network) 가이드라인에서는 gemcitabine과 abraxane 병합요법을 일차적으로 선택할 수 있는 약물로 제시하고 있다. FOLFIRINOX 치료가 우수한 성적이 보고되었으나 호중구감소증, 설사 등의 위중한 독성이 흔히 발생하고, FOLFIRINOX 요법에서 5-fluorouracil bolus를 제거한 mFOLFOX (modified-FOLFIRINOX) 또는 gemcitabine과 capecitabine 등의 병합 치료에서는 위장독성, 미각저하, 피로, 호중구감소증 등의 많은 부작용으로 삶의 질을 떨어뜨리고, 낮은 순응도로 인해 6개월 치료를 완료하지 못하여 보조 항암 치료의 이득을 기대한 목표보다 얻지 못하는 경우가 다수 발생한다. 또한, 아직 국내에서는 gemcitabine과 nab-paclitaxel 병합요법 및 일부약제는 아직 보험급여가 인정되지 않는 부담이 큰 비급여 항목이거나, 허가되어 있지 않아 항암제에 대한 가용성 및 접근성은 높지만, 사용에는 여러 한계가 있다8.
이처럼 암에 대한 표준치료의 부족한 치료 효과, 치료에 따른 부작용 및 항암화학요법의 빠른 내성 획득 등의 한계를 보완하기 위해 전 세계적으로 한의학을 포함한 보완대체의학(complementary and alternative medicine, CAM)및 통합 의학 치료(integrate medicine theraphy, IMT)에 대한 관심이 늘어나고 있으며, 적절한 다학제적 접근이 더욱 필요한 상황이다9-11. 하지만 실제 국내 임상에서는 한의학치료의 객관적 근거 자료의 부족, 간 독성 및 신장 독성에 대한 우려 등으로 심지어 금기시되고 있는 실정으로 활용도가 낮으며, 한의학을 이용한 췌장암 치료 관련 연구는 다른 폐암, 대장암, 유방암 등 타 암 종에 비해서 수행연구 및 증례보고 등 관련 연구가 턱없이 부족한 실정이다8,12.
본 증례는 2017년 10월에 두부의 경계성 절제가능 췌장암 진단을 받고 2017년 11월 8일부터 2018년 1월 21까지 선항암화학요법(neoadjuvant chemotheraphy)으로 FOLFIRINOX 6 cycle 시행 후 2018년 3월 2일 수술 치료 후 2018년 4월 9일부터 2018년 6월 19일까지 수술 후 보조 항암화학요법(adjuvant chemotheraphy)으로 FOLFIRINOX(DR20%) 6 cycle 시행하였으며, 2018년 3월 16일부터 2022년 9월 30일까지 항암 부작용 관리 및 항 종양 치료를 위해 본원 내원하여 통합 암 치료 병행하여 현재 췌장암 진단 후 5년, 2022년 10월 26일로 완치판정까지 이루었기에 유의미한 사례로 이를 보고하고자 한다.
II. 증 례
본 연구는 ○○한방병원 기관생명윤리위원회(IRB)에서 심의 면제 승인을 받았다(HR-2305-01).
1. 환자 정보
1) 환 자 : 김○○, 만 59세, 여성
2) 최초진단 : 2017년 10월 건강검진으로 시행한 복부 초음파상 이상 소견 확인되어 추가 work up 통해 10월 31일 진단됨.
3) 과거력, 가족력 및 사회력
(1) 과거력 : DM, hyperlipidemia, hypothyroidism, operation of myoma of the uterus
(2) 가족력 및 사회력 : 父(HTN, DM), 母(DM), 사회력 별무
4) 현병력 : 상기 환자는 2017년 10월 ○○병원에서 건강검진으로 시행한 복부 초음파 이상소견으로 ○○대학병원에서 2017년 10월 17일 및 10월 19일 진행한 복부 컴퓨터 단층 영상검사(CT-Abdomen & Pelvis(Abdomen)) 및 복부 자기공명영상(MRI-Abdomen) 검사상 췌장암 의심 소견으로, 2017년 10월 31일 췌장암 두부에 대한 내시경 초음파 유도하 세침 흡인 생검(Pancreas, head, EUS-fine needle aspiration biopsy)으로 조직학적으로 선암(adenocarcinoma)으로, 경계성 절제가능 췌장암(Borderline resectable pancreatic cancer(BRPC); SMV abutting, 0.7 cm, firm mass(Fz. Adenoca))으로 진단받았다. ECOG(eastern cooperative oncology group) 평가 중 PS(performance status) 1로 확인되어, 2017년 11월 8일부터 2018년 1월 21일까지 선항암화학요법으로 FOLFIRINOX를 2주 간격으로 6 cycle 시행하고, 2018년 3월 2일 유문부 보존 췌두부십이지장 절제술(pylorus preserving pancreaticoduodenectomy, PPPD)을 시행하였다. 수술 검체로 조직병리검사 시행한 결과 조직병리 진단(Tissue Pathology Diagnosis)은 ductal adnenocacinoma, moderately differentiated, residual 1.6×1.5×1.2 cm, Stage 1(ypT1c(1.6 cm)N0(0/28) M0)으로 최종 진단되었다. 이후 수술 후 보조 항암화학요법으로 FOLFIRINOX(20%DR)를 2018년 4월 9일부터 2018년 6월 19까지 6 cycle 추가 시행하였다(7~12 cycle(finish)). 2018년 3월 16일부터 2022년 9월 30일까지 수술 후 체중감소, 수술 부위 통증으로 인한 불면, 소화불량 등의 수술 후 부작용 관리 및 수술 후 회복 도모와 혈구 감소, 오심, 식욕부진 등의 항암화학요법 부작용에 대해 한방 치료 포함한 통합 의학 치료를 희망하여 ○○한방병원 외래 통원 치료 및 입원 치료 시행하였다.
5) 주소증 및 변증소견
(1) 최초 진료 시(2018년 3년 16일)
① 주소증 : operation site disfomort(복부불편감, 引痛, 통증으로 인한 수면장애), low back pain, general weakness(下肢無力感, 少氣感), body weight loss(2017년 1월 대비 수술 후 약 10 kg 감소)
② 수 면 : 수술 후 통증으로 淺眠. 새벽 4~6시경에 수면 취함. 그전으로는 頻覺.
③ 식 사 : 1/3 이상 식사 어려움. 조기 포만감
④ 대 변 : 不利, 수술 이후 첫 배변(3/14)
⑤ 소 변 : 주간 4~5회/야간 2~3회
⑥ 변 증 : 形體消瘦, 口咽乾燥, 脈沈細, 煩燥不安, 陰虛內熱證
(2) 수술 후 항암 치료 시(2018년 4월 16일 이후)
① 주소증 : 우울감, low back pain(VAS 5) 지속, 구내염, 잇몸 부종, 식욕부진, 소화불량, 식후 더부룩함, 항암치료 후 설사
② 수 면 : 하루 평균 3~4시간 수면하나, 30~ 40분 간격으로 頻覺
③ 식사 및 소화 : 식욕저하, 식후 더부룩함 지속됨. 트림 지속적으로 나옴.
④ 대 변 : 약간 굳은 양상. 2~3일 1회 배변→ 항암치료 후에는 설사, 무른변 양상
⑤ 소 변 : 주간 4~5회/야간 2~3회
⑥ 변 증 : 飮食無味, 神疲乏力, 少氣懶言, 面蒼白, 舌邊齒痕, 薄白苔, 脈細弱, 氣虛證
2. 치 료
1) 한방 치료 : 한방치료는 침구치료, 복부 뜸 치료를 기본으로 하고, 산삼 면역약침치료를 병행하였다. 증상에 따라 탕제 복용뿐만 아니라, RGS, 항암 휘림플러스, 헤르코필 등의 한방 면역약제 복용을 겸하였으며, 필요시 증상에 따라 보험 산제를 활용하였다.
(1) RGS : 산양산삼 분말 6.6 g을 증류수에 전탕한 액상 한약제 50 ml를 식후 1시간에 복용 종양 크기 축소 및 면역력강화를 위해 1일 3회 경구복용 하였다.
(2) 항암휘림플러스 : 삼칠근, 동충하초, 산자고, 인삼, 우황, 진주분, 유향, 몰약 8가지 약제를 300 mesh로 분쇄하여, 캡슐에 담아 1T 500 mg을 1일 1회 복용하였다.
(3) 항암헤르코필 : 공진단(녹용 320 g, 당귀 320 g, 산수유 320 g)의 분말 960 g, 동충하초 160 g, 사향 40 g, 노루궁뎅이버섯 160 g을 수치법제후 분말화 한 후 봉밀 51.4 g과 혼합하여 반죽하여 대환으로 제환하여, 1환 5.5 g을 1일 1회 복용하였다.
(4) 산삼면역약침 : 산양산삼미세분말 1 kg에 물 10L를 가하여 85 ℃에서 72시간 끓인 후 증류추출액을 50 ml 병입하여 제조하였고, 1일 1회, 1회에 5 ml씩 천추(ST25), 중완(CV12) 등의 穴位에 주입하였다.
(5) 침구치료 및 뜸치료 : 공최(LU6), 양구(ST34), 내관(PC6), 합곡(LI04), 태충(IR03), 족삼리(ST36), 곡지(LI11) 등에 15분간 유침(동방메디컬, 0.20 mm×0.30 mm. 1회용 스테인리스호침사용)하였다. 뜸 치료는 1일 1회로 기기구를 이용하여 신궐(CV4), 중완(CV12)에 뜸 치료를 1일 1회 30분간 시행하였다.
(6) 한약치료 : 환자의 수술 후의 증상 또는 항암치료에 따라 나타나는 부작용 및 주소증에 따라 한약치료를 시행하였다. 십전대보탕(十全大補湯, Sibjeondaebo-tang)을 가장 오랜 기간동안(174일) 투약하였으며, 삼출건비탕(蔘朮健脾湯, Samchulgeonbi-tang)이 다음으로 투약되었다. 이외에 쌍화탕(雙和湯, Ssanghwa- tang), 도적강기탕(導赤降氣湯, Dojukgangki- tang), 귀비탕(歸脾湯, Guibi-tang), 향사양위탕(香砂養胃湯, Hyangsayangyi-tang) 등의 탕제가 활용되었으며, 곽향정기산, 양혈사물탕, 쌍화탕 및 기타 산제는 증상에 따라 대증요법으로 단기간 투여 치료 제제로 활용되었다. 십전대보탕 및 삼출건비탕의 약제 구성은 아래 표와 같다(Table 1).
Table 1
Prescription of Herb Medicine
2) 현대의학적 치료
(1) 항암화학요법 : FORIFINOX(Eloxatin 132.6 mg+Irinotecan 280.8 mg+Leucovorin 624 mg +5-FU iv push 624 mg and 5-FU iv 3744 mg)을 2주 간격으로 2017년 11월 8일부터 2018년 1월 21일 까지 6 cycle, 2018년 4월 9일부터 2018년 6월 19까지 FORIFINOX(20%DR) (Eloxatin 106 mg+Irinotecan 225 mg+Leucovorin 500 mg+5-FU iv push 500 mg and 5-FU civ 2995 mg) 수술 후 보조항암요법으로 6 cycle 추가 치료하여 총 12 cycle 시행하였다.
(2) 미슬토, 겨우살이 : Abnoba Visccum Qu(Viscum Album 20 mg/mL)를 주 2회 피하주사 시행하였다.
(3) Thymosin α1 : 면역력 증진을 위해 인체에서 분비되는 thymosin과 유사한 3차원 입체구조인 thymosin alpha 1으로 구성된 주사액. 자닥신 주(Zadaxin) 또는 헤리 주(Heri) (Thymosin-α1 1.6 mg)를 주 2회씩 피하 또는 근육 주사하였다.
(4) 글루타치온 : 루치온주(Glutathione 600 mg) 1 amp을 생리식염수 100 ml에 혼합하여 주 2회 정맥주사 시행하였다.
(5) 비타민C : 생리식염수 750 ml에 비타민C 60 g을 혼합하여 주 2회 정맥주사 하였는데, 매번 진코발(Ginkgo Leaf Dried Ext. 3.5 mg/mL) 1 amp, 삐콤헥사 주(Beecomhexa injection 2 mL; Vitamin B1, B2, B3, B5, B6, B12) 1 amp을 혼합하여 사용하였다.
(6) 이뮨셀-엘씨주(Immuncell-LC, 녹십자셀) : 환자 혈액에서 약 100-150 ml 정도의 혈액을 채혈하여 2-3주 동안 항암면역세포인 cytotoxic T cell(CTL)과 cytokine induced killer cell (CIK)을 선택적으로 특수 배양한 후 극대화된 면역 세포를 다시 환자에게 투여하는 치료법으로 총 27회 주입하였다.
3. 평가도구
1) 영상 검사 : ○○대학병원 주기적으로 follow up 하여 복부 초음파와 췌장 및 흉부 CT(CT Pancreatobiliary+Pelvis, CT Chest+3D), PET-CT (FDG PET-torso)를 통해 평가하였다.
2) Response Evaluation CriteriaI Solid Tumors (RECIST) : RECIST version1.1에 따르면 종양에 대한 치료반응은 Complete Response(CR), Partial Response(PR), Progressive Disease(PD), Stable Disease(SD)로 나누어 평가하며, 고형종양에서의 치료반응에 대한 객관적 평가기준으로, 고형암의 치료법을 평가하는 임상시험에서 대부분 사용된다13.
3) 혈액검사(Blood test) : 치료기간 동안 시행된 통합의학치료의 안전성을 검사하기 위하여 간 기능 검사 및 신장기능 검사를 시행하였고, 병용투여 기간 동안의 변화를 관찰하였다. 또한 WBC, CRP 수치 등 염증 반응과 종양표지자의 치료 기간 동안의 변화를 관찰하였다.
(1) 종양표지자(tumor marker) : 종양표지자는, 종양세포에서 생성되어 분비되거나 종양 조직에 대한 반응으로 정상조직에서 생성되는 물질로, 혈액이나 체액 또는 조직에서 발견된다14,15. 종양의 치료 반응 평가에 보조적인 수단으로 활용될 수 있으며, 췌장암의 종양표지자는 CEA(carcino embryoni cantigen), Ca19-9(carcinomaantigen19-9)로 정상 범위는 각각 0~6.5(ng/mL), 0~34(U/mL)이다.
(2) National Cancer Institute Common Terminology Criteria for Adverse Event (NCI-CTCAE) : 암 환자에게 시행된 치료로 인한 부작용의 정도를 정량화, 표준화한 평가 도구이며, Grade 1에서 Grade 5까지로 분류하고 있다. Grade 1은 무증상이거나 증상이 경미하여 경과 관찰을 요하는 상태, Grade 2는 중등도의 부작용으로 원활한 일상생활에 제약이 있는 상태, Grade 3는 당장의 생명의 위협은 없으나 중증의 상태로 일상생활이 불가한 상태이며, Grade 4는 생명의 위협이 있는 상태로 긴급한 치료가 필요한 상태이며 Grade 5는 부작용으로 인한 사망에 이른 것을 의미한다. 본 증례에서는 NCI-CTCAE version 5.0에 의하여 치료에 따른 간기능, 신장기능, 골수억제기능의 부작용을 평가하였다9.
4. 치료경과
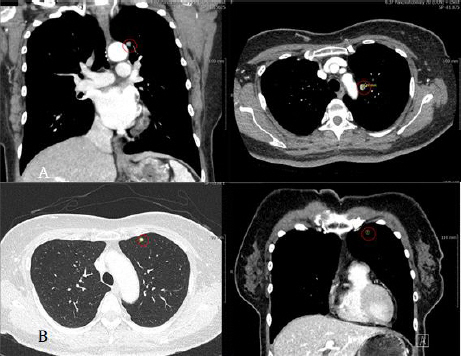
1) 영상 검사 및 RECIST : 2018년 3월 2일 PPPD 수술 치료 후 2018년 3월 6일 촬영한 Pancreatobiliary +Pelvis CT상 수술 후의 기복증(pneumoperitoneum) 있으나, 수술 후의 일시적인 증상 이며, 이후 3개월에서 6개월 동안의 주기적인 추적 관찰 동안 수술 후 NIC(no interval change)를 유지하여 최종적으로 Complete Response(CR) 소견을 나타내었고, 2019년 9월 30일 촬영한 Chest CT상 9 mm nodule이 LUL(left upper lobe)에 확인되었으나, 이후 촬영한 흉부 CT상 큰 변화 없었으며, 2022년 10월 24일 시행한 CT상 LUL에 불분명한 매우 작은 nodule이 확인되었으나, 전이 소견은 아닌 것으로 보여 3개월마다 주기적으로 추적 관찰할 것을 권고받았다(Table 2, Fig. 1-4).
Table 2
The Results of Imaging Examination
Fig. 4
CT chest with contrast and 3D reconstruction (without contrast media).
A) 2019-09-30
B) 2022-10-24
2) 혈액 검사
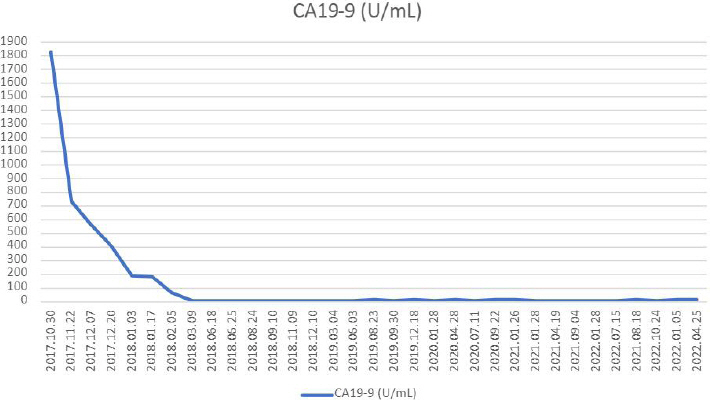
(1) 종양표지자 : 2017년 10월 30일 혈액검사 상 tumor marker의 initial 수치는 CA 19-9는 1825, CEA 4.1로 확인되었으며, 선 항암치료 및 PPPD 후 CA19-9는 5, CEA 1.2로 췌장암에서 상대적으로 특이도가 더 높은 CA 19-9의 수치는 선 항암치료 및 수술 치료 시행까지는 수치가 확연히 감소하였다. 이후 2018년 3월 16일 ○○한방병원 내원하여 통합 의학 치료를 병행한 시기의 CA 19-9 수치는 상승과 하락을 반복하였으나, 정상 범위 0~34(U/mL)를 벗어나지 않았다. CEA 수치 또한 평균 2.4로 정상 범위 이내 0~6.5 (ng/mL)를 지속적으로 유지하였다(Fig. 5).
(2) 기타 혈액 검사 및 NCI-CTCAE : CBC, LFT, RFT 포함 기타 혈액 검사 결과 수치는 아래와 표와 같으며, 항암치료에 따른 골수 기능 저하 및 수술 치료 후의 백혈구 및 염증 수치 또는 간기능 수치 상승 등의 이상 수치 변화가 있었으나, 일시적인 변화로 대부분 정상범위 내로 안정화 되었다. 통합 의학 치료 기간 동안에도 대체적으로 NCI-CTCAE Grade 0-1을 유지하였다. AST, ALT 등의 간기능 수치는 정삼 범위를 유지하였으며, 신장 관련 수치에서 BUN, Creatinine 등의 일시적 상승이 있었으나, GFR 수치 저하가 없고 일시적 상승으로 신장 독성이 없었다. CRP도 정상 범위를 유지하여 한의 치료에 대한 간 독성 및 신장 독성의 안전성에 대해 유의미한 결과를 확인할 수 있다(Table 3).
Table 3
Laboratory Findings
WBC : white blood cell, 103/μL, RBC : redbloodcell, 106/μL, PLT : Platlet, 103/μL, T-bil : total-bilirubin, g/dL, ALP : alkalinephosphatase, U/l, AST : aspartateaminotransferase, U/L, ALT : alanineaminotransferase, U/L, BUN : bloodureanitrogen, mg/dL, Cr : Creatinine, mg/dL, GFR : mL/min/1.73 m2, CRP : C-reactiveprotein, mg/dL
III. 고 찰
췌장암은 2020년 한국 중앙 암 등록 사업 연례보고서에 따르면, 췌장암은 2017년도 악성 종양 등록건수 총 232,255명 중 7,032명(남자 3,733명, 여자 3,299명)으로 전체 암종 중 발생 등록 분율 3.0%, 8위를 차지하고 있으나, 5년 상대생존율은 12.2%로 10대 암종 중 남녀 모두에서 최하위를 차지한다. 2020년 통계청 자료에 의하면 2017년 발생률은 인구 10만 명당 13.7이며, 2018년 사망자 수는 6,036명이며, 사망률은 인구 10만 명당 11.8이며, 고령에서 10만 명당 사망자 수가 급격히 증가하며, 남녀 모두 매년 사망률이 꾸준히 증가하고 있다. 발생률이 높은 암종임에도 불구하고, 암 사망 원인 중 5번째 순위를 차지하고, 5년 생존율이 10%에 그치는 예후가 불량한 암이다16,17.
췌장암 환자에서 장기 생존을 기대하기 위해서는 근치적 목적의 외과적 절제술이 필요하다. 절제가능한 췌장암의 경우 췌장암의 위치에 따라 췌장 두부는 Whipple’s operation 또는 PPPD, 체부 및 미부에 위치한 경우는 원위 췌장 절제술(distal pancreatectomy)을 시행한다. 2020년 NCCN 가이드라인 및 2017년 International Association of Pancreatology(IAP) 등에 따르면 암의 국소 침범 정도를 더욱 세분화하여 절제 가능한 췌장암과 절제 불가능한 국소 진행성 췌장암, 두 군의 중간에 속하는 경계성 절제 가능성을 지닌 췌장암으로 군을 분류하고, 국소 췌장암 또한 절제 가능성 여부에 따라 더욱 세분화하는 등 평가 기술의 발전에 따라 췌장암의 절제 가능성 및 질병 상태에 대한 평가를 명확히 하여 수술 치료의 예후를 더욱 개선하고 생존율을 높이려는 의학적 시도 및 발전이 이루어졌다18,19. 하지만, 후 복막강에 위치한 해부적 특성으로 조기 진단과 외과적 접근이 어려우며, 초기에 발견된다 하더라도 주위 림프절로 전이가 호발하여 절제가 가능한 췌장암은 전체 환자의 약 10%-20%에 불과할 정도로 절제 가능한 예시가 적다. 또한, 절제 범위가 비교적 큰 수술임에도 불구하고 호발 연령이 70-74세로 고령 환자가 대부분이라 수술 후 회복도 느려 절제를 받은 환자의 2/3에서만 수술 후 보조 치료가 가능하다. 심지어 1/4에서는 수술 후 6개월 내에 재발하고 결국 75%-80%에서 재발한다. 이에 따라 전이가 동반되지 않은 췌장암에서도 수술 전 전신 상태가 비교적 좋을 때 다양한 형태의 항암치료와 방사선치료를 선항암치료로 시행하여 치료 성적을 향상시키고, 수술 후 보조요법으로 미세 잔존암을 없앰으로써 전이 재발을 억제하고 궁극적으로 완치율을 높여 전체 생존기간 향상을 도모하려는 시도가 지속적으로 이뤄졌다20.
췌장암의 항암치료는 pyrimidine계 항대사물질(antimetabolite)인 gemcitabine이 1990년대초에 개발되어 기존의 5-FU에 비해 임상반응(clinical benefit response)의 호전과 경도의 생존율 향상 효과가 있음이 보고된 후 진행성 췌장암의 1차 치료제로 지속 사용되었다21. 하지만, gemcitabine에 대한 췌장암의 전체 반응률은 20% 미만이며, 중앙 생존기간도 5-FU와 비교한 결과, 생존 기간이 한 달 정도밖에 연장되지 못하였고, 대부분 1년을 넘지 못하였다5-7,22-24. 기존 항암요법의 한계와 안전성을 개선하고자 하는 방향으로 FOLFIRINOX 또는 mFOLFIRINOX의 용량을 감량하여 독성을 경감하려는 연구, abraxane과 gemcitabine 병합요법에 다른 약물을 추가하는 연구 등의 임상연구가 활발히 진행되었다. Conroy 등25의 연구에서 FOLFORINOX 4제 병합치료는 중앙 생존 기간 및 무진행 생존 기간 모두 gemcitabine 단독군에 비해 유의미한 개선 효과가 있음을 보고하였지만, 혈청 빌리루빈 수치가 거의 정상이고 활동도가 좋은 환자만을 대상으로 시행하였으며, 골수 억제로 인한 호중구감소증으로 42%의 환자에서 granulocyte-colony stimulating factor를 투여했으며, 호중구 감소성 발열(neutropenic fever) 등의 부작용이 동반되어 gemcitabine 단독 투여군에 비해 높은 부작용을 나타내는 등의 한계점이 있었다. 또한 FOLFIRINOX 요법은 2016년부터 수술이 불가능한 전이성, 진행성 췌장암 환자에게 ECOG PS가 0 또는 1인 경우에 한하여 고식적 요법 1차 투약 요법으로 보험 급여 적용이 가능하고, 완전 절제가 가능한 1~3기 췌장선암에 한하여 gemcitabine 단독 요법이 수술 후 보조요법으로 투여 기간 6주기 동안만 급여 적용이 가능하는 등의 항암제 활용에도 여러 제한이 있는 실정이다.
췌장암은 이렇듯 서양의학 치료만으로는 여러 한계가 있어 표준 치료 연구, 발전을 통한 사망률 개선뿐 아니라 질병 치료 및 건강증진, 부작용 완화를 통한 여생에 대한 삶의 질 관리를 위해 최근 CAM 및 한의 암 치료 포함 IMT에 대하여 관심이 높아지고 여러 연구들이 진행되고 있다. 이러한 연구를 통해 IMT가 항암화학요법의 부작용을 완화시킬 뿐만 아니라 삶의 질을 높이고, 나아가 암환자의 생존율을 증가시킨다고 보고하고 있지만, 국내에서는 한의학의 암치료가 근거 중심 의학에 기반을 두고 있지 않다거나 충분한 근거가 부족하다는 이유, 양약과 한약 간의 상충작용이나 한약 자체의 간 독성 및 신 독성에 대한 우려로 공공연하게 금기시되어 실제 임상에서 한의학을 이용한 치료 활용 및 연구는 턱없이 부족한 실정이다. 암 치료에 있어 한의 및 통합 의학치료의 효과를 입증하기 위한 연구가 전반적으로 아직 부족한 점을 감안하더라도, 유방암, 폐암등 기타 암종에 비해 특히, 췌장암 관련 한의 암 치료 또는 통합 암 치료 연구 보고는 더욱 부족한 실정이다. 기존의 국내 췌장암 관련 한의 치료 또는 통합의학 치료관련 임상연구 중 증례보고는 9편 정도 확인되며, 수술 불가능한 간 전이된 진행성 췌장암으로 gemcitabine+ abraxane 병합 항암치료를 병행하는 환자에 대한 통합의학치료 2례12,14, PPPD 후 항암플러스 약제로 전이 및 재발을 예방한 사례26, 수술 불가능한 말기 췌장암에 대한 통합 치료를 통해 통증 감소 효과, 수술 후 보조 치료를 진행하지 않고 경과 관찰하던 중 재발된 환자에게 한의 기반 통합 암 치료를 시행한 사례 등의 증례 보고가 이루어졌다27. 림프절 전이 또는 간 전이된 진행성 말기 췌장암, 수술 불가능한 췌장암 등의 수술적 치료가 불가능한 췌장암이 대부분 이거나, 항암화학요법은 gemcitabine+ abraxane 병합 치료를 이용하였으며, 수술 후 adjuvant therapy가 없었거나, 추적 관찰하던 중 재발된 췌장암 환자에게 통합의학 치료를 이용한 증상 관리 또는 전이 재발 관리 위주였으며, 가장 호전된 사례는 부분 관해까지 이루어진 증례였다.
본 연구는 BRPC의 국소성 췌장 선암에 PPPD 수술 치료 시행 및 선항암치료와 수술 후 보조항암치료 포함 총 12 cycle의 FOLFIRINOX 치료를 시행하고 통합 의학 료를 시행한 증례로, 기존 연구 보고된 연구들과 달리 수술적 치료 및 보조 항암 치료까지 시행한 환자에게서 수술 후 전이 재발 없이 5년 생존 후 완전 관해까지 도달한 사례로 기존 연구들과 다른 유의미한 사례로 보고하는 바이다.
췌장선암을 진단받고 수술 치료 및 선항암 치료를 받은 후 내원한 환자를 대상으로 수술 후 보조 항암치료와 함께 2018년 3월 16일부터 2022년 9월 30일까지 중간 휴지기 약 3개월 제외, 약 4년 3개월간 통합의학치료를 시행하였다. 수술 및 항암 치료 후의 부작용 포함 제반 증상 개선 및 항암치료의 효과 증대를 위해 한약 치료 및 침, 뜸 치료의 한의학적 치료와 글루타치온, 고용량 비타민C 포함 현대 의학치료를 병행하였으며, 면역력 향상을 통한 전이 재발을 위해 미슬토, Thymosin α1, 이뮨셀 포함 현대 의학적 치료 및 한방 면역 약제, 면역 약침 등의 한의학적 치료를 병행한 통합의학치료를 시행하였다.
미슬토는 한의학에서는 ‘상기생’인, 숙주나무에 반생하는 식물인 겨우살이로, 성분 중 미슬토렉틴(Misletoe lectin)은 암세포와 결합한 후 세포 내부에 침투하여 단백질 합성을 저해하고 면역체계를 자극시켜 NK세포 및 대식세포의 활성을 증가시켜 종양세포의 성장을 억제하는 효과가 있다28. Thymosin α1은 흉수에서 추출한 물질로, 골수 세포에서 NK 세포, T 세포를 활성화시키고, 바이러스의 복제를 억제하는 면역조절 효과가 있으며, 골수를 보호하는 효과가 있어 항암 요법에 의한 골수 파괴를 보호하는 효과가 있다29. 글루타치온은 중금속, 발암물질 등을 제거하는 등의 해독 효과가 있는 광범위 해독제로, 강력한 항산화 효과가 있으며, cisplatin 또는 유사계열의 화학요법에 의한 말초신경병증 예방 및 치료에 효과적이고, 면역 시스템에 작용하여 암세포 증식 억제 효과가 있다30. 고용량 비타민C 주사는 일반적인 용량보다 훨씬 고용량의 비타민C를 투여함으로써 대사과정에서 형성된 과산화수소에 의해 암세포가 사멸되며, 암세포의 확산 및 전이를 억제하여 잔여 암세포 사멸 효과로 암에 대한 직접적인 치료 작용이 있다31. 이뮨셀은 환자의 혈액에서 면역세포를 선택적으로 추출, 배양하여 활동성이 강한 면역 세포의 숫자를 늘린 후 다시 환자에게 수혈, 주입하여 면역력을 극대화시켜 암을 직접적으로 치료하는 항종양제이다32.
박 등33의 췌장암 한의 임상 진료지침에 따르면, 통합 의학적 치료 시 종양의 절제 가능성 및 환자의 체력에 따라 방호(防護) 치료, 단순 한방 치료로 구분하여 시행해야 하며, 잠재적으로 제거 가능한 종양의 단계에서는 선 항암치료 시 방호 치료로 수술과 한방 병용 치료에서는 補氣養血 健脾益胃 滋補肝腎 하는 치료가 필요하며, 수술기에는 방호 치료로 補氣養血 健脾益胃하는 치료가 필요하며, 이후 항암 치료기에는 방어 치료로 補氣養血 健脾益胃 滋補肝腎의 방법이 필요함을 제시하였다. 모든 단계에서 補氣養血 健脾益胃가 기본적인 치료법임을 알 수 있다. 십전대보탕은 補氣血劑의 대표적인 처방으로서 補氣, 補血, 益氣回陽하는 약재로 주로 구성되어 골수, 비장, 흉선, 간 pyer’s patch 등에서 면역 반응에 관여할 뿐 아니라 대식 세포 및 비장 세포를 활성화시키고, 골수, 비장, 흉선의 기능을 증대시켜 T세포와 B세포 면역에도 관여하며, 항염증, 항산화 효과가 뛰어나고 면역 증강 활성이 높아 신체 생리기능의 저하를 회복시키고 면역력을 증진시켜 만성 허약성 질환에 광범위하게 활용되고 있다34. 삼출건비탕은 健脾養胃 運化飮食하여 소화액의 분비부족이나 위장의 연동감퇴로 인한 식욕부진, 少食, 식후의 팽만감 등을 해소하는데 활용되는 처방으로, 위장관련 증상 개선뿐만 아니라, MTX(Methotrexate)로 유발된 면역기능 저하에 대해 면역 증강의 효과가 있음을 실험연구를 통해 입증하기도 하였다35. 십전대보탕과 삼출건비탕 모두 補氣養血 健脾益胃의 치료법에 부합되는 것으로 볼 수 있다. 본 증례의 환자는 수술 후 내원당시에는 복부불편감, 引痛, 통증으로 인한 수면장애, 下肢無力感, 少氣感, body weight loss 등의 수술 후 부작용 관련 증상들을 주로 호소하였으며, 수술 수 보조 항암요법시에는 구내염, 구역감, 식욕부진, 소화 불량 등의 항암치료로 인한 부작용을 주로 호소하여 이를 해결하기 위해 탕제 및 침, 뜸치료의 한의 치료를 시행하였다. 탕제치료 및 대증요법으로 사용된 산제를 포함한 한약치료와 침, 뜸 치료의 한의학적 치료를 통해 수술 후의 下肢無力感, 少氣感 및 보조 항암 요법시 구내염, 구역감 등 NRS 5이상으로 증상을 호소한 주소증이 대부분 평균 NRS 1~2 정도로 경감, 해소되어 표준 항암치료의 효과를 방해하지 않고 주증상 개선에 유의미한 효과가 있음을 확인할 수 있었다.
면역 약침치료는 panecene, β-Elemene 등의 sesquiterpene계 화합물과 quercetin, anthocyanidin 등의 flavonoid 함유 제제로서 암세포의 진행 및 전이 억제를 위한 치료 목적으로 한의학적 경혈 부위인 중완혈 경혈 부위에 주입되었으며, 한의 면역약제 중 헤르코필은 cordycepin 및 T세포, NK세포, 대식세포의 활성도를 높여 항암 효과를 보이는 hetero-β-glucan 함유 제제이며, 항암 휘림플러스 및 RGS는 ginsenoside 함유 제제로서, cytotoxic T-cell의 활성을 유발하는 Rg3 10.64 mg, compound K 20.33 mg가 함유되어 면역 세포를 활성화시키고 암세포의 전이와 재발을 방지하고자 처치 되었다36,37.
통합 의학 치료를 시행하는 동안 혈액검사를 통해 간기능 신기능 관련 안전성을 보일 뿐 아니라, 종양 표지자의 감소 및 정상 범위 내 유지를 확인하였고, 영상 검사를 통해 NED(no evidence of disease), NIC(no interval change)에서 종양의 Complete Response(CR)를 확인하여 완전 관해까지 이끌어낼 수 있음을 확인하였다.
이에 따라 본 증례는 한의 암 치료 포함 통합의학치료가 단순히 수술 후 제반증상을 개선시키는 데 효과적일 뿐만 아니라, 간기능 및 신기능 관련 안전성을 유지하면서 표준 항암치료의 효과를 방해하지 않고 항암부작용을 완화시키고, 면역력 증강 효과를 통해 종양표지자 감소, 암의 재발 및 전이를 억제하는데 유의미한 효과가 있음을 확인할 수 있어 예후가 불량하고 근치적 수술 뿐 아니라 항암화학요법에도 여러 제한 및 한계가 있는 췌장암의 생존율 향상을 도모하는데 통합 의학 치료의 유의미한 연구 사례로 활용될 의의를 지닌다.
하지만, 본 증례보고는 후향적 보고로, 선제적인 통제 부재로 인한 한계점이 있다. 경혈 치료에 대해 동일한 시술자가 이루어지지 않아 치료에 대한 재현성이 낮고, 외래 치료 내원 주기 및 입원 치료의 기간이 일정하게 유지되지 않아 일관된 통제하에 치료를 시행할 수 없고, 투약된 면역 약재 또는 탕제 또한 일정하지 않아 특정 약재 또는 탕제의 약리 작용 및 효과를 명확히 입증하기 어려우며, 현대의학 치료와 한의학적 치료가 병행됨에 따라 더욱 명확히 구분하기 어렵다. 두 번째로 주소증에 대한 평가 도구 부족의 한계점이 있다. ECOG, FACT-Hep(FACT-Hepatobiliary cancer(liver, bileduct and pancreas)) 등을 이용한 객관적 평가 도구로 증상 평가가 이루어지지 않아 증상 개선 정도에 대한 정확한 비교 평가가 어려운 한계점이 있다.
Ⅳ. 결 론
본 연구는 비교적 조기에 발견하더라도 5년 생존율이 10% 정도에 불과한 예후가 불량한 췌장암 환자에게서 통합 암 치료를 통해 FOLFIRINOX 항암 치료에 따른 부작용을 감소시키고, 삶의 질을 개선시켰으며, 수술 후 75%-80%까지 재발률이 높은 암종 임에도 불구하고 진단 후 5년 무병 생존 및 2022년 10월 26일 자로 완치판정을 이룬 유의미한 증례이나, 여러 한계점이 있으며, 이에 향후 유사한 사례 포함 췌장암 환자 치료군에 있어서 한의학적 치료와 관련하여 객관적인 평가 도구를 및 선제적인 통제를 통하여 한의 치료 포함 통합 의학 치료에 대해 보다 수준 높은 증례보고 및 연구를 시행하는데 본 증례가 유의미한 자료가 될 것으로 기대한다.