I. 서 론
세계보건기구(world health organization, WHO)의 보고에 의하면 2019년 전 세계 사망자의 32%에 해당하는 1,790만 명이 심혈관 질환으로 사망하였다1. 2010년부터의 국민건강통계를 살펴보면 심혈관 질환의 대표적 위험인자들 중 고혈압 및 당뇨병의 유병률 그리고 흡연율이 오히려 감소하거나 크게 변화하지 않는 것에 비해 고콜레스테롤혈증 유병률은 2005년 이후 지속적으로 증가2하였기에 이를 조절하는 것이 심혈관 질환의 예방에 중요할 것으로 사료된다.
이상지질혈증은 심뇌혈관 질환을 일으키고 악화시키는 주요 위험인자3로 지단백 대사 과정의 이상을 말하며, 임상적으로는 혈장 내 콜레스테롤이나 중성지방 혹은 둘 모두의 증가와 HDL 콜레스테롤의 감소를 동반하는 상태이다4.
II. 재료 및 방법
1. 재 료
1) 시 료
본 연구에서 사용한 향사평위산(Hyangsapyeongwi-san, 이하 HPS)은 ≪東醫寶鑑≫을 기준으로 조제하였으며, 구성 약재는 한약재 유통업체인 (주)옴니허브에서 검수된 한약재를 구입하여 사용하였고, 각 처방의 구성은 아래와 같다(Table 1).
Table 1
The Prescription of HPS
2) 실험동물 및 사료
본 연구에 사용된 4주령의 수컷 C57BL/6 마우스는 라온바이오(Korea)에서 총 24수를 구입하여 각 실험군당 6수씩 배분하였으며, 연구 기간 동안 정상군은 일반 사료(ENVIGO, U.K.)와 증류수를 공급하였고 대조군과 HPS 투여군은 고콜레스테롤 사료(Research Diets, U.S.A.)와 25% 과당수용액(Danisco, Denmark)을 공급하였다. 실험동물에게 공급된 1 kg당 일반 사료와 고콜레스테롤 사료의 조성의 차이는 Table 2와 같다. 동물 사육실을 22±2 ℃의 conventional system으로 설정하였으며, 하루에 12시간 동안 200-300 Lux로 조명하였고 이후 12시간 동안 빛을 완전히 차단하였다. 본 연구는 대전대학교 동물실험윤리 위원회의 승인(승인번호 DJUARB2019-011)을 받아 동물윤리준칙에 의거하여 진행하였다.
3) 시 약
본 연구에는 EGM™-2 endothelial cell growth medium-2 bullet kit™(Lonza, U.S.A.), gelatin solution (Sigma-Aldrich, U.S.A.), EZ-Cytox(Daeilab, Korea), dulbecco’s phosphate buffered saline(D-PBS : Welgene, Korea), ethyl ether(Sigma-Aldrich, U.S.A.), tumor necrosis factor-α human(TNF-α : Sigma-Aldrich, U.S.A.), SYBR Green(Qiagen, Germany), Total RNA prep kit(Intronbio, Korea), DEPC-DW(Bioneer, Korea), accupower cyclescript RT premix(Bioneer, Korea), formalin solution(Sigma-Aldrich, U.S.A.), H&E Staining Kit(Abcam, UK) 등을 사용하였다.
4) 기 기
본 연구에는 rotary vacuum evaporator(EYELA, Japan), centrifuge(Vision scientific, Korea), freeze dryer(ilShinbiobase, Korea), nanodrop(Thermo Fisher, U.S.A.), PCR cycler(alpha cycler 1 PCRmax : PCRmax, U.K.) real-time PCR cycler(Rotor-Gene Q : Qiagen, Germany), laboratory balances(Daihan Scientific, Korea), clinical chemistry analyzer(AU680 : Beckman Coulter, U.S.A.), cryocut microtome(Leica, Germany), optical microscope(Carl ZEISS, Germany) 등을 사용하였다.
2. 방 법
1) 시료 추출
10첩 분량의 HPS(340 g)에 5 ℓ의 증류수를 추가하고 3시간 동안 100 ℃에서 추출한 이후 여과지를 사용하여 추출물을 여과하였다. 여과된 추출물은 rotary vacuum evaporator를 사용하여 감압 농축하고 freeze dryer를 사용하여 동결건조를 진행하였다. 동결건조 완료 후 85.34 g(수득률 : 25.10%)의 분말을 얻었으며, -20 ℃에 보관하면서 실험 당일 소분하고 증류수에 용해시켜 사용하였다.
2) 세포 배양
인간 유래 혈관내피세포 human umbilical vein endothelial cell(이하 HUVEC)은 Lonza(Switzerland)에서 분양받아 사용하였으며, EGM™-2 medium과 EGM™-2 singlequots™ kit으로 배지를 혼합하여 37 ℃, 5% CO2 조건의 세포배양기에서 배양하였다. 세포의 계대 배양은 2~3일 주기로 진행하였으며, 실험에 사용되는 모든 plate는 0.2% gelatin solution으로 30분 동안 코팅한 후 PBS로 세척하여 사용하였다.
3) 세포 생존율 측정
HUVEC을 48 well plate에 1×105 cells/well로 분주하여 24시간 동안 배양하였으며, 이후 HPS를 50, 100, 200, 400, 600 μg/ml의 농도로 처리하여 다시 24시간 동안 배양하였다. 그리고 배양이 모두 종료된 이후 배양액 100 μl당 EZ-Cytox 용액을 10 μl 넣고 세포배양기에서 30분 동안 반응시켰다. 반응을 진행한 이후 450 nm에서 흡광도를 측정하였으며 대조군에 대한 세포 생존율을 백분율로 표시하였다.
4) 시료 및 약물 처리
HUVEC을 6 well plate에 1×106 cells/well로 분주하여 24시간 동안 배양하였으며, 이후 HPS의 50, 100, 200, 400 μg/ml 농도로 전처리를 진행하였다. 1시간 후에 TNF-α를 10 ng/ml 추가한 이후 다시 24시간 동안 배양을 진행하였다. 모든 배양이 종료되고 원심분리하여 얻은 세포를 유전자 발현량 측정에 사용하였다.
5) 시료 투여 및 검체 분리
8주간의 이상지질혈증 유발 후 대조군은 일반 사료와 증류수를 경구투여하였고 실험군은 고지방 식이를 동일하게 공급하면서 HPS를 200, 400 mg/kg 농도로 4주간 매일 1회 오전 11시에 경구투여하였으며, 모든 투여가 종료된 후 ethyl ether를 이용하여 실험동물을 마취하고 심장천자법으로 채혈하였다. 채취한 혈액은 상온에서 30분 동안 굳히고 3,000 rpm에서 15분 동안 원심분리하여 혈청을 분리하고 생화학적 분석에 사용하였으며 적출한 간 조직은 조직학적 분석에 사용하였다.
6) 유전자 발현량 측정
시료 및 약물을 처리한 세포는 Total RNA Prep kit을 사용하여 RNA를 추출하였으며, 추출한 RNA는 reverse transcription premix와 혼합하고 PCR Cycler를 사용하여 45 ℃에서 60분, 95 ℃에서 5분 동안 반응을 통해 cDNA를 합성하였다. 합성된 cDNA로부터 특정 유전자를 증폭시켜 확인하기 위해 Real-time PCR을 진행하였으며, cDNA와 특정 유전자에 맞는 primer, SYBR Green premix를 혼합하여 95 ℃에서 2분 동안 반응시키고 95℃에서 5초, 62.5 ℃에서 30초의 과정을 40회 반복하여 특정 유전자를 증폭하였다. 유전자 발현량은 대조군의 유전자 발현량을 기준으로 상대 정량하였으며, 사용된 primer들의 정보는 Table 3과 같다.
Table 3
Real-Time PCR Primer Sequences
3. 통계처리
연구 결과는 SPSS Statistics Version 21.0(IBM, U.S.A.)을 사용하였으며 mean±standard error of mean으로 나타내었다. 먼저 두 그룹 사이의 통계적 비교는 independent sample t-test를 이용하여 수행하였고 여러 그룹의 통계적 비교는 analysis of variance(ANOVA)를 이용하여 수행하였다. 이후 Tukey’s HSD test를 통하여 유의수준을 0.05로 설정한 후 유의성을 검정하였고, 유의수준을 p<0.05, p<0.01 그리고 p<0.001 3가지로 나누어 나타냈다.
III. 결 과
1. 세포 생존율
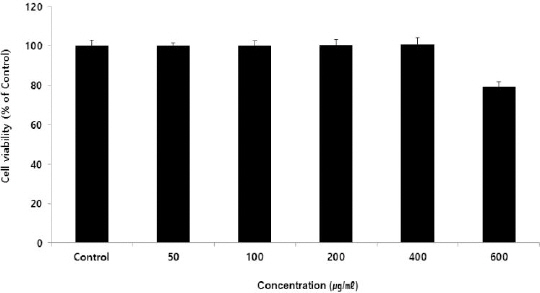
세포 생존율을 측정한 결과, 대조군을 100.0±3.06%로 나타냈을 때, HPS 50, 100, 200, 400, 600(μg/ml) 농도에서 각각 100.03±1.65%, 100.08±2.46%, 100.29± 2.93%, 100.74±3.54%, 79.31±2.69%로 나타났다. HPS 600 μg/ml 이상의 농도에서 80% 이하의 세포 생존율이 나타났기에, 이후 연구에서 50 μg/ml부터 400 μg/ml까지 농도로 설정하여 사용하였다(Fig. 1).
Fig. 1
Cell viability of HPS in HUVEC.
HUVEC were treated by 50, 100, 200, 400, and 600 μg/ml of HPS for 24 h. Treated cells were reacted by EZ-Cytox for 30 min and then absorbance were measured at 450 nm using micro plate reader. Cell viability were calculated as percentage relative to the control. The result were presented by the mean±standard error of mean from three independent experiments. Control : 100.00±3.06, 50 μg/ml of HPS : 100.03±1.65, 100 μg/ml of HPS : 100.08±2.46, 200 μg/ml of HPS : 100.29±2.93, 400 μg/ml of HPS : 100.74±3.54, 600 μg/ml of HPS : 79.31±2.69 (Unit : %).
2. 세포 내 유전자 발현량
1) KLF2
세포 내 KLF2 유전자 발현량을 측정한 결과, 정상군은 1.92±0.07, 대조군은 1.00±0.00로 나타냈을 때, HPS 50, 100, 200, 400(μg/ml) 농도에서 각각 1.02±0.11, 1.08±0.11, 1.24±0.13, 1.30±0.17(Unit : fold change)로 나타났다. HPS 모든 농도에서 농도 의존적으로 증가하였으나 대조군에 비해 유의한 증가는 나타나지 않았다(Fig. 2A).
Fig. 2
Effects of HPS about KLF2, eNOS, MCP-1, ICAM-1 and VCAM-1 mRNA expression level in HUVEC.
HUVEC were treated 50, 100, 200, and 400 μg/ml of HPS, with 10 ng/ml TNF-α for 12 h. The mRNA expression level were measured using a real-time PCR (qPCR). The result were presented by the mean±standard error of mean from three independent experiments. (Significance of results, * : p<0.05, ** : p<0.01, *** : p<0.001 compared to control). (A) KLF2, (B) eNOS, (C) MCP-1, (D) ICAM-1, (E) VCAM-1.
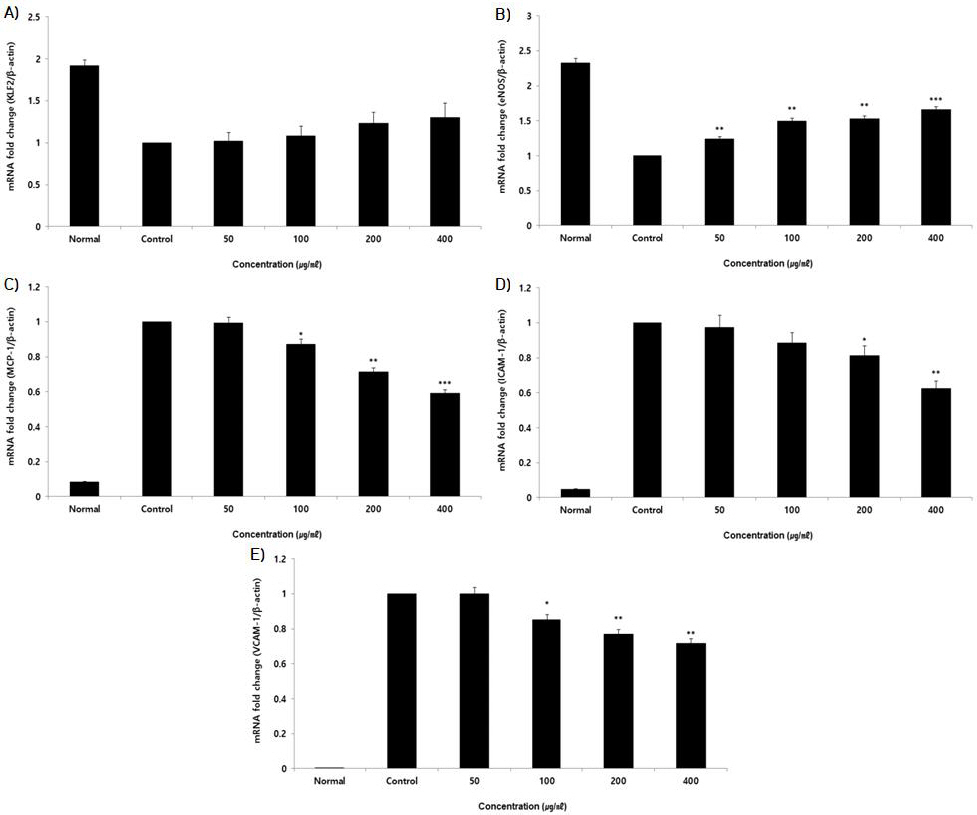
2) eNOS
세포 내 eNOS 유전자 발현량을 측정한 결과, 정상군은 2.33±0.06, 대조군은 1.00±0.00로 나타냈을 때, HPS 50, 100, 200, 400(μg/ml) 농도에서 각각 1.24±0.03, 1.50±0.04, 1.53±0.04, 1.66±0.05(Unit : fold change)로 나타났다. HPS 모든 농도에서 농도 의존적으로 대조군에 비해 유의한 증가가 나타났다(Fig. 2B).
3) MCP-1
세포 내 MCP-1 유전자 발현량을 측정한 결과, 정상군은 0.08±0.00, 대조군은 1.00±0.00로 나타냈을 때, HPS 50, 100, 200, 400(μg/ml) 농도에서 각각 0.99±0.03, 0.87±0.03, 0.71±0.02, 0.59±0.02(Unit : fold change)로 나타났다. HPS 100 μg/ml 이상의 농도에서 농도 의존적으로 대조군에 비해 유의한 감소가 나타났다(Fig. 2C).
4) ICAM-1
세포 내 ICAM-1 유전자 발현량을 측정한 결과, 정상군은 0.05±0.00, 대조군은 1.00±0.00로 나타냈을 때, HPS 50, 100, 200, 400(μg/ml) 농도에서 각각 0.97±0.07, 0.88±0.06, 0.81±0.06, 0.63±0.04(Unit : fold change)로 나타났다. HPS 200 μg/ml 이상의 농도에서 농도 의존적으로 대조군에 비해 유의한 감소가 나타났다(Fig. 2D).
5) VCAM-1
세포 내 VCAM-1 유전자 발현량을 측정한 결과, 정상군은 0.00±0.00, 대조군은 1.00±0.00로 나타냈을 때, HPS 50, 100, 200, 400(μg/ml) 농도에서 각각 1.00±0.03, 0.85±0.03, 0.77±0.03, 0.72±0.02(Unit : fold change)로 나타났다. HPS 100 μg/ml 이상의 농도에서 농도 의존적으로 대조군에 비해 유의한 감소가 나타났다(Fig. 2E).
3. 체중 변화
HPS를 투여하기 전 정상군은 20.32±0.84 g, 대조군은 25.27±0.77 g, HPS 200 mg/kg 투여군은 25.12± 0.72 g, HPS 400 mg/kg 투여군은 25.17±0.77 g이었으며, HPS를 4주간 경구 투여한 이후 실험 동물의 무게는 각각 24.80±0.61 g, 31.63±1.22 g, 29.62±1.23 g, 28.43 ±1.50 g로 나타났다. 실험동물의 체중 변화를 측정한 결과, HPS 모든 투여군에서 대조군에 비해 유의한 감소가 나타났다(Fig. 3).
Fig. 3
Effects of HPS about body weight in dyslipidemia mice model.
The result were presented by the mean±standard error of mean (Significance of results, ** : p<0.01, *** : p<0.001 compared to control). Normal : non-dyslipidemia mice model (n=6), Control : dyslipidemia mice model+distilled water (n=6), Low : dyslipidemia mice model+HPS 200 mg/kg (n=6), High : dyslipidemia mice model+HPS 400 mg/kg (n=6).

4. 지질대사 지표인자
1) Total cholesterol
혈액 내 Total cholesterol 수치를 측정한 결과, 정상군은 98.40±5.41 mg/dl, 대조군은 169.60±6.23 mg/dl로 나타냈을 때, HPS 200 mg/kg, 400 mg/kg 투여군에서 각각 162.00±7.14 mg/dl, 146.00±5.70 mg/dl로 나타났고, HPS 400 mg/kg 투여군에서 대조군에 비해 유의한 감소가 나타났다(Fig. 4A).
Fig. 4
Effects of HPS about total cholesterol, LDL-cholesterol, HDL-cholesterol and triglyceride level in serum of dyslipidemia mice model.
The result were presented by the mean±standard error of mean (Significance of results, ** : p<0.01, *** : p<0.001 compared to control). Normal : non-dyslipidemia mice model (n=6), Control : dyslipidemia mice model+distilled water (n=6), Low : dyslipidemia mice model+HPS 200 mg/kg (n=6), High : dyslipidemia mice model+HPS 400 mg/kg (n=6). (A) Total cholesterol, (B) LDL-cholesterol, (C) HDL-cholesterol, (D) Triglyceride
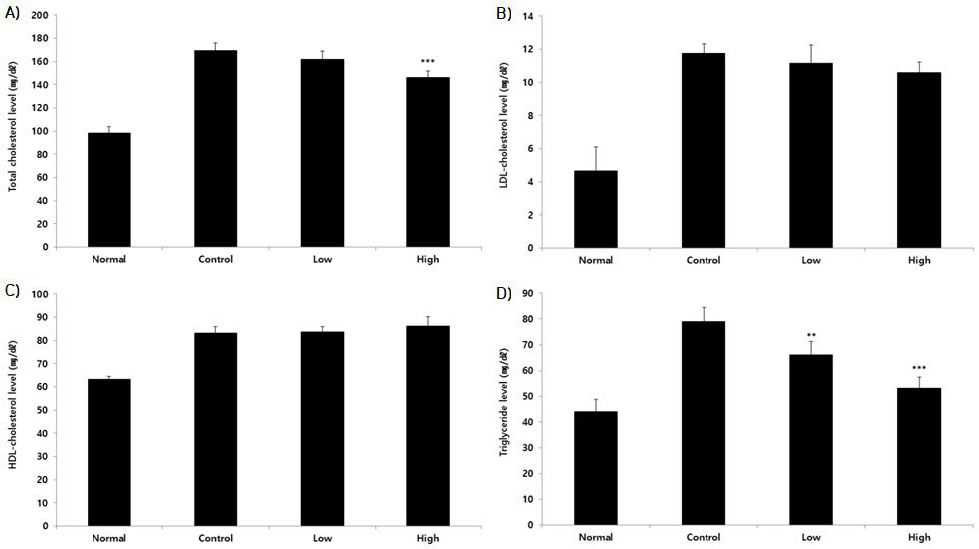
2) LDL-cholesterol
혈액 내 LDL-cholesterol 수치를 측정한 결과, 정상군은 4.66±1.44 mg/dl, 대조군은 11.76±0.55 mg/dl로 나타냈을 때, HPS 200 mg/kg, 400 mg/kg 투여군에서 각각 11.16±1.09 mg/dl, 10.60±0.63 mg/dl로 나타났고, HPS 모든 투여군에서 대조군에 비해 감소하였으나 유의성은 나타나지 않았다(Fig. 4B).
3) HDL-cholesterol
혈액 내 HDL-cholesterol 수치를 측정한 결과, 정상군은 63.34±1.10 mg/dl, 대조군은 83.28±2.65 mg/dl로 나타냈을 때, HPS 200 mg/kg, 400 mg/kg 투여군에서 각각 83.76±2.11 mg/dl, 86.16±4.06 mg/dl로 나타났고, HPS 모든 투여군에서 대조군에 비해 증가하였으나 유의성은 나타나지 않았다(Fig. 4C).
4) Triglyceride
혈액 내 Triglyceride 수치를 측정한 결과, 정상군은 44.00±4.85 mg/dl, 대조군은 79.00±5.39 mg/dl로 나타냈을 때, HPS 200 mg/kg, 400 mg/kg 투여군에서 각각 66.00±5.15 mg/dl, 53.20±4.15 mg/dl로 나타났고, HPS 모든 투여군에서 대조군에 비해 유의한 감소가 나타났다(Fig. 4D).
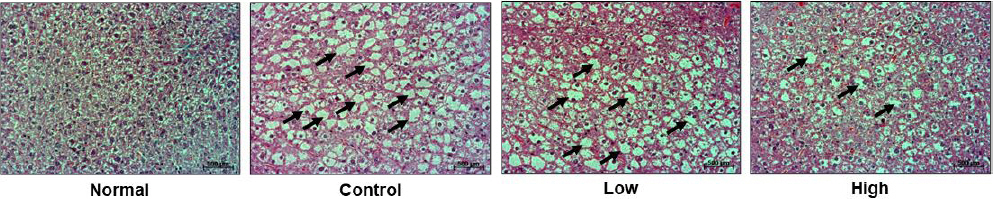
5. 간 조직학적 분석
간 조직의 변화를 분석한 결과, HPS 모든 투여군에서 대조군에 비해 간세포 사이의 지방 축적(black arrows)이 감소되었음을 확인할 수 있었다(Fig. 5).
Fig. 5
Effects of HPS about histological changes in liver tissue of dyslipidemia mice model.
Liver tissue were stained with hematoxylin and eosin (H&E). Hepatocytes fat accumulation was pointed by black arrows. Normal : non-dyslipidemia mice model, Control : dyslipidemia mice model+distilled water, Low : dyslipidemia mice model+HPS 200 mg/kg, High : dyslipidemia mice model+HPS 400 mg/kg.
Ⅳ. 고 찰
WHO는 2019년 1,790만 명의 사람들이 심혈관 질환으로 사망하였고 이는 전 세계 사망자의 32%에 해당한다고 보고하였다1. 통계청의 발표에 따르면 2020년 국내 사망 원인 중 심장 질환이 인구 10만 명당 63명으로 2위, 뇌혈관 질환은 인구 10만 명당 42.6명으로 4위의 높은 순위를 차지하였으며 이는 전년 대비 각 4.2%, 1.2% 증가한 결과이다. 특히 심장 질환으로 인한 사망률은 2010년 인구 10만 명당 46.9명이었던 것에 비해 34.3% 증가율을 보이며 꾸준히 상승해왔으며, 그중 관상동맥 질환 등으로 인한 허혈성 심장 질환은 2019년에 비해 2.6% 증가하였다11.
1948년 시작된 framingham heart study는 심혈관 질환에 관한 최초의 장기 코호트 연구 중 하나로 심혈관 질환의 역학과 특성 및 위험인자 등을 연구하였으며 가장 중요한 위험 요인은 높은 수준의 콜레스테롤과 혈압이고, 그 외에도 흡연, 당뇨병, 신체 활동 부족, 비만 등이 영향을 미친다고 보고하였다12. 국내 만 19세 이상 성인의 심혈관 질환 위험인자 중 고혈압 및 당뇨병의 유병률 그리고 흡연율은 2010년부터 2020년까지 크게 변화하지 않거나 오히려 감소한 반면 고콜레스테롤혈증 유병률은 2020년 남자 20.2%, 여자 18.8%로, 남녀 모두 2005년 이후 지속적으로 증가하는 추세이다2. 혈중 콜레스테롤의 증가는 심뇌혈관 질환을 일으키고 악화시키는 주요한 위험인자로3 관상동맥 질환 및 허혈성 심질환을 치료하기 위해 이상지질혈증을 관리하는 것은 매우 중요하다4.
이상지질혈증이란 지단백 대사 과정의 이상을 말하며, 임상적으로는 혈장 내 cholesterol이나 triglyceride 혹은 둘 모두의 증가와 HDL-cholesterol의 감소를 동반하는 상태로, national cholesterol education program adult treatment panel III(NCEP-ATP III)에 따르면 이상지질혈증의 가장 보편적인 형태는 높은 triglyceride 외 높은 LDL-cholesterol 또는 낮은 HDL-cholesterol 상태이다4,13.
이상지질혈증의 치료는 심혈관 질환의 위험 인자 및 과거력 등을 바탕으로 환자군을 나누고 각 군마다 치료 목표를 정해 LDL-cholesterol, HDL-cholesterol 수치를 조절한다. 모든 환자는 우선 포화지방과 트랜스지방이 적은 식단, 운동, 체중 감량 등 생활습관 교정을 시작해야 하며 이것으로 충분히 조절되지 않는다면 약물치료가 필요하다. 이상지질혈증의 중요한 치료 목표인 LDL-cholesterol을 낮추기 위해 일차적으로 HMG-CoA reductase 억제제인 statin을 선택하며, 이외에도 약물치료로 ezetimibe, PCSK9 inhibitor, fibrates, niacin, omega-3 fatty acid 등을 사용할 수 있다14. 하지만 약물치료의 경우 흔하게는 소화 장애, 속 쓰림, 복통, 간 독성, 근육 독성 및 당뇨병, 인지 장애 등의 부작용을 나타낼 뿐 아니라 약물을 병용하면 부작용 발생 위험이 더욱 커지고 입증된 치료법에도 불구하고 심혈관 질환의 발병률은 여전히 비교적 높게 유지되기에 새로운 치료법에 대한 연구가 필요하다5,15.
한의학에서 지질에 대한 개념은 ≪靈樞⋅衛氣失常論≫16에서 “人有肥, 有膏, 有肉”라고 하여 세 가지 유형으로 나눠 설명한 내용에서 찾아볼 수 있다. ≪素問⋅通評虛實論≫16에서 “凡治消癉, 仆擊, 偏枯, 痿厥, 氣滿發逆, 甘肥貴人, 則高粱之疾也.”라고 하여 무릇 消渴, 卒倒, 半身不遂, 痿厥, 氣急上逆을 기름진 음식을 많이 먹어 발생한 질병으로 여기며 고열량 식이와 질병의 연관성을 언급하였으며 ≪靈樞⋅五癃津液別篇≫16에서는 “五穀之津液, 和合而爲膏者, 內滲入于骨空, 補益腦髓”라고 하여 五穀에서 化生된 津液이 결합하여 생성된 脂膏는 체내의 骨空으로 들어가 腦髓를 補益한다고 하였다.
향사평위산은 龔의 ≪萬病回春≫6에 처음 수록되어 傷食, 食鬱證, 呑酸吐酸을 치료하는 처방으로 소화기계 평활근 진경 작용, 위 점막 손상의 예방과 방어, 항산화 효과 등의 연구8-10가 진행되었다.
구성 약재 대부분에서 위장관 기능 개선을 비롯하여 혈중 지질 감소 및 항염증, 항산화, 혈소판 응집 억제 등의 작용7이 규명된 향사평위산을 통해 혈관 염증 억제와 이상지질혈증 개선 효능을 실험적으로 밝혀낼 수 있을 것으로 예측하였다. 특히 향사평위산은 지질과산화, LDL 산화 및 혈관내피세포의 산화적 손상을 유의하게 억제시켜 동맥경화 진행을 방어하는 연구10가 진행된 바 있으며, 구성 약재 중 혈중 cholesterol 수치를 낮추는 항고지혈 효과에 관한 연구17,18가 이루어진 처방이기에 이번 실험을 계획하게 되었다.
본 연구에서 이상지질혈증으로 유발될 수 있는 죽상동맥경화 및 심혈관 질환의 예방과 치료를 위하여 향사평위산(Hyangsapyeongwi-san, 이하 HPS)의 혈관내피세포에서의 항염증 효과와 항고지혈 효능을 확인하고자 하였다. 먼저 세포 생존율을 측정하여 세포 독성을 일으키지 않는 농도에서 실험을 진행하였으며 HUVEC에 HPS를 처리하고 TNF-α로 혈관 염증 반응을 유도하여 원심분리한 이후 얻은 세포를 사용하여 KLF2, eNOS, MCP-1, ICAM-1, VCAM-1 유전자 발현량을 측정하였다. 이상지질혈증을 유도한 마우스의 체중 변화를 측정하고 채취한 혈액에서 지질 대사 지표인자인 total cholesterol, LDL-cholesterol, HDL-cholesterol, triglyceride를 분석하였으며 간 조직을 적출하고 조직학적으로 분석하여 다음과 같은 결과를 얻었다.
본격적인 연구에 앞서 먼저 HPS의 세포 독성을 평가하기 위해 세포 생존율을 HPS 600 μg/ml 이상의 농도에서 80% 이하의 세포 생존율이 나타났기에, 이후 연구에서 50 μg/ml부터 400 μg/ml까지 농도로 설정하여 실험을 진행하였다.
죽상동맥경화증은 혈관 내막에 염증성 침윤, 콜레스테롤 침착 및 세포 외 기질의 비정상적 축적 등이 일어나 혈관 내경이 좁아지는 만성 염증 질환으로 고지혈증이나 고혈압, 흡연, 당뇨병 등에 의해 내피세포가 손상되어 발생한다. 내막의 손상을 통해 LDL-cholesterol이 동맥벽으로 침입하고 산화 LDL이 되어 혈관내피세포를 자극하여 MCP-1, ICAM-1, VCAM-1 등의 사이토카인의 발현을 증가시켜 단핵구를 포함한 백혈구를 모집한다. 유도된 단핵구는 내피하층으로 침투하여 산화 스트레스를 받아 대식세포가 된 후, 산화 LDL 등을 흡수하여 거품세포가 된다. 이후 사이토카인이 분비되어 중막에 있던 평활근 세포가 내피 하로 이동하고 증식하며 세포 외 기질의 합성 및 분비가 이루어지면서 동맥경화성 플라크가 형성된다. 이후 합병증으로 혈관 내강에 협착이 일어나 허혈이 발생하거나 혹은 플라크의 파열로 혈전 및 색전이 형성되어 허혈성 심장 질환이 발생할 수 있다19-21.
Krüppel-like factor 2(KLF2)는 동맥경화나 염증 신호 전달 경로를 억제하는 내피 전사 인자이며21 endothelial nitric oxide synthase(eNOS)는 산화질소를 생성하는 효소로 혈관 이완, 내피 부착 분자의 발현 차단, 단핵구 부착과 활성화 감소, 지질 산화 억제 등 내피세포 활성화 및 조절을 통해 항염증, 항산화 및 항동맥경화 작용을 한다22. Monocyte chemoattractant protein-1(MCP-1)은 자가면역 질환, 감염, 알레르기, 혈관 이상 등에서 중요한 역할을 하는 chemokine의 일종으로, 백혈구 유주와 염증 반응에 있어 중요한 역할을 하며 주로 단핵구에 화학주성을 일으킨다23. Intercellular adhesion molecule-1 (ICAM-1)과 vascular cell adhesion molecule-1 (VCAM-1)은 혈관 염증의 초기 단계에서 단핵구와 림프구의 부착 및 내피 표면에서의 활동을 매개한다21.
실험 결과 혈관 염증 및 죽상동맥경화의 진행을 억제하는 역할을 하는 세포 내 KLF2, eNOS 유전자 발현량은 대체로 유의한 증가가 나타났으며, 이와 반대로 염증 반응과 죽상동맥경화 발병에 관여하는 세포 내 MCP-1, ICAM-1, VCAM-1 유전자 발현량은 유의한 감소가 나타났다.
비만은 동맥경화성 이상지질혈증, 고혈압, 인슐린 저항성 등의 대사 이상을 유발하며 이는 심혈관 질환을 발병시킬 수 있는 위험 요인이다24. 국내 만 19세 이상의 고콜레스테롤혈증 유병률은 2019년 기준 21.9%인 951만 명으로, 이는 성인 5명 중 1명에 해당하는 수치이며 그중 40% 이상은 비만을 동반하고 있다25. 이처럼 이상지질혈증은 비만과 높은 연관성이 있다.
실험동물의 체중은 HPS의 모든 투여군에서 유의한 감소가 나타났다. 이와 같은 결과는 체중 감소가 total cholesterol, LDL-cholesterol, triglyceride의 감소에 영향을 미친다는 연구5를 고려하였을 때 HPS의 항비만 작용을 통해 이상지질혈증을 개선할 수 있을 것으로 보인다.
국내 성인 중 만 30세 이상의 고콜레스테롤혈증 유병률은 2020년 23.9%로 2010년 13.4%에서부터 약 2배 가까이 꾸준히 증가해왔으며2 높은 수준의 cholesterol은 심혈관 질환의 위험인자이다12. LDL은 혈중 콜레스테롤의 60-70%를 차지하고 동맥경화를 일으키는 매우 강력한 인자로써 이상지질혈증의 개선을 위해 가장 먼저 감소시켜야 하는 지단백이다13. HDL은 말초조직에 있던 cholesterol을 간 혹은 장으로 옮겨 배설되도록 하며4 심혈관 질환의 위험성과 반비례한다13. Triglyceride는 죽상경화를 촉진하고 심혈관 질환의 위험요소이며 비알콜성 지방간의 발생과도 밀접한 관계가 있다26,27.
실험 결과를 바탕으로 HPS의 혈중 지질 개선 효과는 지질 대사 지표 인자 중 total cholesterol과 triglyceride만을 유의하게 감소시켰다는 특징을 가지고 있음을 알 수 있다. 이번 실험에서는 200, 400 mg/kg의 제한적인 농도에서만 실험을 진행한 만큼 추후 더 넓은 범위의 농도에서 LDL-cholesterol 및 HDL- cholesterol의 유의한 변화 등 보다 유의미한 이상지질혈증 개선 효과를 확인하기 위한 보완적인 실험이 필요할 것으로 사료된다.
간 지방증은 간세포에 과도한 지방이 축적된 상태이다. 간의 유리 지방산 흡수 및 초저밀도 지단백질 합성의 증가 혹은 유리 지방산의 산화 및 중성지방의 배출 감소 등 지질 대사 이상으로 인해 발생하며, 특히 이상지질혈증과 유의한 연관성이 있다28.
간을 조직학적으로 분석한 결과 HPS의 모든 투여군에서 간세포 사이의 지방이 축적되어 고음영으로 보이는 영역의 수와 크기가 감소하였으며, 저농도보다 고농도에서 더욱 감소되었음을 확인할 수 있었다. 이와 같은 결과를 통해 지방간 개선 효과를 확인할 수 있으며 이는 혈당이나 당화 혈색소보다 triglyceride가 비알콜성 지방간 발생과 강한 상관관계를 보이는 지표 인자임을 밝혀낸26 기존 연구를 바탕으로 HPS의 항지방간 효과가 이번 실험 중 triglyceride의 유의성 있는 감소를 나타냈던 결과와 밀접한 관련이 있을 것으로 생각된다.
이상의 결과들을 바탕으로 HPS는 혈관 염증 과정에 관여하는 유전자 조절 및 혈중 지질의 감소, 체중 감소 등을 통해 혈관 염증 반응을 억제하고 이상지질혈증 상태를 개선하는 효과가 있음을 확인하였다. 본 실험에서 미비했던 점을 보완하여 향후 죽상동맥경화 및 심혈관 질환을 예방하고 치료할 수 있도록 HPS의 항염증 및 이상지질혈증 개선에 대한 추가적인 연구가 진행되기를 바란다.
Ⅴ. 결 론
HPS의 항염증 및 이상지질혈증 개선 효과를 확인하기 위하여 세포 내 KLF2, eNOS, MCP-1, ICAM-1, VCAM-1 유전자 발현량을 측정하였으며, 이상지질혈증을 유도한 마우스의 체중 측정 및 혈액과 간 조직을 채취하여 혈청에서 지질 대사 지표인자인 total cholesterol, LDL-cholesterol, HDL-cholesterol and triglyceride와 간의 조직학적 변화를 분석하여 다음과 같은 결과를 얻었다.
1. 세포 내 KLF2 유전자 발현량은 HPS의 모든 농도에서 농도의존적으로 증가하였으나 유의성은 나타나지 않았으며, eNOS 유전자 발현량은 HPS의 모든 농도에서 유의한 증가가 나타났다. 세포 내 MCP-1 유전자 발현량은 HPS 100 μg/ml 이상의 농도에서, ICAM-1 유전자 발현량은 HPS 200 μg/ml 이상의 농도에서, VCAM-1 유전자 발현량은 HPS 100 μg/ml 이상의 농도에서 유의한 감소가 나타났다.
2. 실험동물의 체중은 HPS의 모든 투여군에서 유의한 감소가 나타났다.
3. 혈액 내 total cholesterol은 HPS 400 mg/kg 투여군에서, triglyceride는 모든 투여군에서 유의한 감소가 나타났고, LDL-cholesterol은 모든 투여군에서 대조군에 비해 감소하였고 HDL-cholesterol은 모든 투여군에서 대조군에 비해 증가하였지만 유의한 변화는 나타나지 않았다.
4. 간세포 사이의 지방 축적은 HPS의 모든 투여군에서 감소하였다.
이상의 결과를 바탕으로 HPS의 항염증 효능과 이상지질혈증 개선 효능을 확인하였으며 향후 HPS를 죽상동맥경화 및 심혈관 질환의 예방과 치료에 효과적으로 활용할 수 있도록 추가적인 연구가 필요할 것으로 사료된다.











