대황과 실리마린의 병용투여의 간섬유화 보호 효과
ABSTRACT
Objective:
Liver fibrosis is a highly conserved wound-healing response and the final common pathway of chronic inflammatory injury. This study aimed to evaluate the potential anti-fibrotic effect of the combination of Rhei Radix et Rhizoma water extract (RW) and silymarin in a thioacetamide (TAA)-induced liver fibrosis model.
Methods:
The liver fibrosis mouse model was established through the intraperitoneal injection of TAA (1 week 100 mg/kg, 2-3 weeks 200 mg/kg, 4-8 weeks 400 mg/kg) three times per week for eight weeks. Animal experiments were conducted in five groups; Normal, Control (TAA-induced liver fibrosis mice), Sily (silymarin 50 mg/kg), RSL (RW 50 mg/kg+silymarin 50 mg/kg), and RSH (RW 100 mg/kg+silymarin 50 mg/kg). Biochemical analyses were measured in serum, including aspartate aminotransferase (AST), alanine aminotransferase (ALT), malondialdehyde (MDA), and ammonia levels. Liver inflammatory cytokines and fibrous biomarkers were measured by Western blot analysis, and liver histopathology was evaluated through tissue staining.
Results:
A significant decrease in the liver function markers AST and ALT and a reduction in ammonia and total bilirubin were observed in the group treated with RSL and RSH. Measurement of reactive oxygen species and MDA revealed a significant decrease in the RSL and RSH administration group compared to the TAA induction group. The expression of extracellular matrix-related proteins, such as transforming growth factor β1, α-smooth muscle actin, and collagen type I alpha 1, was likewise significantly decreased. All drug-administered groups had increased matrix metalloproteinase-9 but a decreasing tissue inhibitor of matrix metalloproteinase-1. RSL and RSH exerted a significant upregulation of NADPH oxidase 2, p22phox, and p47phox, which are oxidative stress-related factors. Furthermore, pro-inflammatory proteins such as cyclooxygenase 2 and interleukin-1β were markedly suppressed through the inhibition of nuclear factor kappa B activation.
Conclusions:
The administration of RW and silymarin suppressed the NADPH oxidase factor protein level and showed a tendency to reduce inflammation-related enzymes. These results suggest that the combined administration of RW and silymarin improves acute liver injury induced by TAA.
Keywords: thioacetamide, liver fibrosis, Rhei Radix et Rhizoma, silymarin, anti-fibrotic, oxidative stress
I. 서 론
간섬유화는 간 조직에서 일어나는 염증생성 및 치유 과정에서 나타나는 현상으로, 이는 반복된 염증반응과정에서 간성상세포(Hepatic stellate cell, HSC)가 비정상적으로 활성화되어 세포외기질 (Extracellular matrix, ECM)이 과도하게 생성 및 축적되는 것을 특징으로 한다 1. 이러한 간섬유화는 손상받은 간세포나 쿠퍼 세포 등에서 분비되는 여러 사이토 카인이나 산화스트레스 등에 자극을 받아 transformin growth factor b1(TGF-b1) 및 platelet-derived growth factor(PDGF)와 같은 여러 수용체가 발현하고 세포 주변을 둘러싸고 있는 기저막을 손상시킨다 2. 기저막의 손상은 간성상세포를 활성화하고 근섬유모세포(myofibroblast)형태희 세포로 변하여 a-SMA와 같은 단백질 표현형을 분화 및 활성화시킨다 3. 최근에는 HSC의 활성화 단계의 치료를 기반으로 연구가 진행되고 있으며, 여러 간손상 모델에서 독성 대사물로 인한 산화적 스트레스의 생성을 억제하고, ECM에 중요한 역할을 하는 간손상 개선을 위한 약재나 식품에 사용되는 천연물 소재를 찾는데 관심이 많아지는 추세이다 4,5. TAA는 간에 독성은 없지만, 간세포에서 대사되며, 이 과정에서 생성되는 활성 산소 및 유리 라디칼은 간세포 내부의 단백질, 지질 및 DNA와 상호 작용하여 산화적 손상이 발생된다 6. 또한 TAA에 의해 유발하는 간섬유화는 AST와 ALT 및 ammonia을 증가시키며, 이는 손상된 간세포에서 혈류로 혈장 수준을 증가시킨다 7. 따라서 TAA는 간손상 및 간섬유화 동물실험에 일반적으로 사용되고 있으며, 최근 연구에서 TAA로 유발된 산화적 스트레스를 감소시켜 간섬유화를 조절하는 안전하고 효과적인 천연소재들에 대한 연구가 활발히 진행되고 있다. 엉겅퀴(Silybum marianum) 종자에서 추출된 실리마린은 우리 몸에서 자연적으로 발생하는 식물성화합물인 플라보노이드 복합체로서 항산화 작용이 강한 성분으로 간세포를 보호하고, 간세포의 손상을 예방하는 데 도움이 되는 간질환 치료에 널리 사용되고 있다 8,9. 그러나 실리마린은 물에 대한 낮은 용해도, 생체 이용률, 낮은 장내 흡수도와 같은 제한 요인이 있어 지방함량이 높은 식사와 함께 섭취하면 더욱 효과적으로 흡수될 수 있다 10. 대황(Rhei Radix et Rhizoma)은 마디풀과 (Polygonaceae)에 속하는 다년생 초본식물인 금문대황( Rheum palmatum L.), 당고특대황( R. tanguticum Maxim. et Balf.) 또는 약용대황( R. officinale Baill.)의 뿌리와 뿌리줄기를 건조한 것으로 일반적으로 토혈, 수종, 혈뇨를 치료하는 데 사용되며, 그 밖에 해열과 변비에 효능이 있는 것으로 알려져 있다 11,12. 대황의 주성분으로는 chrysophanol, emodin 등의 anthraquinone 유도체와 수종의 glucoside 화합물로 대황과 관련된 연구로는 간세포 보호 효과, 간암 세포주에서의 항암효과 등이 있다 13-15. 이에 본 연구에서는 TAA로 유발된 간손상 동물모델에서 간세포 재생 및 복구를 자극하여 항섬유증의 진행을 예방하거나 감소시키는 실리마린과 간세포 보호 효과를 나타내는 대황 물 추출물(RW, Rhei Radix et Rhizoma water extract)의 병용 투여가 간섬유화에 관련된 요인들을 분석하여 두 약물의 상승작용의 효과가 미치는 영향을 제시하고자 하였다. 또한 항염증과 항산화에 관련된 요인들을 분석하여 간 손상에 치료가 가능한 유의한 결과를 얻었기에 이를 보고하는 바이다.
II. 재료 및 방법
1. 재 료
1) 시 료
본 실험에 사용된 대황은 옹기한약국에서 구매하였으며, 증류수 1000 mL에 대황 100 g을 열탕추출기(DWT-1800T, Daewoong Bio, Seoul, Korea)에 넣고 2시간 가열 추출하였다. 추출액을 얻은 후 여과 과정을 진행하여 50 ℃의 감압 추출장치(Buchi B-480, Buchi Labortechnik AG, Flawil, Switzerland)농축한 후, 동결건조기(FD5508, ilShinBioBase, Yanhju, Korea)로 완전 건조시켜 powder 형태(yield 10%)로 만들어 -80 ℃에서 보관하여 증류수에 녹여 사용하였다.
2) 시 약
본 실험에 사용된 thioacetamide(Cat No. 163678), silymarin(Cat No, S0292)은 Sigma Aldrich Co.(St Louis, MO, USA)에서 사용하였다. Folin-Ciocalteu’s phenol reagent, gallic acid, quercetin, 2-Diphenyl-1- picrylhydeazyl(DPPH), 2,2’-azino-bis(3-ehylbenzothiazoline -6-sulphonic acid(ABTS), potassium phosphate monobasic, potassium phosphate dibasic, 1,1,3,3- tetramethoxyprotpane, 2-thiobarbituric acid, sodium phosphate monobasic, sodium phosphate dibasic, potassium chloride(KCl), HEPES, calcium chloride (CaCl2), magnesium chloride(MgCl2), dithiothreitol (DTT), phenylmethanesulfony fluoride(PMSF), and glycerol은 Sigma-Aldrich Co.(St. Louis, MO, USA)에서 구입하였으며, sodium carbonate와 potassium acetate는 DAEJUNG chemicals & metals(Gyeonggi, Korea)에서 구입하여 사용하였다. Aluminum chloride, L-ascorbic acid, and bicinchoninic acid(BCA)는 Thermo Fisher Scientific(Waltham, MA, USA)에서 구입하였다. 또한, Protease inhibitor mixture, ethylenediaminetetraacetic acid(EDTA)는 Wako Pure Chemical Industries, Ltd.(Osaka, Japan)에서 구입하여 사용하였다. ECL Western Blotting Detection Reagents는 GE Healthcare(Chicago, IL, USA)로부터 구입하여 사용하였다. 1차 항체인 TGF-b1, COL1A1, GAPDH, gp91phox(NOX2), p22phox, p47phox, NF-κB p-IκB, IκB, IL-1b, Lamin B1은 Santa Cruz Biotechnology(Dallas, TX, USA)에서 구입하였으며, a-SMA는 Abcam(Cambridge, Cambs, UK)에서 구입하였다. COX-2항체는 항체는 Cell Signaling Technology, Inc.(Danvers, MA, USA)에서 구입하였다. 2차 항체인 Goat anti-mouse lgG antibody와 goat anti-rabbit lgG antibody는 GeneTex, Inc. (Irvine, CA, USA)에서 구입하여 사용하였다.
3) 실험 동물
동물 실험에 사용된 7주령의 웅성 C57BL/6 mice(DBL Co., Ltd., 음성, 한국)는 실험 당일까지 온도 22±2 ℃, 습도 55±5% 유지되며, conventional system으로 명암주기 12시간이 잘 유지되는 사육 환경에서 물과 고형 사료(Zeigler Bros, Inc., PA, USA)를 자유롭게 공급받으며, 일주일간 사육실 적응기를 가진 후 본 실험에 투입되었다. 또한, 본 실험은 대구한의대학교 동물실험윤리 위원회(Institutional Animal Care and Use Committee, IACUC)에서 승인 (DHU2023-015)을 시행되었으며, 동물관리 규정을 준수하여 진행하였다. 동물실험을 위해 난괴법 (randomized complete block design)에 의해서 각 7마리씩 5군으로 나누었으며, 실험군은 정상군(Normal), 대조군(Control), 실리마린을 50 mg/kg 경구 투여한 Sily군, 실리마린 50 mg/kg+대황 물 추출물 50 mg/kg 경구 투여한 RSL군, 실리마린 50 mg/kg+대황 물 추출물 100 mg/kg 경구 투여한 RSH군으로 분류 하였다. 간섬유화를 유발하기 위해 정상군을 제외한 실험군은 8주간 3회/1주 TAA(1주 100 mg/kg, 2~3주간 200 mg/kg, 4~8주간 400 mg/kg)를 복강 투여하였다. 양성 대조군과 대황 물 추출물은 8주간 경구투여용 존대를 이용하여 TAA 투여 1시간 30분 전에 약물을 경구투여하였다. 동물 실험 종료 후 이소플루란 흡입 마취하였다. 그 후, 심장 천자로 혈액을 채취하였고, 혈액은 4 ℃, 4,000 rpm으로 10분간 냉장고속원심기로 혈청을 분리하였다. 간조직은 차가운 0.9% 생리식염수(10 ML)로 3회 관류하여 간조직을 채취하였으며, 혈청과 간조직은 실험에 사용하기 전까지 -80 ℃에 보관하였다.
2. 방 법
1) 총 폴리페놀 및 플라보노이드 함량 측정
총 폴리페놀 함량은 Folin-Denis법 16을 이용하여 측정하였다. 시료 10 mL와 DW 790 mL, Folin- Ciocalteu’s phenol reagent 50 mL, 20% sodium carbonate 150 mL를 혼합하여 실온에서 2시간 동안 반응시킨 후 UV 분광광도계(Infinite M200, Tecan, Salzburg, Austria)를 이용하여 765 nm에서 흡광도를 측정하였다. 표준물질은 gallic acid를 사용하였으며, 표준 검량선을 구하여 시료 추출물의 총 폴리페놀 함량을 산출하였다. 총 플라보노이드 함량을 측정하기 위하여 시료 100 mL와 diethylene glycol 1 mL, 1 N NaOH 10 mL를 혼합하여 37 ℃에서 1시간 동안 반응시킨 후 420 nm에서 흡광도를 측정하였다 17. 표준물질로는 quercetin을 사용하였으며, 표준 검량선을 구하여 시료 추출물의 총 플라보노이드 함량을 산출하였다.
2) DPPH 및 ABTS 소거능 측정
시료 추출물의 free radical 자유 소거능 측정을 위해 Biosis 등의 방법으로 DPPH radical 소거능을 측정하였다 18. 60 mM DPPH 용액 100 mL와 시료를 농도별 희석한 용액 100 L를 혼합하여 30분간 암소 상태로 실온에서 30분간 반응시킨 다음 540 nm에서 흡광도를 측정하였다. 양성 대조군으로 L-ascorbic acid를 사용하였으며, 시료의 항산화 활성은 IC 50(the half maximal inhibitory concentration, DPPH 라디칼 형성을 50% 억제시키는 농도)으로 표시하였다. 시료 추출물의 항산화 효능을 알아보기 위해서 Re 등의 방법에 의해 ABTS radical 소거능을 측정하였다 19. 7 mM ABTS용액과 2.4 mM의 potassium persulfate를 혼합하면 보라색 용액을 생성하게 되는데, 이를 실온의 암소 상태에서 약 16시간 이상 방치하여 ABTS +을 형성시킨 후 30 ℃, 415 nm에서 흡광도 값이 0.70±0.02이 되게 ethanol로 조절하였다. 희석된 용액 95 mL에 추출물 5 mL를 가하여 15분 동안 반응시킨 후, 415 nm에서 흡광도를 측정하였으며, 양성대조군으로 L-ascorbic acid를 사용하였으며 시료의 항산화 활성은 IC 50(the half maximal inhibitory concentration, ABTS 라디칼 형성을 50% 억제시키는 농도)으로 표시하였다.
2) 혈청 내 생화학적 분석
혈청 내 aspartate aminotransferase(AST) 및 alanine aminotransferase(ALT)은 (Wako Pure Chemical industries Ltd, Osaka, Japan) assay kit를 이용하여 프로토콜에 따라 측정하였다. Ammonia 측정은 ammonia assay kit(Abcam, Cambridge, UK)의 프로토콜에 따라 측정하였다. 혈청 내 reactive oxygen species(ROS)는 Black 96-well plate에 혈청 5 μL, 50 mM phosphate buffer 95 μL, 1.25 μM, DCF_DA 25 μL를 넣고 UV 분광광도계로 흡광도를 측정하였다. 측정된 흡광도는 정상군 대비(%)로 계산하여 ROS 수치를 나타내었다.
2) 간 조직 내 생화학적 분석
간 조직 내 지질 과산화인 malodialdehyde(MDA)수치는 commercially available kit(bioassay system, Hayward, CA) kit를 이용하여 실험하였다. ROS는 혈청과 같은 방법으로 진행되었다. 또한, matrix metalloproteinase(MMP)-9, tissue Inhibitor of Metalloproteinase(TIMP)-1를 분석하기 위해 Mybiosource, Inc.(San Diego, CA, USA)의 ELISA kit를 구입하여 사용하였다.
3) Western blotting
간 조직의 세포질을 분리하기 위해 2 mM MaCl2, 10 mM HEPES, 10 mM KCl, 0.1 mM PMSF, 1 mM DTT, 0.1 mM EDTA, protease inhibitor를 첨가하여 조직분쇄기(BioSpec Product, Oklahoma, USA)로 분쇄하였다. 분쇄한 조직을 ice에서 30분간 정치한 다음, 10% NP-40 용액을 첨가하여 4 ℃, 12,000 rpm으로 2분간 원심 분리하여 상층액을 분리하였다. 또한, 남아있는 pellet에서 핵을 분리하기 위해 10% NP-40가 포함된 buffer로 두 번 세척하고 0.3 mM NaCl, 50 mM KCl, 10% glycerol, 50 mM HEPES, 0.1 mM EDTA, 1 mM DTT, 0.1 mM PMSF를 넣고 10분 간격으로 3번 vertex하여 사용하여 세포질과 핵을 분리하였다. 간 조직의 세포질에서 TGF-b1, α-SMA, COL1A1, NOX2, p47phox p22phox, p-IκB, IκB, COX-2, IL-1b단백질과 핵에서의 NF-κB, Lamin B1단백질 발현을 측정하기 위해서 12 μg의 단백질을 8-12% SDS-polyacrylamide gel에 전기영동 후, acrylamide gel을 nitrocellulose membrane으로 이동시켰다. 각각의 1차 항체를 1:1,000으로 희석 처리하여 4 ℃에서 overnight 후 PBS/T로 세척하였으며, 2차 항체 PBS/T를 사용하여 1:3,000으로 희석처리하여 상온에서 2시간 반응 후 PBS/T로 세척하였다. 그리고 membrane을 enhanced chemiluminescence(ECL)을 사용하여 Sensi-Q2000 Chemidoc(Lugen Sci Co. Ltd, Seoul, Korea)에 감광시켜 단백질 발현을 확인하였으며, ATTO Densitograph Software(ATTO Corporation, Tokyo, Japan) 프로그램으로 정량하였다. 각군의 단백질 수준을 정상군의 상대적 비로 나타내었다.
4) 간 조직의 조직병리학적 분석
간 조직의 염증 및 괴사 정도를 관찰하기 위해 H&E 염색을 시행하였다. 간 조직은 24시간 동안 10% 중성 완충 포르말린에 고정시킨 다음 paraffin으로 embedding하여 block을 제작하였다. 그 다음 microtome으로 조직을 3 μm두께의 조직 절편으로 제작하여 hematoxylin & eosin 염색을 하였다. 염색된 슬라이드를 permount로 처리한 후 고정하여 광학 현미경(DSCHX50V, Sony, Tokto, Japan)을 이용하여 관찰하였다. Masson’s trichrome(MT) 염색을 통하여 collagen과 교원질의 침착을 확인하고자 하였으며, 간 조직 슬라이드를 weigert iron hematoxylin에서 7분 동안 염색 후 세척해주었으며, iebrich scarletacid fuchsin으로 2분 동안 염색하였다. 그 후, phosphotungstic-phosphomolybdic acid에서 7분 동안 배양하고, aniline blue로 10분 동안 염색한 다음 1% 아세트산에서 3분 동안 고정시켰다. 마지막으로 Sirius Red/Fast Green 염색은 protocol에 따라 진행하였고 Olympus BX51 Microscope (Olympus Co., Ltd., Tokyo, Japan) 광학현미경으로 관찰하였다.
5) 통계분석
모든 수치는 평균(mean)±표준오차(standard error of the mean)로 표시하였으며, SPSS(Version 26.0, IBM, Armonk, NY, USA)를 사용하여 one-way analysis of variance(ANOVA) test를 실시하고, Fisher’s least-significant differences(LSD) test로 검정을 실시하여 각 군의 평균 차이에 대한 통계적 유의성을 *p<0.05, **p<0.01, ***p<0.001에서 검증하였다.
III. 결 과
1. Total polyphenol과 Total flavonoid 함량 측정
대황의 total polyphenol과 total flavonoid 함량을 측정한 결과, total polyphenol의 경우 255.56±0.21 mg (GAE)/g으로 나타났으며, total flavonoid 함량은 24.59±0.02 mg(QE)/g 함량을 나타냈다.
2. DPPH 및 ABTS 라디칼 소거 활성 측정
대황의 항산화 능력을 확인하기 위해 DPPH 및 ABTS 라디칼 소거법을 이용하여 측정하였으며, 실험의 양성 대조군으로는 L-ascorbic acid을 사용하였다. 대황의 DPPH를 측정한 결과, IC50 값은 3.48±0.03 μg/mL로 나타났으며, ABTS 라디칼 소거 활성은 IC50 값은 9.82±0.03 μg/mL로 높은 항산화 활성을 나타냈다.
3. 실험동물의 체중변화
TAA로 유발된 동물 모델의 약물투여 종료 시점에 따라 체중(g) 변화량을 측정하였다. 그 결과, 정상군 6.55±0.65과 비교하여 대조군 3.34±0.37( p<0.001)으로 유의적으로 감소하였고, 약물 투여군인 실리마린 단독 투여군 2.61±0.48, RSL 투여군 2.40±0.30, RSH 투여군 2.15±0.23 대조군에 비해 체중 변화량이 감소하는 결과를 나타냈다( Table 1).
Table 1
Body Weight Change of Liver Fibrosis Model
|
Group |
Body weight (g) |
Change |
|
|
Initial B.W. (g) |
Final B.W. (g) |
|
Normal |
23.60±0.50 |
30.15±1.02 |
6.55±0.65 |
|
Control |
23.61±0.31 |
20.27±0.40###
|
-3.34±0.37###
|
|
Sily |
23.95±0.41 |
21.34±0.76 |
-2.61±0.48 |
|
RSL |
23.59±0.17 |
21.18±0.30 |
-2.40±0.30 |
|
RSH |
23.75±0.27 |
21.59±0.44 |
-2.15±0.23 |
4. 간 기능 지표 분석 AST와 ALT 수치 및 Ammonia 측정
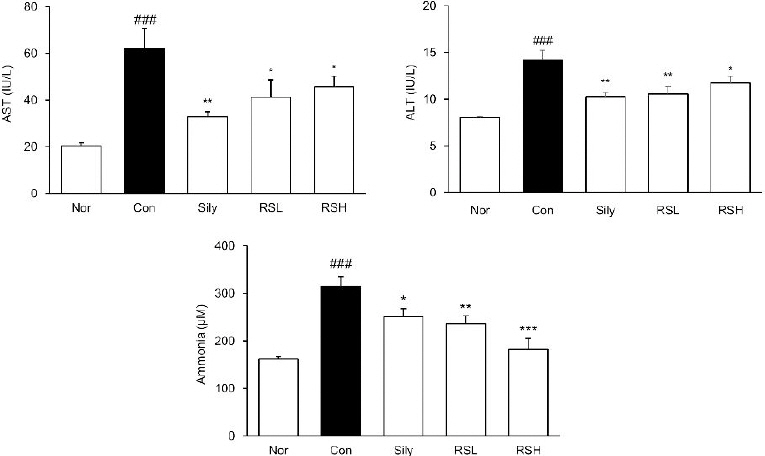
간 기능을 확인하기 위해 혈청에서 AST, ALT 및 Ammonia 수치를 측정하였다. TAA를 투여한 후 대조군에서 AST수치(IU/L)는 정상군과 비교하여 3배 증가하였고, 실리마린 단독 투여군, RSL과 RSH군에서 대조군과 비교하여 각각 47%, 33%, 26%로 감소하는 것을 확인하였다. ALT수치(IU/L)는 정상군과 비교하여 대조군( p<0.001)은 1.7배 증가하였고, 실리마린 투여군, RSL과 RSH 투여군에서 대조군과 비교하여 각각 28%, 26%, 17%로 감소하는 것을 확인하였다. 또한, 혈중 암모니아의 농도(μM)가 분해되지 못하면 여러 대사 장애를 일으키는데 본 실험에서 암모니아를 측정한 결과, 정상군 163.00±3.83에 비해 대조군 314.90±20.50으로 약 2배의 유의적인 증가를 보였으며, 실리마린 단독 투여군은 250.58±17.25, RSL 투여군은 236.33±16.52, RSH 투여군은 182.33±23.13으로 RSH에서 농도 의존적으로 유의하게 감소하였다( Fig. 1).
Fig. 1
The ALT, AST, and ammonia levels in serum.
Normal : normal mice, Control : TAA-induced liver fibrosis mice, sliy : TAA-induced liver fibrosis with silymarin, RSL : TAA-induced liver fibrosis mice treated with silymarin (50 mg/kg)+Rhei Rhizoma (50 mg/kg), RSH : TAA-induced liver fibrosis mice treated with silymarin (50 mg/kg)+Rhizoma (100 mg/kg). All data are expressed means±SEM (n=7). Significance : ###p<0.001 vs. Normal, *p<0.05, **p<0.01, and ***p<0.001 vs. Control.
5. MDA와 ROS측정
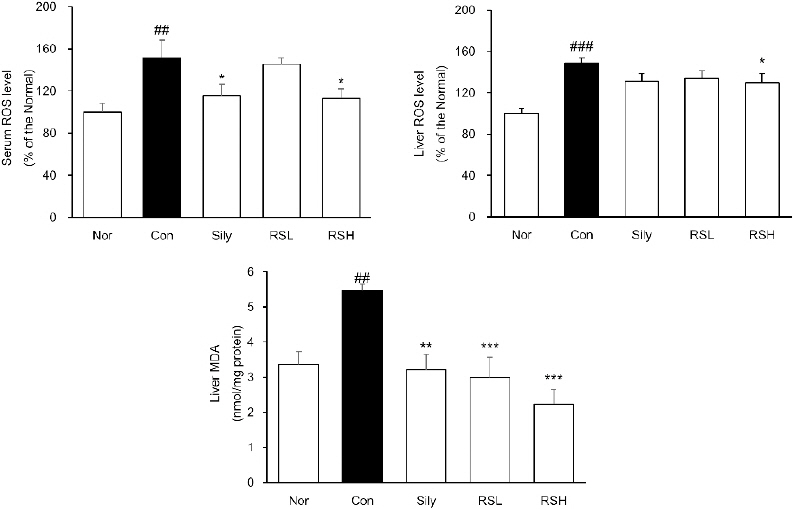
혈청에서의 ROS의 경우 정상군 100.00±8.39에 비해 대조군( p<0.01) 151.31±16.66으로 1.5배의 증가를 보였으며, 실리마린 단독 투여군 115.85±10.26, RSL 투여군은 145.38±5.69, RSH 투여군( p<0.01)은 112.89±9.47으로 감소하였다. 또한, 간조직의 ROS의 경우는 정상군 100.00±4.89에 대비 대조군( p<0.01) 148.71±4.84으로 약 1.5배의 증가를 보였으며, 실리마린 단독 투여군 131.33±4.80, RSL 투여군은 133.89 ±4.51, RSH 투여군( p<0.01) 129.69±4.84로 감소하였다. 간 조직의 MDA 수치를 확인해 본 결과, TAA 투여군인 대조군은 정상군에 비해 1.6배 증가하였으며, 대조군과 비교하여 실리마린 단독 투여군 41%, RSL 투여군 45%, RSH 투여군 59%로 농도 의존적인 감소를 보였다( Fig. 2).
Fig. 2
ROS level and MDA concentration in serum and liver.
Normal : normal mice, Control : TAA-induced liver fibrosis mice, sliy : TAA-induced liver fibrosis with silymarin; RSL : TAA-induced liver fibrosis mice treated with silymarin (50 mg/kg)+RW (50 mg/kg), RSH : TAA-induced liver fibrosis mice treated with silymarin (50 mg/kg)+RW (100 mg/kg). All data are expressed as means±SEM (n=7). Significance : ##p<0.01 and ###p<0.001 vs. Normal, *p<0.05, **p<0.01, and ***p<0.001 vs. Control.
6. MMP-9과 TIMP-1 측정 결과
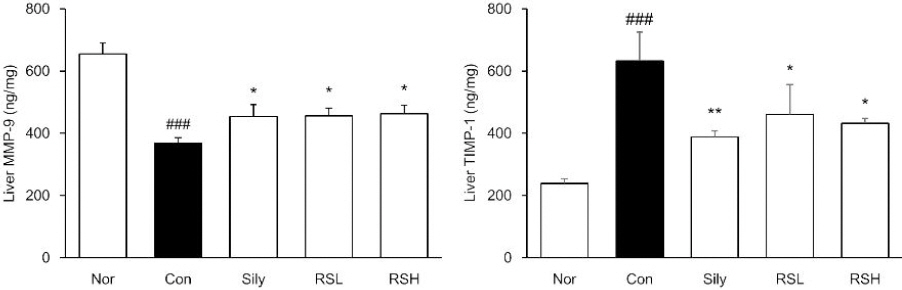
MMP-9을 측정한 결과, TAA 유발 군에서는 정상군에 비해 44% 감소하는 경향을 보였으며, 실리마린 단독 투여군, RSL 투여군, 및 RSH 투여군은 대조군에 비해 각각 23%, 24%, 25%로 증가하는 경향을 보였다. 반면에, MMP-9을 억제하는 단백질인 TIMP-1은 정상군에 비해 TAA 투여군에서 165%로 증가하였으며, 실리마린 단독 투여군, RSL 투여군, 및 RSH투여군은 대조군에 비해 각각 39%, 27%, 32% 감소하였다( Fig. 3).
Fig. 3
MMP-9 and TIMP-1 activity in livers.
Normal : normal mice, Control : TAA-induced liver fibrosis mice, sliy : TAA-induced liver fibrosis with silymarin, RSL : TAA-induced liver fibrosis mice treated with silymarin (50 mg/kg)+RW (50 mg/kg), RSH : TAA-induced liver fibrosis mice treated with silymarin (50 mg/kg)+RW (100 mg/kg). All data are expressed as means±SEM (n=7). Significance : ###p<0.001 vs. Normal, *p<0.05, **p<0.01 vs. Control.
7. 간조직 내 단백질 발현량 분석
1) 간섬유화 단백질 발현량 분석
간섬유화에 관련 인자 중 TGF-b1와 a-SMA의 발현량을 분석한 결과, TGF-b1의 발현량은 정상군에 비해 대조군에서 2.2배( p<0.001) 증가하였으며, 대조군 대비 실리마린 단독 투여군 12%, RSL 투여군 17%, RSH 투여군 29% 농도 의존적으로 감소하는 경향을 보였다. a-SMA 수치를 확인한 결과, 정상군 대비 TAA를 투여한 대조군에서 1.4배( p<0.01) 증가한 반면, 실리마린 단독 투여군 30%, RSL투여군 30%, RSH 투여군 28% 감소하였다. 또한, collagen I의 경우, 정상군 대비 TAA를 투여한 대조군에서 2.2배( p<0.001) 증가하였으며, 실리마린 단독 투여군에서 대조군 대비 2.2배( p<0.05), 실리마린 투여군 20%, RSL 투여군은 34%, RSH 투여군은 36% 농도 의존적으로 감소하였다( Fig. 4).
Fig. 4
Expressions of TGF-β1, a-SMA, and COL1A1 protein in liver tissue.
Normal : normal mice, Control : TAA-induced liver fibrosis mice, sliy : TAA-induced liver fibrosis with silymarin, RSL : TAA-induced liver fibrosis mice treated with silymarin (50 mg/kg)+RW (50 mg/kg), RSH : TAA-induced liver fibrosis mice treated with silymarin (50 mg/kg)+RW (100 mg/kg) body weight. All data are expressed as means±SEM (n=7). Significance : ##p<0.01 and ###p<0.001 vs. Normal, *p<0.05, **p<0.01, and ***p<0.001 vs. Control.

2) NADPH 산화효소 단백질 발현량 분석
NADPH 산화효소는 독성 활성산소 음이온을 형성하기에 간섬유화를 유발하는 산화 스트레스의 원인으로 알려져 있으며 웨스턴블롯을 통해 발현량을 분석하였다. NOX2의 발현량을 확인한 결과, 정상군 대비 TAA를 투여한 대조군에서 1.9배( p<0.001) 증가한 반면 실리마린 단독 투여군 15%, RSL투여군 12%, RSH 투여군 18% 감소하였다. p22 phox 수치를 확인한 결과, 정상군 대비 TAA를 투여한 대조군에서 2.1배( p<0.001) 증가한 반면, 대조군에 비해 실리마린 단독 투여군 10%, RSL투여군 13% ( p<0.05), RSH 투여군 14% 유의하게 감소하였다. 또한 p47 phox의 분석 결과, 정상군에 비해 TAA를 투여한 대조군에서 2배( p<0.001) 증가한 반면, 실리마린 단독 투여군 10%, RSL투여군 19%, RSH 투여군 22% 농도 의존적으로 유의하게 감소하였다( Fig. 5).
Fig. 5
Expressions of NOX2, p22phox, and p47phox protein in liver tissue.
Normal : normal mice, Control : TAA-induced liver fibrosis mice, sliy : TAA-induced liver fibrosis with silymarin, RSL : TAA-induced liver fibrosis mice treated with silymarin (50 mg/kg)+RW (50 mg/kg), RSH : TAA-induced liver fibrosis mice treated with silymarin (50 mg/kg)+RW (100 mg/kg) body weight. All data are expressed means±SEM (n=7). Significance : ###p<0.001 vs. Normal, *p<0.05 and **p<0.01 vs. Control.

3) 염증 단백질 발현량 분석
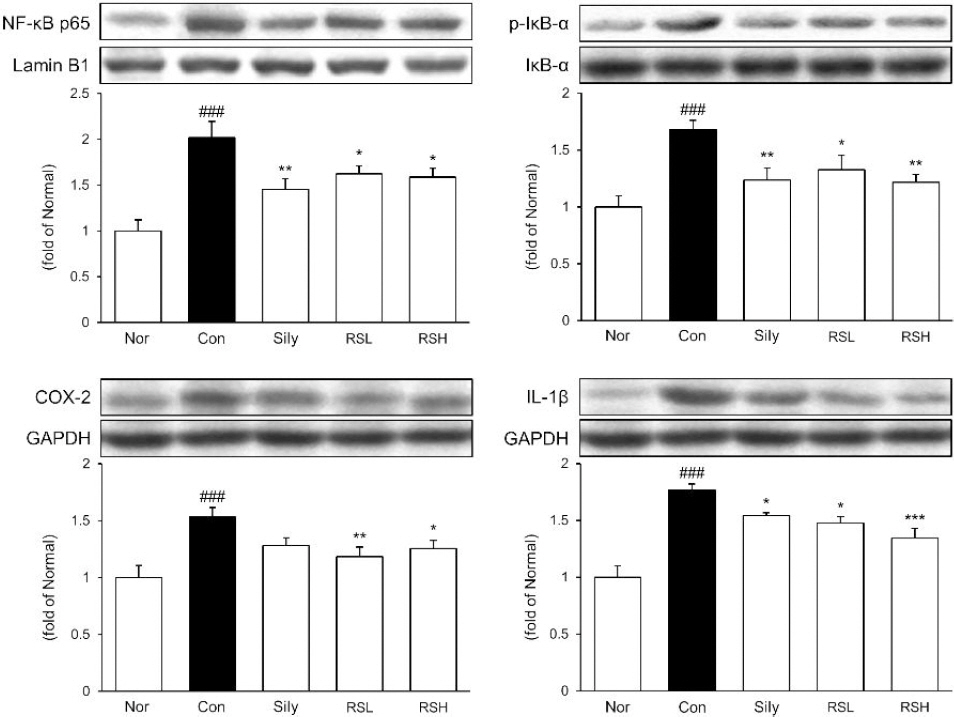
염증에 관련된 인자로 알려진 NF-κB의 발현량을 측정한 결과, 정상군에 비해 대조군에서 2.0배 ( p<0.001) 유의하게 증가하는 것을 확인하였으며, 대조군 대비 실리마린 단독 투여군 28%, RSL 투여군 19% 그리고 RSH 투여군 21%로 각각 감소하는 경향을 보였다. 또한, p-IκB 수치를 확인한 결과, 정상군 대비 TAA를 투여한 대조군에서 1.7배 증가하였으며( p<0.001), 대조군 대비 실리마린 단독 투여군에서 26%, RSL 투여군에서 21%, RSH 투여군에서 27%로 모든 처치군에서 유의적인 감소를 보였다. 또한 COX-2의 경우, 정상군 대비 TAA를 투여한 대조군에서 1.5배 증가하였으며( p<0.001), 대조군 대비 실리마린 단독 투여군에서 17%, RSL 투여군에서는 23%, RSH 투여군은 18% 유의적인 감소를 보였다. 마지막으로 IL-1b를 비교한 결과, 정상군 대비 TAA를 투여한 대조군에서 1.8배 증가하였으며( p<0.001), 대조군 대비 실리마린 단독 투여군에서 13%, RSL 투여군에서는 17% RSH 투여군은 24% 감소하였으며, 실리마린 단독 투여군보다 RSH 투여군에서 유의적인 감소를 보였다( Fig. 6).
Fig. 6
Expressions of NF-kB p65 and IkB-ɑ, COX-2, IL-1b protein in liver tissue.
Normal : normal mice, Control : TAA-induced liver fibrosis mice, sliy : TAA-induced liver fibrosis with silymarin, RSL : TAA-induced liver fibrosis mice treated with silymarin (50 mg/kg)+RW (50 mg/kg), RSH : TAA-induced liver fibrosis mice treated with silymarin (50 mg/kg)+RW (100 mg/kg) body weight. All data are expressed as means±SEM (n=7). Significance : ###p<0.001 vs. Normal, *p<0.05 and **p<0.01 vs. Control.
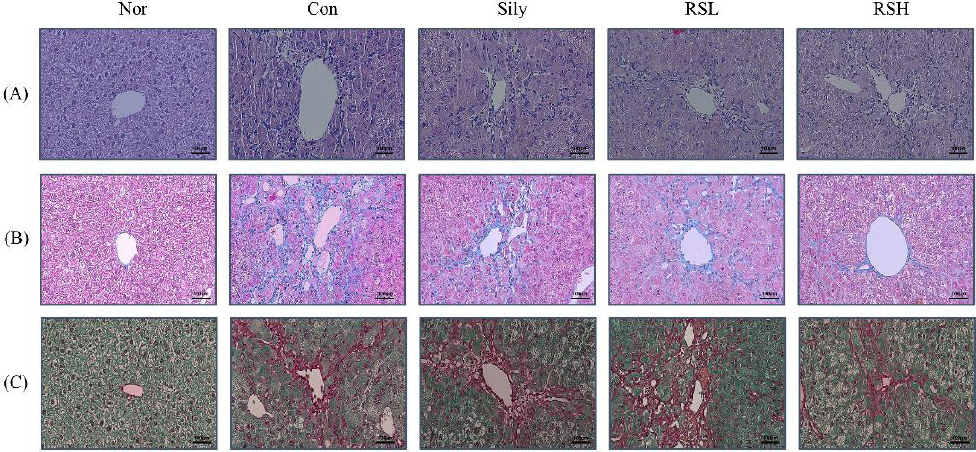
8. 간 조직의 H&E, MT 및 Sirius red 염색 결과
H&E과 MT staining을 통해 간 조직을 광학현미경으로 조직 병리학적 분석을 하였다. H&E staining 결과, 정상군과 TAA를 주입한 대조군을 비교하여 간조직의 병변과 염증 및 조직 괴사를 관찰하였으나, 대조군에 비해 RSH 투여군에서 현저하게 줄어드는 것을 확인할 수 있었다. MT와 Sirius Red/Fast Green 염색을 통해 콜라겐이 농도 의존적으로 침착이 개선되는 것을 확인할 수 있었으며, 정상군에 비해 대조군에서 염증세포 침윤 및 교원 섬유 침착과 같은 조직병리학적 변화가 확인되었다. 이로 인해 대황과 실리마린의 병용투여가 간 섬유화를 억제하는 것으로 판단된다( Fig. 7).
Fig. 7
Histopathological analysis.
hematoxylin-eosin : (H&E) staining, A : Masson’s trichrome (MT), B : Sirius Red/Fast Green Stain, C in liver tissue. Normal : normal mice, Control : TAA-induced liver fibrosis mice, sliy : TAA-induced liver fibrosis with silymarin, RSL : TAA-induced liver fibrosis mice treated with silymarin (50 mg/kg)+RW (50 mg/kg), RSH : TAA-induced liver fibrosis mice treated with silymarin (50 mg/kg)+RW (100 mg/kg) body weight. (x200, Scale bar 100 μm).
Ⅳ. 고 찰
간섬유화 발병은 만성 간질환의 중요한 원인으로 지속적인 상처 치유의 반응으로 나타나며, 간섬유화로 인한 간경변증 진행으로 간 내외 심각한 간 기능 저하를 초래하게 된다 20. 병인이 무엇이든 간섬유화의 진행은 세포의 necrosis, ECM의 변화, 면역 및 염증세포의 반응, HSC, 대식세포 및 Kupffer cells의 활성화를 특징으로 한다 21. 간섬유화와 관련하여 발생되는 간손상은 과도한 ROS로 인한 산화적 스트레스와 염증반응으로 나타나게 되며, 세포 사멸에 관련이 있으며, 간섬유화의 직접적인 원인이 되는 TGF-β1는 근섬유세포로의 분화를 자극할 뿐만 아니라 섬유단백질인 collagen I의 과잉 생산과 관련이 있다 22,23. 실리마린은 다양한 질병치료와 버섯 독성에 대한 보호 효과로 알려져 있으며, 간과 담낭 질환에 사용된 고대 약용식물로 간세포의 섬유화를 억제한다고 밝혀진 바 있다 24. 대황은 한방에서는 주로 변비 치료제로 이용되고 있으며, 항응고 작용이 있어 임상적으로 혈소판 감소증 및 지혈, 구내염, 구순궤양 및 화상 등의 치료에 응용되고 있다. 주성분으로는 chrysophanol, emodin 등의 anthraquinones 유도체와 glucoside 화합물이 보고되었다. 그 중 emodin은 anthraquinones류의 화합물로서, 이뇨제, 항균작용 및 혈관 이완제, 항염증 및 항암효과가 있는 것으로 알려져있다 25. TAA에 의한 간섬유화 모델에서는 혈청 간효소의 상승과 암모니아 수치 증가 등을 초래하고, 그에 따른 지질 과산화를 유발하여 조직 손상과 염증을 유발하게 된다 26. 현재 연구에서도 8주간의 TAA 투여로 인해 이러한 세 인자들이 증가하였으나, 대황과 실리마린(RS) 병용 투여로 이러한 상승된 수치들을 유의하게 감소시킴을 확인하였다. TAA 투여가 혈청 ALT, AST 및 암모니아 수치의 상당한 상승을 초래하여 간손상을 야기시켰으며, RS 투여로 인하여 간기능 수치가 개선됨을 확인하였다. 또한, 암모니아 수치에서 TAA를 투여할 경우, 혈중 수치가 2배로 증가하였고, 실리마린 단독 투여군과 비교하여 RS 투여군에서 농도 의존적으로 감소하는 것을 알 수 있었다. 항산화 수치를 나타내는 ROS의 결과는 실리마린의 단독 투여군과 RSH 투여군이 현저하게 감소함을 확인하였다. TAA로 인해 유발되는 지질 괴산화의 최종 생성물인 MDA 증가를 확인하였으며, 약물 처리 시 실리마린 단독 투여군보다 RS 처리군에서 더 낮은 수치를 확인할 수 있었다. 간섬유화는 중요한 요인으로 HSC에 의해 분비되는 ECM 단백질, MMPs및 MMPs 조절인자인 TIMPs를 분비하여 간섬유화를 유발한다. 이로 인해 ECM의 생산과 분해 사이의 불균형을 초래하면 ECM의 축적은 매트릭스 단백질을 분해하는 효소인 MMP-9의 기질 분해 기능을 억제하게 되며, TIMP-1의 과도한 분비로 인해 간 섬유화를 조절한다고 알려져 있다 27. 본 연구 결과에서 TAA의 노출로 인해 특정 ECM 분해에 관여하는 MMP-9의 분해를 감소시키고, 실리마린 단독 투여뿐만 아니라 RS 투여로 인해 조절되는 경향을 보였다. 반면, TIMP-1의 발현이 증가됨에 따라 ECM 생산 및 간섬유화가 유발되었음을 확인하였으며, RS 투여한 실험군에서 감소하는 경향을 확인하였다. TGF-b1은 세포의 성장과 분화를 조절하는 단백질로 간내부의 손상 부위에서 생성되어, 섬유아세포(fibroblast)를 활성화하여 섬유화 반응을 유도한다. 또한, 간섬유화 과정에서 α-SMA는 간 내부 조직의 손상 부위에서 생성되어 콜라겐(collagen) 및 섬유화 관련 단백질 합성을 촉진한다고 알려져 있다 28. 본 연구에서 TGF-b1, α-SMA 및 collagen의 단백질 발현을 분석한 결과, RS 투여군이 실리마린 단독 투여군 보다는 현저하게 줄어드는 결과를 얻었다. NOX2는 세포 내에서 산소 자유 라디칼을 생성하는 효소로 TAA 노출에 의해 증가되며, p47 phox의 발현증가로 인해 간섬유화을 유도한다 29. 여러 자극들에 의해 반응하여 ROS를 생성하는 효소로 NOX 시스템에 의하여 발생하는 산화적 스트레스는 간손상 등의 여러 간질환들의 진행에 중요한 역할을 한다고 알려져 있다 30. 간섬유화 질환의 환자를 치료하기 위해서는 NOX의 억제제가 구성요소 및 기능에 대한 연구가 중추적인 역할을 하고 있으며, NOX2의 활성화와 ROS의 생성의 연속적인 반응은 p47 phox과 p22 phox 같은 효소들을 유발하게 된다. 본 실험에서는 대황과 실리마린의 병용 투여와 산화 스트레스 억제의 관련성을 확인하기 위해 NOX2, p47 phox 및 p22 phox의 발현을 확인하였으며, 그 결과 TAA 유발로 인한 산화적 손상을 감소시킴으로써 RS 투여가 NADPH oxidase 발현에 관여하는 것으로 사료된다. TAA에 의한 간손상은 세포 염증, 세포사멸, 성장 및 발달에 관여하는 중요한 인자인 NF-κBp65는 IL-1b와 COX-2 및 profibrogebic 사이토카인과 같은 다양한 전염증 매개체의 생성을 조절하는 것으로 알려져 있다 31. 본 실험에서 간조직의 웨스턴블롯을 통하여 측정한 결과, TAA 투여군에서 정상군에 비해 NF-κBp65가 활성화되었으며, 이는 염증성 단백질인 IL-1b와 COX-2의 발현을 이끌었다. 반면에, RS 투여군에서는 이러한 염증성 단백질을 감소하는 것으로 나타났다. 또한, 간의 조직병리학적 변화를 보고자 H&E, MT 및 Sirius Red/Fast Green 염색을 시행한 결과, TAA 투여군의 간조직에서 ECM의 축적을 확인하였으며, 모든 약물 투여군에서 콜라겐과 염증세포의 침착이 개선됨을 확인하였다. 이러한 결과는 대황과 실리마린 병용 투여가 TAA에 의해 유도된 조직 내 염증성 병변과 염증세포 침윤을 현저하게 감소시키는 것으로 판단된다.
Ⅴ. 결 론
본 연구는 TAA로 유발한 간섬유화 마우스 모델에서 대황과 실리마린 병용 투여의 효과를 분석하였고, 아래와 같은 결과를 얻었다.
1. 체중 변화를 분석하였을 시, 모든 약물 투여군에서 체중 감소의 경향을 확인하였다. 또한, 혈청 AST, ALT 및 Ammonia의 경우는 대조군 대비 모든 약물 처리군에서 유의하게 감소시켰다.
2. RSH 투여군은 혈청 및 조직 둘 다에서 ROS 수치가 유의적으로 감소하였으며, 이는 다른 약물군과 비교했을 시 MDA를 효과적으로 억제시켰다. 또한, MMP-9의 증가와 TIMP-1의 감소를 통해 collagen을 효과적으로 분해하였다.
3. RS 병용 투여는 간섬유화 합성 관련 인자와 콜라겐 생성 인자 둘 다를 유의적으로 억제하였다. 특히, RSH 투여군은 TGF-b1와 collagen의 발현을 가장 우수하게 감소시켰다.
4. RSH 투여군은 산화 스트레스 관련 인자인 NADPH oxidase(NOX2, p47phox 및 p22phox)의 단백질 발현 분석에서 모두 유의하게 감소하였으며, NF-κBp65 발현의 유의한 억제를 통해 염증성 단백질을 효과적으로 조절하였다.
따라서 대황과 실리마린의 병용 투여는 간섬유화 마우스 모델에서, NF-κBp65 경로 억제를 통한 항염증 효과를 발휘하였으며, collagen 축적을 조절하여 간섬유화를 억제하였다. 따라서, 대황과 실리마린의 병용은 간섬유화를 예방하고, 치료하는 후보 소재의 하나로 판단되어진다.
감사의 글
본 연구는 2022년도 정부(과학기술정보통신부)의 재원으로 한국연구재단의 지원(No. 2018R1A5A2025272)을 받아 수행되었습니다. 또한 과학기술정보통신부(MSIT)의 R&D 복귀자 프로그램에 따라 한국과학기술여성재단(WISET) 보조금의 지원(2021-014)을 받았습니다.
참고문헌
1. Kisseleva T, Brenner DA. Role of hepatic stellate cells in fibrogenesis and the reversal of fibrosis. J Gastroenterology and Hepatology 2007:22(1):78–88.  2. Ramos-Tovar E, Muriel P. Molecular Mechanisms that link oxidative stress, inflammation, and fibrosis in the liver. Antioxidants 2020:9(12):1249.    3. Xu J, Liu X, Koyama Y, Wang P, Lan T, Kim IG, et al. The type of hepatic myofibroblasts contributing to liver fibrosis of different etiologies. Front Pharmacol 2014:5:167.   4. Özdemir-Kumral ZN, Erkek BE, Karakuş B, Almacı M, Fathi R, Yüksel M, et al. Potential effect of 1,25 Dihydroxyvitamin D3 on thioacetamide -induced hepatotoxicity in rats. J Surg Res 2019:243:165–72.   5. Lee JA, Lee SH, Shin MR, Sook NJ, Roh SS. The Effect of Chaenomelis Fructus Extract on Thioacetamide-induced Fibrosis. JKSFSN 2021:50(4):322–9.
6. Muller A, Machnik F, Zimmermann T, Schibert H. Thioacetamide-induced cirrhosis-like liver lesions in rats-usefulness and reliability of this animal model. Exp Pathol 1998:34(4):229–36.  7. Higashi T, Friedman SL, Hoshida Y. Hepatic stellate cells as key target in liver fibrosis. Adv Drug Deliv Rev 2017:121:27–42.    8. Breitkopf K, Godoy P, Ciuclan L, Singer MV, Dooley S. TGF-beta/Smad signaling in the injured liver. Z Gastroenterol 2006:44(1):57–66.   9. Hassan HA. Oxidative stress as a crucial factor in liver associated disorders:Potential therapeutic effect of antioxidants. The Liver, Academic Press 2018:121–30.  10. Lieber CS, Leo MA, Cao Q, Ren Cm Decarli LM. Silymarin retards the progression of alcohol-induced hepatic fibrosis in baboons. J Clin Gastroenterol 2003:37(4):336–9.  11. Jeong JH, Kim JH, Lee JD. A review on the medicinal potentials of Radix et Rhizoma Rhei. Journal of pharmacopuncture 2015:18(3):7–16.
12. Kiruthga PV, Shafreen RB, Pandian SK, Devi KP. Silymarin protection against major reactive oxygen species released by environmental toxins:exogenous H 2O 2 exposure in erythrocytes. Basic Clin Pharmacol Toxicol 2007:100(6):414–9.   13. Di Costanzo A, Angelico R. Formulation strategies for Enhancing the Bioavailability of Silymarin:The state of the art. Molecules 2019:24(11):2155.    14. Song JH, Yang TC, Chang KW, Han SK, Yi HK, Jeon JG. In vitro anti-cariogenic activity of dichloromethane fraction from Rheum undulatum L. root. Archives of pharmacal research 2006:29(6):490–6.    15. Hwang IY, Jeong CS. A study on the Antigastric effects of Rheum Species Extracts and Their Active Components. Journal of food Hygiene and safety 2013:2(4):330–6.
16. Folin O, Denis W. On phosphotungasticphospho- molybdic compounds as color reagent. Journal of biological chemisty 1912:12(2):239–43.
17. Lister CE, Lancaster JE, Sutton KH, Walker JR. Developmental changes in the concentration and composition of flavonoids in skin of a red and a green apple cultivar. Journal of the science of food and agriculture 1994:64(2):155–61.  18. Blois MS. Antioxidant determinations by the use of a stable free radical. Nature 1958:181(4617):1199–200.   19. Re R, Pellegrini N, Proteggente A, Pannala A, Yang M, Rice-Evans C. Antioxidant activity applying an improved ABTS radical cation decolorizationassay. Free Radical Biology and Medicine 1999:26(9-10):1231–7.   20. Park SM, Lee GW, Cho YH. Effect of rheum undulatum extract on antioxidant activity and activity of matrix metalloproteinase-1 in human skin fibroblasts. Journal of Life Science 2008:18(12):1700–4.  21. Schuppan D, Popov Y. Hepatic fibrosis:from bench to bedside. Journal Gastroenterol Hepatol 2002:17(3):300–5.   22. Sanchez-Valle V, Chavez-Tapia NC, Uribe M, Mendez-Sanchez N. Role of oxidative stress and molecular changes in liver fibrosis:a review. Curr Med Chem 2012:19(28):4850–60.   23. Parola M, Pinzani M. Liver fibrosis:pathophysiology, pathogenetic targets and clinical issues. Mol Aspect Med 2019:(65):37–55.  24. Kren V, Walteriva D. Silybin and Silymarin new effects and applications. Biomed Papers 2005:149(1):29–41.  25. Li Q, Gao J, Pang X, Chen A, Wang Y. Molecular Mechanism of Action of Emodin:As an Anti-Cardiovascular Disease Drug. Frontiers in Pharmacology 2020:11:559607.
26. Kim HJ, Kim SY, Shin SP, Yang YJ, Bang CS, Baik GH. Immunological measurement of aspartate/alanine aminotransferase in predicting liver fibrosis and inflammation. Korean J Intern Med 2020:35(2):320–30.    27. Arriazu E, De Galarreta MR, Cubero FJ, Varela-Rey M, De Obanos MPP, Leung TM, et al. Extracellular Matrix and Liver Disease. Antioxid. Redox Signal 2014:21(7):1078–97.
28. Bataller R, Brenner DA. Hepatic stellate cells as a target for the treatment of liver fibrosis. Seminars in Liver Disease 2005:25(4):419–31.  29. Bataller R, Gines P, Nicolas JM, Görbig MN, Garcia-Ramallo E, Gasull X, et al. AngiotensinII induces contraction and proliferation of human hepatic stellate cells. Gastroenterology 2000:118(6):1149–56.   30. Bataller R, Schwabe RF, Choi TH, Tang L, Paik YH, Lindquit J, et al. NADPH oxidase signal transduces angiotensin II n in hepatic stellate cells and critical in hepatic fibrosis. J Clin Invest 2003:112(9):1383–94.    31. De Souza Basso B, Haute GV, Ortega-Ribera M, Luft C, Antunes GL, Bastos MS, et al. Methoxyeugenol deactivates hepatic stellate cells and attenuates liver fibrosis and inflammation through a PPAR-ɣ and NF-kB mechanism. Journal of Ethnopharmacol 2021:280:114433. 
|
|


















