계혈등 에탄올 추출물의 RANKL 처리 RAW264.7 세포의 분화와 염증성 골 손실에 미치는 영향
Abstract
Purpose:
We evaluated whether Spatholobus suberectus extract (SSE) can be used as a means of preventing and treating osteoporosis by measuring its effect on osteoclast differentiation, gene expression, and bone resorption.
Methods:
SSE was used to examine the effect on RAW 264.7 cells stimulated with RANKL to induce bone resorption. The inhibitory effect of TRAP formation and the expression of the bone resorption factors TRAP, cathepsin K, and MMP-9 during differentiation were measured. The effects on the differentiation-related factors NFATc and TRAIL and on the expression of OC-STAMP, DC-STAMP, ATP6v0d2, MITF, c-Fos, and inflammation-related factors were also evaluated. The effect on bone resorption was evaluated by culturing RANKL-treated osteoclasts on artificial bone fragments and observing the resulting resorption traces. The effect on bone damage in experimental animals was also measured.
Results:
SSE inhibited the differentiation of RANKL-stimulated osteoclasts into osteoclasts and suppressed the expression of cathepsin K, TRAP, MMP-9, NFATc1, TRAIL, MITF, OC-STAMP, DC-STAMP, ATP6v0d2, and c-Fos genes. Bone pore formation due to osteoclast action was also inhibited, and LPS-induced bone loss was suppressed in animal experiments.
Conclusions:
SSE could be useful for the prevention or treatment of osteoporosis by inhibiting osteoclast differentiation and bone resorption and suppressing bone loss induced in experimental animals. However, studies of larger populations are required.
Keywords: Spatholobus suberectus, osteoporosis, osteoclast, RANKL
I. 서 론
의학의 발달과 함께 평균수명이 증가하면서 인류의 기대수명 또한 늘어나고 있다. 경제협력개발기구 통계에 따르면, 2017년 우리나라의 기대수명은 OECD 평균 80.7년 보다 2.0년 긴 82.7년으로 것으로 나타났다 1. 그러나 유병기간을 제외한 건강수명의 경우 2016년 64.9세, 2020년 66.3세로 기대수명에 비해 현저히 낮게 보고되었다 2,3. 기대수명이 점차 증가함에 따라 퇴행성 질환의 예방 및 치료의 필요성이 대두되고 있는데, 대표적인 퇴행성 질환인 골다공증의 유병률과 관련 의료비 지출이 증가하고 있다 4. 특히 골다공증은 골절로 쉽게 이어져 육체적 활동이 제한되어 다양한 성인성 질환의 유발 원인으로 작용하기도 한다 5. 골다공증은 ‘골 손실이 증가하거나, 골 재생 감소 또는 둘 모두로 인해 발생하는 골 질환으로 그 결과 골 강도가 약화되어 넘어지거나 심할 경우 재채기나 가벼운 타박으로 인하여 골절 위험성이 증가하는 골격계 질환’으로 정의하고 있다 6. 일반적으로 골강도는 골질(quality)과 골량(quantity)에 의해 결정되는데 7,8, 골형성과 골유지의 조골세포(osteoblast)와 파골세포(osteoclast)의 불균형으로 인해 골다공증이 유발되는 것으로 알려져 있다 9. 한의학적으로 골다공증은 골위(骨萎)의 개념 등에 포괄될 수 있으며, ≪黃帝內經⋅素問⋅痿論≫에서 ‘腎主身之骨髓’, ‘腎氣熱, 則腰脊不擧, 骨枯而髓減, 發爲骨痿’라 하여, 補腎陰, 補腎陽, 補肝腎, 健脾益腎 등의 치료법이 다용된다. 기존 연구에서 어성초(魚腥草) 10, 여정자(女貞子)와 곡기생(槲寄生) 11 등의 천연약물들과 생맥산(生脈散) 등이 파골세포의 분화 및 활성을 억제하여 치료에 매우 효과적인 것으로 보고되고 있다. 본 실험에서 사용한 계혈등은 콩과(Leguminosae)에 속한 낙엽 목질대등본(落葉 木質大藤本)인 밀화두(密花豆, Spatholobus suberectus Dunn)의 줄기를 건조한 것으로, 苦甘하면서 溫하여 血行하되 陰血을 상하지 않게 하며 補血하되 滯血하지 않게 하는 특징이 있다. 肝經과 腎經에 귀경하여 혈액순환을 도와주고 근육을 풀어주는 효능이 있고, 여성의 월경을 고르게 하는 작용과 손과 발의 마비감, 관절통에 활용한다. 또한 방사선 치료로 백혈구 수치가 감소하는 증상에도 일정한 효과가 있는 등 12 여러 연구에서 항산화 활성, 항염활성, 항균활성 및 간보호 효과 등을 보고하였다 13-15. 그러나 골다공증 자체가 ≪황제내경≫에서의 골위 외에 특별히 언급되지 않고 있으며, 특히 신주골 이론에 근거한 보신음, 보신양, 보간신, 건비익신 등의 치료법에 해당하는 약재들이 효과가 미약하거나 거의 없는 경우도 있기 때문에, 본 논문에서는 계혈등의 파골세포에 작용하는 기능을 분석하여 골다공증 예방 및 치료 수단으로 활용 가능 여부를 평가하고자 하였다.
II. 방 법
1. 재 료
1) 계혈등 추출 및 검액 제조
계혈등(Spatholobus suberectus, 조화제약, 중국산)을 분쇄기를 이용하여 분말화한 후 둥근 플라스크에 넣은 후, 30% 에탄올을 5시간 이상 열을 가하는 방식으로 환류냉각하여 추출하였다. 여과지에 여과한 여액을 감압 농축하고 냉동 건조하여 사용 시까지 냉동 보관 하였다(수득률 9.2%). 실험 시 DMSO(Dimethyl sulfoxide)를 이용하여 계혈등 추출물(이하 SSE라 함)을 배지에 녹이고 pore size 0.45 um의 여과지로 여과하였다.
2) 세 포
Mouse myeloid 세포주인 RAW 264.7 세포(한국세포주은행에서 구입)를 RANKL(Receptor Activator of Nuclear Factor-Kappa B Ligand)로 유도한 세포 모델을 파골세포의 전구세포로 사용하였다.
2. 실험 방법
1) SSE가 파골세포에 미치는 영향 측정
(1) RAW 264.7 세포 배양
CO2 세포 배양기에서 Dulbecco’s modified eagle medium(DMEM), 10% Fetal bovine serum(FBS), Penicillin-streptomycin(PC-SM) 배지를 이용하여 RAW 264.7 세포를 배양하였고, 96 well plate를 사용하여 세포 수를 5×103 cells/well로 하였다. 24시간 동안 배양한 후 기존 배양액을 버리고, 10% FBS, 1 ng/ml TGFβ, 50 ng/ml RANKL을 첨가한 α-MEM으로 교환하였다. 여러 농도의 SSE를 위의 배양액에 첨가하였고, 동일한 조건의 배지로 2일마다 1회씩, 총 6일간 교환하여 배양하였다.
(2) 파골세포 형성에 미치는 영향 측정
RAW 264.7 세포를 RANKL을 이용하여 파골세포로 유도한 후, 파골세포의 발현 지표인 TRAP를 염색하여 TRAP-positive 세포를 확인하였다. 분화된 파골세포를 PBS로 3회 세척하고, 3.7% formaldehyde -citrate-acetone 용액으로 10분간 고정시킨 후 증류수로 3회 세척하였다. NaNO3 용액과 2% TRAP fast garnet SSEC base 용액을 같은 비율로 섞어 만든 용액과 2% tartaric acid, 4% acetic acid, 5% naphtha AS-BI phosphoric acid를 포함한 용액을 고정시킨 세포에 처리하고 40분간 상온 유지하였다. 파골세포의 생성지표로서 핵이 3개 이상인 TRAP- positive 다핵세포를 광학현미경을 이용하여 계수하였다.
2) SSE가 파골세포 유전자 발현에 미치는 영향 측정
(1) 총 RNA 분리
RANKL로 RAW 264.7 세포를 파골세포로 분화한 후 배양하고, 파골세포로 분화시킨 세포에 인산 완충 생리식염수인 PBS를 넣어 균질화한 후, 1 ml TRIzol reagent(Invitrogen, USA)을 이용하여 총 RNA를 분리하였다. 분리한 RNA 용액에 chloroform과 isoamylalcohol을 24:1의 비율로 200 μl을 넣고 섞은 다음, 14,000 rpm의 강도로 상층액 500 μl을 원심 분리하였다. 0.5 ml isopropyl alcohol을 첨가하고 -20 °C에서 8시간 이상 RNA를 침전시킨 다음, 1,400 rpm의 강도로 25분간 원심 분리하였다. 남은 상등액을 버리고 70% 에탄올로 세척한 후 자연 건조시켰다. RNase free water에서 RNA를 녹이고 RNase-free DNase를 첨가한 후 -70 °C로 저장하였다.
(2) cDNA 제조
대조군 및 시험군에서 각각 total RNA 액 1 μl (1 μg RNA 함유)을 분리하여 RNase free water 3 μl, oligo dT(농도 100 pmol) 1μl을 넣고 조심히 혼합하여 65 °C에서 15분간 incubation하였다. 4 °C에서 5분 동안 Primer가 annealing 하도록 대기한 후, RNase inhibitor, dNTP, Reverse transcriptase buffer (각 2.5 mM), DTT(100 nM), Reverse transcriptase (M-MLV 200 U/μl)를 첨가한 후, 아주 조심히 혼합한 다음 42 °C에서 90분간 incubation하고, 95 °C에서 5분간 처리한 다음 사용하였다.
(3) Real time RT-PCR
각각의 optical tube(MicroAmp ® Optical 96-Well Reaction Plate with Barcode and Optical Adhesive Films, Applied Biosystems, Cat.No. 4314320)에 3배의 SybrGreen Mix 2.5 μl(Sigma-Aldrich, Cat.No. S9430), (2)에서 합성한 cDNA 1 μl, 10 pmol/μl primer pair mix 1 μl, 각각 2.5 mM의 dNTP 2 μl, 10xTag polymerase buffer 2.5 μl, Tag Polymerase 0.3 μl와 14.7 μl H 2O를 넣고, 95 °C 5 min 1 cycle, 95 °C 30 sec, 45 °C 30 sec, 72 °C 60 sec 40 cycles, 95 °C 20 min 1 cycle로 증폭시켰다. PCR을 종료하고 tube를 꺼낸 후, 반응액 5 μl를 사용하여 3%의 agarose gel에서 PCR 특이성(specificity)을 측정하고, ABI PRISM ® 7000 Sequence Detection System (Applied Biosystems, Cat.No.4349157)로 Real time PCR 결과를 분석하였다. 사용한 primer는 Table 1에 기재하였다. RT-PCR에서 대조군으로 사용한 housekeeping gene은 β-actin TCACCCACACTCTGCCCAT TCCTTAATGTCACGCACCATTT이다.
Table 1
|
Target gene |
Forward (5’-3’) |
Reverse (5’-3’) |
|
Cathepsin K |
AGG CGG CTA TAT GAC CACTG |
CCG AGC CAA GAG AGC ATATC |
|
c-fos |
CCA GTC AAG AGC ATC AGCAA |
AAG TAG TGC AGC CCG GAGTA |
|
OC-STAMP |
TCA CTG ACC TGC GTT TCG ACAA |
GCG TAG GCC TGT AGC CAC CAA |
|
DC-STAMP |
ACT AGA GGA GAA GTC CTG GGA GTC |
CAC CCA CAT GTA GAG ATA GGT CAG |
|
TRAIL |
CAG AGG AAG AAG CAA CAC ATT CTCT |
TGA TGA TTC CCA GGA GTT TAT TTTG |
|
ATP6v0d2 |
ATG GGG CCT TGC AAA AGA AAT CTG |
CGA CAG CGT CAA ACA AAG GCT TGTA |
|
MITF |
GGA ACA GCA ACG AGC TAAGG |
TGA TGA TCC GAT TCA CCAGA |
|
MMP-9 |
CGT CGT GAT CCC CAC TTACT |
AGA GTA CTG CTT GCC CAGGA |
|
NFATc1 |
GGG TCA GTG TGA CCG AAGAT |
GGA AGT CAG AAG TGG GTGGA |
|
TRAP |
ACA CAG TGA TGC TGT GTG GCA ACTC |
CCA GAG GCT TCC ACA TAT ATG ATGG |
3) Bone resorption Assay
파골세포의 분화 및 활성의 결과로 인한 골의 흡수상태을 평가하기 위하여, plate에 calcium-collagen으로 코팅된 인공 뼈를 사용하였다. phenol-red-free MEM 배지로 calcium phosphate와 collagen으로 코팅한 plate를 세척하고, 분화되지 않은 파골세포 전구세포를 1×103 cells/well로 분주한 후 24시간 동안 배양하였다. 이후 RANKL 100 ng/ml을 처리하여 60분간 배양한 다음, SSE를 농도별로 처리하고 10일 동안 배양하였다. 배지는 2일에 1회 교체하였다. 배양을 마치고 5% Sodium hypochlorite를 처리하여 세포를 제거하고 DDW로 세척한 다음 ×400 역상 현미경으로 뼈의 흡수를 관찰하고 사진을 촬영하였다.
4) 동물 모델에서의 골 손실 평가
실험동물로 마우스(ICR, 5주령)를 3일 동안 사육장 환경에서 적응시키고 사용하였다. 실험기간 동안 식이를 자유롭게 섭취할 수 있게 하였다. 실험동물을 정상군(N)과 골다공증 대조군(LPS) 그리고 시료 투여군(SSE)으로 나누고, 정상군과 골다공증 대조군에는 생리식염수를 투여하였으며 시료 투여군에는 SSE를 1일 1회 경구로 500 mg/kg 용량을 투여하였다. 투여를 시작한지 4일, 7일차에 LPS(5 mg/kg)를 LPS군과 SSE군의 복강에 투여하였다. 투여 10일 후 실험동물을 희생시켜 적출한 대퇴부를 4% formaldehyde로 고정시키고 골 손실도 평가 이미지 촬영은 micro-CT(Bruker, Kartuizersweg 3B, 2550 Kontich, Belgium, Skyscan 1172)로 하였다.
3. 통계학적 분석
Student’s t-test를 이용하여 각 결과에 대한 유의성을 검증하였다. p값이 0.05 보다 작을 경우 유의성이 있다고 판정하였다.
III. 실험결과
1. SSE가 파골세포 분화에 미치는 영향
1) SSE가 세포 생존율에 미치는 영향
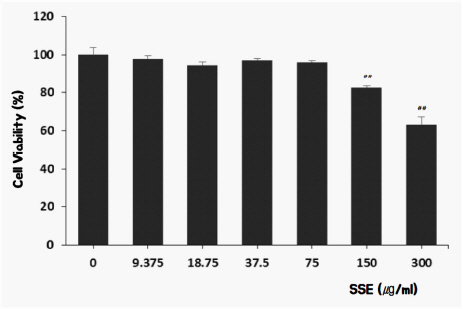
SSE가 세포상해를 통하여 분화를 억제하는지를 확인하기 위하여 미분화된 세포에 추출물을 첨가한 후 3일간 배양하였고, MTT방법으로 세포 생존율을 평가하였다. 실험결과, SSE는 150 μg/ml 이상에서 세포 생존율을 낮추는 것을 알 수 있었다. 따라서 세포 생존율에 영향을 미치지 않는 75 μg/ml 이하 농도에서 실험을 진행하였다( Fig. 1).
Fig. 1
Effects of SSE on cell viability of osteoclast.
0 (Control) : vehicle
9.375 : 9.375 ug/ml of SSE
18.75 : 18.75 ug/ml of SSE
37.5 : 37.5 ug/ml of SSE
75 : 75 ug/ml of SSE
150 : 150 ug/ml of SSE
300 : 300 ug/ml of SSE
## : p<0.01 vs Control
2) SSE가 파골세포 세포 형성에 미치는 영향
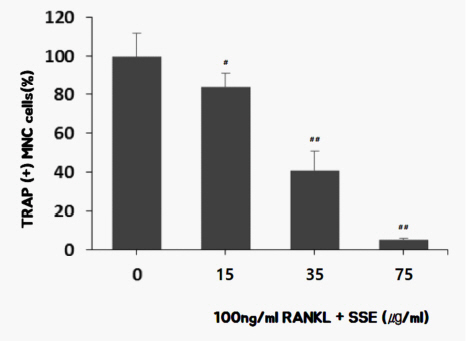
RANKL과 TGFβ를 RAW 264.7 세포에 첨가하여 배양을 한 경우 성숙한 파골세포의 발현 지표인 TRAP-positive 다핵세포가 다수 형성되었고, 이에 SSE를 투여하여 파골세포 형성에 SSE가 미치는 영향을 측정하였다. 실험결과, 파골세포로 분화한 TRAP-positive 다핵세포 생성량은 15 μg/ml 농도의 group은 Control에 비해 약 17% 감소하였고, 35μg/ml 농도의 group은 Control에 비해 약 59% 감소하였다. 또한 75 μg/ml 농도의 group은 96% 감소하였다( Fig. 2, 3).
Fig. 2
Effects of SSE on osteoclast differentiation in RANKL induced RAW 264.7 cell. 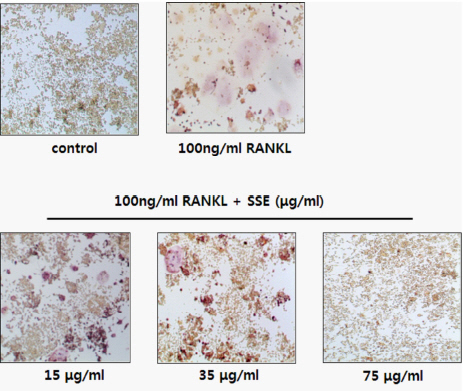
Fig. 3
Effects of SSE on the formation of TRAP(+) MNCs in RANKL induced osteoclast.
0 (Control) : 100 ng/ml of RANKL
15 : 15 ug/ml of SSE+100 ng/ml of RANKL
35 : 35 ug/ml of SSE+100 ng/ml of RANKL
75 : 75 ug/ml of SSE+100 ng/ml of RANKL
## : p<0.01 vs Control
# : p<0.05 vs Control
2. SSE가 파골세포 유전자 발현에 미치는 영향
1) SSE가 Cathepsin K 발현에 미치는 영향
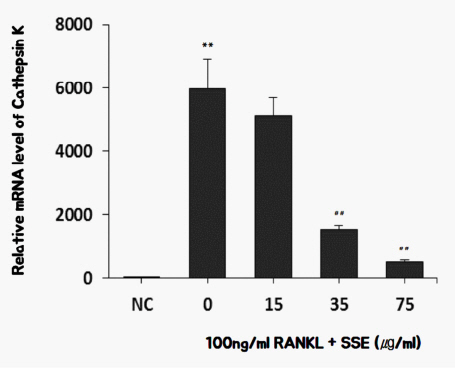
실험결과, RANKL을 처리한 대조군은 처리하지 않은 정상군에 Cathepsin K 유전자 발현이 현저히 증가하였으며, SSE를 투여한 경우 35 ug/ml, 75 ug/ml 농도에서 RANKL 자극으로 증가한 Cathepsin K 유전자 발현이 억제되었다( Fig. 4).
Fig. 4
Effects of SSE on the mRNA expression of cathepsin K in RANKL induced osteoclast.
NC : vehicle
0 (Control) : 100 ng/ml of RANKL
15 : 15 ug/ml of SSE+100 ng/ml of RANKL
35 : 35 ug/ml of SSE+100 ng/ml of RANKL
75 : 75 ug/ml of SSE+100 ng/ml of RANKL
** : p<0.01 vs NC
## : p<0.01 vs Control
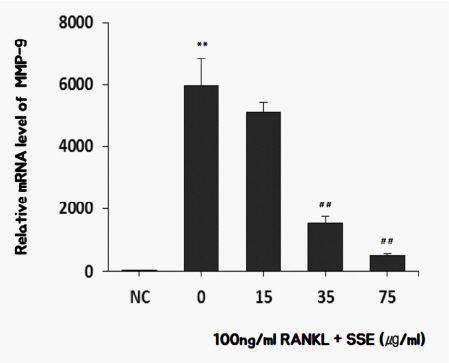
2) SSE가 MMP-9 발현에 미치는 영향
실험 결과, RANKL을 처리하여 분화시킨 대조군은 처리하지 않은 정상군에 비해 MMP-9 발현이 현저히 증가하였으며, 파골세포에 SSE를 처리하여 MMP-9의 활성을 측정한 결과, SSE를 35 ug/ml, 75 ug/ml 농도에서 MMP-9 발현이 현저히 억제 되었다( Fig. 5).
Fig. 5
Effects of SSE on the mRNA expression of MMP-9 in RANKL induced osteoclast.
NC : vehicle
0 (Control) : 100 ng/ml of RANKL
15 : 15 ug/ml of SSE+100 ng/ml of RANKL
35 : 35 ug/ml of SSE+100 ng/ml of RANKL
75 : 75 ug/ml of SSE+100 ng/ml of RANKL
** : p<0.01 vs NC
## : p<0.01 vs Control
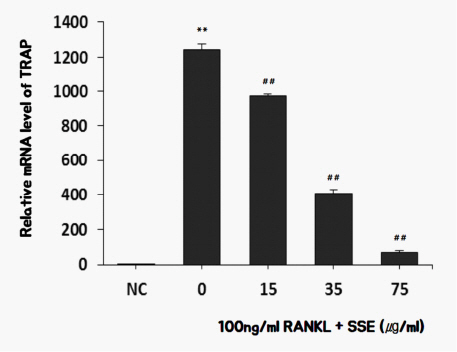
3) SSE가 TRAP 발현에 미치는 영향
골수에서 유래한 전구세포들이 파골전구세포로 분화하면 TRAP(Tartarate-Resistant Acid Phosphatase)과 같은 파골세포 표식 유전자를 발현하게 된다 16. 실험결과 SSE를 투여한 경우 RANKL 처리로 분화된 파골세포에서 TRAP의 유전자 발현이 억제되었다( Fig. 6).
Fig. 6
Effects of SSE on the mRNA expression of TRAP in RANKL induced osteoclast.
NC : vehicle
0 (Control) : 100 ng/ml of RANKL
15 : 15 ug/ml of SSE+100 ng/ml of RANKL
35 : 35 ug/ml of SSE+100 ng/ml of RANKL
75 : 75 ug/ml of SSE+100 ng/ml of RANKL
** : p<0.01 vs NC
## : p<0.01 vs Control
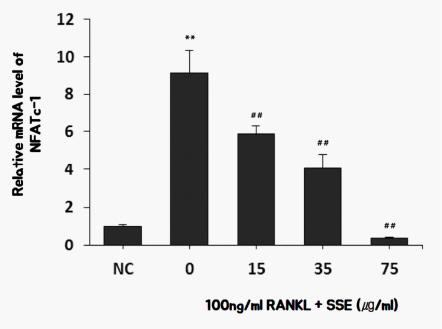
4) SSE가 NFATc1 발현에 미치는 영향
NFATc1는 파골세포로 분화를 촉진하는 신호전달 단백질로, RANKL/RANK 복합체가 형성되면, 이 과정에서 TRAF 활성화, MAPK의 pathway 활성화(ERK, p38, JNK)를 거쳐 유전자 발현을 조절하는 전사인자인 transcription factor의 활성화 및 NFATc1, Src, AP-1, Akt, NF-kB 등이 포함되어 있다 17. 실험결과, SSE를 투여한 경우 RANKL로 처리된 파골세포의 분화과정에서 NFATc1의 발현이 억제되었다( Fig. 7).
Fig. 7
Effects of SSE on the mRNA expression of NFATc1 in RANKL induced osteoclast.
NC : vehicle
0 (Control) : 100 ng/ml of RANKL
15 : 15 ug/ml of SSE+100 ng/ml of RANKL
35 : 35 ug/ml of SSE+100 ng/ml of RANKL
75 : 75 ug/ml of SSE+100 ng/ml of RANKL
** : p<0.01 vs NC
## : p<0.01 vs Control
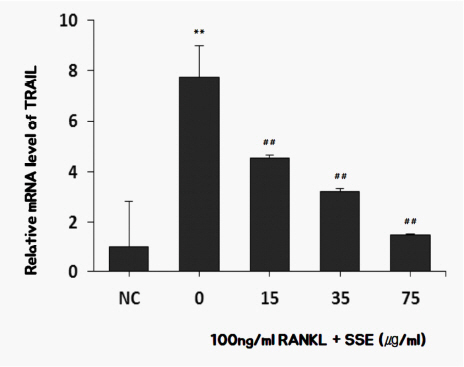
5) SSE가 TRAIL 발현에 미치는 영향
TRAIL(TNF-α-related apoptosis-inducingligand)이 세포사멸과 구별되는 신호 경로를 통해 TRAIL 사망 수용체와 직접 결합함으로써 파골세포 분화를 유도한다 18,19. SSE가 신호전달 과정의 일부분인 TRAIL의 발현에 미치는 영향을 측정하였고 실험결과, SSE를 투여한 경우 RANKL로 유도된 파골세포의 분화 과정에서 TRAIL의 합성이 억제되었다( Fig. 8).
Fig. 8
Effects of SSE on the mRNA expression of TRAIL in RANKL induced osteoclast.
NC : vehicle
0 (Control) : 100 ng/ml of RANKL
15 : 15 ug/ml of SSE+100 ng/ml of RANKL
35 : 35 ug/ml of SSE+100 ng/ml of RANKL
75 : 75 ug/ml of SSE+100 ng/ml of RANKL
** : p<0.01 vs NC
## : p<0.01 vs Control
6) SSE가 OC-STAMP 발현에 미치는 영향
OC-STAMP는 골 흡수와 파골세포 분화를 촉진한다 20. RANKL로 처리하여 분화되는 파골세포에서는 OC-STAMP의 발현이 현저히 증가하였다. 실험결과 파골세포로 분화되는 과정에서 SSE를 투여한 경우 75 ug/ml 농도에서 OC-STAMP의 발현이 현저히 억제되었다( Fig. 9).
Fig. 9
Effects of SSE on the mRNA expression of OC-STAMP in RANKL induced osteoclast.
NC : vehicle
0 (Control) : 100 ng/ml of RANKL
15 : 15 ug/ml of SSE+100 ng/ml of RANKL
35 : 35 ug/ml of SSE+100 ng/ml of RANKL
75 : 75 ug/ml of SSE+100 ng/ml of RANKL
** : p<0.01 vs NC
## : p<0.01 vs Control

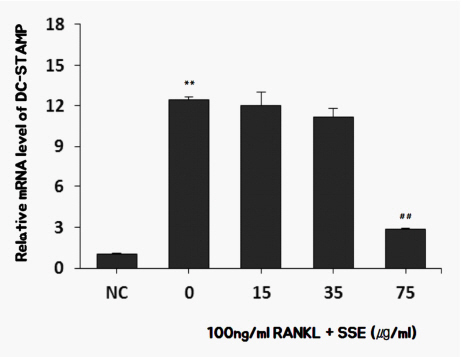
7) SSE가 DC-STAMP 발현에 미치는 영향
DC-STAMP는 파골세포의 지표유전자 중 하나로 알려져 있다 21. SSE가 파골세포 분열에 나타나는 DC-STAMP의 mRNA생성량을 측정하여 비교하였다. RANKL로 처리하여 분화된 파골세포에서는 DC-STAMP의 발현이 현저히 증가하였으나 SSE를 투여한 경우 파골세포로 분화되는 과정에서 DC-STAMP의 발현이 억제되었다( Fig. 10).
Fig. 10
Effects of SSE on the mRNA expression of DC-STAMP in RANKL induced osteoclast.
NC : vehicle
0 (Control) : 100 ng/ml of RANKL
15 : 15 ug/ml of SSE+100 ng/ml of RANKL
35 : 35 ug/ml of SSE+100 ng/ml of RANKL
75 : 75 ug/ml of SSE+100 ng/ml of RANKL
** : p<0.01 vs NC
## : p<0.01 vs Control
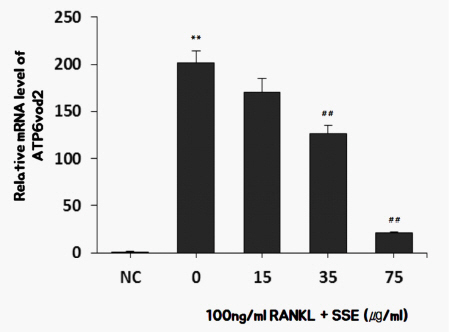
8) SSE가 ATP6v0d2 발현에 미치는 영향
ATP6v0d2는 골 흡수에서 세포 외 산화를 매개한다 22. RANKL로 처리하여 분화된 파골세포에서는 ATP6v0d2의 발현이 현저히 증가하는데, 75 ug/ml 농도로 SSE를 투여한 경우 파골세포로 분화되는 과정에서 증가하는 ATP6v0d2의 발현이 현저히 억제되었다( Fig. 11).
Fig. 11
Effects of SSE on the mRNA expression of ATP6v0d2 in RANKL induced osteoclast.
NC : vehicle
0 (Control) : 100 ng/ml of RANKL
15 : 15 ug/ml of SSE+100 ng/ml of RANKL
35 : 35 ug/ml of SSE+100 ng/ml of RANKL
75 : 75 ug/ml of SSE+100 ng/ml of RANKL
** : p<0.01 vs NC
## : p<0.01 vs Control
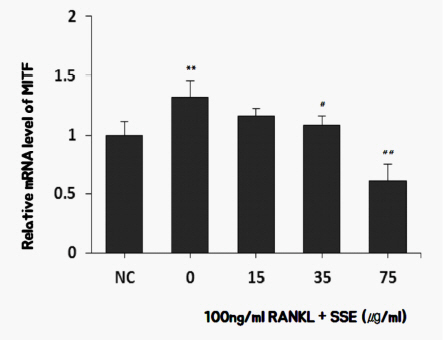
9) SSE가 MITF 발현에 미치는 영향
MITF(microphthalmia-associated transcription factor) 파골세포 생성 동안에 발현된다. RANKL로 처리한 파골세포에서 파골세포 분화에 핵심적인 역할을 하는 전사인자인 MITF의 발현은 증가하였다 23. SSE를 투여한 경우 75 ug/ml 농도에서 MITF 발현이 유의미하게 억제되었다( Fig. 12).
Fig. 12
Effects of SSE on the mRNA expression of MITF in RANKL induced osteoclast.
NC : vehicle
0 (Control) : 100 ng/ml of RANKL
15 : 15 ug/ml of SSE+100 ng/ml of RANKL
35 : 35 ug/ml of SSE+100 ng/ml of RANKL
75 : 75 ug/ml of SSE+100 ng/ml of RANKL
** : p<0.01 vs NC
## : p<0.01 vs Control
# : p<0.05 vs Control
10) SSE가 c-Fos 발현에 미치는 영향
PGE2 생성량이 증가하면 파골세포의 분화가 촉진되므로, c-Fos의 발현을 통해 파골세포 분화가 촉진된다고 볼 수 있다 24. 실험결과, SSE를 투여한 경우 75 ug/ml 농도에서 c-fos 발현이 뚜렷하게 억제되었다( Fig. 13).
Fig. 13
Effects of SSE on the mRNA expression of c-FOS in RANKL induced osteoclast.
NC : vehicle
0 (Control) : 100 ng/ml of RANKL
15 : 15 ug/ml of SSE+100 ng/ml of RANKL
35 : 35 ug/ml of SSE+100 ng/ml of RANKL
75 : 75 ug/ml of SSE+100 ng/ml of RANKL
** : p<0.01 vs NC
## : p<0.01 vs Control

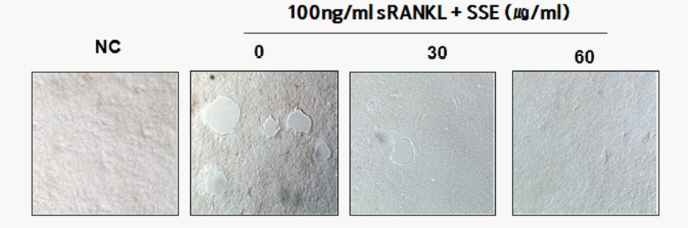
3. SSE가 골 흡수에 미치는 영향
SSE가 파골세포의 분화를 억제하는 실험결과를 바탕으로 골 조직에서의 골 흡수 억제 작용를 평가하고자 bone pit을 사용하여 평가하였다 25. RANKL로 파골세포을 분화시킨 후 인조 골편에 SSE를 함께 처리하고 10일 간 배양한 결과, control은 pit 면적이 뚜렷한 것에 반해 SSE를 60 μg/ml 처리한 경우에 pit 형성이 거의 나타나지 않았다. 따라서 SSE가 골 흡수를 억제하는 것으로 판단할 수 있다( Fig. 14).
Fig. 14
Effects of SSE on bone pit formation by RANKL induced osteoclast.
NC : vehicle
0 (Control) : 100 ng/ml of RANKL
30 : 30 ug/ml of SSE+100 ng/ml of RANKL
60 : 60 ug/ml of SSE+100 ng/ml of RANKL
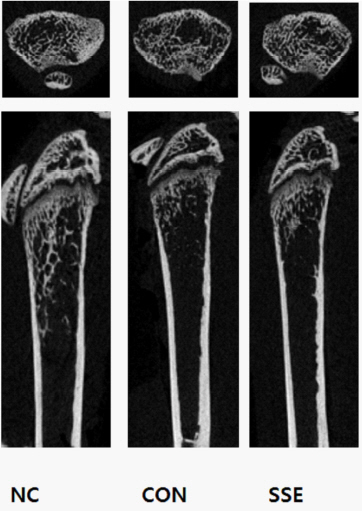
4. SSE가 마우스의 골 손실에 미치는 영향
RAW 264.7 세포에서 LPS(lipopolysaccharide)는 파골세포의 분화 및 활성화를 촉진시킨다 26. SSE가 LPS로 유도된 실험동물의 골 손실에 미치는 영향을 평가하기 위한 실험결과, LPS(5 mg/kg)를 주입한 대조군의 BV/TV는 약 9.8%로 정상군의 16.4% 에 비하여 골 손실이 뚜렷하게 나타났으며, SSE를 500 mg/kg 주입한 처리군의 BV/TV는 12.3%로 LPS에 의해 골 손실이 유발된 대조군에 비해 현저히 개선되는 것을 관찰할 수 있었다( Fig. 15).
Fig. 15
In Vivo effect of SSE on LPS-induced bone degradation.
NC : normal control
CON : LPS only
SSE : LPS+SSE (500 mg/kg)
IV. 고 찰
평균수명의 증가와 함께 노령화 사회로의 진입으로 인해 퇴행성 질환에 대한 예방과 치료에 대한 관심이 절대적으로 요구된다. 특히 골다공증은 쉽게 간과되기 쉬운데 골절이 발생하기 전까지는 특별한 증상이 없기 때문이다. 골다공증은 파골세포의 활성화에 따른 골 흡수 증가로 인해 나타나는 호르몬성 골다공증과 조골세포의 기능이 감소하여 골 형성이 감소하는 노인성 골다공증이 대표적이며 그 외 약물에 의해 유발되는 골다공증 등이 있다. 2012년 보건복지부 보고에 따르면 우리나라의 골다공증 유병률은 50세 이상의 남성의 경우 7.8%, 폐경 후 여성의 경우 34.9%로 여성이 남성보다 약 4.5배 높다. 남성의 경우 50-59세에서 4.5%, 60-69세에서 5.5%, 그리고 70세 이상에서 20.0%로 70세를 기준으로 4배가량 증가한다. 여성의 경우 50-59세에서 15.4%, 60-69세에서 32.8%, 그리고 70세 이상에서 65.2%로 연령층별 두 배가량 증가한다고 보고되었다 27,28. 골다공증은 그 원인에 따라 치료법이 달라야 한다. 생활교정을 제외하면 대부분 약물 치료제를 이용하고 있다. 현재 골다공증에 다용하는 서양의학적 치료방법으로는 골 흡수 억제제, 골 형성 촉진제 그리고 골 흡수를 억제하고 동시에 골 형성을 촉진하는 복합작용제 등으로 구성된다. 골 흡수 억제제로는 칼슘제와 비타민D 등의 영양소와 Estrogen, Bisphosphonate, 선택적 에스트로겐 수용체 조절제(SERM), Calcitonin 등의 호르몬제가 있으며, 골 형성 촉진제로는 불화나트륨(NaF), 부갑상선호르몬, 성장호르몬 등이 있다. 또한 골 흡수 억제제와 골 형성 촉진제의 동시작용제로는 스트론튬이 있다. 그러나 이미 진행된 골다공증의 치료에 대한 한계, 고가의 비용의 단점과 유방암, 정맥혈전증, 뇌졸중, 위장장애, 턱뼈괴사 등 부작용 29,30이 있어, 개선하기 위한 조치가 필요하다. 따라서 부작용이 적거나 없는 천연물을 기반한 파골세포 억제제의 발굴 및 개발에 대한 노력으로 한의학적 접근을 통한 골다공증의 예방 및 치료에 대한 연구가 절실한 시점이다. 본 연구에서 사용한 계혈등(Spatholobus suberectus)은 이미 항산화 활성, 항염활성, 항균활성, 간보호 효과가 있다고 잘 알려져 있다 31,32. 또한 계혈등이 류마티스 관절염의 치료에 대한 약리적인 연구에서 유효한 효과있는 것으로 연구되고 있으나 33, 골 손실로 인한 골 질환에 대한 연구에 대해서는 거의 다뤄지지 않아 계혈등의 RAW 264.7 세포를 이용한 파골세포에서의 분화 억제 및 골 손실 억제 효과에 대한 연구를 진행하게 되었다. 이번 실험을 통해 SSE가 골 손실을 억제할 수 있는 지를 입증하기 위해 TRAP(+) MNCs(Tartrate- Resistant Acid Phosphatase Macrophage Necleic Cells) 형성을 억제할 수 있는지 측정하였다. 사용된 세포는 파골세포 형성(Osteoclastogenesis)을 확인하는데 이용된 Mouse의 Myeloid 세포주인 RAW 264.7 세포와 RANKL로 유도하여 분화시킨 세포 모델이다. RANK는 종양괴사인자인 TNF(Tumor Necrosis Factor)의 종류에 감염된 세포조직, 뼈, 골수, 폐 조직과 림프관 조직에서 발현을 유도한다 34. 신호전달 수용체인 RANK에 RANKL이 결합하면 파골세포의 형성과 생존을 자극하게 된다 35. 실험결과 SSE가 파골세포의 TRAP(+) MNCs에 일정한 양 이상에서 파골세포 분화를 억제하는 것을 관찰하였으며( Fig. 3) SSE가 세포상해를 통한 분화 억제 가능성을 배제하기 위한 세포 생존율 평가에서 SSE 배양 배지에 7일간 처리한 결과 150 μg/ml 이상에서 세포 생존율이 낮아지는 것을 확인할 수 있었고, 75 μg/ml 이하에서 세포독성이 없었음을 확인하였다( Fig. 1). SSE가 TRAP(Tartrate-Resistant Acid Phosphatase)의 생성에 미치는 영향을 평가하고자 TRAP의 mRNA 생성량을 비교 측정하였다. RANKL 처리 시 TRAP 발현은 뚜렷하게 증가하였으나 SSE를 처리한 결과 TRAP 발현은 억제되었다( Fig. 6). MMP-9(Matrix Metallopeptidase-9)은 단백질 분해와 펩티드 결합을 가수분해하는 효소이다. RANKL로 유도되어 분열된 파골세포는 TRAP, DC-STAMP, MMP-9의 발현 증가와 세포 간 융합 골 흡수 등 여러 인자의 촉진을 유도한다. TRAP, DC-STAMP, MMP-9은 세포 복합체로 융합되고 NFATc1은 파골세포 분열에 조절자로 중요하게 작용한다 36. 이에 SSE가 파골세포를 형성하는 과정에서 MMP-9의 발현에 미치는 영향을 평가한 결과 SSE처리 시 RANKL 유도에 의한 분열된 파골세포에서 MMP-9의 억제효과를 나타내었다( Fig. 5). Cathepsine K는 세포기질 collagen을 분해할 수 있는 물질 효소로 TRAP, MMP-9 등과 함께 파골세포 분열 및 촉진을 통하여 골 흡수와 손실에 작용된다고 알려져 있다. 따라서 파골세포 활성의 유력한 방향수치 지표로 Cathepsin K를 활용할 수 있다 37. 연구결과 Cathepsine K는 RANKL 처리 시 유전자 mRNA 발현이 증가하였으나 SSE 처리 시 억제효과를 나타내었다( Fig. 4). NFATc1(Nuclear Factor of Activated T Cell)은 파골세포 분화에서 전사인자로 발현을 촉진하는 중요한 역할을 하며, c-Fos와 함께 활성화되기 때문에 c-Fos와 필수적 관계에 있다고 알려져 있다 38. SSE가 파골세포 분열에서 나타나는 NFATc1 발현에 미치는 영향을 확인하기 위하여 NFATc1의 생성량을 측정하여 비교하였다. RANKL(Receptor Activator NF-Kppa Ligand)에 의해 유도된 NFATc1의 mRNA는 현저히 증가된 반면 SSE 처리 시 75 μg/ml에서 억제되었다( Fig. 7). MITF(Microphtamia-associated Transcription Factor)는 파골세포에 다량으로 존재하며 파골세포 분화를 활성하는 인자로, RANKL/RANK 복합체는 TRAF의 활성화, TAK1의 자극활성이 되어 P38 등에 의한 신호전달로 인한 MITF가 활성화되어 파골세포의 분화가 촉진되며, 전사인자로 작용한다 39. 그리고 DC-STAMP(Dendritic Cell-Specific Transmembrane Protein)는 주로 T세포에 항원제시작용을 수행하는 막 관통 단백질 수지상 세포로서 림프조직과 여러 조직 세포간극에서 존재하는 것으로 알려졌다. 또한 OC-STAMP(Osteoclast-Stimulated Transmembrane Protein)는 파골세포로 유도되는 막 관통 단백질로 알려져 있으며, 생체막의 구성요소로 내재성이 대부분이다 40,41. SSE가 c-Fos, MITF, DC-STAMP, OC-STAMP 발현에 미치는 영향을 평가하기 위해서 각 농도별 생성량을 측정하여 비교분석한 결과 RANKL로 처리 시 각각 인자의 발현은 현저히 증가하였으나, SSE 처리 시 각각 75 μg/ml에서 억제 효과를 나타내었다( Fig. 13, 9, 7, 6). SSE가 골 흡수에 미치는 영향을 알기 위해 인조 골편에 RANKL로 분화된 파골세포와 SSE를 함께 처리하고 배양한 결과, SSE를 처리한 실험에서 골 흡수를 억제하는 것을 알 수 있었다( Fig. 14). 또한 SSE가 실험동물의 골 손실에 미치는 영향을 알기 위한 평가에서 LPS를 투여한 대조군은 정상군에 비해 심각한 골 손실이 관찰되었고, 반면에 SSE를 투여한 처리군은 대조군에 비해 골 손실이 억제된 것이 관찰되었다( Fig. 15). SSE의 화학분석 결과 genistein, daidzein을 포함한 여러 플라보노이드를 포함하고 있는 것으로 밝혀졌다 42-44. 또한 크로마토그래피 기술로 분리한 결과 suberectin, formononetin, daidzein 등과 처음 얻어지는 성분들의 화합물인 것으로 알려져 있다 45. 플라보노이드는 폴리페놀계 화학구조 때문에 강력한 항산화 효과를 가지고 있다고 알려져 있으며 46 또한 일부 플라보노이드는 c-Fos 발현을 억제하여 파골세포 생성을 억제하는 것으로 나타났다 47. 따라서 SSE의 여러 플라보노이드는 복합적으로 파골세포 분화를 억제하는 것으로 보인다. 결과적으로 SSE는 파골세포 분화와 발생을 활성화시키는 유전인자의 발현을 억제함으로써 골 손실을 억제할 것으로 생각되며, 뼈의 항상성을 유도하고 단일 천연물로 골다공증을 예방하고 치료하는 데 유용하게 사용될 가능성을 제시하였다. 다만 본 연구에서는 SSE가 파골세포의 분화과정과 골 흡수 과정에서의 관련 인자를 억제하는 결과만 알 수 있는 한계점이 있다. 또한 SSE의 파골세포 분화 과정과 골 흡수 과정의 억제 기전 중 어떤 경로에 대한 억제 효과가 있는지 등의 심도 깊은 연구가 필요하다.
V. 결 론
SSE를 이용하여 골다공증의 예방 또는 치료 목적으로 사용하고자 파골세포의 분화와 유전자 생합성 및 골 흡수에 의한 골 손실에 미치는 영향을 실험하였고, 아래와 같은 측정 결과를 얻었다.
1. SSE는 RANKL로 처리한 RAW 264.7 세포의 TRAP-positive 세포 합성을 억제하였다.
2. SSE는 RANKL로 유도된 파골세포에서 TRAP 활성을 억제하였다.
3. SSE는 RANKL로 유도된 파골세포의 분화에서 Cathepsin K, TRAP, MMP-9의 mRNA 유전자 발현을 억제하였다.
4. SSE는 RANKL로 유도된 파골세포의 분화에서 TRAIL, NFATc1, OC-STAMP, DC-STAMP, ATP6v0d2, MITF, c-Fos의 유전자 발현을 억제하였다.
5. SSE는 파골세포로 인한 골 흡수를 억제하였다.
6. SSE는 실험동물에서 LPS로 유도한 염증성 골 손실을 억제하였다.
이상의 연구 결과, 계혈등 추출물(SSE)은 파골세포로의 분화를 억제하고 파골세포 분화 및 기능 활성화에 관련된 인자들인 Cathepsin K, TRAP, MMP-9, c-fos, NFATc1 및 염증관련 인자의 생성 조절을 통해 골 흡수를 억제하여 골다공증 치료에 효과적일 것으로 판단된다.
참고문헌
1. OECD Health Statistics 2019, OECD
2. 통 계청, 생 명표. 국가승인통계 제101035호 2020:
3. Jung YH. The Life Expectancy and Health-Adjusted Life Expectancy of Koreans. 보건복지포럼 2012:11:5–18.
4. Lee YH, Kim W, Nam JY. Socioeconomic Burden of Disease Due to Osteoporosis in South Korea. 경기연구원 기본연구 2019:1–84.
5. Gass M, Dawson-Hughes B. Preventing osteoporosis- related fractures:an overview. Am J Med 2006:119(4 Suppl 1):S3–11.  6. Lin JT, Lane JM. Osteoporosis:a review. Clinical Orthopaedics and Related Research 2004:425:126–34.  7. Sweet MG, Sweet JM, JereMiah MP, Galazka SS. Diagnosis and Treatment of Osteoporosis. Am Family Physician 2009:79(3):193–200.
8. Lim YW, Sun DH, Kim YS. Review Articles :Osteoporosis:Pathogenesis and Fracture Prevention. Hip and Pelvis 2009:21(1):6–16.
9. Cho SB, Lee SR, Koh KJ. Effects of irradiation on the mRNA expression of the osteocalcin and osteopontin in MC3T3-E1 osteoblastic cell. Korean J oral Maxillofac Radiol 2003:33(3):179–85.
10. Song GC, Hwuang GS. Effects of Houyttnia cordata on Bone Marrow Stromal Cell and Osteoporetic Rat. Journal of Oriental Medicine Preventive 2009:13(2):103–13.
11. Lee SY, Seo BI, Park JH, Noh SS, Kim DJ. Effect of Ligustri Lucidi Fructus Extract and Vici Herba Extract on Treatment of Osteoporosis in Ovariectomized Rat. Korea Institute of Oriental Medicine 2011:17(1):153–65.
12. Pang J, Guo JP, Jin M, Chen ZQ, Wang XW, Li JW. Antiviral effects of aqueous extract from Spatholobus suberectus Dunn. against coxsackievirus B3 in mice. Chinese journal of integrative medicine 2011:17(10):764–9.    13. Lee EH, Noh M, Cha BC. Antioxidant activity of Spatholobus suberectus Dunn. Korean Journal of Pharmacognosy 2005:36(1):50–5.
14. Peng F, Zhu H, Meng CW, Ren YR, Dai O, Xiong L. New isoflavanes from Spatholobus suberectus and their cytotoxicity against human breast cancer cell lines. Molecules 2019:24(18):3218.    15. Park WM, Choi HS, Kim SM, Woo CH. The Hepatoprotective Activity of Spatholobi Caulis Water Extract against Cadmium-Induced Toxicity in Rats. Journal of Korean Medicine 2010:31(5):90–102.
16. Hayman AR. Tartrate-resistant acid phosphatase (TRAP) and the osteoclast/immune cell dichotomy. Autoimmunity 2008:41(3):218–23.   18. Yen ML, Tsai HF, Wu YY, Hwa HL, Lee BH, Hsu PN. TNF-related apoptosis-inducing ligand (TRAIL) induces osteoclast differentiation from monocyte/macrophage lineage precursor cells. Molecular immunology 2008:45(8):2205–13.   20. Yang M, Birnbaum MJ, MacKay CA, Mason-Savas A, Thompson B, Odgren PR. Osteoclast stimulatory transmembrane protein(OC-STAMP), a novel protein induced by RANKL that promotes osteoclast differentiation. Journal of cellular physiology 2008:215(2):497–505.    22. Wu H, Xu G, Li YP. Atp6v0d2 is an essential component of the osteoclast-specific proton pump that mediates extracellular acidification in bone resorption. Journal of Bone and Mineral Research 2009:24(5):871–85.   23. Lu SY, Li M, Lin YL. Mitf induction by RANKL is critical for osteoclastogenesis. Molecular biology of the cell 2010:21(10):1763–71.    24. Boyce BF, Xing L. Functions of RANKL/RANK/OPG in bone modeling and remodeling. Archives of biochemistry and biophysics 2008:473(2):139–46.    25. Collin-Osdoby P, Osdoby P. RANKL-mediated osteoclast formation from murine RAW 264.7 cells. Methods Mol Biol 2012:816:187–202.   26. Hou GQ, Guo C, Song GH, Fang N, Fan WJ, Chen XD, et al. Lipopolysaccharide (LPS) promotes osteoclast differentiation and activation by enhancing the MAPK pathway and COX-2 expression in RAW264. 7 cells. International journal of molecular medicine 2013:32(2):503–10.   27. 보건복지부. 건강행태 및 만성질환 통계 2012:
28. Kim YM, Kim JH, Cho DS. Gender Difference in Osteoporosis Prevalence, Awareness and Treatment:Based on the Korea National Health and Nutrition Examination Survey 2008~2011. Journal of Korean Academy of Nursing 2015:45(2):293–305.    29. Park YD, Kim YR, Kim DY, Jung YS, Lee JG, Kim YG, et al. Awareness of Korean Dentists on Bisphospohnate related osteonecrosis of the jaws :Preliminary report. Journal of the Korean Association of Oral and Maxillofacial Surgeons 2009:35(3):153–7.
30. Chae BN, Hong YG, Lee SG, Jung YS, Lee GW, Kim HM. Cyclic Pamidronate Infusion in Primary Osteoporotic Women. Endocrinology and metabolism 2001:16(2):221–30.
31. Liu XY, Zhang YB, Yang XW, Yang YF, Xu W, Zhao W, et al. Anti-inflammatory activity of some characteristic constituents from the vine stems of Spatholobus suberectus. Molecules 2019:24(20):3750.    32. Chen SR, Wang AQ, Lin LG, Qiu HC, Wang YT, Wang Y. In vitro study on anti-hepatitis C virus activity of Spatholobus suberectus Dunn. Molecules 2016:21(10):1367.    33. Liu D, Wang Q, Wei Z, Liu X, Zheng X, Qian K, et al. Network Pharmacology Study on the Mechanism of Couplet Medicine of Tripterygium hypoglaucum-Spatholobus suberectus in the Treatment of Rheumatoid Arthritis. China Pharmacy 2019:2639–44.
34. Darnay BG, Besse A, Poblenz AT, Lamothe B, Jacoby JJ. TRAFs in RANK signaling. Adv Exp Med Biol 2007:597:152–9.   36. Sundaram K, Nishimura R, Senn J, Youssef RF, London SD, Reddy SV. RANK ligand signaling modulates the matrix metalloproteinase-9 gene expression during osteoclast differentiation. Experimental cell research 2007:313(1):168–78.   37. Goto T, Yamaza T, Tanaka T. Cathepsins in the osteoclast. Microscopy 2003:52(6):551–8.  38. Kim JH, Kim N. Regulation of NFATc1 in osteoclast differentiation. Journal of bone metabolism 2014:21(4):233–41.    39. Huang H, Ryu J, Ha J, Chang EJ, Kim HJ, Kim HM, et al. Osteoclast differentiation requires TAK1 and MKK6 for NFATc1 induction and NF-κB transactivation by RANKL. Cell Death &Differentiation 2006:13(11):1879–91.   40. Yang M, Birnbaum MJ, MacKay CA, Mason-Savas A, Thompson B, Odgren PR. Osteoclast stimulatory transmembrane protein (OC-STAMP), a novel protein induced by RANKL that promotes osteoclast differentiation. Journal of cellular physiology 2008:215(2):497–505.   41. Chiu YH, Ritchlin CT. DC-STAMP:a key regulator in osteoclast differentiation. Journal of cellular physiology 2016:231(11):2402–7.   42. Ren-Neng TANG, Xiao-Bo QU, Shu-Hong GUAN, Ping-Ping XU, Yang-Yang SHI, De-An GUO. Chemical constituents of Spatholobus suberectus. Chinese journal of natural medicines 2012:10(1):32–5.  43. Lee MH, Lin YP, Hsu FL, Zhan GR, Yen KY. Bioactive constituents of Spatholobus suberectus in regulating tyrosinase-related proteins and mRNA in HEMn cells. Phytochemistry 2006:67(12):1262–70.  44. Shim SH. 20S proteasome inhibitory activity of flavonoids isolated from Spatholobus suberectus. Phytotherapy Research 2011:25(4):615–8.  45. Cui YJ, Liu P, Chen RY. Studies on the chemical constituents of Spatholobus suberectus Dunn. Yao xue xue bao=Acta Pharmaceutica Sinica 2002:37(10):784–7.  46. Fraga CG. Plant polyphenols:how to translate their in vitro antioxidant actions to in vivo conditions. IUBMB life 2007:59(45):308–15.   47. Karieb S, Fox SW. Phytoestrogens directly inhibit TNF-α-induced bone resorption in RAW264. 7 cells by suppressing c-fos-induced NFATc1 expression. Journal of cellular biochemistry 2011:112(2):476–87.  
|
|


























