丁香추출물이 골관절염 흰쥐에 미치는 효과 및 기전 연구
Abstract
Objective:
The aim of this study was to identify the efficacy and underlying mechanism of cloves as an osteoarthritis (OA) treatment in a monosodium iodoacetate (MIA)-induced rat OA model. Osteoarthritis (OA) is nowadays one of the most prevalent degenerative joint diseases.
Methods:
Sprague-Dawley rats treated with MIA (50 μL; 80 mg/mL) were used as in vivo OA models. Cloves (100 and 200 mg/kg b.w.) were administered orally once daily for 2 weeks from 7 days after MIA injection. Changes in hindpaw weight distribution (HWD) were measured as a joint discomfort index. Activation markers related to inflammatory responses and cartilage degeneration in the right knee joints were evaluated by serum analysis and western blotting.
Results:
HWD decreased in the MIA control group but showed a dose-dependent elevation after clove treatment. Clove treatment inhibited inflammatory factors by PI3K/Akt/NF-κB signaling pathways, while also activating antioxidant factors through Sirt1/AMPK signaling pathways. Clove treatment also suppressed matrix metalloproteinase (MMP) overexpression and significantly increased the levels of tissue inhibitors of metalloproteinases (TIMPs).
Conclusions:
Treatment with cloves effectively reversed MIA-induced effects. Therefore, clove treatment could have the potential to protect against or treat OA.
Keywords: anti-inflammatory, cloves, MIA, osteoarthritis
I. 서 론
골관절염(osteoarthritis, OA)은 현재까지 가장 흔한 근골격계 질환으로 관절 통증, 관절 기능 장애 등의 증상을 유발할 수 있으며, 골관절염을 겪고 있는 이들의 삶의 질에 심각한 영향을 미칠 수 있다 1. 세계 인구의 고령화에 따라 골관절염 환자의 수가 급격히 증가하는 추세를 보이고 있으며 2, OA의 증상을 악화시킬 수 있는 요인으로 노화, 비만, 염증, 외상 및 유전이 포함된다 3. 급성 염증은 활성 산소종 및 질소종의 과잉 생산, 전염증 및 염증 매개체의 생산, 효소 복합체의 활성화와 관련이 있다 4. 그 중 nuclear factor kappa B(NF-κB)는 다양한 생리학적 및 병리학적 과정, 특히 염증의 발달을 조정하는 전사 인자이다 5. 현재까지 많은 연구에서 PI3K/AKT의 활성은 NF-κB 신호전달경로를 자극하여 p65 인산화 및 후속 핵 전위를 유도하는 신호전달 캐스케이드를 유발한다는 것이 입증되었다. IκBα의 인산화에 의해 NF-κB의 핵으로 전위가 이루어지며, 활성화된 NF-κB는 COX-2, iNOS, TNFα, IL-6, MMPs 등과 같은 전염증 매개체를 코딩하는 표적 유전자의 프로모터 영역의 특정 서열에 결합하게 한다 6. 따라서 PI3K/Akt/NF-κB 경로는 OA 치료의 핵심 표적으로서 PI3K/Akt/NF-κB 경로의 억제는 골관절염 치료를 위한 유망한 접근법으로 주목을 받고 있다. 한의학에서 골관절염은 關節痺證으로 진단되어지며, 痺症은 外邪 중 주로 風寒濕의 三氣가 經絡으로 침입 또는 關節에 응체되어 血氣運行의 원활한 흐름을 막아 關節에 重着, 麻木, 酸楚, 腫脹 및 疼痛을 유발한다 7. 한의학에 있어서 골관절염에 대한 치료는 약물 치료, 물리적 요법, 침구, 약침 치료 등 다양한 방면으로 이뤄지고 있다. 丁香( Syzygium aromaticum L., Cloves) 향기로운 약용 식물로 말린 꽃봉오리는 음식의 향신료와 향료로 사용되었으며, 특히 치과 치료에서 전통적인 동아시아 의약품에도 사용되었다 8. 또한, 정향은 항균, 항바이러스 및 항진균 활성을 나타낼 뿐만 아니라 9, 항산화제, 항염증제와 같은 다양한 기타 약리학적 특성 및 항종양 효과도 보고되어 있다 10. 하지만 아직 丁香의 골관절염에 미치는 영향에 대한 효과 및 그 기전에 대한 연구는 알려진 바가 없다. 이에 본 연구는 정향 추출물 투여가 MIA로 유발된 골관절염 동물모델에서 산화 스트레스 및 PI3K/Akt/NF-κB 경로에 의한 염증 개선효과를 확인하였기에 보고하는 바이다.
II. 재료 및 방법
1. 재 료
1) 시 료
본 실험에서 사용한 말린 丁香은 옹기한약국(Daegu, Korea)에서 구입하였으며, 생약규격집에 적합한 것을 사용하였다. 丁香 300 g에 증류수 3,000 mL 첨가한 후 열탕 추출기를 사용하여 매번 3시간 동안 두 번 추출하였다. 얻어진 추출물은 감압 농축장치로 농축 후, 동결 건조기를 이용해 최종적으로 분말 (SA, 수율 20.87%)을 얻었으며, 실험에 사용되기 직전까지 -80 °C에서 보관하였다.
2) 시 약
본 실험에 사용된 nuclear factor-kappa Bp65 (NF-κBp65), inhibitor of kappa Bα(IκBα), phosphorylated inhibitor of kappa Bα(p-IκBα), cyclooxygenase 2(COX-2), inducible nitric oxide synthase(iNOS), tumor necrosis factor alpha(TNF-α), interleukin-4(IL-4), interleukin-6(IL-6), interleukin-10 (IL-10), Gp91phox(NOX2), p47phox, p22phox, phosphoinositide 3-kinase p85α(PI3K), histone 및 β-actin은 Santa Cruz Biotechnology(Santa Cruz, CA, USA)로부터 구입하였다. Phospho-phosphoinositide 3-kinase p85/p55 (p-PI3K), phospho-protein kinase B(p-Akt) 및 protein kinase B(Akt) 항체는 Cell Signaling Technology, Inc.(Danvers, MA, USA) 구입하였다. Tissue inhibitor of metalloproteinases-1, -2(TIMP-1, -2), matrix metalloproteinase-1, -3, -13(MMP-1, -3, -13) 항체는 Thermo Scientific(Rockford, IL, USA) 구입하였으며, 2차 항체는 Gene Tex Inc.(CA, USA)에서 구입하였다. Indomethacin, dithiothreitol(DTT), potassium persulfate, phenylmethylsulfonyl fluoride(PMSF), monosodium iodoacetate(MIA)는 Sigma Aldrich Co., Ltd.(St. Louis, MO, USA)에서 구입하였다. 단백질 정량을 위하여 BCA protein assay kit는 Thermo Scientific(Waltham, MA, USA)에서 구입하였다. Nitrocellulose membranes는 Amersham GE Healthcare (Chicago, IL, USA)에서 구입하였으며, Protease inhibitor mixture, Ethylenediaminetetraacetic acid (EDTA)는 Wako Pure Chemical Industries, Ltd. (Osaka. Japan)에서 구입하여 사용하였다.
3) 실험 동물
골관절염 유발을 위하여 실험동물의 오른쪽 무릎의 주변 털을 깨끗하게 제거한 후, 0.9% saline으로 희석한 MIA(monosodium iodoacetate)를 0.3 mL insulin syringe를 사용하여 오른쪽 무릎 관절강 내에 50 μL(80 mg/mL)씩 주입하여 골관절염을 유발하였다 11. MIA로 골관절염 유발 1주일 후 뒷다리 체중 부하 검사를 통해 골관절염이 유발된 실험동물을 각 군당 8마리씩 5 group으로 구분하여 실험을 진행하였다. 실험군은 골관절염을 유발하지 않은 정상군(Normal), 골관절염 유발 후 약물처치를 하지 않은 대조군(Control), 유발 후 indomethacin을 5 mg/kg로 투여해주는 양성대조군(Indo), 유발 후 丁香 추출물을 100 mg/kg로 투여한 약물처리군 (SA100)과 丁香 추출물을 200 mg/kg로 경구 투여한 약물처치군(SA200)으로 2주간 약물투여를 진행하였다. 본 연구는 동물실험의 윤리적, 과학적 타당성 검토 및 효율적인 관리를 위하여 대구한의대학교 동물실험윤리 위원회(Institutional Animal Care and Use Committee, IACUC)의 승인(승인번호: DHU2022-045)을 받아 진행되었다.
2. 방 법
1) 체중 및 식이섭취량 측정
실험동물의 체중은 전자체중계를 이용하여 2일에 한 번 동일 조건에서 측정하였고, 사료섭취량은 제공된 사료에서 2일간 섭취 후 남아있는 사료의 양을 제하여 해당 실험군의 사료섭취량을 계산하였다.
2) 뒷다리 체중 부하 측정
MIA로 골관절염을 유발하기 하루 전, 유발 1주 후, 丁香 추출물 경구투여 1주 후, 丁香 추출물 경구투여 2주 후에 측정하였다. 뒷다리 양쪽의 부하는 Incapacitance tester(Ser No. 01/45/25, Linton instrument Co., UK)를 이용하였으며, 4번씩 측정한 후 평균을 내어 뒷다리 체중 부하를 산출하였다. 뒷다리 체중 부하 측정 결과는 MIA로 골관절염이 유발된 오른쪽 뒷다리의 체중 부하를 정상적인 왼쪽 뒷다리 부하량으로 나누어 계산하였으며, 상대적 체중 부하는 아래의 식을 사용하였다.
⋅뒷다리 체중 부하
=관절염이 유발된 오른쪽 뒷다리의 체중 부하/정상 왼쪽 뒷다리의 체중 부하
⋅상대적 체중 부하
=(각 군의 체중 부하 평균/정상군의 체중 부하 평균)×100
3) 산화 스트레스 바이오마커 측정
관절조직 내의 reactive oxygen species(ROS)를 측정하기 위하여 25 mM DCFH-DA를 혼합한 후, 형광 광도계를 이용하여 방출파장 530 nm와 여기파장 485 nm에서 5분씩 간격을 두어 0분부터 30분간 측정한 값을 통해 산출하였다 12. 그리고 peroxynitrite (ONOO-)를 측정하기 위하여, Kooy 등의 방법을 시행하여 측정하였다 13. 각 샘플을 pH 7.4의 rhodamine buffer와 5 mM DHR123과 섞은 후 5분간 37 °C에서 흔들어 준 후 5분 간격으로 emission wavelength of 535 nm와 excitation wavelength of 480 nm를 이용하여 0분부터 30분간 측정하여 나온 값을 통해 산출하였다. 혈청 지질과산화(Thiobarbituric acid reactive substances, TBARS)는 Mihara and Uchiyama의 방법을 사용하여 측정하였다 14. 복대정맥에서 채혈한 혈액을 4,000 rpm 10분 원심 분리하여 혈청을 얻었다. 흡광도는 UV 분광광도계(spectrophotometer) (Infinite M200, Tecan, Salzburg, Austria)로 540 nm에서 흡광도를 측정하였다.
4) 관절조직 western blotting
2주간 투여가 끝난 뒤 오른쪽 무릎 부위를 절단하여 1.5 M sucrose, protease inhibitor cocktail, 0.1 M DTT, 100 mM Tris-HCl(pH 7.4), 2 mM MgCl2, 5 mM Tris-HCl(pH 7.5), 15 mM CaCl2를 첨가시킨 buffer A를 넣은 후 tissue grinder(Bio Spec Product, USA)로 분쇄하여 10% NP-40 용액을 첨가하였다. 이후 ice 위에서 20분간 정치시킨 후, 12,000 rpm으로 2분간 원심분리시켜 세포질을 포함한 상층액을 분리하였다. 핵을 얻기 위해 상층액을 제거하고 남은 물질에 10% NP-40가 더해진 buffer A에 두 번 헹구고 100 L의 buffer C(50 mM HEPES, 0.1 mM EDTA, 1 mM DTT, 50 mM KCl, 0.3 mM NaCl, 0.1 mM PMSF, 10% glycerol)를 첨가해 재 부유시킨 후 10분 간격으로 vortex를 3번 하였다. 4 °C에서 12,000 rpm으로 10분간 원심 분리한 후 핵을 포함하고 있는 상층액을 얻어 -80 °C에서 각각 냉동 보관하였다. 세포질 및 핵 내의 단백질 발현을 측정하기 위해 10 μg의 단백질을 8~15% SDS-polyacrylamide gel을 이용하여 전기영동 후, acrylamide gel을 nitrocellulose membrane으로 이동시켰다. 그 다음, membrane에 각각의 1차 antibody를 처리하여 4 °C에서 overnight 시킨 다음 PBS-T로 6분마다 5회 세척하고, 각각 처리된 1차 항체에 사용되는 2차 항체(1:3000)를 사용하여 상온에서 2시간 반응시킨 후, PBS-T로 6분마다 8회 세척하였다. 그리고 enhanced chemiluminescence (ECL) 용액에 노출시킨 다음, Sensi-Q2000 Chemidoc에 감광시켜 단백질 발현을 확인한 후, ATTO Densitograph Software(ATTO Corporation, Tokyo, Japan) 프로그램을 사용하여 해당 band를 정량하였다.
5) 관절조직의 조직병리학적 분석
부검 후 오른쪽 관절 부위를 절단하여 10% 포르말린 용액에 넣어 관절을 탈회시킨다. 그 후, 파라핀 왁스에 관절을 넣고 고정시킨 다음 coronal section을 진행하였다. 고정된 조직을 7 mM로 자른 뒤, Safranin-O 염색을 시행하였으며, proteoglycan층을 염색하여 연골 조직의 손상 관련 관절조직의 상태를 관찰하였다.
6) 통계분석
모든 수치는 평균±표준오차로 표시하였으며, SPSS (Version 26.0, IBM, Armonk, NY, USA)를 사용하여 one-way analysis of variance(ANOVA) test를 실시한 후 least-significant differences(LSD) test로 사후검증을 실시하여 각 군의 평균 차이에 대한 통계적 유의성을 *p<0.05, **p<0.01, ***p<0.001에서 검증하였다.
III. 결 과
1. 체중 변화 및 사료섭취량
군분리 후 약물 투여 2주 동안의 체중의 변화량 (g)은 Normal군 68.56±6.03, Control군 69.89±1.94, Indo군 71.56±2.46, SA100군 67.75±2.48 및 SA200군 75.38±1.58으로 다른 실험군 대비 SA200군의 체중 증가가 보였으나 군간 유의성은 나타나지 않았다 (p=0.267 vs. Control). 사료섭취량(g/day)은 하루 평균 Normal군 21.8±0.70, Control군 21.5±0.28, Indo군 21.1±0.34, SA100군 20.8±0.30 및 SA200군 22.2± 0.33으로 SA200군이 다른 실험군 대비 사료섭취량이 다소 증가하였기에 체중 증가가 나타난 것으로 사료되나 각 군 간의 유의성은 없었다( Table 1).
Table 1
The Changes of Body Weight and Food Intake
|
Group |
Initial body weight (g) |
Final body weight (g) |
Body weight gain (g) |
Food intake (g/day) |
|
Normal |
316.89±4.87 |
385.44±8.58 |
68.56±6.03 |
21.8±0.70 |
|
Control |
301.89±6.11 |
371.78±7.21 |
69.89±1.94 |
21.5±0.28 |
|
Indo |
299.11±5.87 |
370.67±8.07 |
71.56±2.46 |
21.1±0.34 |
|
SA100 |
298.50±6.03 |
366.25±8.13 |
67.75±2.48 |
20.8±0.30 |
|
SA200 |
305.63±4.30 |
381.00±5.48 |
75.38±1.58 |
22.2±0.33 |
2. 뒷다리 체중 부하 측정 결과
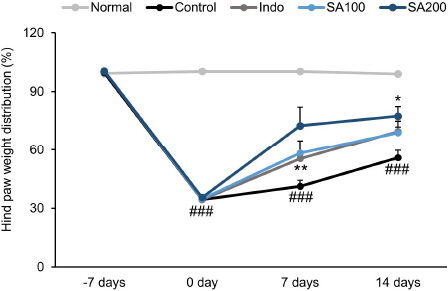
실험기간 동안 뒷다리 체중 부하는 군분리 7일 전(-7 days), 군분리 날(0 day), 약물투여 7일(7 days), 약물투여 14일(14 days) 총 4번을 측정하여 비교하였다. Normal군의 뒷다리 체중 부하 비율을 100으로 하였을 때, 약물투여 14일 후 각 군의 상대적 뒷다리 체중 부하의 변화(%)를 평가한 결과. Control군 56.46±3.81, Indo군 70.28±5.33(p<0.001), SA100군 69.61±2.92 및 SA200군 78.24±4.94(p<0.05)으로 SA200군에서만 유의하게 증가하였다( Fig. 1).
Fig. 1
The changes in hind paw weight distribution in MIA-induced osteoarthritis rats.
Normal : normal rats, Control : MIA-induced osteoarthritis rats, Indo : MIA-induced osteoarthritis rats treated with indomethacin 5 mg/kg body weight, SA100 : MIA-induced osteoarthritis rats treated with SA 100 mg/kg body weight, SA200 : MIA-induced osteoarthritis rats treated with SA 200 mg/kg body weight. All data are expressed means±SEM (n=8). Significance : ###p<0.001 vs. Normal group and *p<0.05, **p<0.01 vs. Control group
3. 산화 스트레스 바이오마커 측정 결과
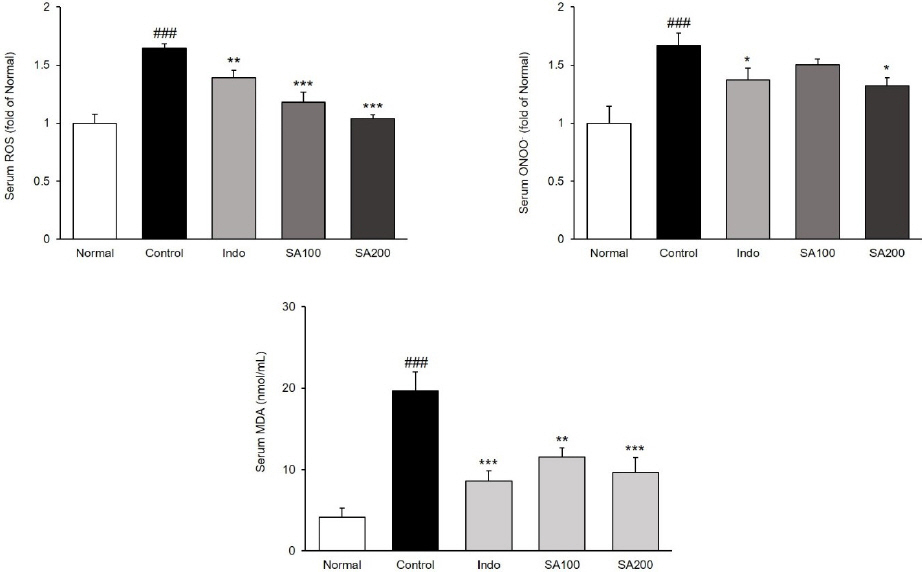
혈액 내 산화 스트레스 마커인 ROS, ONOO- 및 TBARS를 측정하였다. ROS를 측정한 결과, Normal군 1.00±0.08 대비 Control군은 1.64±0.04(p<0.001)으로 유의하게 증가하였으며, Indo군, SA100군 및 SA200군은 각각 1.39±0.06(p<0.01), 1.18±0.09(p<0.001), 1.04±0.04(p<0.001)으로 유의하게 감소하였다. ONOO-를 측정한 결과, Normal군 1.00±0.14 대비 Control군은 1.67±0.11(p<0.001)으로 유의하게 증가하였으며, Indo군, SA100군 및 SA200군은 각각 1.37±0.10 (p<0.05), 1.50±0.05, 1.32±0.07(p<0.05)으로 Indo군과 SA200군에서만 유의하게 감소하였다. 마지막으로 TBARS를 측정한 결과(nmol/mL), Normal군 4.12 ±1.12 대비 Control군은 19.72±2.27(p<0.001)으로 유의하게 증가하였으며, Indo군, SA100군 및 SA200군은 각각 8.61±1.24(p<0.001), 11.51±1.10(p<0.01), 9.62 ±1.85(p<0.001)으로 유의하게 감소하였다( Fig. 2).
Fig. 2
Levels of serum ROS, ONOO-, and TBARS in MIA-induced osteoarthritis rats.
Normal : normal rats, Control : MIA-induced osteoarthritis rats, Indo : MIA-induced osteoarthritis rats treated with indomethacin 5 mg/kg body weight, SA100 : MIA-induced osteoarthritis rats treated with SA 100 mg/kg body weight, SA200 : MIA-induced osteoarthritis rats treated with SA 200 mg/kg body weight. All data are expressed means±SEM (n=8). Significance : ###p<0.001 vs. Normal group and *p<0.05, **p<0.01, ***p<0.001 vs. Control group
4. 관절조직 내 산화 스트레스 생성 관련 NADPH oxidases 단백질 발현량 분석
관절조직 내에서 NADPH oxidase인 NOX2, p47 phox 및 p22 phox의 발현을 확인하였다. NOX2의 발현은 Normal군 대비 Control군에서 57% 유의하게 증가하였으며, Control군 대비 SA200군에서만 24% 유의하게 감소하였다(p<0.05). 또한, p47 phox와 p22 phox의 발현은 Normal군 대비 Control군에서 각각 68%, 89% 유의하게 증가하였으며, Control군 대비 Indo군 35%, 20%, SA100군 23%, 19%, SA200군 25%, 29%로 각각 유의하게 감소하였다( Fig. 3).
Fig. 3
Expressions of NADPH oxidases in MIA-induced osteoarthritis rats.
Normal : normal rats, Control : MIA-induced osteoarthritis rats, Indo : MIA-induced osteoarthritis rats treated with indomethacin 5 mg/kg body weight, SA100 : MIA-induced osteoarthritis rats treated with SA 100 mg/kg body weight, SA200 : MIA-induced osteoarthritis rats treated with SA 200 mg/kg body weight. All data are expressed means±SEM (n=8). Significance : #p<0.05, ###p<0.001 vs. Normal group and *p<0.05, *p<0.01 vs. Control group

5. 관절조직 내 염증 관련 단백질 발현량 분석
1) 관절조직 내 PI3K/AKT 단백질 발현량 분석
관절조직 내에서 PI3K/AKT 단백질 발현을 확인하였다. PI3K의 인산화를 측정한 결과, Normal군 1.00±0.06 대비 Control군은 1.75±0.13(p<0.001)으로 유의하게 증가하였으며, Indo군, SA100군 및 SA200군은 각각 1.20±0.14, 1.20±0.16, 1.10±0.14로 모든 투여군에서 유의하게 감소하였다(p<0.01). AKT의 인산화를 측정한 결과, Normal군 1.00±0.10 대비 Control군은 1.69±0.10(p<0.01)으로 유의하게 증가하였으며, Indo군, SA100군 및 SA200군은 각각 1.24 ±0.17(p<0.05), 1.23±0.12(p<0.05), 1.15±0.12(p<0.01)로 모든 투여군에서 유의하게 감소하였다( Fig. 4).
Fig. 4
Expressions of PI3K and AKT in MIA-induced osteoarthritis rats.
Normal : normal rats, Control : MIA-induced osteoarthritis rats, Indo : MIA-induced osteoarthritis rats treated with indomethacin 5 mg/kg body weight, SA100 : MIA-induced osteoarthritis rats treated with SA 100 mg/kg body weight, SA200 : MIA-induced osteoarthritis rats treated with SA 200 mg/kg body weight. All data are expressed means±SEM (n=8). Significance : ##p<0.01, ###p<0.001 vs. Normal group and *p<0.05, **p<0.01 vs. Control group

2) 관절조직 내 NF-kBp65 및 p-IkBɑ 발현량 분석
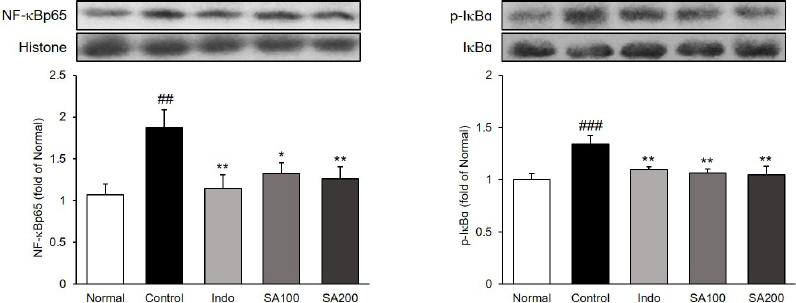
관절조직 내에서 NF-kBp65 및 p-IkBɑ의 단백질 발현을 확인하였다. NF-kBp65의 발현량을 측정한 결과, Normal군 1.00±0.12 대비 Control군은 1.88±0.21(p<0.01)으로 유의하게 증가하였으며, Indo군, SA100군 및 SA200군은 각각 1.14±0.16(p<0.01), 1.32 ±0.13(p<0.05), 1.26±0.15(p<0.01)로 모든 투여군에서 유의하게 감소하였다. p-IkBɑ의 발현량을 측정한 결과, Normal군 1.00±0.05 대비 Control군은 1.34 ±0.08(p<0.01)으로 유의하게 증가하였으며, Indo군, SA100군 및 SA200군은 각각 1.09±0.03, 1.06±0.04, 1.04±0.08로(p<0.01) 모든 투여군에서 유의하게 감소하였다( Fig. 5).
Fig. 5
Expressions of NF-kBp65 and p-IkBɑ in MIA-induced osteoarthritis rats.
Normal : normal rats, Control : MIA-induced osteoarthritis rats, Indo : MIA-induced osteoarthritis rats treated with indomethacin 5 mg/kg body weight, SA100 : MIA-induced osteoarthritis rats treated with SA 100 mg/kg body weight, SA200 : MIA-induced osteoarthritis rats treated with SA 200 mg/kg body weight. All data are expressed means±SEM (n=8). Significance : ##p<0.01, ###p<0.001 vs. Normal group and *p<0.05, **p<0.01 vs. Control group
3) 관절조직 내 염증매개인자 및 염증성 cytokines 발현량 분석
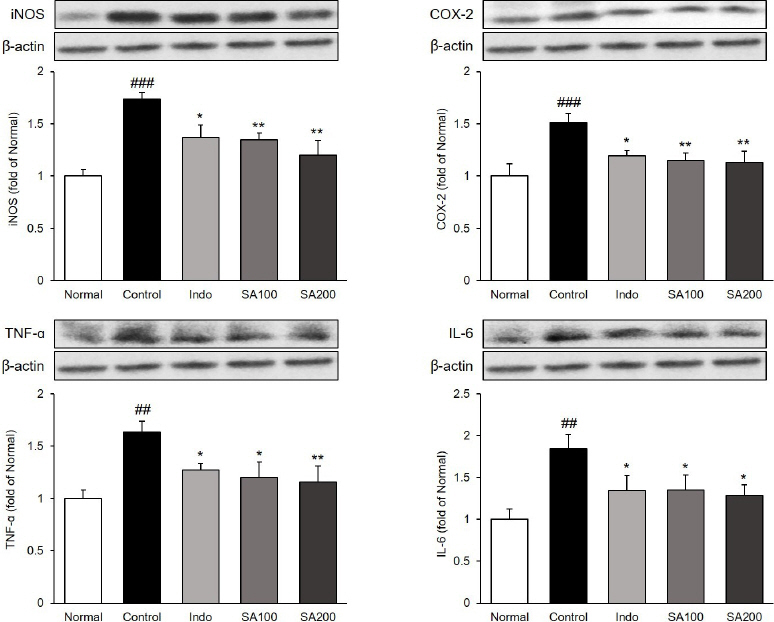
관절조직 내에서 염증매개인자 iNOS, COX-2와 염증성 cytokine인 TNF-ɑ, IL-6의 단백질 발현을 확인하였다. iNOS와 COX-2의 발현량은 Normal군 대비 Control군에서 74%, 51% 유의하게 증가하였으며(p<0.001), Control군 대비 Indo군에서는 둘 다 21% 유의하게 감소하였다. 또한, SA 투여는 두 유전자를 농도의존적으로 감소시켰으며, SA200군에서 Control군 대비 각각 31%, 25% 유의하게 감소하였다(p<0.01). 염증성 cytokine인 TNF-ɑ와 IL-6의 발현량은 Normal군 대비 Control군에서 각각 63%, 85% 유의하게 증가하였으며(p<0.01), Control군 대비 Indo군에서 각각 22%, 27% 유의하게 감소하였다. 또한, SA 투여는 두 cytokine을 농도의존적으로 감소시켰으며, SA200군에서 Control군 대비 각각 29%, 30% 유의하게 감소하였다(p<0.01, p<0.05). SA200군에서의 모든 인자들의 발현량은 유의하지는 않으나 Indo군 대비 감소하는 경향을 보여주었다( Fig. 6).
Fig. 6
Expression of inflammatory proteins in MIA-induced osteoarthritis rats.
Normal : normal rats, Control : MIA-induced osteoarthritis rats, Indo : MIA-induced osteoarthritis rats treated with indomethacin 5 mg/kg body weight, SA100 : MIA-induced osteoarthritis rats treated with SA 100 mg/kg body weight, SA200 : MIA-induced osteoarthritis rats treated with SA 200 mg/kg body weight. All data are expressed means±SEM (n=8). Significance : ##p<0.01, ###p<0.001 vs. Normal group and *p<0.05, **p<0.01 vs. Control group
6. 관절조직 내 항염증성 cytokines 발현량 분석
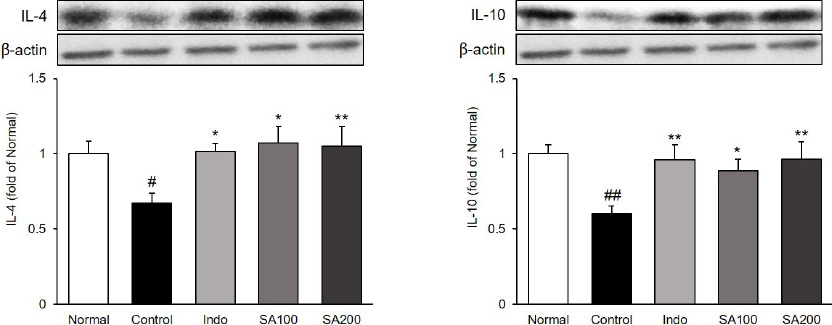
관절조직 내에서 항염증성 cytokine IL-4와 IL-10의 단백질 발현을 확인하였다. IL-4의 발현량을 측정한 결과, Normal군 1.00±0.09 대비 Control군은 0.68±0.06(p<0.05)으로 유의하게 감소하였으며, Indo군, SA100군 및 SA200군은 각각 1.01±0.05(p<0.05), 1.07±0.11(p<0.01), 1.05±0.13(p<0.01)로 모든 투여군에서 유의하게 증가하였다. IL-10의 발현량을 측정한 결과, Normal군 1.00±0.06 대비 Control군은 0.60 ±0.05(p<0.01)으로 유의하게 감소하였으며, Indo군, SA100군 및 SA200군은 각각 0.96±0.10(p<0.01), 0.89 ±0.08(p<0.05), 0.97±0.11(p<0.01)로 모든 투여군에서 유의하게 증가하였다( Fig. 7).
Fig. 7
Expressions of anti-inflammatory proteins in MIA-induced osteoarthritis rats.
Normal : normal rats, Control : MIA-induced osteoarthritis rats, Indo : MIA-induced osteoarthritis rats treated with indomethacin 5 mg/kg body weight, SA100 : MIA-induced osteoarthritis rats treated with SA 100 mg/kg body weight, SA200 : MIA-induced osteoarthritis rats treated with SA 200 mg/kg body weight. All data are expressed means±SEM (n=8). Significance : #p<0.05, ##p<0.01 vs. Normal group and *p<0.05, **p<0.01 vs. Control group
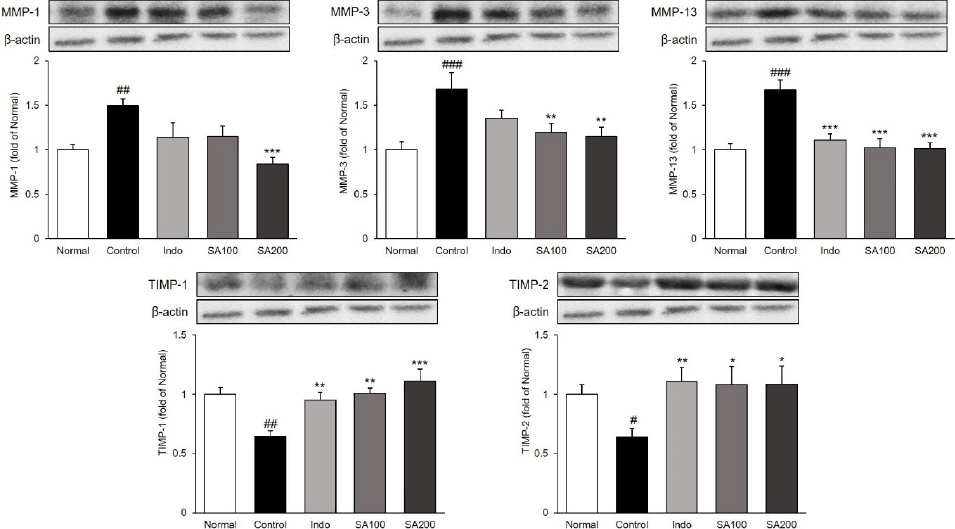
7. 관절조직 내 MMPs와 TIMPs의 발현량 분석
관절조직 내에서 MMPs(MMP-1, MMP-3, MMP-13)의 단백질 발현을 확인하였다. MMP-1, -3, -13의 발현량을 측정한 결과, Normal군 대비 Control군에서 49%, 68% 및 67% 유의하게 증가하였으며(p<0.01, p<0.001, p<0.001), Control군 대비 MMP-1, MMP-3을 제외한 MMP-13만 Indo군에서 34% 유의하게 감소하였다. 또한, SA 투여는 세 유전자를 농도의존적으로 감소시켰으며 SA200군에서 Control군 대비 각각 44%, 31%, 39% 유의하게 감소하였다(p<0.001, p<0.01, p<0.001). 관절조직 내에서 TIMPs(TIMP-1, TIMP-2)의 발현량을 확인하였다. TIMP-1과 TIMP-2의 발현량을 측정한 결과, Normal군 대비 Control군에서 65%, 64% 유의하게 감소하였으며(p<0.01, p<0.05), Control군 대비 모든 투여군에서 유의하게 증가시키는 것으로 확인되었다. 특히, SA 투여는 두 유전자를 농도의존적으로 증가시켰으며 SA200군에서 Control군 대비 각각 11%, 9% 유의하게 증가하였다(p<0.001, p<0.05)( Fig. 8).
Fig. 8
Expressions of MMPs and TIMPs in MIA-induced osteoarthritis rats.
Normal : normal rats, Control : MIA-induced osteoarthritis rats, Indo : MIA-induced osteoarthritis rats treated with indomethacin 5 mg/kg body weight, SA100 : MIA-induced osteoarthritis rats treated with SA 100 mg/kg body weight, SA200 : MIA-induced osteoarthritis rats treated with SA 200 mg/kg body weight. All data are expressed means±SEM (n=8). Significance : #p<0.05, ##p<0.01, ###p<0.001 vs. Normal group and *p<0.05, **p<0.01, ***p<0.001 vs. Control group
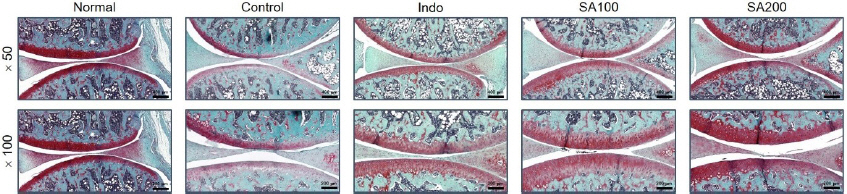
8. 조직병리학적 변화에 미치는 효과 분석
관절조직의 Safranin-O stain을 통해 proteoglycan층의 소실 정도를 관찰해 본 결과, Control에서는 골관절염이 유발되어 proteoglycan의 대부분이 파괴되어 연골의 형태학적 변화를 야기하였다. 반면에, Indo와 SA 투여군에서는 Control에 비해 proteoglycan의 소실이 억제되는 것으로 나타났다. 또한, SA100군보다는 SA200군에서 proteoglycan의 파괴 정도가 현저히 억제되었다( Fig. 9).
Fig. 9
Histopathological analysis in MIA-induced osteoarthritis rats.
The representative images. Safranin O staining was performed. (magnification, ×50, ×100).
Normal : normal rats, Control : MIA-induced osteoarthritis rats, Indo : MIA-induced osteoarthritis rats treated with indomethacin 5 mg/kg body weight, SA100 : MIA-induced osteoarthritis rats treated with SA 100 mg/kg body weight, SA200 : MIA-induced osteoarthritis rats treated with SA 200 mg/kg body weight.
IV. 고 찰
염증 및 연골 저하를 특징으로 하는 골관절염 (Osteoarthritis, OA) 질환을 앓는 환자들은 신체적 고통과 불편으로 인해 삶의 질이 심각하게 저하된다 15. 따라서 연골 세포의 균형 유지 및 연골 변성 억제는 OA의 진행 완화 및 증상 개선을 가져올 수 있기에 무엇보다 중요하다 16,17. OA의 치료를 위해 처방되어지는 전형적인 약물인 비스테로이드성 소염진통제(nonsteroidal anti-inflammatory drugs, NSAID)는 효과는 탁월하지만 장기간 및 과량 사용으로 인해 심각한 부작용을 야기한다 11. 최근 골관절염의 잠재적인 치료 표적으로 PI3K/AKT 신호 전달 경로가 주목받고 있다 2. PI3K/AKT 염증 경로는 세포 스트레스 동안 생존의 핵심 조절자이다. AKT는 포도당 대사, 전사 및 세포 이동, 세포 증식, 세포 사멸을 포함한 수많은 세포 과정에서 핵심적인 역할을 하는 PI3K 경로의 중심 매개체인 세린/트레오닌 키나제(Serine/Threonine Protein Kinase)이다 18. AKT는 PIP3에 의해 세포질막으로 모집된 다음 PDK1(단백질 의존성 키나제 1)에 의해 Thr308에서 인산화된다. 완전한 활성화를 위해 AKT는 PDK2에 의해 Ser473에서 후속적으로 인산화되어야 한다. AKT 활성화는 이어 NF-κB의 활성화를 유도하게 된다 19. 본 연구에서는 丁香 추출물 경구 투여가 MIA (monosodium iodoacetate)로 유도된 골관절염 모델에서 PI3K/AKT/NF-κB 경로의 활성화를 통해 유발되어진 염증 반응에서 산화 스트레스 감소, 염증관련 인자 억제 및 연골 세포의 세포외기질 분해를 억제하여 OA를 개선시킨다는 것을 입증했다. 여기에서 MIA로 유발된 골관절염 동물모델은 Kalbhen과 Blum에 의해 최초로 확립되었으며, 사람의 골관절염과 유사한 관절조직의 손상 및 통증을 유발하였기에 많은 연구에서 이용되고 있다 20. MIA의 관절 내 주사는 glyceraldehyde-3-phosphatase dehydrogenase (GAPDH)를 억제함으로써 연골 세포의 해당작용을 방해하고 염증, 연골 세포 사멸 및 연골하골 괴사를 초래한다 21. 우선, 丁香 추출물이 골관절염이 유발된 동물모델에서 몸무게 변화, 뒷다리 체중 부하 측정, 혈청 내 산화스트레스 관련 인자(ROS, ONOO- 및 TBARS) 측정, 관절조직에서 염증관련 인자들을 Western blotting 분석 및 Safranin-O 조직병리학적 염색을 통해 골관절염에 개선 효과가 있는지에 대하여 알아보았다.
실험기간 동안의 체중 변화 결과, 모든 실험군에서 몸무게 증가를 보였으나 유의한 변화를 나타내지 않았다. 특히, SA200 투여군에서 몸무게가 증가하는 것으로 나타났으나 이것은 사료섭취량이 다른 군에 비해서 SA200 투여군이 많은 것으로 인해 나타난 것으로 판단되나 사료섭취량에 있어서도 유의한 변화는 없었다( Table 1). 뒷다리 체중 부하는 통증의 정도를 평가할 때 흔히 사용되는 지표로 실험군의 체중 증가나 증가된 산화스트레스가 통증의 정도에 어떤 영향을 미칠 것인가를 평가하였다. 실험기간 동안 뒷다리 체중 부하는 총 4번을 측정하였으며, 측정된 값은 Normal군의 뒷다리 체중 부하 비율을 100으로 하여 상대적 뒷다리 체중 부하의 변화(%)를 비교 평가하였다. 약물투여 14일에 Control군은 Normal군 대비 뒷다리 체중 부하가 유의적으로 감소되었고(p<0.001), 이러한 감소는 약물 투여에 의해 호전이 되었으나 SA200 투여에 의해서만 유의적으로 개선되었다(p<0.05). 즉, SA200 투여군은 Control군 대비 39% 개선되었다. 이를 통해 SA200의 투여가 골관절염에서의 통증을 개선시킴을 시사한다( Fig. 1). 산화 스트레스(Oxidative Stress, OS)는 OA 진행의 병태생리학적 요인 중 하나로 간주되고 있다 22. 그래서 산화 스트레스 관련 인자들을 혈액(ROS, ONOO- 및 TBARS) 분석 및 관절조직(NADPH oxidase) western bloting을 통해 분석하였다. 활성산소종(ROS)은 과산화수소(H 2O 2), 하이드록실(OH-), 슈퍼옥사이드(O 2-) 등의 고도의 산화성 라디칼을 포함하며, 미토콘드리아 세포 산화 스트레스를 유발하는 미토콘드리아 손상 또는 기능 장애를 유발한다. Peroxynitrite(ONOO-)은 염증 부위에서 과도하게 생성된 NO와 O 2-가 빠르게 상호작용으로 생체 내에서 생성되어지는데 강력한 산화성으로 인해 비교적 오래 세포 손상을 야기한다 23. TBARS는 말론디알데히드(malondialdehyde, MDA)를 측정하는 분석법으로 불포화지방산의 지질과산화에 의해 발생하며 지질과산화 정도를 추정할 수 있다 24. ROS를 생성하는 다른 경로는 NADPH oxidase(NOX) 계열이며 NOX 증가는 ROS의 과잉 생산을 위한 메커니즘으로 다양한 연구에서 보고되어지고 있다 25. 혈액 내에서 ROS, ONOO- 및 TBARS를 측정한 결과, Indo군과 SA200군에서 세 인자가 모두 유의하게 억제함을 보여주었다. 특히, ROS의 억제는 Indo군 대비 SA200군에서 26% 더 효과적으로 억제하였다(p<0.001)( Fig. 2). 게다가 NOX의 subunits의 단백질 발현량을 비교분석 하였을 때, NOX2의 경우 SA200군에서만 유의하게 감소하였고, 이는 Control군 대비 24% 감소하는 것을 확인할 수 있었다. p47 phox와 p22 phox 두 유전자는 모든 약물 처리군에서 유의하게 억제하였으나 p47 phox는 Indo군에서, p22 phox은 SA200군에서 탁월하게 감소하는 것으로 나타났다. Indo군에서 p47 phox는 대조군 대비 35% 감소, SA200군에서 p22 phox는 대조군 대비 29% 감소한 것을 확인하였다( Fig. 3). 관절조직 내 PI3K/AKT 단백질 발현을 western blot으로 분석하였다. PI3K의 인산화를 측정한 결과, Normal군 대비 Control군에서 75%(p<0.001)으로 유의하게 증가하였으며, 모든 약물처리군에서 유의하게(p<0.001) 감소하였다. PI3K의 인산화는 AKT의 인산화를 유도하였으며 Normal군 대비 Control군에서 69% 유의하게 증가하였다. 증가된 AKT의 인산화는 모든 약물투여군에서 유의하게 감소하였다( Fig. 4). PI3K/AKT 경로의 활성화는 NF-κB를 유도한다. IκB의 인산화의 증가는 NF-κB의 핵 내 이동 및 핵 내 전사를 이끌고, 이는 염증성 매개인자와 염증성 사이토카인을 유도하게 된다 6. 실험 결과, Control군에서의 유의적으로 상승된 NF-κB는 약물 처리군에 의해서 유의적으로 감소하였다( Fig. 5). NF-κB의 활성화 의해 유도되어지는 염증매개인자 iNOS, COX-2와 염증성 cytokine인 TNF-ɑ, IL-6의 발현량을 확인하였다. Normal군 대비 유의하게 증가된 iNOS, COX-2, TNF-ɑ 및 IL-6의 발현량은 약물투여군 중에서 SA200군에서 가장 효과적으로 감소시키는 것으로 나타났다( Fig. 6). 반면, 항항염성 사이토카인인 IL-4와 IL-10은 Control군에서 감소된 수준을 모든 약물투여군에서 유의적으로 상승시켰음을 확인하였다( Fig. 7). 관절조직 내의 단백질 분해 인자인 MMPs와 그것의 저해제인 TIMPs의 단백질 발현을 분석하였다. 골관절염에서 세포외기질(Extracellular Matrix, ECM)은 활액 관절, 특히 무릎, 손 및 고관절 내에서 분해되며 골관절염 환자의 심한 통증의 요인으로 나타난다. 관절 세포와 면역 세포에서 생성되는 수많은 염증 매개체는 MMPs(matrix metalloproteinase, 기질금속단백분해효소)의 생성을 자극한다. ECM의 모든 구성 요소를 분해할 수 있는 효소인 MMP-1과 MMP-13은 콜라겐 분해 과정에서 속도 제한적이기 때문에 OA에서 주된 역할을 한다. MMP-1은 주로 관절을 이루는 활액막 세포에서 생산되며, MMP-13은 연골에 존재하는 연골 세포의 산물이다. MMP-13은 콜라겐을 분해하는 것 외에도 프로테오글리칸 분자인 aggrecan도 분해하여 기질 파괴에 이중 역할을 한다. 또한, MMP-3도 관절염에서 증가하며, 관절의 비콜라겐 기질 성분을 분해한다 26. TIMPs(Tissue inhibitors of metalloproteinases, 기질금속단백분해효소의 저해제)는 MMPs와 서로 상호작용으로 인해 MMPs의 단백 분해를 억제하는 내인성 인자로서, TIMP-1과 TIMP-2가 알려져 있다 27. MMPs와 TIMPs를 단백질 발현을 측정한 결과, MMP-3와 MMP-13은 모든 약물처리군에서 Control군 대비 유의적으로 감소함을 보였으나, MMP-1은 SA200군에서만 유의하게 탁월하게 억제되었다(p<0.001). 또한, TIMPs는 Normal군 대비 Control군에서 유의성 있게 감소하였으나, 모든 약물처치군에서 유의적으로 증가하는 것을 확인하였다( Fig. 8). 마지막으로 관절조직의 Safranin-O stain을 통해 proteoglycan층의 소실 정도를 평가한 결과, Control에서는 proteoglycan의 대부분이 파괴되어 연골의 형태학적 변화를 야기하였다. 반면에, Indo와 SA 투여군에서는 소실된 proteoglycan층을 회복시키는 것으로 나타났다. 또한, SA200군은 SA100군 대비 proteoglycan의 파괴 정도가 현저히 감소하였다( Fig. 9). 이 결과를 통해 丁香 추출물는 MIA로 유발된 골관절염 동물모델에서 산화적 스트레스 및 PI3K/ Akt/NF-κB 경로에 의한 염증을 개선하는 것으로 평가되었다.
Ⅴ. 결 론
본 연구에서는 MIA 골관절염 유발 동물모델에서 丁香 추출물을 경구 투여하여 골관절염 개선 효과를 평가하였으며, 다음과 같은 결과를 도출하였다.
1. 뒷다리 체중 부하 측정 결과, Control군에 비해 丁香 추출물 투여군이 유의성 있게 증가하였다.
2. 혈액 내에서 산화스트레스 관련 인자인 ROS, ONOO- 및 TBARS를 측정한 결과, Control군에 비해 丁香 추출물 투여군이 유의성 있게 감소시켰다.
3. 관절조직 내에서 산화 스트레스 관련 인자인 NADPH oxidase 단백질 발현을 분석한 결과, Control군에 비해 丁香 추출물 투여군이 유의성 있게 감소시켰다.
4. 관절조직 내에서 PI3K/AKT/NF-kBp65 경로의 활성화를 통한 염증성 매개인자와 염증성 사이토카인의 증가는 丁香 추출물 투여군이 유의성 있게 감소시켰다.
5. 관절조직 내에서 감소된 항염증성 사이토카인인 IL-4와 IL-10의 단백질 발현이 丁香 추출물 투여로 유의성 있게 증가하였다.
6. 관절조직 내 단백질 분해 인자의 발현량을 확인하기 위하여 MMPs와 그것의 저해제인 TIMPs의 발현량을 측정한 결과, 모든 약물투여군에서 MMP-3과 MMP-13의 유의적 감소 및 TIMP-1과 TIMP-2의 유의적 증가를 보여주었다. 특히 MMP-1은 SA200군에서만 유의하게 감소시킴을 확인할 수 있었다.
따라서 MIA로 유발된 골관절염 동물모델에서 丁香 추출물은 산화 스트레스 및 PI3K/AKT/NF-κB 경로의 활성화로 유발된 염증을 완화시켰으며, 세포외기질을 분해하는 인자의 억제 및 저해인자의 활성을 통해 개선효과를 보여주었다. 이를 통해 추후 丁香 추출물이 골관절염 예방 및 치료를 위한 후보소재로서의 과학적 근거로 제시될 수 있을 것으로 판단된다.
감사의 글
이 연구는 2022년도 정부(과학기술정보통신부)의 재원으로 한국연구재단의 지원을 받아 수행되었습니다(No. 2018R1A5A2025272와 No. 2021R1I1A1A01059605).
참고문헌
1. Glyn-Jones S, Palmer AJ, Agricola R, Price AJ, Vincent TL, Weinans H, et al. Osteoarthritis. Lancet 2015:386(9991):376–87.   2. He L, Pan Y, Yu J, Wang B, Dai G, Ying X. Decursin alleviates the aggravation of osteoarthritis via inhibiting PI3K-Akt and NF-kB signal pathway. Int Immunopharmacol 2021:97:107657.   3. Frasca D, Blomberg BB, Paganelli R. Aging, Obesity, and Inflammatory Age-Related Diseases. Front Immunol 2017:8:1745.    4. Wang T, He C. Pro-inflammatory cytokines:The link between obesity and osteoarthritis. Cytokine Growth Factor Rev 2018:44:38–50.   5. Vallabhapurapu S, Karin M. Regulation and function of NF-kappaB transcription factors in the immune system. Annu Rev Immunol 2009:27:693–733.   6. Yan W, Fan W, Chen C, Wu Y, Fan Z, Chen J, et al. IL-15 up-regulates the MMP-9 expression levels and induces inflammatory infiltration of macrophages in polymyositis through regulating the NF-kB pathway. Gene 2016:591(1):137–47.   7. Hyeong K, Won JH, Woo CH. Anti-oxidant and Anti-inflammatory Effects of Chulbu-tang. J Korean Acad Rehabil Med 2020:30(3):71–87.  9. Nuñez L, Aquino MD. Microbicide activity of clove essential oil (Eugenia caryophyllata). Braz J Microbiol 2012:43(4):1255–60.    10. Ahmad T, Shinkafi TS, Routray I, Mahmood A, Ali S. Aqueous Extract of Dried Flower Buds of Syzygium aromaticum Inhibits Inflammation and Oxidative Stress. J Basic Clin Pharm 2012:3(3):323–7.    12. Ali SF, LeBel CP, Bondy SC. Reactive oxygen species formation as a biomarker of methylmercury and trimethyltin neurotoxicity. Neurotoxicology 1992:13(3):637–48.  13. Kooy NW, Royall JA, Ischiropoulos H, Beckman JS. Peroxynitrite-mediated oxidation of dihydrorhodamine 123. Free Radic Biol Med 1994:16(2):149–56.   14. Mihara M, Uchiyama M. Determination of malonaldehyde precursor in tissues by thiobarbituric acid test. Anal Biochem 1978:86(1):271–8.   15. Johnson VL, Hunter DJ. The epidemiology of osteoarthritis. Best Pract Res Clin Rheumatol 2014:28(1):5–15.   16. Fei J, Liang B, Jiang C, Ni H, Wang L. Luteolin inhibits IL-1β-induced inflammation in rat chondrocytes and attenuates osteoarthritis progression in a rat model. Biomed Pharmacother 2019:109:1586–92.  17. Philpott HT, O'Brien M, McDougall JJ. Attenuation of early phase inflammation by cannabidiol prevents pain and nerve damage in rat osteoarthritis. Pain 2017:158(12):2442–51.    18. Xie Y, Shi X, Sheng K, Han G, Li W, Zhao Q, et al. PI3K/Akt signaling transduction pathway, erythropoiesis and glycolysis in hypoxia (Review). Mol Med Rep 2019:19(2):783–91.   19. Zhu W, Hu X, Xu J, Cheng Y, Shao Y, Peng Y. Effect of PI3K/Akt Signaling Pathway on the Process of Prostate Cancer Metastasis to Bone. Cell Biochem Biophys 2015:72(1):171–7.   20. Kalbhen DA, Blum U. Theoretisches Konzept und experimentell Bestätigung für ein neues Arthrose-Modell am Versuchstier [Hypothesis and experimental confirmation of a new pharmacological model of osteoarthrosis (author's transl)]. Arzneimittelforschung 1977:27(3):527–31.
21. Pitcher T, Sousa-Valente J, Malcangio M. The Monoiodoacetate Model of Osteoarthritis Pain in the Mouse. J Vis Exp 2016:111:53746.  22. Woo YJ, Joo YB, Jung YO, Ju JH, Cho ML, Oh HJ, et al. Grape seed proanthocyanidin extract ameliorates monosodium iodoacetate-induced osteoarthritis. Exp Mol Med 2011:43(10):561–70.  23. Fernandes E, Toste SA, Lima JL, Reis S. The metabolism of sulindac enhances its scavenging activity against reactive oxygen and nitrogen species. Free Radic Biol Med 2003:35(9):1008–17.  25. van Dalen SCM, Kruisbergen NNL, Walgreen B, Helsen MMA, Slöetjes AW, Cremers NAJ, et al. The role of NOX2-derived reactive oxygen species in collagenase-induced osteoarthritis. Osteoarthritis Cartilage 2018:26(12):1722–32.   26. Mehana EE, Khafaga AF, El-Blehi SS. The role of matrix metalloproteinases in osteoarthritis pathogenesis:An updated review. Life Sci 2019:234:116786.  
|
|




















