위축성 위염에 대한 반하사심탕과 표준치료 병용요법의 최신 연구 동향
Abstract
Objective
The purpose of this study was to investigate the effect of combined therapy with Banhasasim-tang and conventional treatment for atrophic Gastritis.
Methods
The study collected data of clinical studies of combined therapy with Banhasasim-tang and conventional treatment for atrophic gastritis. Electronic databases were used, including PubMed, Cochrane, CNKI, Wanfang, CINII, J-stage, NDSL, and OASIS. The main search terms included such as “Atrophic Gastritis”, “Banhasasim-tang”, “BanXia Xiexin Tang”. This study only included randomized controlled trials (RCTs) that adopted combined therapy with Banhasasim-tang and conventional treatment for atrophic gastritis.
Results
A total of 18 RCTs were selected. They all adopted combined therapy with Banhasasim-tang and conventional treatment for atrophic gastritis. In all the studies, the intervention group significantly improved the score of effective rate, and in the 8 studies, Hp negative conversion rate was significantly improved when Banhasasim-tang was taken.
Conclusion
Through the analysis of 18 RCTs, we found Banhasasim-tang combined with conventional therapy were more effective in the positive performance of atrophic gastritis than conventional therapy single contribution. However, due to the low quality of the selected studies and the lack of endoscopy, biopsy, follow-up observation, so there is a slight insufficient to prove its conclusion. Therefore, we hope that more systematic and diverse clinical studies will be conducted.
Keywords: review, atrophic gastritis, Banhasasim-tang, Korean medicine
I. 서 론
위암은 세계적으로 암 관련 사망률에서 4번째로 흔한 원인이다 1. 우리나라에서는 전체 암 발생 중 남자에서 17.1%, 여자에서 9.2%를 차지하며, 암종별 발생률 1위이고, 남자에서는 발생률 1위, 여자에서는 발생률 4위이다 2. 위암의 위험도는 위축성 위염의 등급(grade)과 범위에 비례하여 증가하기 때문에 3, 위축성 위염을 진단하는 것은 위암의 조기 선별에 매우 중요하다 4. 다양한 연구 5-7를 통하여 위축성 위염과 장상피화생이 위암의 전구 병변으로 인정받게 되었으며, 이러한 병변의 진단과 치료 및 추적 관찰을 통한 위암의 예방 및 조기 진단에 대한 관심이 증대되고 있다. 위축성 위염은 지속적인 염증 반응에 의해 발생하며, 선형 구조물(gastric glandular structures)이 파괴되어 점막층이 얇아지며 점막의 색조가 퇴색되어 보이고, 점막층 또는 점막하층의 혈관상이 노출되게 된다 8. 위축성 변화는 주로 위각에서 시작하여 점차 근위부 쪽과 위문부(pyloric antrum)로 양측으로 진행하게 된다 9. 일반적으로 내시경 검사와 병리검사를 통해서 진단하게 되는데, 내시경 검사만으로는 일반적인 점막 위축과 위축성 위염을 구별하지 쉽지 않으며, 조직학적 소견을 병행하여 분석할 것을 권고하고 있다 5-7. 또한 위축성 위염에 대한 표준화된 진단 기준이 없기 때문에 발병률에 대한 역학 데이터는 거의 없지만, 14개의 연구의 메타 분석에 따르면 전 세계적으로 위축성 위염 발병률은 연간 0%에서 10.9%에 이른다 10. 특히 동아시아 국가에서의 유병률은 다른 국가에 비해 높고, 연령과 상관성이 높다고 알려져 있다 11,12. 치료에 있어서는 위점막을 보호하는 제산제와 염증 억제제 등 위염에 사용되는 대증적인 치료와, 환자에게서 높은 이완율을 보이는 Helicobacter pylori(Hp)의 제거 목적으로 쓰이는 항생제 등의 사용을 표준치료로 시행하고 있다 5-7. 한의학적으로 위염은 胃脘痛, 痞滿, 惡心嘔吐, 納呆, 呑酸, 噯氣, 嘈雜 등의 범주에 포함되는데, 胃脘疼痛, 嘔吐頻繁, 吐物酸臭의 증상을 나타낸다 13. 半夏瀉心湯은 ≪傷寒論≫ 14에 최초로 수록되어 心下痞滿不痛, 乾嘔, 嘔吐, 腸鳴下痢를 치료하는 대표적인 處方으로 인식되어 왔으며 15, 임상에서는 급⋅만성 위장관 카타르, 발효성 설사, 급성 위장관염 등에 활용되고 있다 16. 이에 본 연구에서는 위암 발생 위험률을 증가시키는 전구병변으로 잘 알려져 있는 위축성 위염에 반하사심탕과 양약의 병용 치료 효과를 파악하기 위해, 최근 3년 간 위축성 위염 환자에게 반하사심탕과 표준치료로 사용되는 양약의 병용요법으로 치료한 무작위 임상연구를 대상으로 고찰하여 그 결과를 보고하고자 한다.
II 연구 방법
1. 검색 엔진 및 문헌 검색 전략
검색엔진은 PubMed(https://www.ncbi.nlm.nih.gov/ pubmed), Cochrane library(https://www.cochranelibrary. com), Wiley online library(https://onlinelibrary.wiley. com)를 사용하였다. 또한, 중국과 일본, 한국의 경우는 한약을 다용하는 국가이므로, 좀 더 세밀한 검색을 위해 각 국가의 검색엔진을 추가로 검색하였다. 국내 논문 검색은 OASIS(Oriental medicine Advanced Searching Integrated System, https:// oasis.kiom.re.kr), NDSL(National Digital Science Links, http://scholar.ndsl.kr), KISS(Korean studies Information Service System, http://kiss.kstudy.com), 과학기술학회마을(http://society.kisti.re.kr), RISS (Research Information Service System, http://www. riss.kr), DBpia(https://dbpia.co.kr) 검색엔진을 사용하였다. 중국에서는 CNKI(China National Knowledge Infrastructure, https://search.cnki.net), Wanfang(http:// www.wanfangdata.com.cn), 일본에서는 J-STAGE(Japan Science and Technology information Aggreator, Electronic, https://www.jstage.jst.go.jp)와 CiNii articles (https://ci.nii.ac.jp) 검색 엔진을 사용하였다.
영미권의 검색엔진 키워드는 ‘atrophic gastritis’, ‘RCT’, ‘randomized controlled trials’, ‘random allocation’, ‘banhasasim-tang’, ‘banxiaxiexintang’, ‘banxiaxiexin-tang’, ‘banxiaxiexin tang’, ‘banxia xiexintang’, ‘banxiaxiexin’, ‘banxia xiexin’, ‘pinellia heart-draining’, ‘TJ-14’, ‘DBXX’이었다. 국내의 검색엔진 키워드는 ‘위축성위염’, ‘무작위화 임상시험’, ‘무작위화’, ‘임상 시험’, ‘반하사심탕’을 사용하였다. 중국의 검색 엔진 키워드는 ‘萎缩性胃炎’, ‘随机’, ‘试验’, ‘对照’, ‘双盲’, ‘半夏泻心汤’이었다. 일본의 검색엔진 키워드는 ‘萎縮性胃炎’, ‘臨床試験’, ‘無作為化’, ‘半夏瀉心湯’, ‘TJ-14’이었다. 상기 검색 키워드들은 각 국가별 검색엔진의 특성에 맞추어 조합하여 검색하였다. 총 13개의 검색엔진에서 2019년 8월 15일에 검색을 진행하였고, 검색기간은 2017년 1월 1일부터 2019년 08월 15일까지를 범위로 하였다, 언어는 제한을 두지 않았다.
2. 문헌 선정 및 자료 추출
일차적으로 국내외 검색엔진에서 검색된 문헌을 취합하여 중복 문헌을 제거하고, 선정 및 제외기준에 의거하여 문헌 제목과 초록을 중심으로 본문을 검토하여 최종 문헌을 선정하였다. 최종 선정된 문헌에 관하여 미리 검토된 자료 추출 서식에 따라 자료를 추출하였다. 자료 추출 서식에는 환자의 질환, 성별 및 인원 수, 질병 이환기간, 시험군의 중재(투여약물, 복용방법), 대조군의 중재(투여약물, 복용방법), 시험군과 대조군의 중재기간, 결과변수, 결과값, 이상반응 여부를 포함하였다.
III. 결 과
1. 문헌 선별
최초 155편의 문헌이 검색되었으며, 30편 중복 문헌을 제외하여 1차적으로 125개 문헌이 선정되었다. 문헌의 제목과 초록을 검토하여 본 연구 주제와 일치하지 않는 63개 문헌을 배제하고 2차적으로 62개의 문헌이 선정되었다. 이후 문헌의 전문을 검토하여 위축성 위염을 대상으로 하지 않은 문헌 6편, Non-RCT 문헌 3편, 대조군이 양약이 아닌 문헌 13편, 반하사심탕 복합 처방 문헌 4편과 시험군이 반하사심탕과 양약 병용요법이 아닌 문헌 15편을 배제하여 21편의 문헌이 선정되었고, 이 중 평가지표가 불량한 문헌 3편을 제외하여 최종적으로 18편의 문헌이 선정되었다( Fig. 1).
Fig. 1
PRISMA flow diagram for process of literature search. 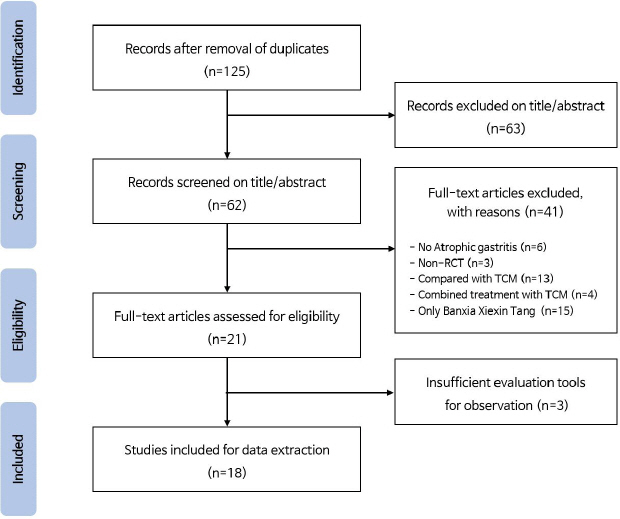
2. 선정 문헌의 분석
1) 문헌 특성
최종 선정된 18편의 문헌은 각각 2019년에 5편 17-21, 2018년에 9편 22-30, 2017년에 4편 31-34이 발행되었다. 모든 문헌이 만성 위축성 위염 환자를 대상으로 하였으며, 위축성 위염과 함께 Hp 양성인 환자만을 대상으로 한 문헌은 4편 19,22,25,26이었다( Table 1).
Table 1
Characteristics and Methodological Quality of Included Studies
|
Authors (published year) |
Classification |
Participants N (intervention/control) 1) Intervention group N=male/female ; age (yr) ; CAG duration (yr) 2) Control group N=male/female ; age (yr) ; CAG duration (yr) |
Intervention treatment |
Control treatment |
Treatment duration |
Outcome variables |
Effective results |
Adverse event |
|
Wang XN (2019)17
|
CAG |
90 (45/45)
1) 25/20 ; 69.1±4.2 ; 1.4±0.2
2) 27/18 ; 68.7±4.3 ; 1.1±0.2 |
Banxia Xiexin Tang+Control treatment |
Rebamipide 0.3 g/d |
3 months |
1. Serum OPN level
2. Gastrin content
3. TER |
1. p<0.05
2. p<0.05
3. p<0.05 |
not mentioned |
|
|
Liu (2019)18
|
CAG |
84 (42/42)
1) 25/17 ; 70.35±4.19 ; 9.48±1.33 2)
24/18 ; 70.25±4.26 ; 9.42±1.35 |
Banxia Xiexin Tang+Control treatment |
Amoxicillin 1.5 g/d, Omeprazole 40 mg/d, Clarithromycin 500 mg/d |
4 weeks |
1. Symptoms
2. QoL
3. Hp negative conversion rate
4. TER |
1. p<0.05 2. p<0.05 3. p<0.05 4. p<0.05 |
not mentioned |
|
|
Li (2019)19
|
CAG, Hp (+) |
68 (34/34)
1) 22/12 ; 47.62±2.41 ; none
2) 20/14 ; 47.66±2.54 ; none |
Banxia Xiexin Tang+Control treatment |
Clarithromycin 1.0 g/d, Amoxicillin 2.0 g/d, Rabeprazole sodium 40 mg/d |
2 weeks |
1. TER |
1. p<0.05 |
not mentioned |
|
|
Wang XM (2019)20
|
CAG |
120 (60/60)
1) 26/34 ; 55.83±7.32 ; 1.31±0.48
2) 24/36 ; 56.19±7.36 ; 1.36±0.51 |
Banxia Xiexin Tang+Control treatment |
Lansoprazole 30~60 mg/d, Amoxicillin 1.0 g/d, Clarithromycin 0.5 g/d |
2 months |
1. Symptoms
2. Serum inflammatory reactions
3. Immunological function
4. TER |
1. p<0.05
2. p<0.05
3. p<0.05
4. p<0.05 |
none |
|
|
Xu H (2019)21
|
CAG |
117 (59/58)
1) 34/25 ; 48.31±3.49 ; 7.83±1.47
2) 35/23 ; 48.72±3.63 ; 8.01±1.54 |
Banxia Xiexin Tang+Control treatment |
Omeprazole 40 mg/d, Amoxicillin 1.0 g/d, Metronidazole 0.8 g/d |
2 months |
1. TER
2. Hp negative conversion rate
3. Adverse reactions |
1. p<0.05
2. p<0.05
3. p<0.05 |
Intervention : none control : 2 adverse event |
|
|
Wang W (2018)22
|
CAG, Hp (+) |
90 (45/45)
1) 29/16 ; 46.38±7.92 ; 6.33±1.75
2) 27/18 ; 46.57±7.37 ; 6.18±1.69 |
Banxia Xiexin Tang+Control treatment |
Amoxicillin 0.2 g/d, Rabeprazole sodium 40 mg/d, Clarithromycin 1.0 g/d |
2 weeks |
1. Hp negative conversion rate
2. Symptoms
3. TER |
1. p<0.05
2. p<0.05
3. p<0.05 |
Intervention : none control : 3 dizziness, 1 nausea |
|
|
Wu (2018)23
|
CAG |
114 (57/57)
1) 33/24 ; 45.11±9.87 ; 4.54±1.17 (m)
2) 34/23 ; 44.78±10.05 ; 4.65±1.23 (m) |
Banxia Xiexin Tang+Control treatment |
Ornidazole 1.0 g/d, Amoxicillin 2.0 g/d, Rabeprazole sodium 40 mg/d, Colloidal bismuth tartrate 0.44 g/d |
4 weeks |
1. TER
2. Hp negative conversion rate
3. Gastrin Content
4. Adverse reactions |
1. p<0.05
2. p<0.05
3. p<0.05
4. p>0.05 |
Intervention : 1 slight liver function abnormality, 1 nausea control : 1 slight liver function abnormality |
|
|
Zhang (2018)24
|
CAG |
80 (40/40)
1) 22/18 ; 35.2±6.6 ; 8.4±2.2
2) 21/19 ; 35.3±6.9 ; 8.5±2.1 |
Banxia Xiexin Tang+Control treatment |
Metronidazole 0.8 g/d, Amoxicillin 2.0 g/d, Pantoprazole 2.0 g/d |
not mentioned |
1. TER
2. Hemorheology indicators |
1. p<0.05
2. p<0.05 |
not mentioned |
|
|
You (2018)25
|
CAG, Hp (+) |
60 (30/30)
1) 20/10 ; 45 ; 10
2) 18/12 ; 42 ; 11 |
Banxia Xiexin Tang+Control treatment |
Omeprazole 40 mg/d, Amoxicillin 2.0 g/d, Clarithromycin 2.0 g/d |
2 months /4 weeks |
1. TER |
1. p<0.05 |
not mentioned |
|
|
Yang C (2018)26
|
CAG, Hp (+) |
80 (40/40)
1) 24/16 ; 46.2±7.5 ; 5.8±1.5
2) 22/18 ; 45.7±7.9 ; 6.3±1.8 |
Banxia Xiexin Tang+Control treatment |
Amoxicillin 0.2 g/d, Rabeprazole sodium 40 mg/d, Clarithromycin 1.0 g/d |
not mentioned |
1. Hp negative conversion rate
2. TER |
1. p<0.05
2. p<0.05 |
not mentioned |
|
|
Chen (2018)27
|
CAG |
90 (45/45)
1) 33/12 ; 46.1±8.7 ; 3.2±0.9
2) 31/14 ; 45.6±8.5 ; 3.1±0.7 |
Banxia Xiexin Tang+Control treatment |
Rabeprazle sodium 20 mg/d, Amoxicillin 1.5 g/d, Bismuth potassium citrate 660 mg/d |
8 weeks |
1. TER
2. Symptoms
3. Hp negative conversion rate
4. Serum SOD level
5. Serum MDA level |
1. p<0.05
2. p<0.05
3. p<0.05
4. p<0.05
5. p<0.05 |
not mentioned |
|
|
Yang Z (2018)28
|
CAG |
500 (250/250) 222/278 ; 47.16±2.25 ; 5.13±0.36 |
Banxia Xiexin Tang+Control treatment |
Bismuth pectin 300 mg/d, Amoxicillin 1.5 g/d |
4 weeks |
1. TER |
1. p<0.05 |
not mentioned |
|
|
Jiang (2018)29
|
CAG |
142 (71/71)
1) 33/38 ; 42.12±4.37 ; none
2) 34/37 ; 41.38±4.28 ; none |
Banxia Xiexin Tang+Control treatment |
Ampicillin, Bismuth compound, Proton Pump Inhibitors, Metronidazole |
4 weeks |
1. TER |
1. p<0.05 |
not mentioned |
|
|
Zhu (2018)30
|
CAG |
110 (55/55)
1) 29/26 ; 44.3±5.1 ; 5.1±2.2
2) 31/24 ; 44.9±5.3 ; 5.2±2.4 |
Banxia Xiexin Tang+Control treatment |
Omeprazole 20 mg/d, Bismuth potassium citrate 1.2 g/d |
1 month |
1. Total score of TCM syndrome
2. TER |
1. p<0.05
2. p<0.05 |
not mentioned |
|
|
Lu (2017)31
|
CAG |
92 (46/46)
1) 21/25 ; 40.40±3.10 ; 3.98±1.62
2) 22/24 ; 37.33±2.45 ; 3.65±1.51 |
Banxia Xiexin Tang+Control treatment |
Amoxicillin 0.3 g/d, Clarithromycin 0.5 g/d, Bismuth potassium citrate 1.2 g/d |
4 weeks |
1. TER
2. Symptoms |
1. p<0.05
2. p<0.05 |
not mentioned |
|
|
Cui (2017)32
|
CAG |
97 (49/48)
1) 27/22 ; 55.3±5.7 ; 5.2±1.4
2) 29/19 ; 55.1±5.2 ; 4.9±1.6 |
Banxia Xiexin Tang+Control treatment |
Clarithromycin 0.5 g/d, Bismuth pectin 600 mg/d |
3 months |
1. Hp negative conversion rate
2. TER |
1. p<0.05
2. p<0.05 |
not mentioned |
|
|
Xu G (2017)33
|
CAG |
78 (39/39)
1) 24/15 ; 50.45±6.32 ; 7.6±5.5
2) 22/17 ; 51.22±6.41 ; 7.5±5.6 |
Banxia Xiexin Tang+Control treatment |
Metronidazole 0.8 g/d, Amoxicillin 2.0 g/d, Pantoprazole 80 mg/d |
2 weeks |
1. TER
2. Hp negative conversion rate |
1. p<0.05
2. p<0.05 |
not mentioned |
|
|
Fang (2017)34
|
CAG |
80 (40/40) 43/37 ; 50.32±4.56 ; 11.35±6.40 |
Banxia Xiexin Tang+Control treatment |
Pepsin 30 mL/d, Amoxicillin 0.375 g/d, Cholestyramine 15 g/d, Metoclopramide 15 mg/d |
not mentioned |
1. TER
2. Gastric mucosal atrophy and Intestinal metaplasia |
1. p<0.05
2. p<0.05 |
not mentioned |
2) 연구 대상자
연구 대상자 수는 문헌에 따라 60명에서 500명으로 다양했으며, 대상자의 평균 연령대는 30대가 2편 24,31, 40대가 10편 19,21-23,25-30, 50대가 4편 20,32-34, 60대가 1편 17, 70대가 1편 18이었다. 연구 대상자의 평균 질병 이환기간은 1년 미만이 1편 23, 10년 이상이 2편 25,34이었고, 나머지는 1년 이상 10년 미만이었다. 2편 19,29은 질병 이환기간을 언급하지 않았다.
3) 시험군 및 대조군 투여 약물
시험군의 병용요법 및 대조군으로 사용된 위축성 위염 표준치료 양약 중에서 단독으로 사용한 약은 Rebamipide가 1편 17이었고, 나머지는 2개 이상의 약을 동시에 복용하였으며, 3가지의 약을 조합하여 복용한 경우가 11편 18-22,24-27,31,33으로 가장 많았다. Amoxicillin을 사용한 문헌이 15편 18-29,31,33,34으로 가장 흔하게 사용되었고, 다음으로 Clarithromycin이 8편 18-20,22,25,26,31,32, Rabeprazole이 5편 19,22,23,26,27, Omeprazole 18,21,25,30과 Metronidazole 21,24,29,33이 각각 4편, Bismuth potassium citrate가 3편 27,30,31, Pantoprazole 24,33, bismuth pectin 28,32이 각각 2편, Rebamipide 17, Lansoprazole 20, Ornidazole 23, Colloidal bismuth tartrate 23, Ampicillin 29, Bismuth compound 29, Proton pump inhibitors 29, Pepsin 34, Cholestyramine 34, Metoclopramide 34가 각각 1편의 문헌에 사용되었다. 시험군에는 대조군에 사용된 양약과 반하사심탕을 병용하여 투여하였다.
4) 치료 기간
약물 투여 기간은 2주, 4주, 1달, 8주, 2달, 3달 순으로 길었고, 4주가 5편 18,23,28,29,31, 2주가 3편 19,22,33 순으로 기간을 많이 사용하였다. 시험군과 대조군의 투여 기간을 각각 2달, 4주로 다르게 한 문헌이 1편 25 있었고, 3편 24,26,34은 약물 투여 기간에 대한 언급이 없었다.
5) 평가 도구
시험군과 대조군의 위축성 위염 치료 효과를 나타내기 위해 다양한 평가 방법들이 사용되었다. 증상 평가 척도인 Total Effective Rate(TER)은 대부분의 문헌에서 이용되었고, 그 다음으로는 Hp negative conversion rate가 8편 18,21-23,26,27,32,33, 증후 (symptom)가 5편 18,20,22,27,31에서 이용되었다. 이 외에도 gastrin content 17,23, adverse reactions 21,23, QoL 18, serum OPN level 17, serum SOD level 27, serum MDA level 27, serum inflammatory reactions 20, immunological function 20, hemorheology indicators 24, Total score of TCM syndrome 30, Gastric mucosal atrophy and intestinal metaplasia 34 등의 평가 도구가 사용되었다( Fig. 2).
Fig. 2
Frequency of outcome variables. 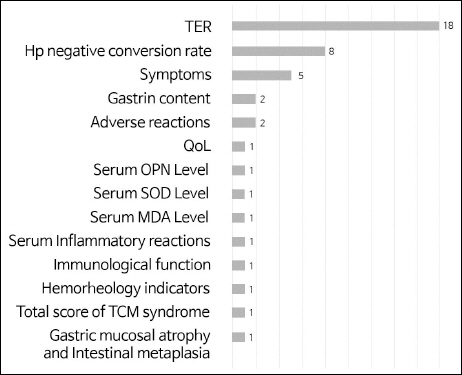
6) 안전성
연구 결과 나타난 이상 반응에 대해 Wang XM의 연구 20에서는 반하사심탕과 관련이 있다고 의심되는 이상 반응은 보고된 바가 없다고 간략하게 기술하였다. Xu 21와 Wang W 22의 연구에서는 시험군에서는 이상 반응이 나타나지 않았지만 대조군에서 각각 2건, 4건의 어지러움, 오심 등의 이상 반응이 나타났다고 보고했다. 시험군과 대조군 모두에서 이상 반응이 나타난 Wu 23의 연구에서 시험군에서는 1건의 경도 간기능 장애, 1건의 오심이 나타났고, 대조군에서는 1건의 경도 간기능 장애가 나타났다. 나머지 문헌에서는 이상 반응에 대한 언급이 없었다.
7) 치료 결과
14편의 문헌 모두에서 시험군이 대조군에 비해 총유효율에서 유의한 차이를 보였고(p<0.05), Hp negative conversion rate를 평가한 8편 18,21-23,26,27,32,33의 문헌 또한 유의성이 있다고 나타났다(p<0.05). Symptom을 평가한 문헌 5편 역시 유의미한 결과를 보였다(p<0.05). 이상 반응을 평가 도구로 활용한 문헌은 2편 21,23이었는데, Xu H 21의 연구에서는 통계적으로 유의성이 있었지만(p<0.05), Wu 23의 연구에서는 시험군이 대조군에 비해 유의한 효과를 나타내지 못하였다(p>0.05). 체내 혈액학적, 면역학적 측면에서 유효율을 평가한 문헌들 17,20,24,27의 분석 결과 시험군이 대조군에 비해 유의성 있다고 보고되었으며(p<0.05), Liu의 연구 18에서 평가된 QoL 또한 유의성을 보였다 (p<0.05).
IV. 고찰 및 결론
위암의 전구병변 중 하나인 위축성 위염을 조기에 발견하고 치료하는 것이 위암을 조기 선별하고 추적 관찰하여 예방할 수 있다는 사실은 잘 알려져 있다. 따라서 위축성 위염을 조기에 발견하여 치료하는 방법이 강조되고 있다. 하지만 국내에서 위축성 위염 치료에 대한 한의학적 접근 임상 연구는 많이 보고되지 않고 있다.
이에 본 연구에서는 문헌 조사에 의거한 半夏瀉心湯의 효과를 바탕으로 위축성 위염 환자에게 半夏瀉心湯과 양약의 병용 치료 효과를 파악하고자 최신 연구 동향을 살펴보았다. 최근 3년 간 위축성 위염 환자에게 半夏瀉心湯과 표준치료로 사용되는 양약의 병용요법으로 치료한 RCT 연구 중 본 연구의 목적과 부합하는 문헌은 총 18편 확인되었으며, 이를 토대로 문헌 분석을 진행하였다.
본 연구에서 문헌고찰을 시행한 결과 반하사심탕과 표준치료 병용요법은 표준치료 단독요법에 비해 위축성 위염의 증상 및 여러 평가 도구에서 유의미한 효과를 나타냈다.
8편의 문헌 18,21-23,26,27,32,33에서 Hp 균의 제거율 또는 감염률 등을 평가 도구로 하여 시험군의 제균 효과에 대해 확인하였다. 특히 Wu 23와 Xu 33의 연구는 치료 전후 Hp에 대한 감염률을 비교하였다. Wu 23의 연구에서 치료개시 전후를 비교였을 때 Hp의 감염률이 시험군과 대조군 각각 치료개시 전 89.47%, 92,98%에서 치료 후 14.04%, 24,56%로 감소하였음을 알 수 있었다. 한편, Xu 33의 연구는 대조군의 치료개시 전 감염률이 76.92%에서 치료 후 38.46%로 감소했던 데데 반해, 시험군의 치료개시 전 감염률이 79.49%에서 치료 후 10.26%로, 감염률이 현저하게 감소하였음을 확인할 수 있었다. 1편의 문헌 17을 제외한 모든 문헌이 표준치료로 항생제와 함께 위점막보호제 혹은 위산 분비 억제제를 사용하였다. 항생제를 사용하지 않은 Wang XN 17의 문헌에서는 위점막 혈류를 증가시켜 점막을 보호하는 rebamipide를 투여하였는데, 반하사심탕을 병용하였을 때 평가 도구가 유의성 있게 개선됨을 확인하였다. 이는 다른 문헌에서 보고되었던 반하사심탕과 항생제 병용투여의 유의미한 효과뿐만 아니라 반하사심탕과 위점막보호제 병용투여의 효과를 확인하여, 항생제를 투여하지 않고도 위축성 위염 호전시킬 수 있는 가능성을 시사한다. SOD는 체내의 중요한 항산화효소이며, MDA는 상승 시 종양의 유전자 표현을 촉진하고 암 발생을 유도한다 27. 이 두 가지 평가 도구를 사용한 Chen의 연구 27에서는 시험군이 대조군에 비해 현저하게 혈중 SOD와 MDA를 개선시켰음을 보고하였다. 또한 OPN은 phosphoprotein 1(Spp 1)에 의해 코딩되어, 면역과 발암을 포함한 병리생리학적인 과정에서 많은 역할을 담당한다 35. Wang XN의 연구 17에서 반하사심탕과 위점막보호제의 병용투여는 위점막보호제 단독투여보다 혈중 OPN 농도를 유의미하게 개선하였다. 이를 통해 반하사심탕의 투여가 위축성 위염의 증상뿐만 아니라 혈액학 및 면역학적 기전에 관여하여 질환의 호전에 기여할 수 있음을 유추할 수 있다. 다만 반하사심탕의 유효성을 입증하기에는 본 고찰에 선정된 문헌의 수가 적고, 반하사심탕과 양약의 병용 투여에 대한 문헌을 분석하였기 때문에 반하사심탕의 단독 효과를 명시하기에 적절하지 않을 것으로 판단된다. 또한 연구에 사용된 병용투여 약물에 있어서 단일 약재와 비교한 문헌이 없고, 대부분의 문헌에서 표준치료법으로 사용되는 3~5종의 약물을 혼합하여 투여하였다. 또한 약물의 종류와 용량도 제각기 차이가 있어서 각 문헌간의 데이터 동질성이 떨어져 본 연구에서 메타분석을 시행하지는 못하였다. 아울러 각 RCT에서 치료 후에도 일정한 기간 동안 동일한 환자군을 대상으로 내시경 및 조직 검사를 실시하여 위축성 위염의 상태를 평가하고 위암의 발생 유무를 확인할 수 있었다면 바람직했을 것이라는 아쉬움이 남는다.
이상반응에 대해서는 특별한 이상 반응이 없다는 연구도 있지만, 여러 문헌에서 이상 반응 유무를 언급하지 않아 안전성 평가에는 어려움이 있었다. 위축성 위염이 위암의 전구병변인 점을 감안하여 치료 이후 장기간 내시경 관찰 및 추적관찰을 통해 시험군과 대조군의 위암 발생 보고에 대해 분석하고 발생률을 비교할 필요도 있다고 생각된다. 또한 본 문헌 분석은 한약과 양약의 병용투여가 양약 단독투여보다 효과가 있다는 것을 보여주므로, 분석 결과를 임상에 적용하기 위해서는 양한방의 협진이 잘 이루어져야 할 것이다.
본 연구에서는 위축성위염에 반하사심탕과 표준치료 병용요법에 대한 최근 3년간 발행된 RCT 연구를 분석하였다. 이상의 고찰을 통해 반하사심탕의 임상 적용 가능성 및 근거를 확인하였으며, 향후 지속적인 연구와 국내에서의 표준 치료 및 반하사심탕의 병행 또는 효과 크기를 확인하기 위한 무작위대조 임상시험이 진행될 필요가 있을 것으로 사료된다.
감사의 말
본 연구는 한국보건산업진흥원을 통해 Γ보건복지부 양⋅한방 융합기반 기술개발사업Δ의 재정 지원을 받아 수행된 연구임(과제고유번호: HI16C0322)
참고문헌
1. Bray F, Ferlay J, Soerjomataram I, Siegel RL, Torre LA, Jemal A. Global cancer statistics 2018:GLOBOCAN estimates of incidence and mortality worldwide for 36 cancers in 185 countries. CA Cancer J Clin 2018:68(6):394–424. doi:10.3322/caac.21492.   3. Sipponen P, Kekki M, Haapakoski J, Ihamaki T, Siurala M. Gastric cancer risk in chronic atrophic gastritis:statistical calculations of cross- sectional data. Int J Cancer 1985:35(2):173–7.   4. Di Gregorio C, Morandi P, Fante R, De Gaetani C. Gastric dysplasia:a follow-up study. Am J Gastroenterol 1993:88(10):1714–9.  5. Kim N, Park YS, Cho SI, Lee HS, Choe G, Kim IW, et al. Prevalence and risk factors of atrophic gastritis and intestinal metaplasia in a Korean population without significant gastroduodenal disease. Helicobacter 2008:13(4):245–55. doi:10.1111/j.1523-5378.2008.00604.x.   6. de Vries AC, van Grieken NC, Looman CW, Casparie MK, de Vries E, Meijer GA, et al. Gastric cancer risk in patients with premalignant gastric lesions:a nationwide cohort study in the Netherlands. Gastroenterology 2008:134(4):945–52. doi:10.1053/j.gastro.2008.01.071.   7. Kim N, Park RY, Cho SI, Lim SH, Lee KH, Lee W, et al. Helicobacter pylori infection and development of gastric cancer in Korea:long-term follow-up. J Clin Gastroenterol 2008:42(5):448–54. doi:10.1097/MCG.0b013e318046eac3.   8. Rugge M, Correa P, Dixon MF, Fiocca R, Hattori T, Lechago J, et al. Gastric mucosal atrophy:interobserver consistency using new criteria for classification and grading. Aliment Pharmacol Ther 2002:16(7):1249–59. doi:10.1046/ j.1365-2036.2002.01301.x.   9. Cassaro M, Rugge M, Gutierrez O, Leandro G, Graham DY, Genta RM. Topographic patterns of intestinal metaplasia and gastric cancer. Am J Gastroenterol 2000:95(6):1431–8. doi:10.1111/ j.1572-0241.2000.02074.x.   10. Adamu MA, Weck MN, Gao L, Brenner H. Incidence of chronic atrophic gastritis:systematic review and meta-analysis of follow-up studies. Eur J Epidemiol 2010:25(7):439–48. doi:10.1007/ s10654-010-9482-0.    11. Asaka M, Kato M, Kudo M, Katagiri M, Nishikawa K, Koshiyama H, et al. Atrophic changes of gastric mucosa are caused by Helicobacter pylori infection rather than aging:studies in asymptomatic Japanese adults. Helicobacter 1996:1(1):52–6. doi:10.1111/j.1523-53781996.tb00008.x.   12. Aoki K, Kihaile PE, Wenyuan Z, Xianghang Z, Castro M, Disla M, et al. Comparison of prevalence of chronic atrophic gastritis in Japan, China, Tanzania, and the Dominican Republic. Ann Epidemiol 2005:15(8):598–606. doi:10.1016/j.annepidem.2004.11.002.   13. Fang JY, Liu WZ, Li ZS, Du YQ, Ji XL, Ge ZZ, et al. Consensus on standard management of choronic gastritis in China. Chinese J Gastroenterology 2013:18(1):24–36.
14. Moon J, Ahn G, Kim S, Park J, Kim D, Choi D, et al. Shanghanlun Jeonghae Seoul: Publication Haneui Munhwasa: 2010. p. 317–9.
15. Kook YB, Kim SC, Park SD, Park SK, Seo BI, Seo YB, et al. Formula Study Seoul: Publication Younglimsa: 2006. p. 162–4.
16. Naito T, Itoh H, Yasunaga F, Takeyama M. Hange-shashin-to raises levels of somatostatin, motilin, and gastrin in the plasma of healthy subjects. Biol Pharm Bull 2002:25(3):327–31. doi:10.1248/bpb.25.327.   17. Wang XN, Li X. Clinical Observation of Banxia Xiexin Decoction combined with Rebamipide in the Treatment of Chronic Atrophic Gastritis. J North Pharmacy 2019:16(2):77.
18. Liu J. Effect of Modified Banxia Xiexin Decoction in the Treatment of Chronic Atrophic Gastritis. J Practical Traditional Chinese Medicine 2019:35(7):837–8.
19. Li J, Rao L. Evaluation of Modified Banxia Xiexin Decoction Combined with Triple Therapy in the Treatment of Helicobacter Pylori-related Atrophic Gastritis. J Clinical Medical 2019:6(18):167–70.
20. Wang XM, Yan G, Liu C. Effects of Banxia Xiexin Decoction on Chronic Atrophic Gastritis of Spleen-stomach Damp-heat Type and Serum Inflammatory Index and Immune Function. World Chinese Medicine 2019:14(2):412–6.
21. Xu H. Clinical effect of Banxia Xiexin Decoction on chronic atrophic gastritis. Chinese Health Vision 2019:9:15.
22. Wang W. Observation of Clinical Effect of Modified Banxia Xiexin Decoction Combined with Triple Therapy on Helicobacter Pylori-related Atrophic Gastritis. Modern J Integrated Traditional Chinese and Western Medicine 2018:27(28):3153–5. doi:10.3969/j.issn.1008-8849.2018.28.023.
23. Wu T. Effect and safety of Banxia Xiexin Decoction combined with western medicine in the treatment of chronic atrophic gastritis. Chinese and Foreign Medical Research 2018:16(35):33–4. doi:10.14033/j.cnki.cfmr.2018.35.015.
24. Zhang S. Analysis of clinical effect of modified Banxia Xiexin decoction in the treatment of chronic atrophic gastritis. Chin J Mod Drug Appl 2018:12(4):73–4.
25. You H. Clinical application of Banxia Xiexin Decoction combined with western medicine anti-HP in the treatment of atrophic gastritis. World Latest Medicine Information 2018:18(96):135doi:10.19613/j.cnki.1671-3141.2018.96.102.
26. Yang C, Wang P. Observation of Clinical effect and safety of Modified Banxia Xiexin Decoction combined with triple therapy in the treatment of H. pylori-related atrophic gastritis. Our Health 2018:11:42.
27. Chen W. Clinical Observation of Banxia Xiexin Tang Combined with Triple Therapy for Chronic Atrophic Gastritis. J New Chinese Medicine 2018:50(6):93–5.
28. Yang Z. Clinical Observation of Banxia Xiexin Decoction in Treating Chronic Atrophic Gastritis. Healthmust-Readmagazine 2018:3:182.
29. Jiang G. Observation of clinical effect of Modified Banxia Xiexin Decoction on chronic atrophic gastritis. China Health Care &Nutrition 2018:28(1):144–5.
30. Zhu T. Analysis of the clinical effect of Pinellia Heart-Draining Decoction in the treatment of chronic atrophic gastritis. For all Health 2018:12(5):2–3.
31. Lu X. Clinical effect of Banxia Xiexin Decoction on chronic atrophic gastritis. Research of Integrated Traditional Chinese and Western Medicine 2017:9(6):295–6. doi:10.3969/j.issn.1674-4616.2017.06.006.
32. Cui Z. Clinical Observation of Modified Banxia Xiexin Decoction in the Treatment of Chronic Atrophic Gastritis. Nei Mongol J Traditional Chinese Medicine 2017:4:32doi:10.16040/j.cnki.cn15-1101.2017.04.032.
33. Xu G. Clinical Effect of Modified Banxia Xiexin Decoction on Chronic Atrophic Gastritis. China Prac Med 2017:12(5):143–5. doi:10.14163/j.cnki.11-5547/r.2017.05.072.
34. Fang J. Clinical effect observation of Banxia Xiexin decoction in treating chronic atrophic gastritis. Traditional Chinese medicine 2017:29:107–8. doi:10.19347/j.cnki.2096-1413.201729052.
35. Lee S. The roles of osteopontin on gastric and hepatic carcinogenesis in mouse model (Doctoral dissertation). Seoul National University 2017 Retrieved from Semantic Scholar database
36. Kim J. Atrophy and intestinal metaplasia of the stomach. Korean Society of Gastrointestinal Endoscopy 2013:50:29–31.
|
|













