효소처리를 이용한 마늘 추출물이 Lipopolysaccharide 유발 급성 장염 모델에 미치는 효과 및 기전 연구
Study of the Effect and Underlying Mechanism of Enzyme-Treated Garlic Extract on a Lipopolysaccharide-Induced Acute Colitis Model
Article information
Abstract
Objective:
This study aims to explore the pharmacological effects and mechanisms of enzyme (Viscozyme)-treated garlic extract (EG) in an animal model of acute enteritis induced by lipopolysaccharide (LPS).
Methods:
The experiment included four subgroups: normal, control, EG200 (treated with 200 mg/kg EG), and EG400 (treated with 400 mg/kg EG). Drug administration lasted 3 days, followed by the induction of acute enteritis in all groups (except normal) through the intraperitoneal administration of 20 mg/kg of LPS 1 h after the last oral dose. Autopsy was conducted 24 h later to collect serum and colon tissue. Serum was analyzed for reactive oxygen species (ROS) and C-reactive protein (CRP), while Western blotting was performed on the colon tissue.
Results:
After analyzing the ROS and CRP levels in serum, the EG treatment group exhibited a significant decrease compared with the control group. The EG treatment group exhibited a significant decrease in the activation of the mitogen-activated protein kinases (MAPKs)/nuclear factor-kappa B p65 (NF-κB) pathway compared with the control group. EG administration significantly regulated apoptosis-related factors, including B-cell lymphoma-2 (Bcl-2), Bcl-2-associated X, cysteine aspartyl-specific protease-3, and cytochrome C.
Conclusions:
EG treatment in mice with LPS-induced acute colitis reduced the ROS and CRP levels, suppressed the MAPKs/NF-κB pathway in the colon, and effectively alleviated acute enteritis by modulating apoptosis-related factors. Based on these findings, EG emerges as a promising candidate for the prevention and treatment of acute colitis, showing its potential therapeutic efficacy in this experimental model.
I. 서 론
염증성 장질환(Inflammatory bowel diseases)은 비정상적인 염증 반응이 소장이나 대장에 반복적으로 발생하는 질환으로 최근에는 선진국은 물론 개발도상국에서도 증가하고 있으며, 전 세계적으로 공중보건 문제로 많은 주목을 받고 있다1-3. 이러한 염증성 장질환은 지역과 인종에 따라 발생 빈도가 다르며, 북미와 북유럽 백인들에게 높게 나타나고, 상대적으로 아시아와 동유럽 국가에서는 낮은 발생 빈도를 보이지만, 최근에는 우리나라에서도 발생률이 증가하는 추세이다4. 염증성 장질환은 크게 궤양성 대장염(Ulcerative colitis)과 크론병(Crohn’s Disease)으로 나뉘며 위장관 전체 및 장점막에서 염증의 완화와 악화가 반복되어 대장암의 발병률을 상승시키는 특징을 가지고 있다5. 나타나는 증상으로는 복통, 설사, 혈변 및 고름 등이 있으며, 이러한 증상들이 반복적으로 일어나 환자의 신체적 및 정신적 건강에 심각한 영향을 미친다6. 지금까지 염증성 장질환의 치료는 항염증제, 면역억제제, steroid 및 corticosteroid 등의 약물을 사용하였지만 약 20~40%의 환자들은 치료에 실패하거나 장기간 복용으로 인하여 부작용이 발생하게 된다7,8. 이에 염증성 장 질환의 치료 대체제로 한약제제와 같이 부작용이 적으며 염증 치료에 효과적인 치료제 개발에 대한 연구가 증가하는 추세이다9.
마늘(Allium sativum L., Garlic)은 백합과의 부추속에 속하는 식물로 날것을 통으로 먹거나, 향신료로 전 세계적으로 식생활에 널리 사용되고 있으며, 한약재명은 대산(大蒜)이라고 하며, 비위(脾胃)를 튼튼하게 하고 정장(整腸) 작용을 한다고 알려져 있다10,11. 최근 연구결과에 따르면 마늘 추출물은 항산화12, 콜레스테롤 저하13, 혈압저하14 및 혈전생성 억제15 등과 같은 여러 생리활성을 지니고 있다는 연구들이 있다. 또한, 마늘 소재를 활용한 마늘 다당류 추출물16 및 마늘 오일17 등에서는 acetic acid 및 dextran sulfate sodium로 유도된 장염 동물 모델에서 항염증 효과로 인하여 장염을 개선시키는 것으로 나타났다. 이에 항염증 효능을 지닌 마늘 추출물에 효소처리를 통해 더욱 향상된 효과를 확인하고자 연구를 진행하였다.
효소 중 비스코자임(Viscozyme)은 β-glucanase, arabanase 및 polygalacturonase를 포함하는 탄수화물 분해 효소 중 하나이다18,19. 기존 연구들에 의하면 비스코자임을 처리시 약용식물 내 polyphenol 및 flavonoid 함량의 증가시키고 항산화 및 항염증 효과를 높인다고 알려져 있다20,21.
이에 본 연구에서는 효소(비스코자임)처리 마늘 추출물이 LPS로 유발된 급성 장염 동물모델에 미치는 약리학적 효과와 기전에 대하여 연구하였으며, reactive oxygen species, C-reactive protein, 단백질 발현, 조직 염색 및 관찰을 통해 유의한 결과를 얻었기에 이를 보고하는 바이다.
II. 재료 및 방법
1. 재 료
1) 시료추출
본 실험에서 사용한 마늘은 옹기한약국(대구,한국)에서 구입하였다. 마늘 100 g에 증류수 1 L를 넣고 열탕 추출기를 사용하여 2시간 열수 추출을 시행한 후, 추출물을 여과지로 여과해 주었다. 마늘 추출물과 효소(비스코자임)를 1:1로 혼합하여 37 °C에서 24시간 반응을 시켰다. 그 후, 혼합액을 121 °C에서 15분 멸균을 통해 효소 반응을 중단시킨 후, 원심분리기를 사용해 액상 부분을 분리하였으며, 이를 동결건조를 통해 완전 분말화 시켜주었다(Enzyme-treated garlic extract, EG). 분말화된 시료는 실험에 사용하기 직전까지 -80 °C에서 보관되었다.
2) 시 약
본 실험에서 사용된 aluminium chloride는 Alfa Aesar(Ward Hill, MA, USA)에서 구입하여 사용하였다. Gallic acid, lipopolysaccharide(LPS), quercetin, sodium carbonate, diethylene glycol 및 Folin- Ciocalteu’s phenol reagent는 Sigma Aldrich(St. Louis, MO, USA)에서 구입하여 사용하였다. 1차항체인 nuclear factor-kappa B p65(NF-κB), inhibitor of nuclear factor kappa B α(IĸBα), phosphorylation IĸBα(p-IκBα), cyclooxygenase-2(Cox-2), interleukin-1β (IL-1β), B-cell lymphoma-2(Bcl-2), Bcl-2-associated X (Bax), cysteine aspartyl-specific proteases-3(caspase-3), cytochrome C, GAPDH 및 Lamin B1은 Santa Cruz Biotechnology(Santa Cruz, CA, USA)로부터 구입하였으며, 2차 항체는 GeneTex, Inc.(Irvine, CA, USA)에서 구입하여 사용하였다. 단백질 정량을 위한 BCA protein assay kit는 Thermo Scientific(Rockford, IL, USA)에서 구입하였으며, Wako Pure Chemical Industries, Ltd.(Osaka, Japan)에서 protease inhibitor mixture, ethylenediaminetetraacetic acid(EDTA)를 구입하였으며, ECL western blotting detection reagents와 nitrocellulose membranes은 Amersham GE Healthcare (Little Chalfont, UK)에서 구입하여 사용하였다.
2. 방 법
1) Total polyphenol 및 flavonoid 함량
시료의 total polyphenol 함량을 분석하기 위해서 Folin Ciocalteu’s의 방법을 사용하였다22. 먼저 시료 100 μL와 10% Folin-ciocalteu’s phenol reagent 500 μL, 7.5% sodium carbonate 400 μL를 e-tube에 넣고 잘 혼합하여 빛을 차광한 상태로 30분간 반응시켜주었다. 그 후, microplate reader(Infinite M200, Tecan, Männedorf, ZH, Switzerland)를 이용하여 765 nm에서 흡광도를 측정하였다. Total polyphenol 함량은 표준물질로 사용된 gallic acid의 검량선에 시료의 흡광도를 대입하여 산출되었다(Gallic acid equivalents, GAE). 이를 3회 반복하여 산출된 값들의 평균값을 구하였다.
시료의 total flavonoid 함량을 분석하기 위해서 aluminum chloride 비색법을 사용하였다22. 먼저 시료 100 μL와 10% aluminium chloride solution 20 μL, 1M potassium acetate solution 20 μL 및 증류수 560 μL를 e-tube에 넣고 잘 혼합하여 빛을 차광한 상태로 30분간 반응시켜주었다. 그 후, microplate reader를 이용하여 415 nm에서 흡광도를 측정하였다. Total flavonoid 함량은 표준물질로 사용된 quercetin의 검량선에 시료의 흡광도를 대입하여 산출되었다(Quercetin equivalents, QE). 이를 3회 반복하여 산출된 값들의 평균값을 구하였다.
2) 급성 장염 실험 동물
실험을 위해 대한바이오링크(음성, 한국)에서 6주령의 ICR 수컷 마우스를 구입하여 충분한 물과 고형사료(나트륨 0.25% 이상, 조단백질 18% 이상, 칼륨 0.55% 이상, 조지방 5.0% 이상, 조섬유 5.0% 이하, 조회분 8.0% 이하, 칼슘 1.0% 이상, 인 0.85% 이상, 마그네슘 0.15% 이상, NIH-41, Zeigler Bros, Inc., Gardners, PA, USA)를 충분히 공급하며 일주일간 사육실 환경(습도 50±5%, 온도 22±2 °C, 명암주기 12시간)에 적응시킨 후 실험에 사용하였다. 본 동물실험은 윤리적, 과학적 타당성 검토 및 효율적인 관리를 위하여 대구한의대학교 동물실험윤리 위원회(Institutional Animal Care and Use Committee, IACUC)의 승인(승인번호 : DHU2023-003)을 얻어 실험을 시행하였으며 동물관리 규정을 준수하였다.
실험군은 정상군(Normal), 대조군(Control), EG 200 mg/kg로 경구 투여한 EG 200군, EG 400 mg/kg로 경구 투여한 EG 400군으로 각 군당 7마리씩 4개의 그룹으로 나누어 실험을 진행하였으며, 대조군의 경우 증류수를 경구 투여해주었다. EG의 경우 사용 직전에 증류수에 녹여서 사용하였다. 약물투여는 3일간 1회/1일 수행되었으며, 정상군을 제외한 대조군, EG200군, EG400군은 투여 3일째 경구 투여 1시간 후 20 mg/kg 용량의 LPS가 들어있는 주사기로 마우스의 복강 부분에 삽입한 다음 용액을 주입하여 급성 장염을 유발하였다. LPS 투여 24시간 후 isoflurane으로 흡입 마취 후 혈액과 맹장 아래부터 직장 윗부분까지의 대장 조직을 채취하였다. 혈액은 4 °C, 4000 rpm의 조건에서 10분간 원심분리하여 혈청을 분리하였으며, 혈청과 대장 조직은 실험에 사용하기 직전까지 -80 °C에 보관하였다.
3) 혈청 내 산화적 스트레스 마커
Ali의 방법을 사용해 혈청 내의 reactive oxygen species(ROS)를 측정하였다21. Black 96-well plate에 혈청 10 μL, 50 mM phosphate buffer 190 μL, 1.25 μM DcFDA 50 μL를 넣고 microplate reader로 ex 480 nm/em 535 nm에서 흡광도를 측정하였다. 측정된 흡광도는 정상군 대비(%)로 계산하여 ROS 수치를 나타내었다.
4) 혈청 내 C-reactive protein(CRP)
혈청 내 CRP를 Elabscience(TA, USA)의 Mouse CRP ELISA Kit를 사용하여 측정하였다. 96-well plate에 표준물질과 혈청 100 μL를 넣고 plate sealer로 덮어주고 1시간 30분 동안 37 °C에서 배양하였다. 그 후, 표준물질과 혈청을 제거하고 biotinylated detection Ab working solution을 각 well에 100 μL씩 추가하고 1시간 동안 37 °C에서 배양하였다. 1시간 후 well에 남아있는 용액을 제거하고 세척한 후 HRP conjugate working solution을 100 μL를 분주하고 37 °C에서 30분간 배양하였다. 그 후, 남아있는 용액을 제거하고 세척해주었으며, substrate reagent 90 μL넣고 plate sealer로 덮어주고 37 °C에서 빛을 차광하고 15분 동안 배양하였다. 마지막으로 각 well에 stop solution 50 μL를 넣고 microplate reader를 사용해 450 nm에서 흡광도를 측정하였다.
5) 대장 조직 Western blot
대장 조직에 1 mM DTT, 0.1 mM PMSF, 0.1 mM EDTA, 2 mM MgCl2, 10 mM HEPES(pH 7.8), 10 mM KCl, protease inhibitor로 구성된 buffer A를 넣고 tissue grinder(Bio Spec Product, USA)로 조직을 분쇄한 다음에 ice 위에서 30분간 정치시킨 후, 10% NP-40를 추가하고 4 °C, 12,000 rpm의 조건으로 2분간 원심분리하여 세포질을 함유하고 있는 상층액을 분리시켰다. 세포질이 함유된 상층액을 따고 남은 조직에 10% NP-40를 넣은 buffer A를 사용해 세척한 후 50 mM HEPES, 50 mM KCl(pH 7.8), 300 mM NaCl, 0.1 mM PMSF, 1% glycerol, 1 mM DTT, 0.1 mM EDTA로 구성된 buffer C를 첨가해 재부유시킨 다음에 10분 간격으로 vortex를 4회 시행하였다. 그리고 4 °C, 12,000 rpm의 조건으로 10분간 원심분리하여 핵을 함유하고 있는 상층액을 분리시켰다. 세포질과 핵 내 단백질 발현을 분석하기 위해 10 μg의 단백질을 10~12% SDS-polyacrylamide gel에 전기영동 시킨 후, 분리된 단백질을 nitrocellulose membrane으로 이동시켰다. 그리고 nitrocellulose membrane에 PBS-T로 1:1,000 희석된 1차 항체 처리 후 4 °C에서 하룻밤 동안 처리하였다. 그런 다음, PBS-T로 세척한 후 PBS-T로 1:3,000 희석된 2차 항체를 처리하고 실온에서 2시간 반응시킨 후 세척하였다. 그 후, nitrocellulose membrane에 ECL 용액을 처리하고 Sensi-Q2000 Chemidoc(Lugen Sci Co., Ltd., Gyeonggi-do, Korea)로 밴드를 촬영하였다. 촬영된 밴드를 ATTO Densitograph Software(ATTO Corporation, Tokyo, Japan)를 사용하여 단백질을 정량하여 수치화하였으며, 이를 정상군 수치에 대비하여 비교하였다(Fold of Normal).
6) 조직학적 관찰
대장 조직을 10% 중성 완충 포르말린에 고정한 다음 10% EDTA로 탈회하였다. 그 다음, 알코올을 이용해 탈수화 후 paraffin block을 제작하였다. 그 다음, microtome으로 조직을 4 μm의 두께로 박절하여 hematoxylin and eosin(H&E) 염색을 실시하였으며 광학현미경으로 병변의 유무를 관찰하였다
7) 통계분석
In vitro의 수치는 평균±표준오차로 나타내었으며, in vivo 수치는 평균±표준편차로 나타내었다. SPSS(Version 26.0, IBM, Armonk, NY, USA)를 사용하여 one-way analysis of variance(ANOVA) test를 사용한 후, least-significant differences(LSD) test로 사후검정을 실시하여 유의수준을 p<0.05, p<0.01, p<0.001에서 검증하였다.
III. 결 과
1. Total polyphenol과 flavonoid 함량 결과
효소 처리한 마늘 추출물 내 total polyphenol 함량을 측정한 결과, 119.2±0.2 mg(GAE)/g으로 측정되었으며, total flavonoid 함량 결과, 22.0±0.2 mg (QE)/g으로 측정되었다(Table 1).
2. 혈청 내 ROS 및 CRP 분석 결과
혈청 내 ROS 측정 결과, LPS 주입으로 인하여 증가한 ROS를 EG200군과 EG400군에서 억제시키는 경향이 나타났으며, 특히 EG200군의 경우 대조군 보다 10.60%(p<0.05) 유의적으로 억제시키는 것으로 나타났다(Fig. 1).
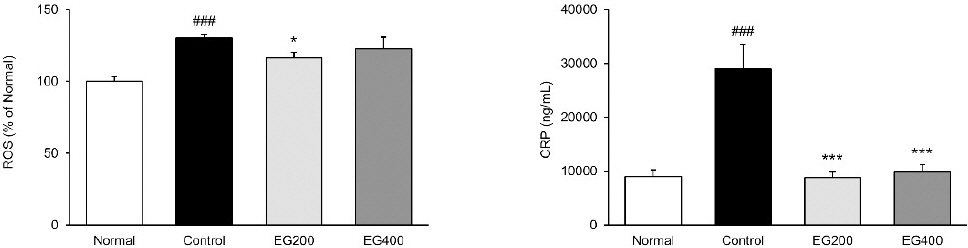
Effect of EG on ROS and CRP levels in serum of LPS-induced acute colitis mice.
Normal : Normal mice, Control : Distilled water-administered and LPS-induced acute colitis mice, EG200 : EG200 mg/kg-administered and LPS-induced acute colitis mice, EG400 : EG400 mg/kg-administered and LPS-induced acute colitis mice. All date are expressed mean±SD (n=7 mice per group). Significance: ##p<0.01, ###p<0.001 vs. Normal and *p<0.05, ***p<0.001 vs. Control. EG, Enzyme-treated garlic extract.
CRP 측정 결과, 대조군의 경우 정상군 수치보다 약 225.15%(p<0.001) 유의하게 증가시켰다. 반면에 투여군들은 대조군 수치보다 EG200군 69.76% (p<0.001), EG400군 65.76%(p<0.001) 유의하게 억제시킴으로써 혈청 내 CRP 수치를 정상군 수준까지 개선시켰다(Fig. 1).
3. 대장 조직 내 Mitogen-activated protein kinases (MAPKs) 발현
대장 조직 내에서 염증조절에 중요한 역할을 하는 MAPKs 경로인 p-ERK와 p-JNK의 발현을 확인하였다(Fig. 2). p-ERK의 경우, 정상군 1.00±0.05 대비 대조군 1.38±0.08에서 유의하게 증가하였으며(p<0.001), EG200군 1.08±0.07(p<0.01), EG400군 1.14 ±0.06(p<0.05)으로 모든 투여군에서 대조군 대비 유의하게 억제시키는 것을 확인할 수 있었다. p-JNK의 발현을 측정한 결과, 정상군 1.00±0.06 대비 대조군은 1.39±0.06(p<0.01)으로 LPS 유발로 인하여 유의하게 증가하였으며, EG200군 및 EG400군은 각각 1.10±0.08(p<0.01), 1.21±0.10으로 EG200군에서 유의하게 억제하는 것을 확인할 수 있었다.
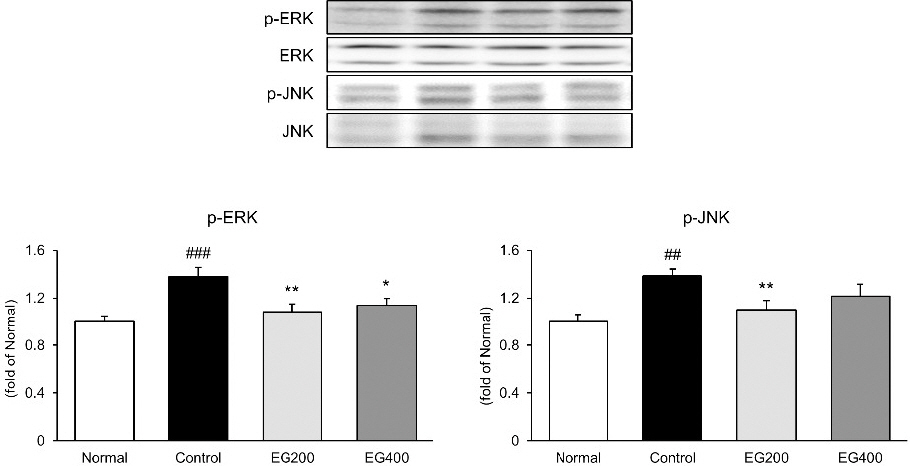
Effect of EG on MAPKs activation in colon of LPS-induced acute colitis mice.
The expression of p-ERK and p-JNK in the colonic tissues was measured by western blot analysis.
Normal : Normal mice, Control : Distilled water-administered and LPS-induced acute colitis mice, EG200 : EG200 mg/kg-administered and LPS-induced acute colitis mice, EG400 : EG400 mg/kg-administered and LPS-induced acute colitis mice. All date are expressed mean±SD (n=7 mice per group). Significance: ##p<0.01, ###p<0.001 vs. Normal and *p<0.05, **p<0.01 vs. Control.
4. 대장 조직 내 염증 관련 인자 발현
대장 조직 내에서 NF-κB, p-IκBα, Cox-2 및 IL-1β의 발현을 측정하였다(Fig. 3). 그 결과, LPS는 대장 조직 내 NF-κB, p-IκκBα, Cox-2 및 IL-1β의 발현을 유의하게 증가시켰다. 반면에 투여군들의 발현은 NF-κB의 경우, EG200군 1.40±0.15(p<0.05), EG400군 1.71±0.28으로 대조군 2.19±0.23과 비교하여 억제시키는 것을 확인하였으며, p-IκBα의 경우, EG200군 1.44±0.17(p<0.01), EG400군 1.52±0.35(p<0.05)으로 대조군 2.64±0.33에 비하여 유의하게 억제시키는 것으로 나타났다. 또한 Cox-2와 IL-1β의 발현은 EG200군 0.80±0.08(p<0.001), 1.11±0.12(p<0.01), EG400군 1.00±0.05(p<0.05), 1.26±0.20(p<0.05)으로 대조군 수치와 비교하여 유의적으로 억제시키는 것으로 나타났다.
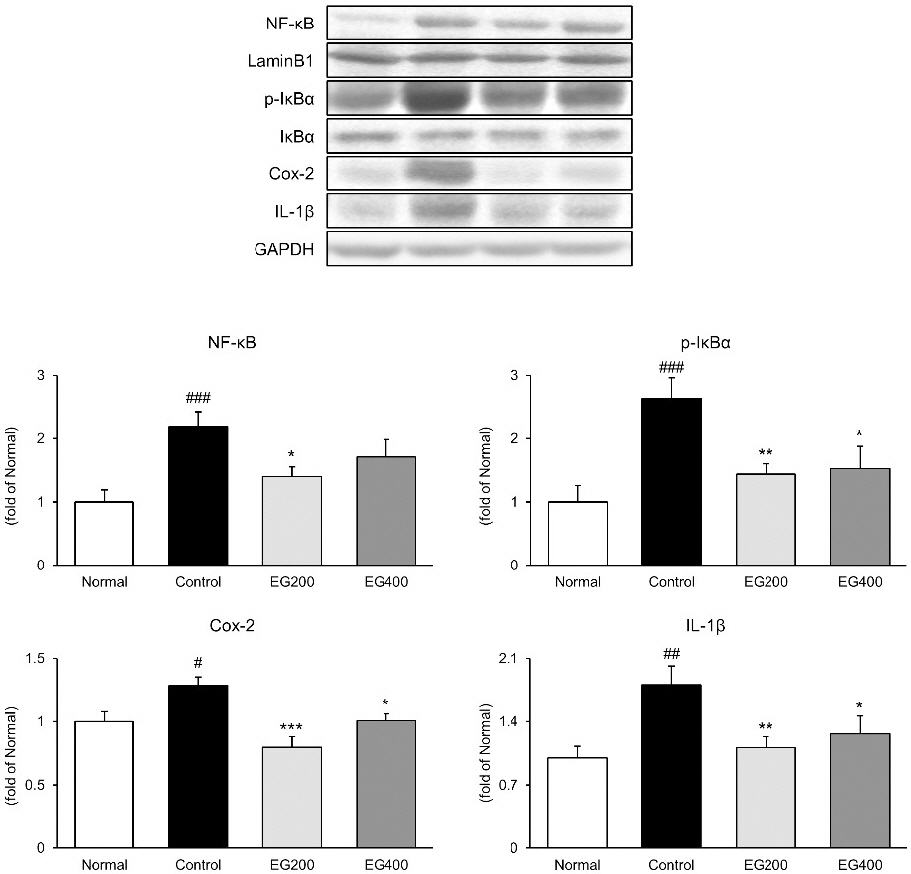
Effect of EG on NF-κB pathway activation in colon of LPS-induced acute colitis mice.
The expression of NF-κB, p-IκBα, Cox-2, and IL-1β in the colonic tissues was measured by western blot analysis.
Normal : Normal mice, Control : Distilled water-administered and LPS-induced acute colitis mice, EG200 : EG200 mg/kg-administered and LPS-induced acute colitis mice, EG400 : EG400 mg/kg-administered and LPS-induced acute colitis mice. All date are expressed mean±SD (n=7 mice per group). Significance: #p<0.05, ##p<0.01, ###p<0.001 vs. Normal and *p<0.05, **p<0.01, ***p<0.001 vs. Control.
5. 대장 조직 내 세포사멸 관련 인자 발현
대장 조직 내에서 세포사멸 관련 인자인 Bax, Bcl-2, cytochrome C 및 Caspase-3의 발현을 측정하였다(Fig. 4). 그 결과, LPS의 주입은 대장 조직 내 Bax, cytochrome C 및 Caspase-3 발현을 유의하게 증가시켰다. 반면에 Bcl-2의 발현은 정상군 1.00±0.08에 비하여 대조군 0.73±0.06(p<0.05)으로 유의하게 억제시키는 것을 알 수 있다. 투여군들의 발현은 Bax의 경우, EG200군 1.07±0.06(p<0.01), EG400군 1.22±0.06으로 대조군 1.39±0.05와 비교하여 발현이 억제되는 것을 확인하였으며, Bcl-2의 경우, EG200군 0.83±0.11, EG400군 0.86±0.06으로 대조군에 비하여 수치가 증가하지만 유의한 결과는 나타나지 않았다. 그리고 cytochrome C와 Caspase-3의 발현을 EG200군 1.22±0.06(p<0.01), 1.04±0.16(p<0.01), EG400군 1.30±0.10(p<0.05), 1.10±0.23(p<0.05)으로 대조군 수치와 비교하여 유의적으로 억제시키는 것으로 나타났다.
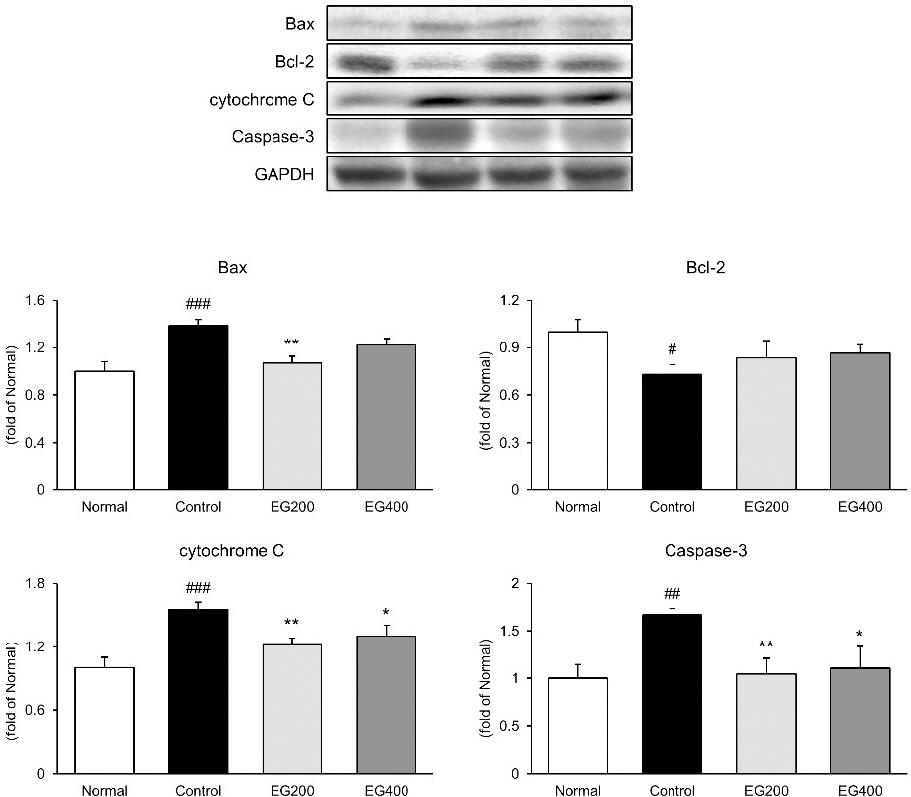
Effect of EG on apoptosis factors in colon of LPS-induced acute colitis mice.
The expression of Bax, Bcl-2, cytochrome C, and Caspase-3 in the colonic tissues was measured by western blot analysis.
Normal : Normal mice, Control : Distilled water-administered and LPS-induced acute colitis mice, EG200 : EG200 mg/kg-administered and LPS-induced acute colitis mice, EG400 : EG400 mg/kg-administered and LPS-induced acute colitis mice. All date are expressed mean±SD (n=7 mice per group). Significance: #p<0.05, ##p<0.01, ###p<0.001 vs. Normal and *p<0.05, **p<0.01, ***p<0.001 vs. Control.
6. 조직학적 관찰
점막 염증을 알아보기 위해 H&E 염색을 수행하였다(Fig. 5). 그 결과, 정상군의 대장 조직과 비교하여 대조군의 대장 조직에서 대장 근육의 소실과 과도한 염증 세포 침윤을 포함한 염증성 병변이 관찰되었다. 반면에 EG200군과 EG400군 모두에서 감소하였다.
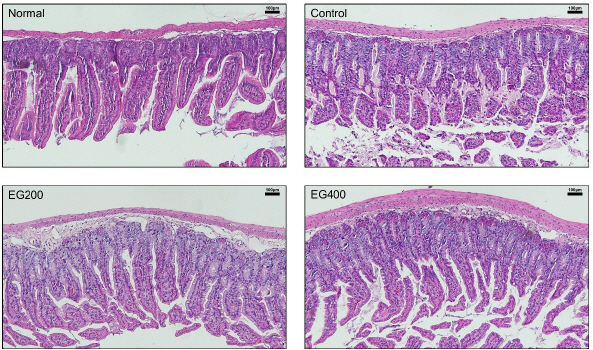
Effect of EG on colon histomorphology in LPS-induced acute colitis mice.
Magnification 100x, scale bar 100 μm.
Normal : Normal mice, Control : Distilled water-administered and LPS-induced acute colitis mice, EG200 : EG200 mg/kg-administered and LPS-induced acute colitis mice, EG400 : EG400 mg/kg-administered and LPS-induced acute colitis mice
IV. 고 찰
염증성 장질환(Inflammatory bowel diseases)은 위장관에 영향을 미치는 염증성 질환의 한 종류로, 그 중 급성 장염은 과식, 날것의 음식 또는 차가운 음식 섭취, 바이러스 감염 등에 의하여 나타나며, 주요 증상으로는 체중감소, 설사, 혈변, 복통, 발열 등이 포함될 수 있으며, 이러한 증상들은 염증성 장질환 환자에게서 주로 나타난다24-26. 본 연구에서는 효소(비스코자임)로 처리된 마늘 추출물(EG, Enzyme-treated garlic extract)이 lipopolysaccharide (LPS) 유발 급성 장염 동물모델에 미치는 영향을 조사하였다.
대부분의 약용식물들에는 항산화, 항균, 항염증 등의 활성을 지닌 식물의 2차 대사산물인 polyphenol과 flavonoid를 함유되어 있다27. 여러 질병의 원인들은 다양하지만 주요한 요인 중 하나는 몸 내에서 과도한 산화적 스트레스로 인한 세포 손상이 있다. Polyphenol과 flavonoid는 이러한 산화적 스트레스를 감소시키는 역할을 한다고 알려져 있다28. 이에 EG 내 total polyphenol과 flavonoid 함량을 측정한 결과, 119.2±0.2 mg(GAE)/g의 polyphenol과 22.0±0.2 mg(QE)/g의 flavonoid를 지니고 있는 것으로 나타났다. 기존 연구에서 보고된 산마늘 잎 추출물의 polyphenol 8.77 mg/g, flavonoid 12.83 mg/g과 마늘종 추출물 및 마늘 추출물의 polyphenol 29.2 mg(GAE)/100 g 및 33.7 mg(GAE)/100 g에 비하여 EG가 비교적 높은 함량을 가지고 있어, 이는 천연 항산화제로서 높은 이용 가치를 갖을 것으로 판단된다29,30. 이를 바탕으로 동물실험 후 혈청 내 산화적 스트레스 마커인 reactive oxygen species (ROS)를 측정한 결과, EG 투여로 인해 혈청 내 ROS를 유의하게 억제시키는 것을 확인할 수 있었다.
C-reactive protein(CRP)는 일반적으로 염증성 질환 모델의 혈청에서 많이 분석하는 바이오마커로 염증 기간의 CRP 수치는 건강한 사람의 100배로 증가할 수 있다32. CRP는 염증성 장질환의 특정한 지표는 아니지만, 적혈구 침강 속도, 빈혈, 저알부민혈증 등과 같은 염증 바이오마커와 깊게 관련되어 있다33. 이에 혈청 내 CRP를 측정한 결과, 증가된 CRP 수치를 정상군 수치의 EG200군 약 0.98배, EG400군 약 1.11배로 정상군 수준까지 낮추어 LPS로 인한 장염을 개선시키는 것으로 나타났다.
Mitogen-activated protein kinases(MAPKs)는 전형적인 염증 관련 신호 단백질로 c- JNK, ERK 1/2 및 p38가 있다34. 본 연구에서는 LPS로 유발된 급성 장염 모델의 대장 조직 내 JNK와 ERK의 발현을 Western blot으로 분석하였다. 그 결과, EG 투여가 LPS로 인하여 증가되는 두 인자의 인산화를 억제하는 것을 확인할 수 있었다. 특히, EG200 군에서는 유의적인 수준으로 개선되는 것으로 나타났다. 염증성 전사인자로 알려진 NF-κB는 세포질과 inhibitor IκB에서 비활성화 상태로 있다가 과도한 ROS 및 여러 가지 염증성 사이토카인에 자극을 받아 활성화되어 인산화를 통해 분해 후 핵으로 이동하여 염증관련 유전자들을 자극하여 염증을 더욱 심화시킨다35. 이에 대장 조직 내 NF-κB 경로를 분석한 결과, EG 투여가 LPS로 인하여 증가되는 NF-κB 경로를 억제하는 것을 확인하였고, 특히 Cox-2의 발현은 정상군 수치의 EG200군 약 0.80배, EG400군 약 1.00배로 정상군 수준까지 억제하는 것으로 나타났다. 이러한 결과는 EG가 염증 관련 신호 경로를 조절하여 장염으로 인한 염증 반응을 억제하는데 기여할 수 있음을 시사한다.
또한, 과도한 ROS로 인하여 발병된 염증성 장질환은 장 상피세포의 손실과 함께 세포사멸을 유도하게 된다36. 이에 대장 조직 내 세포사멸 관련 인자들의 발현을 분석한 결과, EG의 투여는 LPS로 인하여 증가될 Bax, cytochrome C 및 Caspase-3의 발현을 억제시키는 것으로 나타났으며, 특히 EG200군은 Bax, cytochrome C 및 Caspase-3의 발현을 대조군 대비 각각 22.78%(p<0.01), 21.82%(p<0.01), 37.49%(p<0.01) 유의하게 개선시키는 것을 확인할 수 있었다. 반면에 세포사멸 관련 인자 중에서 세포의 자가파괴를 억제하여 세포 생존 및 성장에 도움을 주는 Bcl-2의 경우37, EG의 투여로 발현이 증가하는 것으로 나타났다. 이러한 결과는 EG가 염증성 상태에서 발생하는 세포사멸을 억제하고, 세포의 생존 및 성장을 촉진에 도움을 주어 LPS로 인한 장염증을 개선시키는 것으로 판단된다.
이상의 결과들을 종합해보면 효소(비스코자임)로 처리된 마늘 추출물인 EG의 투여는 LPS로 인하여 유발된 급성 장염 동물모델에서 산화적 스트레스 및 염증을 개선시키는 것으로 평가되었다.
V. 결 론
본 연구는 LPS로 유발한 급성 장염 동물모델에서 효소(비스코자임)로 처리된 마늘 추출물(EG)의 효과를 분석하였고, 아래와 같은 결과를 얻었다.
Total polyphenol 및 flavonoid 함량을 분석한 결과, 각각 19.2±0.2 mg(GAE)/g, 22.0±0.2 mg(QE)/g를 함유하고 있는 것으로 나타났다.
혈청 내 산화적 스트레스 바이오마커 ROS와 염증 바이오마커 CRP을 분석한 결과, 대조군에 비해 EG 투여군이 유의성 있게 억제시켰다.
대장조직 내에서 LPS 주입으로 염증과 관련된 MAPK/NF-kB 경로의 활성화를 EG가 유의하게 억제하였다.
또한, EG의 투여는 Bax, Bcl-2, cytochrome C 및 Caspase-3와 같은 세포사멸 관련 인자들을 유의적으로 조절시켰다.
따라서 LPS로 유발된 급성 장염 동물모델에서 EG의 투여는 혈청 내 산화적 스트레스 및 염증 관련 바이오마커와 MAPK/NF-kB 경로를 유의적으로 개선시켰으며, 또한, 세포사멸 관련 인자들을 유의적으로 조절하여 급성 장염을 억제하였다. 이에 EG가 급성 장염을 예방 및 치료하기 위한 후보 소재로 판단되어 진다.
감사의 글
본 연구는 중소벤처기업부의 기술개발사업[S3281126]과 정부 (과학기술정보통신부)의 재원으로 한국연구재단의 지원을 받아 수행되었습니다(No. 2018R1A5A2025272).
