염증성 장 질환에서 전침을 중심으로 한 미주신경자극에 대한 고찰
Vagus Nerve Stimulation Through Electro-acupuncture for Inflammatory Bowel Disease
Article information
Abstract
ABSTRACT
Inflammatory bowel disease (IBD) is defined as a chronic inflammatory-mediated disease that causes ulceration and inflammation in the gastrointestinal tract. Among most patients, the course of chronic inflammation repeatedly shows intermittent exacerbations and alternating remissions. However, despite the various therapeutic options to relieve symptoms, such as corticosteroids, TNF-α inhibitors, and antibiotic drugs, there is no known cure for IBD. Nonetheless, previous research has revealed that the autonomic nervous system is involved in the pathophysiology of IBD. In this study, we reviewed clinical trials confirming the therapeutic effect of vagus nerve stimulation (VNS) on IBD in vivo. We searched in vivo and human studies on Pubmed using keywords combined with “vagus nerve stimulation”, “VNS”, and “inflammatory bowel disease”. All studies included in this review reported that direct VNS is effective in relieving symptoms of IBD and has no severe adverse effects. The most frequently stimulated site was the unilateral cervical vagus nerve area, and parameters for stimulation were set as 5-20 Hz. Based on the results, we aim to summarize the evidence for the efficacy of VNS on IBD and suggest the possibility of auricular electroacupuncture treatment as a therapeutic option for IBD.
I. 서 론
염증성 장 질환은 만성적으로 위장관에 염증과 궤양을 유발하는 면역 매개 질환으로, 대표적으로궤양성 대장염과 크론병이 있으며 장관 내에서 비정상적인 만성 염증이 악화와 완화를 반복하는 특징을 가진다. 이는 주로 선진국에서 높은 유병률을 보이며 최근 아시아에서의 발병률도 빠르게 증가하고 있다1. 염증성 장 질환의 발생 기전은 명확하지 않지만, 유전적 영향, 환경적 요인, 비정상적 면역 반응, 장내 미생물, 식이 등이 연관이 있는 것으로 밝혀져 있다. 부신피질 스테로이드, 항생제, 생물학적 제제 등의 다양한 치료법이 시행되고 있으나, 아직까지 장기적이고 완전한 해결법은 밝혀져 있지 않다2.
염증성 장 질환 환자에서는 장 기능의 항상성이 실조되며 자율신경계의 균형에 변화가 나타나는데, 신경절과 신경세포체의 구조적 및 형태적 변화, 내장벽에 분포된 신경계 시냅스에서의 신경전달물질 또는 그 수용체의 발현 변화가 발생할 수 있다3. 염증성 장 질환의 병태 생리에 자율신경이 관여한다는 것을 밝힌 최근의 연구들에 의하면 염증성 장 질환 환자에서는 부교감신경의 활성이 저하되며, 이에 따라 미주신경을 통한 항염증 작용이 억제되어 장 항상성의 손상과 만성적인 내장 염증 및 통증이 유발된다4-6. 이는 곧 염증성 장 질환의 병리에서 자율신경의 변화가 내장 기능의 생리와 밀접한 연관을 맺고 있음을 방증하며, 질환의 발생 기전에 중요한 역할을 할 가능성이 있음을 시사한다.
한편, 부교감신경 중 미주신경에 대한 주기적인 전기 자극은 아세틸콜린의 분비를 증가시키는데, 이는 면역계에 영향을 끼쳐 종양괴사인자α(TNFα), 인터류킨1(IL-1) 등과 같은 염증성 사이토카인 생산이 억제되도록 함으로써 염증을 완화하는 효과를 가진다7. 이러한 원리에 착안하여 미주신경 자극술이 염증성 질환의 치료법 중의 하나로 개발되고 있으며, 연구를 통해 미주신경 자극이 염증성 장 질환 증상의 호전에 효과가 있다는 근거가 밝혀지고 있다4. 미주신경의 자극은 직접적 자극 또는 경피적 외이 미주신경 자극의 방식으로 이루어질 수 있는데, 임상 현장에서의 활용은 대부분 침습적인 형태로 신경 자극기를 체내에 삽입하는 방식으로 이루어지고 있다8-10. 이는 감염을 비롯하여 쉰 목소리를 유발하는 등의 부작용이 있고, 배터리의 주기적 교체를 위하여 피부 절개와 봉합을 실시해야 하는 불편함을 안고 있다.
본 논문은 미주신경자극의 염증성 장 질환에 대한 효과를 살펴보기 위하여 관련 연구 논문들을 살펴보는 데에 초점을 두었다. 그리고 더 나아가 비교적 최근 개발된 미주신경자극 방법인 이(耳)-미주신경 자극술(transauricular vagus nerve stimulation, taVNS)이 귀의 미주신경 분포 구역에 전기적 자극을 가하는 것이라는 점에 착안하여, 염증성 장 질환에 대하여 미주신경 자극술을 시행하고 효과를 확인한 연구를 검토하고 나아가 한의학적 치료로서 이(耳)-전침 치료를 통하여 이러한 기술과 원리를 활용할 수 있는 가능성에 대하여 고찰하고자 한다.
II. 이론적 배경
1. 미주신경성 항염증 기전
미주신경은 뇌간에서 분지하여 얼굴 및 흉복부에 걸쳐서 분포하는 뇌신경의 한 종류이다. 이는 부교감 신경섬유를 포함하며, 심장, 폐, 소화관 등의 운동성 조절에 관여한다. 한편, 구심성 감각 신경 섬유는 신체에서 일어나는 변화에 대한 감각 정보를 뇌로 전달하는 기능을 수행한다. 가령, 음식물에 의한 위의 기계적 팽창 정도나 화학 물질 정보는 미주신경에 의해 뇌로 전달된다11.
인체의 소화기관은 항상 음식을 비롯한 항원 및 잠재적 병원체, 그리고 장내 미생물총과 맞닿아 있으므로 염증 반응에 취약하다. 감염성 독소를 비롯한 유해 자극에 대한 반응으로 소화기관에서는 대식세포 등에서 분비되는 대표적인 사이토카인인 종양괴사인자에 의한 염증이 유발되는데, 염증성 장 질환 환자의 장 점막과 장벽에서 이러한 염증이 증가한다12. 이로 인한 염증 반응은 장 점막과 상피 벽 장벽의 붕괴를 초래하고, 결과적으로 부종, 궤양, 조직 파괴, 육아종이 생성되게 한다. 염증성 장 질환에서는 이와 같은 과도한 염증 반응이 핵심적인 병리 기전으로 작용하기 때문에 이를 완화하기 위해서는 염증성 사이토카인을 억제하는 것이 필요하다. 다양한 경로로 염증 반응을 억제할 수 있지만, 그 중 미주신경을 통한 항염증 반응에는 크게 두 가지가 있다.
먼저, 말초의 염증성 사이토카인 신호에 대응하여 미주신경은 뇌실결핵(paraventricular nucleus)의 신경세포로 신호를 전달하는데, 이는 코르티코트로핀분비호르몬(corticotrophin releasing hormone, CRH)이 생성되어 뇌하수체 문맥계로 분비되게 한다13,14. CRH가 뇌하수체 전엽을 자극하면 부신피질 자극 호르몬(adrenocorticotropin hormone, ACTH)이 분비되는데, 이는 다시 부신 피질에서 스트레스 호르몬으로 잘 알려져 있는 코티솔의 생성을 촉진한다. 이는 심근 수축력을 높이고 혈관에서 노르아드레날린의 작용을 민감하게 만들어 스트레스에 적응하게 할 뿐만 아니라 강력한 항염 작용을 나타낸다. 즉, 미주신경의 구심성 섬유는 시상하부-뇌하수체-부신 축에서 신경면역학적인 역할을 담당한다15.
또한, 미주신경은 아세틸콜린의 신호를 전달하여 항염증 반사를 일으킨다는 것이 알려져 있다. 장에서의 면역 반응으로 분비되는 전구 염증성 사이토카인은 미주신경성 수용체 신호를 활성화하고, 이는 미주신경의 배측 운동핵으로부터의 원심성 섬유를 자극한다. 이때 원심성 섬유는 아세틸콜린을 분비하고, 이는 대식세포를 비롯한 면역 세포에 발현된 수용체에 부착되어 면역학적 연계 반응을 유발한다. 면역세포의 세포막에 존재하는 니코틴성 수용체의 α7 소단위는 아세틸콜린의 신호를 받아 면역학적 연계 작용을 일으킨다. 먼저 아세틸콜린이 니코틴성 수용체에 부착되면 아세틸콜린이 농도-의존적 전사 후 기전을 통해 종양괴사인자의 생성을 억제한다. 또한 종양괴사인자와는 별개로 아세틸콜린은 내독소-유발성 전구 염증성 단백질 계열인 인터류킨-1, 인터류킨-6, 인터류킨-18 등의 생성을 억제한다. 이는 염증성 단백질의 발현은 억제하면서도, 내독소에 반응하여 대식세포가 분비하는 항염증성 사이토카인인 인터류킨-10의 발현은 억제하지 않음으로써 항염증 작용을 한다. 즉, 미주신경을 매개로 구심성 섬유와 원심성 섬유가 전구 염증성 사이토카인에 반응하여 항염증 반응을 유발하는 것이다. 정리하면 미주신경의 구심성 감각 섬유와 원심성 운동 섬유가 염증 반응에 대항하여 하나의 신경 회로를 이루는데, 이를 콜린성 항염증 반사라고 한다7.
2. 직접적 미주신경 자극술
신경조절술이란 전기적, 화학적 자극 등으로 특정한 신경계를 목표로 하여 신경 활성을 인위적으로 조절하는 것이다16. 이를 통해 신경 활성을 변화시키거나 정상화하여, 신경 활성의 이상으로 인한 여러 증상을 교정하고 완화할 수 있다.
직접적 미주신경 자극술은 신경조절술의 일환으로 미주신경 활성 이상의 정상화를 목표로 한다. 직접적 미주신경 자극술은 체내에 삽입된 장치를 통해 미주신경에 전기적인 자극을 가하여 뇌 기능에 영향을 줌으로써 치료 효과를 기대하는 방법이다. 미주신경 자극기는 배터리가 내장된 전기신호 발생기, 전선, 프로그램 막대, 소프트웨어가 설치된 개인용 디지털 단말기나 컴퓨터와 같은 조절장치, 휴대용 자석 등으로 구성되어 있으며 피부를 절개하고 장치를 좌측 쇄골 아래 가슴 부위에 거치시킨 후 전기신호 발생기와 목 부위의 미주신경을 전선으로 연결하는 시술을 통해 체내에 삽입된다17.
염증성 장 질환 환자에서 부교감신경 기능이 저하되어 있다고 밝힌 연구 결과에 따르면 미주신경 에 직접적인 자극을 가함으로써 염증성 장 질환 증상의 호전을 기대할 수 있다18. 미주신경에 전기 자극을 가하면 원심성 경로를 통하여 말초 기관에 직접적인 신경 신호가 전달될 뿐만 아니라 감각을 뇌로 전달하는 구심성 경로를 거쳐 뇌를 경유하는 간접적인 효과를 낸다. 고립핵으로 전달된 신호는 이후 노르아드레날린을 분비하는 청반핵과 세로토닌을 분비하는 솔기핵을 통해 다양한 뇌 부위로 여러 단계의 시냅스 경로를 거치며, 하향적인 신호 전달을 매개한다19. 이렇게 매개된 신호는 상술한 경로를 통해 항염증 효과를 내고, 이에 따라 염증성 장 질환을 치료할 가능성이 있는 것이다.
3. 경피적 이(耳) 미주신경 자극술
비침습적 미주신경 자극은 미주신경이 지나가는 경로에 대한 경피적 전기 자극, 혹은 미주신경이 지배하는 피부 분절 즉 귀에 대한 자극을 통해 비침습적으로 미주신경을 자극하는 것을 일컫는다. 비침습적 미주신경 자극으로서 경피적 이(耳) 미주신경 자극술은 직접적 미주신경 자극과는 달리 체내 삽입되는 장치가 없어 간편한 기법으로 알려져 있다. 또한, 직접적 미주신경 자극이 갖는 부작용이 없고 비교적 안전하게 미주신경을 효과적으로 자극할 수 있는 방법으로서, 간접적인 방식으로 신경계의 활성 변화를 유발한다20.
비침습적 미주신경 자극술 중 경피적 이(耳) 미주신경 자극술은 미주신경 분포도가 높은 이갑개정의 표피에 금속 전극 또는 미세침을 부착하여 전기 자극을 가하는 것이다. 미주신경은 귀의 감각 신경을 뇌에 전달할 뿐만 아니라 소화기관 등의 말초 기관을 지배하므로 귀의 자극으로 말미암아 말초 기관의 변화를 유발할 수 있다. 귀에 전기 자극을 가하면 귀를 따라 분포한 미주신경의 구심성 섬유를 통해 미주신경핵으로 신호가 전달되고, 이렇게 전달된 신호는 미주신경의 배측 운동핵을 통해 내장 활성을 직접 조율하거나, 혹은 고립핵으로부터 청반핵, 솔기핵을 거쳐 뇌의 활성을 통해 치료 효과를 내도록 한다21,22.
III. 연구 대상 및 방법
본 문헌 고찰은 염증성 장 질환에 대해 미주신경자극술을 시행한 실험 논문을 대상으로 하였다. 두 명의 저자가 독립적으로 논문 검색 및 자료 추출을 수행하였으며, 논문 검색은 전자 데이터베이스로 PubMed를 이용하였다. 검색식은 ‘vagus nerve stimulation’, ‘inflammatory bowel disease’ 등의 조합으로 구성하였다(Table 1). 검색은 2023년 05월 05일에 수행되었고, 이전까지 출판된 모든 논문을 대상으로 하였다. 비실험논문, 실험논문 프로토콜, 리뷰 논문, 종설은 제외하였다.
동물 실험에 있어 종에 제한을 두지 않았고, 염증성 장 질환 동물 모델에 대하여 자연발생 모델, 약물을 이용한 유도 모델, 유전적 조작 모델 등 염증성 장 질환을 유발하는 모든 모델을 포함하였으며 미주신경 자극을 시행하지 않은 경우, 염증성 장 질환 모델에 해당하지 않는 경우는 제외하였다. 임상 시험은 연구의 설계와 상관없이 염증성 장 질환 환자를 대상으로 미주신경자극술을 시행하여 효과를 측정한 경우를 모두 포함하였으며, 동물 실험과 마찬가지로 염증성 장 질환 환자를 대상으로 하지 않은 경우와 미주신경자극술을 시행하지 않은 경우는 제외하였다.
조건에 부합하는 연구를 선별하기 위하여 검색된 논문을 제목과 초록 수준에서 일차적으로 검토하였으며, 이차적으로 논문 전문의 세밀한 검토를 통하여 논문을 추렸고, 논문으로부터 추출된 데이터는 제1저자, 출판연도, 연구 대상, 치료 중재, 대조 중재, 자극한 미주신경 부위, 자극 파라미터, 치료 기간, 결과로 정리하여 분석하였다.
Ⅳ. 결 과
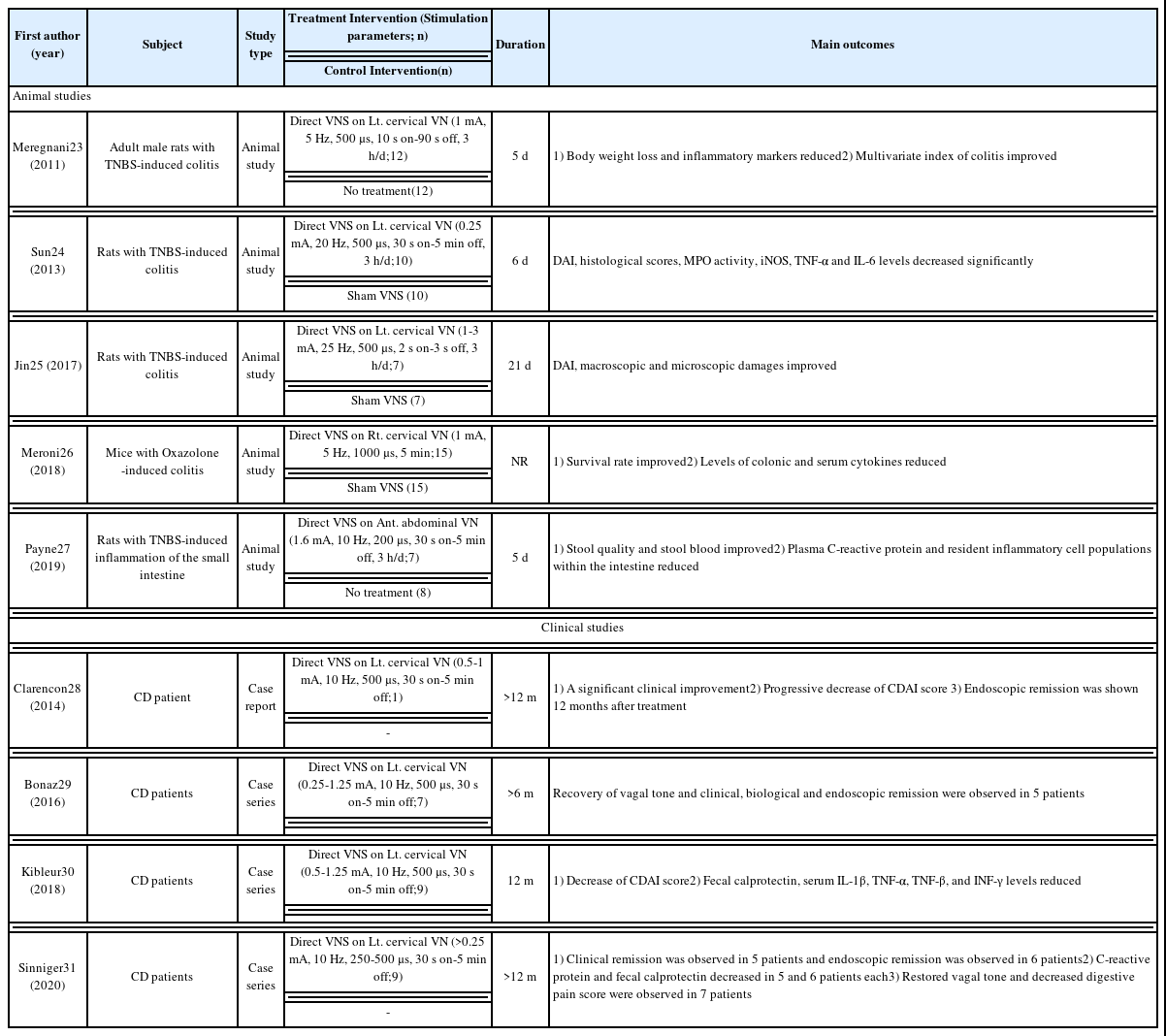
검색 결과 23건의 연구가 검색되었고, 이 중 총 9건의 연구가 분석 대상으로 선정되었다. 선정된 논문에서 분석된 데이터를 다음의 표로 정리하였다(Table 2).
모든 연구는 미주신경을 직접 자극하는 직접적 미주신경 자극술을 실험 중재로 사용하였고, 인간 대상의 연구는 모두 증례를 통해 연구가 진행되었다.
염증성 장 질환에 대한 동물 실험 연구는 주로 2,4,6-trinitrobenzene sulfonic acid(TNBS)에 의한 대장염 설치류 모델을 이용한 무작위 대조군 연구를 통해 이루어졌다. 2건의 연구를 제외하면 대조군은 모두 거짓 미주신경 자극을 활용하였다. 동물연구에서 직접적 미주신경성 자극술은 다양한 전기적 파라미터의 사용을 통해 이루어졌는데, 전류는 0.25~3 mA, 진동수는 5~25 Hz, 펄스 너비는 200~1000 μs, 자극 시간은 2~30 s-ON, 3 s~5 min-OFF의 범위 내에서 설정되었다. 연구 기간은 5~21일 내에서 이루어졌다. 이들 연구에서 대장의 염증성 병변에 대해 직접적인 미주신경 자극은 염증 반응을 호전시키는 데에 효과가 있는 것으로 보고되었다. 이와 같은 효과는 주로 질병 활성 지표(disease activity index, DAI), 사이토카인과 염증성 단백질 등의 분자생물학적 지표, 조직학적 관찰상에서 나타났다.
또한 인간 대상의 연구들을 통해서도 직접적 미주신경 자극의 염증성 장 질환의 치료 효과가 밝혀졌는데, 연구들은 모두 크론병 환자를 대상으로 하였다. 전류는 0.25~1.25 mA, 진동수는 10 Hz, 펄스 너비는 250~500 μs, 자극시간은 30 s-ON, 5 min-OFF의 범위 내에서 설정되었다. 임상 연구에서도 마찬가지로 염증성 장 질환에 대하여 유의미한 호전을 관찰할 수 있었는데, 주관적으로 느끼는 증상이 개선되었으며 크론병 활성 지표(Crohn’s Disease Activity Index, CDAI)와 내시경적 소견, 염증성 사이토카인과 C 반응 단백 등의 염증 물질 수치 등에서 호전을 보였고, 미주신경 활성 또한 정상적으로 회복되기도 하였다. 비록 증례 보고들이 모두 크론병 환자를 대상으로 했다는 점에서 이러한 효과를 염증성 장 질환으로 일반화할 수는 없지만, 미주신경의 활성 저하라는 공통 병리가 염증성 장 질환에서 나타난다는 사실로 미루어보면 이와 같은 효과가 다른 염증성 장 질환에서도 발현되기를 기대할 수 있다.
본 연구에서는 경피적 이(耳) 미주신경 자극술의 직접적인 근거를 탐색하지 못하였으나, 직접적 미주신경 자극과 같이 경피적 이(耳) 미주신경 자극술 또한 그에 상응하는 효과를 낸다는 것이 연구되고 있다. 앞서 언급한 바와 같이 직접적 미주신경 자극에서 활성화되는 뇌 부위와 유사한 부위를 경피적 이(耳) 미주신경 자극으로 활성화할 수 있다는 점 또한 이를 뒷받침한다21,22. 뇌 영상 수준에서의 간접적인 증거 외에도 확연한 근거를 위한 임상 시험은 현재 진행 중에 있다. 일례로, 임상 시험 전 예비 연구에 의하면 중등도의 염증성 장 질환 심각도를 지닌 10세에서 21세 사이 소아청소년을 대상으로 미주신경 자극술을 14주간 시행했을 때 임상 지표상 개선이 나타났고 상당한 수가 임상적 관해를 보였으며, 이때 안전상의 부작용은 발생하지 않았다32.
Ⅴ. 고 찰 : 이혈 전침 치료 제언
최근 미주신경 자극을 통해 염증성 장 질환을 치료할 수 있다는 가능성이 제기되었다. 미주신경은 장-뇌축을 구성하는 부교감신경으로서 몇 가지 기전을 통해 염증성 장 질환에 대해 항염증 효과를 발휘한다. 먼저, 신경내분비학적으로 미주신경을 통해 전달된 내장 감각은 뇌를 경유하여 부신에서 코티솔이 분비되게 하는데, 이는 소위 ‘스트레스 호르몬’으로서 전신의 염증 수준을 낮춘다. 또한 미주신경은 대식세포에 아세틸콜린이라는 신경전달물질을 전달하여 염증성 사이토카인이 분비되는 것을 억제한다5. 염증성 장 질환 환자에서는 부교감신경, 특히 미주신경 활성이 저하되어 있으므로 미주신경의 활성 조절을 통해 염증성 장 질환의 호전을 기대할 수 있다.
전침 자극은 수기 침 치료의 진통 및 소염 효과에 더하여 특정한 전기생리학적 신호를 통해 신경면역학적으로 그 효과를 증대시킬 수 있다33. 특히 이와 같은 항염증 효과는 동물 실험에 의해 잘 밝혀져 있는데, 일련의 화학물질로 유발된 다양한 장기의 염증이 전침의 효과를 통해 억제되는 것을 확인한 연구가 있었다34. TNBS로 유발한 대장염 모델에서도 염증성 단백질 수치의 감소, 미주신경 활성의 증가, 교감신경 활성의 저하와 같은 효과가 전침에 의해 나타날 수 있다는 것을 보고하였다27,35. 전침 치료는 항염증 효과에 더해 장내미생물총의 보전성을 유지하고36,37, 소화기관 장벽을 보호하며38, 통증을 억제하는 효과 기전으로 임상 현장에서 염증성 장 질환에 대한 유효한 선택지로 활용될 수 있다39. 또한 전침은 염증성 장 질환에서 나타날 수 있는 우울 및 불안 등의 정신적인 증상도 개선한다고 알려져 있어 이와 같은 효과가 신경계의 직⋅간접적인 경로를 통해 나타난다는 것을 유추할 수 있다40.
염증성 장 질환에 대한 전침 치료에서는 대개 ST36(足三里)를 필두로 한 체간 및 사지의 경혈이 주되게 사용된다. ST36(足三里)에 대한 전침 자극은 미주신경-부신축을 통해 항염증 효과를 유발한다는 것이 알려져 있다2. 이침 요법 또한 미주신경을 자극한다고 알려졌음에도 불구하고, 그 효과나 치료적 근거가 다른 치료에 비해 잘 알려져 있지는 않은 실정이다. 이침의 혈위는 세분화되어 있으며, 특히 미주신경이 지배하는 이갑개정에는 인체의 다양한 장기를 자극한다고 알려진 이침 혈위가 구획되어 있다. 이에 따라 치료 대상인 부위나 치료 목표의 효과에 따라 해당 이혈(耳穴)을 자극하게 된다. 이침 요법, 즉 외이에 대한 자극은 일반적인 침 치료와 마찬가지로 접근성이 좋고, 치료의 경제성이 좋으며, 위해가 적다. 따라서 이를 통해 미주신경과 같은 자율신경이 효과적으로 자극되고, 그로부터 유의한 임상 효과가 나타날 수 있다면 유용한 치료법으로써 적극적으로 고려할 수 있다.
이혈(耳穴)에 대한 전침 치료는 임상 현장에서 적지 않게 활용되며, 이(耳) 미주신경 부위에 전침을 활용한 임상 연구가 진행된 바 있다41. 귀에 대한 전침 치료는 보통의 경피적 이(耳) 미주신경 자극에 비해 몇 가지의 장점을 가지고 있는데, 이갑개정의 넓은 부위에 전기 자극을 주는 것에 비하여 부위-특이적이고 전기적 파라미터의 설정에 따라 일관된 자극을 가할 수 있으므로 재현성이 높다. 또한 경제적이며 안전성이 높다는 장점을 갖는다.
상기 검토된 근거들을 토대로, 염증성 장 질환 치료 목적으로 이혈(耳穴) 전침 치료를 활용하기 위해서 전기적 파라미터는 30 Hz, 250~500 μs로, 자극 시간은 5분 이상으로 설정하는 것이 적절할 것으로 사료된다. 이는 10 Hz 미만의 주파수가 원심성 섬유를 자극하지만 그 이상의 주파수가 대개 구심성 섬유를 자극하며, 이혈(耳穴) 전침 치료의 효과는 뇌를 경유하여 미주신경 활성이 조절되게 하는 것을 목표 기전으로 하고 250~500 μs의 펄스 너비가 미주신경 자극의 핵심 영역인 고립핵을 활성화하는 것으로 알려져 있는 것에 근거한다42,43. 또한 이침 혈위는 각각의 장부 및 효과에 따라 세밀하게 구획되어 있어, 대장 및 직장과 연관된 혈위를 선혈할 것을 고려할 수 있다.
이혈(耳穴) 전침 치료의 효과를 정량적⋅정성적으로 검증하기 위해서는 임상 연구가 필요하겠으나, 전침은 이미 안전하고 효과적으로 사용되고 있는 치료법 중의 하나라는 점에서 현장에 바로 투입할 수 있다. 이러한 치료가 부담 없이 사용될 수 있다면 후속 연구를 통해 최적의 설정 및 효과 크기를 검증해야 할 것이다. 향후 진행되는 연구는 근거를 공고히 하기 위한 임상 연구의 설계와 더불어 효과적인 치료를 제안하기 위한 전기적 파라미터들과 최적의 설정을 알아보는 데에 초점을 두어야 할 것으로 사료된다.
Ⅵ. 결 론
무작위 대조군 동물 실험과 임상 증례 보고들을 통해 미주신경 자극술의 염증성 장 질환에 대한 효과를 확인해보았다. 동물 실험에서 미주신경자극술은 장 염증 유도 모델에서 질병 활성 지표, 분자생물학적 지표, 조직학적 관찰상의 호전을 보였으며 크론병 환자를 대상으로 한 임상 연구들에서도 크론병 활성 지표, 분자생물학적 지표 등의 호전을 유도하였다. 최근 비침습적 미주신경 자극 기법이 개발되어 경피적 자극을 통해 미주신경의 활성을 조절할 수 있게 되었으며, 특히 귀를 자극함으로써 미주신경을 조절하는 경피적 이(耳) 미주신경 자극에 대한 연구가 이루어지고 있다.
경피적 이(耳) 미주신경 자극술은 온전히 미주신경의 체성 감각 지배를 받는 이갑개정을 전기적으로 자극하는 것으로, 이와 관련하여 한의학 임상 현장에서 응용해볼 수 있는 것은 귀에 대한 전침 치료이다. 이(耳)-전침을 염증성 장 질환에 활용할 시에 다음과 같은 장점이 있다: 우선, 별도의 기기가 필요하지 않다는 점에서 경제성이 좋은 치료법이 된다. 또한, 이침 치료에서 목표 부위의 혈위가 세분화되어 있으므로 이를 전침과 결합하여 가산적인 효과를 낼 수 있다. 마지막으로, 전침 치료는 소화기 질환에 대한 일반적인 처치이므로 다른 부위의 전침 자극에 더하여 사용할 수 있다. 그리고 전침의 일반적인 장점으로 치료적 재현성이 높고 안전하다는 것을 들 수 있다.
염증성 장 질환은 난치 질환으로 아직까지 효과적으로 치유할 수 있는 표준적인 치료가 개발되지 않은 실정이다. 이에 염증성 장 질환의 신경면역학적 기전을 감안하여 미주신경 자극을 하나의 새로운 치료적 선택지로 고려할 수 있다. 의료 현장에서 널리 쓰이는 전침을 통해 미주신경을 자극할 수 있다면, 이를 염증성 장 질환을 치료하는 데에 사용할 수 있을 것이다.
감사의 글
이 성과는 정부(과학기술정보통신부)의 재원으로 한국연구재단의 지원을 받아 수행된 연구임(No. 2022R1C1C1004937).