기능성 소화불량 한의 변증 표준화를 위한 이중탕, 평위산 및 시호소간탕 투여 : 무작위 배정, 평가자 눈가림, 3군 비교, 평행 설계, 공개, 다기관 임상시험 프로토콜
Administration of Yijung-tang, Pyeongwi-san, and Shihosogan-tang for Standardization of Korean Medicine Pattern Identification for Functional Dyspepsia: A Study Protocol of a Randomized, Assessor-blind, 3-Arm, Parallel, Open-label, Multicenter Clinical Trial
Article information
Abstract
Objectives:
The purpose of this study is to explore the effectiveness and safety of frequently used clinical herbal medicines (Yijung-tang [Lizhong-tang, LJT], Pyeongwi-san [Pingwei-san, PWS], and Shihosogan-tang [Chaihu Shugan-tang, SST]) in patients with functional dyspepsia (FD) when administered according to herbal medicine and Korean medicine pattern identification. The results of this study will be used to standardize the diagnostic instrument used in Korean medicine and to investigate biomarkers of Korean medicine pattern identification.
Methods:
This study will be a randomized, assessor-blind, 3-arm, parallel, open-label, multi-center clinical trial. A total of 300 FD participants will be recruited from 3 Korean medical hospitals and assigned to the LJT (n=100), PWS (n=100), and SST (n=100) groups according to FD pattern identification. The patients will take the medication for 8 weeks, 3 times a day, before or between meals. The primary outcome will be total dyspepsia symptom (TDS) and the secondary outcomes will be adequate relief (AR) for dyspepsia, overall treatment effect (OTE), visual analogue scale (VAS), functional dyspepsia-related quality of life (FD-QoL), gastrointestinal symptom score (GIS), and pattern identification questionnaires. For the exploratory outcomes, we will analyze blood and fecal metabolome profiles, microbiota from fecal and saliva samples, single nucleotide polymorphism (SNP), and results of Korean medicine diagnosis device measurements (heart rate variability, and tongue, pulse, and abdominal diagnosis).
Conclusions:
The results of this study will prove objectivity for Korean medicine pattern identifications, and the effectiveness and safety of herbal medicines for the population with FD.
I. 서 론
기능성 소화불량이란 기질적 원인 없이 상복부의 불편감 혹은 통증이 주 증상인 질환을 일컬으며, 일반적으로 식후 충만감, 조기 포만감, 상복부 통증 또는 상복부 속쓰림을 특징으로 한다1. 이 4가지 증상 중 한 가지 이상이 최소 6개월 전에 발생하여 최근 3개월 동안 지속되었을 경우 기능성 소화불량으로 진단받을 수 있다2. 2016년도 개정된 로마기준 IV3에 따르면 기능성 소화불량을 식후고통증후군(postprandial distress syndrome, PDS), 명치통증증후군(epigastric pain syndrome, EPS), 그리고 이 두 아형이 혼합된 유형으로 분류하고 있다.
기능성 소화불량의 유병률은 전 세계적으로 다양하며, 서양 국가에서는 10~40%, 아시아 국가는 상대적으로 낮은 5~30% 정도로 보고된다2. 2016년 9월에서 2017년 6월까지 수행된 다기관 연구4에 따르면 국내 기능성 소화불량 유병률은 10.3% 정도로 나타났다.
기존 기능성 소화불량의 일차적 치료는 증상 완화를 목적으로 하며, 주로 약물 치료를 사용하고 있으며, 질환 특성상 원인을 제거하는 치료가 없어 치료 기간이 8주~12주 정도로 제한되고 있다5. 프로톤 펌프 저해제 같은 위산 억제제는 EPS에 해당하는 환자에게 주로 사용하고 있으며2, 위장 운동성에 문제가 있는 PDS의 경우 위장운동촉진제가 일차적으로 사용되고 있다6. 일차적으로 사용하는 약물이 반응하지 않을 경우, PDS에서 위저부 이완제(Fundus-relaxing drugs)를 사용하게 되며2, 세 가지 약물 치료에도 효과가 없을 경우 항우울제나 정신 치료를 고려할 수 있다2,5. 하지만 기존 서양의학적 약물이 모든 환자들에게 효과적인 것은 아니며 특정 신경전달물질 수용체를 차단하는 약물들이 대부분으로, 추체외로 증상7, QT 간격 연장8, 어지러움9, 식욕부진10 등의 이상반응이 나타난다는 단점이 있다.
이러한 서양의학적 치료의 한계를 극복하고자 국외에서는 이미 기능성 소화불량에 대해 한약, 침 등의 한의학적 치료가 활발히 수행되고 있으며11, 국내에서는 기능성 소화불량 한의표준임상진료지침이 개발되었다. 기능성 소화불량 한의표준임상진료지침에 따르면 성인 기능성 소화불량 증상 개선 및 개선된 증상 유지를 위해 한약치료를 권고하고 있으며, 대표적으로 반하사심탕, 육군자탕, 소요산, 평위산, 시호소간산 등을 제시하고 있다12.
한의학에서 기능성 소화불량은 비기허약(脾氣虛弱)이 주된 원인으로 여겨지나, 간위불화(肝胃不和), 위장정음(胃腸停飮), 위기부족(胃氣不足)의 원인으로도 발생되기도 하며, 기허(氣虛), 기체(氣滯), 혈어(血瘀), 식적(食積), 담음(痰飮) 등이 서로 뒤섞이며 나타나거나, 허실한열(虛實寒熱)이 동시에 보이기도 한다13. 기능성 소화불량의 변증은 간위불화(肝胃不和), 음식정체(飮食停滯), 비위습열(脾胃濕熱), 한열착잡(寒熱錯雜), 비위허한(脾胃虛寒), 비허기체(脾虛氣滯)의 6가지 유형으로 분류할 수 있다12. Park 등14의 연구에서 68명의 기능성 소화불량증 환자를 대상으로 한의학적 변증을 분석하였으며, 간위불화가 약 53%으로 가장 많은 비율을 차지했고, 그 다음으로 음식정체가 22%, 한열착잡이 16%, 비위허약이 9%를 차지했다. 이는 정신적 인자도 기능성 소화불량의 증상 발생에 기여한다는 것을 의미한다.
전통 한의학에서 진단 방식은 망문문절(望聞問切)의 사진(四診)을 통해 이루어지며, 한의사는 적절한 치료를 제공하기 위해 질병의 각 단계를 관찰하고 환자에서 나타나는 증상과 징후 간 상관관계를 종합하는 변증(辨證)을 수행한다15. 사진의 구체적인 방법으로 한의학에서는 예전부터 설진, 맥진, 복진, 문진 등의 진단법이 있으며, 현재까지도 임상에서 주된 진단 방식으로 사용하고 있다16. 따라서 한의학에서 변증은 환자를 진단하고 치료하는데 있어 중요하게 작용하지만, 환자의 주관적인 표현이나 의사의 주관이 들어가기 때문에 객관적인 진찰이 어렵다는 단점이 있다17. 현대 한의학에서는 이를 보완하기 위해 설진18, 맥진19, 복진20, 문진21-25 등을 표준화하기 위한 기기와 설문지도 개발되었다. 즉, 기능성 소화불량은 기존 서양의학 치료의 한계가 분명하고 한의학적 수요가 높은 다빈도 질환이나, 한의학적 진단 체계의 객관화, 표준화가 되어 있지 않아 치료 시 재현성, 효용성에 한계가 있어 이를 극복할 수 있는 연구가 필요한 상황이다. 특히, 기능성 소화불량의 비허(脾虛)증에는 이중탕(理中湯, Yijung-tang, YJT), 식적(食積)에는 평위산(平胃散, Pyeongwi-san, PWS) 그리고 간울(肝鬱)에는 시호소간탕(柴胡疏肝湯, Shihosogan-tang, SST) 등의 한약제제들이 경험적으로 제시되고 임상에서 널리 사용되고 있다. YJT은 이전부터 설사, 구토, 복통 등 증상에 사용되었으며26, 비허기체 환자들을 대상으로 한 무작위 대조군 연구에서 기능성 소화불량 증상이 완화되었음을 보고하였다27. 기능성 소화불량 한의표준임상진료지침에서 PWS은 소화불량 외에도 수성음(水聲音), 오심, 현훈 등의 습곤비위(濕困脾胃) 변증에 사용하도록 권고하고 있으며12, SST은 간위불화(肝胃不和)에 해당하는 처방으로 정서적 자극으로 인한 소화불량 활용할 수 있다12. 그러나 이들의 변증별 투약 효과를 객관적으로 증명한 연구는 많지 않다.
이에 본 임상연구는 기능성 소화불량 환자를 대상으로 임상 다빈도 한약제제를 무작위로 투약하는 전향적 임상시험을 통해 약물별 및 변증별 효과 및 안전성을 탐색하고자 한다. 변증을 위해 설진, 맥진, 복진, 문진 등을 사용하여 전통 한의학적 진단법에 대한 표준화를 마련하고 혈액 및 분변 대사체, 단일염기다형성(single nucleotide polymorphism, SNP), 장내 및 구강 미생물 군집 분석 등을 통해 한의 변증의 바이오마커 발굴을 위한 예비 자료로 사용하고자 한다.
II. 대상 및 방법
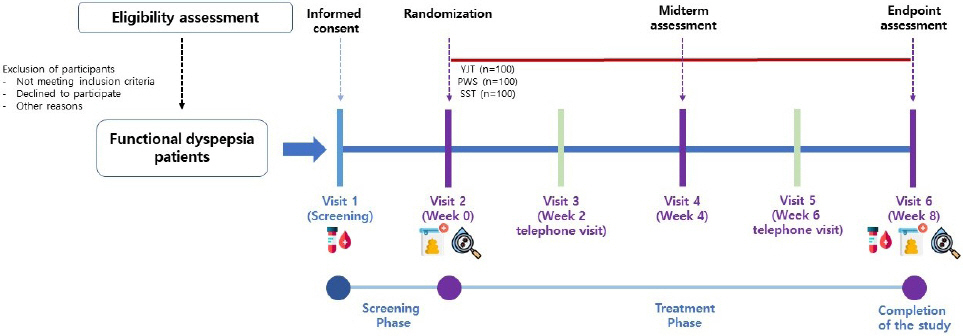
본 임상시험은 무작위 배정, 평가자 눈가림, 3군 비교, 평행설계, 공개, 다기관 임상시험으로 8주 동안 시행될 예정이다. 실시기관은 동국대학교일산불교한방병원, 강동경희대학교한방병원 및 부산대학교한방병원의 세 기관이며, 임상시험 계획서, 증례기록서, 임상시험 설명문 및 동의서, 인체유래물 연구 설명문 및 동의서, 설문지 등 제반 서류는 기관생명윤리위원회(Institutional Review Board, IRB)의 심의 승인을 받았다(심의승인번호: 동국대학교일산불교한방병원, DUIOH 2022-07-007; 강동경희대학교한방병원, KHNMCOH 2022-09-004; 부산대학교한방병원, PNUKHIRB 2022-09-005). 본 임상연구는 한국연구재단으로부터 지원을 받으며 프로토콜은 임상연구정보서비스(clinical research information service, CRIS)에 등록되었다(등록번호: KCT0007867; 등록일: 2022년 11월 2일).
1. 대상자
본 연구의 목표 대상자 수는 300명으로 기능성 소화불량 환자에 대한 YJT, PWS 및 SST의 약물별 및 변증별 효과와 안전성을 탐색하고자 하며, 이에 대상자 수 산출에 참고할 수 있는 선행 문헌이 없다. 또한, 본 연구에서 사용될 세 종류의 한약제제는 한방건강보험용으로, 이미 임상 현장에서 소화불량 치료에 활발하게 사용되고 있는 약물이다. 이에 통계적 방법에 의한 대상자 수 산출이 아닌 연구의 규모와 목적에 맞추어 YJT, PWS 및 SST 투여군 각 100명씩, 총 300명의 대상자를 모집하고자 하며, 각 실시기관에서 경쟁 모집을 실시할 예정이다.
1) 선정기준
(1) 만 19세 이상 만 75세 이하의 성인 남녀
(2) Rome IV criteria의 기능성 소화불량 정의에 근거하여, 기질적 소견 없이 식후 충만감, 조기 포만감, 상복부 통증, 상복부 속쓰림 중 한 가지 이상이 최소 6개월 이전에 발병하여 최근 3개월 이상 증상이 지속되는 경우
(3) 0-100 mm Visual analogue scale(VAS)로 측정한 소화불량의 강도가 40점 이상인 경우
(4) 임상시험 기간 동안 소화불량과 관련된 다른 새로운 치료를 받지 않기로 서약한 경우
(5) 시험 참가에 앞서 충분한 설명을 듣고, 자유의사에 따라 본 연구에 참여하기로 하고 IRB의 승인을 받은 서면동의서에 서명한 자
2) 제외기준
(1) 스크리닝 이전 1년 이내에 소화성궤양, 식도암, mucosa-associated lymphoid tissue(MALT) 림프암, 위암, 대장암, 담도췌장질환(단, 무증상 담석증 제외), 염증성 장 질환 등 기질적 질환을 진단받은 자
(2) 역류성 식도염과 과민성 장증후군의 증상이 소화불량 증상보다 심한 경우
(3) 심한 체중감소, 혈변, 연하곤란, 연하통, 지속적 구토 등 Alarm symptom이 존재하는 경우
(4) 주요 우울장애, 불안장애, 조현병, 거식증, 간질 등 신경 또는 정신학적으로 중요한 병력이 있거나 현재 질환을 앓고 있는 자
(5) 심각한 기질적 질환(예, 심부전, 협심증, 심근경색, 부정맥, 판막질환, 악성종양, 뇌졸중 등)이 있는 경우
(6) 위장관 수술력이 있는 자(단, 충수 절제술의 경우 수술을 받은 지 6개월이 지난 경우 임상시험 참여 가능)
(7) 스크리닝 이전 2주 이내에 위장관에 영향을 주는 프로톤 펌프 억제제, 히스타민 수용체 길항제, 제산제, 위장관 운동 촉진제, 위저부 이완제, 위점막 보호제, 항콜린제, 흡착제, 항팽만제, 항구토제, 최토제, 가스트린 수용체 길항제 및 프로스타글란딘 유사체 복용 혹은 헬리코박터 제균 치료를 받은 경우
(8) 스크리닝 이전 2주 이내에 소화불량 개선을 목적으로 침, 한약, 뜸 등의 한의치료를 받았거나 연구 기간 중 치료받을 예정인 자
(9) 스크리닝 이전 3개월 이내에 항생제를 복용한 자
(10) 스크리닝 이전 1개월 내 유산균 제제를 복용한 자(단, 스크리닝 1개월 이전부터 지속적으로 유산균 제제를 복용하였으며, 임상시험 기간 동안 용법, 용량을 변경하지 않을 예정인 경우 임상시험 참여 가능)
(11) 스크리닝 시 aspartate aminotransferase(AST) 또는 alanine aminotransferase(ALT)가 정상 상한치의 3배, 혈중 Creatinine(Cr)이 정상 상한치의 2배 이상인 자
(12) 중대한 알코올 또는 약물 오남용의 병력이 있는 자
(13) 임부 또는 수유부이거나 시험기간 중 효과적인 피임방법을 사용할 것을 동의하지 않은 가임기 여성
(14) 갈락토오스 불내성, Lapp 유당분해효소 결핍증 또는 포도당-갈락토오스 흡수장애 등의 문제가 있는 자
(15) 임상시험용 의약품에 알려진 과민반응이 있는 자
(16) 다른 임상시험용 의약품을 복용한 지 3개월 미만인 자
(17) 적절한 치료에도 잘 조절되지 않은 만성 질환을 가진 자(고혈압, 당뇨 등으로 인해 생명의 위협이 있거나, 입원치료가 필요하거나, 심각한 신체장애가 유발되는 경우, 혹은 일상생활에 지장이 있는 경우)
(18) 기타 사유로 시험책임자 또는 시험담당자가 시험 참여에 부적합하다고 판단한 자
3) 시험대상자 확보 방법
시험대상자의 확보를 위해 신문전단, 일간지 등 대중매체를 통해 정기적인 홍보를 하며, 실시기관 내외 게시판 및 웹사이트 등에 홍보물을 부착한다. 임상시험 수행 중 대상자 등록이 지체되는 경우, 지하철 광고, 버스 광고, 아파트 게시판 광고 등 지역광고 및 올리브씨, 메디25 등 임상시험 웹사이트 또는 어플리케이션을 활용한 광고를 시행한다. 이외에도 기능성 소화불량 환자들이 접근하는 온라인 커뮤니티, 지역 소모임, 동호회 등에 협조를 요청하여 관심을 유도할 수 있도록 한다.
2. 시험설계
1) 시험기간
본 연구는 IRB 승인일로부터 36개월이나, 시험대상자 등록 속도에 따라 연장될 수 있다.
2) 시험설계 및 배정방법
본 연구는 무작위 배정, 평가자 눈가림, 3군 비교, 평행설계, 공개, 다기관 임상시험으로 임상시험 참가 동의서에 자발적으로 서명한 대상자에 한하여 스크리닝 방문에 문진, 활력징후 측정, 설문지 조사, 실험실적 검사 등 스크리닝 검사를 시행하여 본 임상시험에 적합하다고 판단되는 대상자를 선정한다. 대상자는 변증 결과에 따라 비허, 식적, 간울 변증군으로 구분되며, 스크리닝 방문으로부터 2주 이내에 방문하여 YJT, PWS 및 SST에 무작위로 배정된다. 대상자의 변증에 따라 배정된 약물 치료군은 변증기반군 혹은 통치방군(A군 또는 B군)이 된다.
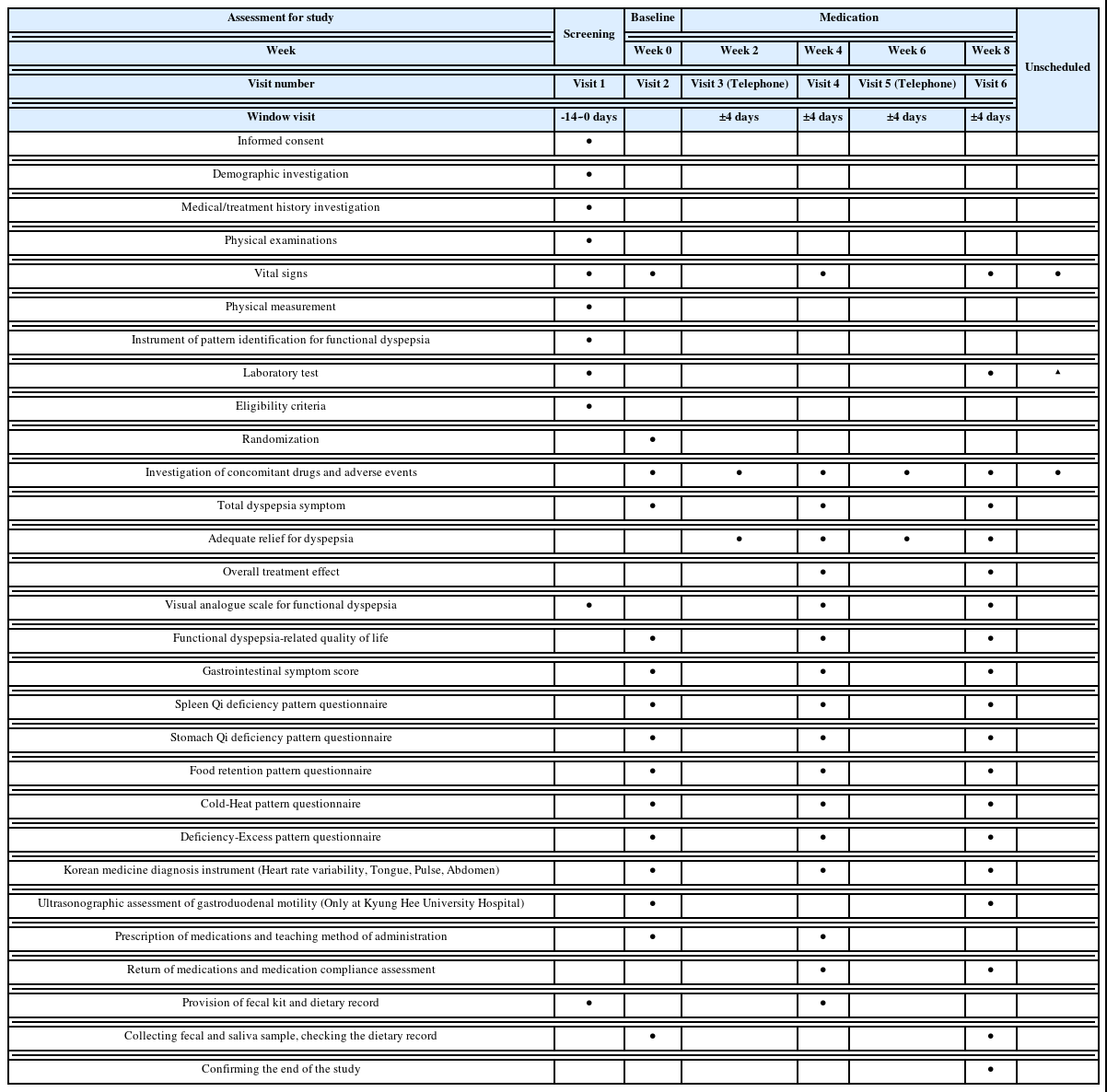
모든 군은 해당 임상시험용 의약품을 8주 동안 복용하며, 대상자는 4주 간격(0주, 4주, 8주)으로 방문하여 활력징후, 설문지 조사, 한의진단기기(Heart rate variability(HRV), 설진, 맥진 및 복진 등) 측정 등 임상적 변수에 대한 평가를 받으며, 중간에 2주 간격(2주, 6주)으로 전화 방문(telephone visit)을 통해 지난번 치료 이후 기능성 소화불량 통증이나 불편감이 적당히 완화되었는지 조사한다. 임상시험용 의약품 복용 전과 후 대상자로부터 혈액 (스크리닝, 8주), 분변 및 타액(0주, 8주) 검체를 채취하여 대사체 및 유전체, 장내 및 구강미생물 군집을 관찰한다(Table 1, Fig. 1). 가임기 여성의 경우 임신 가능성을 확인하기 위해 Urine human chorionic gonadotropin(HCG)을 스크리닝 방문에만 측정하며 방문 전 3개월 이내 검사가 있을 경우 해당 검사 결과를 사용할 수 있다.
본 임상시험에 사용되는 YJT, PWS 및 SST은 모두 한국신약에서 제조되었으며, 임상연구 진행 중에 시험대상자는 1일 3회, 1회 1포씩 식전 또는 식간에 약물을 복용한다. 세 종류의 임상시험용 의약품은 모두 기밀용기에 실온보관(1-30 °C)을 원칙으로 하며 그 사용기한은 제조일로부터 36개월이다.
3) 무작위 배정 및 평가자 눈가림
본 임상시험은 변증기반군(비허-YJT, 식적-PWS, 간울-SST)과 통치방 A군, 통치방 B군으로 나누어 시행될 예정이다. 예를 들어, 비허 변증에 있어서 YJT 투여군은 변증기반군이 되며, PWS 및 SST 투여군은 각각 통치방 A군 및 B군이 된다.
대상자 배정은 각 변증별로 층화 블록 무작위 배정방법을 이용하여 임상시험 전 발생할 수 있는 비뚤림을 최대한 통제한다. 본 임상시험에서는 각 변증별로 군별 배정 비율은 2:1:1(변증기반군:통치방A군:통치방B군)이며, 블록크기는 4, 8을 혼합하여 사용한다. 무작위배정표는 임상시험의 중재 및 평가와 독립적인 의학 통계학자가 통계프로그램 SAS® Version 9.4(SAS institute. Inc., Cary, NC)를 이용하여 각 개체가 뽑힐 가능성이 동일한 상태에서 배정한다. 생성된 무작위배정 목록을 이용하여 전체 모집 대상자 수 안에서 각 기관별로 경쟁 등록하며 무작위배정 목록에 따른 시험대상자별 군 정보는 사전에 온라인 무작위배정시스템에 업로드하여 보관한다. 본 임상연구의 선정 및 제외기준을 충족한 대상자에게 무작위배정시스템을 통해 각 변증별로 사용 가능한 최소 번호부터 배정하고, 기관코드, 변증코드가 포함된 대상자 식별코드를 확정하여 증례기록서에 기재하며, 한 번 배정된 무작위번호는 재사용하지 않는다.
본 임상시험은 시험자 및 시험대상자 눈가림이 불가능한 공개 임상시험으로 평가자 눈가림이 가능하도록 설계하여 임상시험과 관련된 비뚤림을 최소화하고자 한다. 시험대상자의 효과 평가는 의약품 처방을 진행하지 않고, 의무기록과 증례기록서 등 모든 근거문서에 접근하지 않는 시험담당자가 실시할 예정이며, 평가자는 평가항목 작성을 위해서만 질문하고 작성하며 임상시험 대상자가 어떠한 군에 배정되었는지 모르도록 한다.
3. 평가변수
1) 1차 유효성 평가변수: Total dyspepsia symptom (TDS)27
소화불량 증상을 평가하기 위해 TDS를 0주, 4주 및 8주차에 평가할 예정이며, 8개 항목의 답변에 해당하는 점수를 합하여 전체 점수를 구한다. 점수가 높을수록 더 심각한 소화불량을 의미한다.
2) 2차 유효성 평가변수
(1) Adequate relief(AR) for dyspepsia28
시험자는 시험대상자에게 지난번 치료 이후 기능성 소화불량 통증 혹은 불편감이 적당히 완화되었는지 여부에 대하여 2주, 4주, 6주 및 8주차에 평가한다. 두 군에서 총 8주 시험기간 중 AR 질문에 “예”라고 답한 횟수가 50% 이상인 경우를 반응군으로 정의하며 각 군 간 반응군의 비율을 비교한다.
(2) Overall treatment effect(OTE)29
지난 임상시험 기간 동안 소화불량 증상과 삶의 질 관련하여 대상자 스스로 느낀 전반적인 치료 효과에 대하여 평가하는 척도로 4주 및 8주차에 평가한다.
(3) 소화불량 VAS30
임상시험 대상자의 지난 2주간 주관적인 소화불량의 강도를 평가하며 스크리닝 방문, 4주 및 8주차에 평가한다. VAS는 0-100이 그려진 수평선 모양의 시각상사척도를 사용하는 방법으로 0은 소화불량으로 인한 불편감이 없는 상태이며, 100은 상상할 수 있는 최고의 불편감을 의미한다. 스크리닝 방문 시 40점 미만인 경우 탈락으로 처리한다.
(4) Functional dyspepsia-related quality of life (FD-QoL)31
소화불량 환자의 삶의 질을 평가하기 위한 것으로 0주, 4주 및 8주차에 평가한다. 점수가 높을수록 더 높은 삶의 질을 의미하며, 각 영역별 총점 및 전체 총점을 계산한다.
(5) Gastrointestinal symptom score(GIS)32
10가지 소화기 증상에 대하여 각각 5점 리커트 척도로 평가하며, 0주, 4주 및 8주차에 평가한다.
본 임상시험에 사용하는 변증 설문지로는 비기허 설문지, 위기허 설문지, 식적 설문지, 한열 설문지 및 허실 설문지가 있으며, 0주, 4주 및 8주차에 평가한다.
(7) 기능성 소화불량 변증도구
스크리닝 방문 시 시험대상자의 최근 2주간 기능성 소화불량 관련 건강 상태를 평가하며, 시험자는 각 문항별 가중치를 반영하여 점수를 구한 후 시험대상자를 6가지 변증유형 중 하나로 결정한다12. 본 연구에서는 비허는 脾胃虛弱(寒), 脾虛氣滯 점수의 합, 간울은 肝胃不和, 寒熱錯雜 점수의 합, 식적은 脾胃濕熱, 飮食停滯 점수의 합으로 계산되며, 3가지 중 가장 높은 점수를 가진 변증으로 결정한다.
3) 안전성 평가 변수
간기능(AST, ALT) 및 신장기능(Blood urea nitrogen(BUN), Cr) 검사의 경우 스크리닝 방문과 8주차에 실시하며 검사 전 최소 8시간 동안 금식한다.
활력징후의 경우 혈압(수축기, 이완기), 맥박수 및 체온을 측정한다. 혈압 및 맥박수는 전화 방문 외 매 방문마다 3분 이상 안정을 취한 후 전자혈압계를 이용해 앉은 상태에서 측정하며, 체온은 혈압을 측정한 후 전자체온계를 이용해 측정한다.
이상반응의 경우 임상시험 기간 동안 대상자가 증상을 보고하거나 연구자가 대상자를 관찰함으로써 수집된다.
4) 탐색적 평가 변수
한의진단기기 측정을 위해 HRV, 설진기, 맥진기 및 복진기를 사용하며 0주, 4주 및 8주차에 측정한다. HRV는 비침습적으로 건강 상태를 평가할 수 있는 효율적인 도구로 환자에게 부담이 적고, 교감신경과 부교감신경을 측정하여 임상에서 다양하게 활용할 수 있다. 기기는 강동경희대학교 한방병원과 부산대학교한방병원의 경우 SA-6000(MEDICORE Co., Ltd)을, 동국대학교 일산불교한방병원병원은 SA-3000NEW(MEDICORE Co., Ltd)를 사용한다. 설진기는 설태의 후박, 분포 및 설질 색상 등을 평가하며, 기기 모델명은 Tongue diagnosis system CTS-2000(제품명: CTS-1000, 대승의료기기)이다. 맥진기는 요골동맥에서 비침습적으로 맥파를 측정하여 심혈관계의 상태를 확인할 수 있는 정보와 맥상 정보(맥의 세기, 깊이, 빠르기, 모양)를 분석하여 제공하며 기기 모델명은 DMP-Lifeplus(대요메디(주))이다. 복진기는 巨闕(CV-14 [Ren-14]), 中脘(CV-12 [Ren-12]), 좌우 承滿(ST-20), 좌우 天樞(ST-25), 關元(CV-4 [Ren-4]), 좌우 水道(ST-28)로 총 9개 경혈 부위의 복부 압통을 진단하고자 하며, Digital Algometer(FPX25, Wagner Instrument, USA)로 측정한다.
임상시험용 의약품 복용 전과 후에 대상자로부터 혈액(스크리닝, 8주), 분변 및 타액(0주, 8주) 검체를 채취한다. 분변은 장내 미생물 군집과 분변 대사체 profile을 위해, 혈액은 혈액 대사체 profile과 SNP을 위해 그리고 타액은 구강 미생물 군집을 관찰하기 위해 사용한다. SNP의 경우 소화효소, 담즙산, 기타 소화기능 및 약물대사 관련 유전적 다형성을 분석한다.
초음파 위-십이지장 운동기능 측정의 경우 0주 및 8주차에 강동경희대학교 한방병원에서만 측정한다.
대상자의 식사는 투약 외 교란변수로 작용하여 장내 및 구강미생물 군집에 영향을 미칠 수 있으므로 섭취 음식물에 대한 전후 비교를 실시한다. 식이 패턴 분석을 위해 시험대상자는 0주 및 8주차에 방문일 전 3일 동안 식사의 종류와 양을 기록한 식사기록지(3일 식사기록법)를 제출한다. 식사 내용은 Computer aided nutritional analysis program (CAN Pro)을 이용하여 영양소 분석을 실시한다. 또한, 0주차에는 지난 1년간 평균 식품 섭취 빈도 및 분량을 조사하는 식품섭취빈도조사를 실시한다.
이외에도 대상자의 건강상태 측정 및 유효성, 안전성 평가를 위해 스크리닝 방문과 8주차에 White blood cell(WBC), WBC differential count, Red blood cell(RBC), Hemoglobin, Hematocrit, Platelet, Erythrocyte sedimentation rate(ESR), glucose, AST, ALT, gamma-glutamyl transpeptidase(GTP), BUN, Cr 측정을 위한 실험실적 검사를 실시하며, 검사 전 최소 8시간 동안 금식한다.
4. 통계분석 방법
모든 통계분석은 양측검정을 원칙으로 하며 유의수준은 5%로 설정한다. 연속형 자료의 경우 평균과 95% 신뢰구간을 제시하고, 범주형 자료는 빈도와 백분율을 제시한다. 분석도구는 통계 프로그램 SAS® Version 9.4(SAS institute. Inc., Cary, NC)를 사용한다.
1) 인구학적⋅사회학적 자료 및 기타 치료 전 대상자 특성
인구학적⋅사회학적 특성과 치료 전 대상자 특성에 대한 요약 통계를 각 군별로 제시한다. 정규성 여부에 따라 연속형 자료는 analysis of variance (ANOVA) test 또는 Kruskal-Wallis test를 이용하여 분석하며, 범주형 자료는 Chi-square test 또는 Fisher’s Exact test를 이용하여 분석한다. 필요한 경우, 군 간 유의한 차이를 보이는 기초정보는 이질성을 보정하기 위해 유효성 분석에서 보정하여 분석할 수 있다.
2) 유효성 평가변수의 통계분석 및 평가
1차 유효성 평가변수는 변증기반군과 통치방군의 8주차 TDS 점수의 차이로 한다. 1차 유효성 평가변수 분석 시 각 치료군과 방문시점을 고정요인 (fixed factor), 대상자를 랜덤요인으로 하는 mixed-effect models for repeated measures(MMRM) 방법을 사용하여 분석한다.
2차 유효성 평가변수는 AR for dyspepsia, OTE, 소화불량 VAS, FD-QoL, GIS, 비기허 설문지, 위기허 설문지, 식적 설문지, 한열 설문지 그리고 허실 설문지로 한다. 1차 유효성 평가변수와 동일한 방법으로 분석하며, 범주형 변수는 Chi-square test 또는 Fisher’s exact test를 이용하여 분석한다. 또한, 각 변증별 및 약물별로 1, 2차 유효성 평가변수와 동일한 방법으로 하위군 분석을 수행한다.
임상시험에서 수집된 신체계측지표 및 평가변수, 설문지, HRV, 설진, 맥진 및 복진 정보, 장내 및 구강미생물 군집 정보, 분변 대사체 profile, 혈액 대사체 profile 및 유전체 분석 정보 등을 통합한다. 이를 판별분석 및 로지스틱 회귀분석 또는 랜덤포레스트(random forest) 및 Support vector machine(SVM), 인공신경망 등을 이용하여 각 약물에 따른 치료반응여부 차이를 파악하고 기능성 소화불량의 치료 효율성 증대를 위한 최적의 예측식을 추정한다.
3) 안전성 변수 분석
안전성 평가는 시험자가 치료와의 연관성을 의심하는 이상반응, 중대한 이상반응 발생 빈도를 분석하여 수행한다. 발현된 모든 이상반응은 자세한 설명과 함께 서술적으로 기술하고, 시험의 중재와 연관성이 있는 이상반응과 연관성이 없는 이상반응의 빈도를 기록하며, 기술통계량으로 제시한다. 약물투여와 연관성이 있는 이상반응 발현건수의 군별 비교에는 Chi-square test 또는 Fisher’s exact test를 실시한다. 또한, 안전성 평가변수인 AST, ALT, BUN, Cr, 활력징후(혈압, 맥박, 체온) 수치가 치료 전과 후 차이가 있는지를 paired t-test 혹은 Wilcoxon signed rank test를 이용하여 분석한다.
5. 시험종료 및 조기중단 기준
1) 개별 대상자의 임상시험 종료, 탈락 및 중단 기준
개별 대상자의 임상시험 종료는 탈락 또는 중단되지 않고 임상시험 계획서에 명시된 전 과정을 진행한 경우, 최종적으로 시험을 완료한 것으로 보고 시험을 종료한다. 아래 조건의 하나라도 해당되는 자는 시험책임자 또는 담당자의 판단에 의해 연구에서 중도 탈락한다.
(1) 스크리닝 이후 선정/제외기준에 위배되는 것으로 판명된 경우
(2) 임상시험 기간 중 시험대상자가 동의를 철회하는 경우
(3) 임상시험 기간 중 시험대상자가 만족스럽지 않은 치료 효과로 인해 시험 중단을 요구하거나 치료를 거부하는 경우
(4) 시험대상자의 추적이 안 되는 경우
(5) 임상시험 담당자 및 책임자가 판단할 때 임상시험 과정의 이상반응 또는 병발질환으로 인해 더 이상 시험 참여가 불가능하다고 판단되는 경우
(6) 임상시험 기간 동안 담당의사의 지시 없이 연구 결과 판정에 영향을 미칠 수 있는 병용 금지약물 등을 복용한 경우
(7) 전체 임상시험용 의약품 복약 순응도가 70% 미만으로 임상시험의 유효성 평가가 적합하지 못하다고 판단되는 경우
(8) 시험대상자가 시험계획을 위반하여 시험의 지속이 어려운 경우
(9) 기타 임상시험 담당자 및 책임자의 판단에 의해 임상시험의 진행이 적합하지 못하다고 판단되는 경우
2) 임상시험의 종료 혹은 조기중단 기준
본 임상시험은 원칙적으로 계획된 목표대상자 수의 등록이 완료되고, 수집된 데이터의 완결성이 확보되었을 때 최종 종료한다.
다음의 경우에는 본 임상시험을 조기에 중단할 수 있다.
(1) 공급된 임상시험용 의약품에 관한 유해성이 발견되었을 때
(2) 본 임상시험과 관련성이 있다고 판단되는 중등도 또는 중증의 이상반응이 전체 시험대상자의 25% 이상에서 발생하는 경우
(3) 충분한 모집기간이 주어졌으나, 모든 임상시험 대상자가 등록되지 않은 경우
6. 이상반응 보고
1) 이상반응과 중대한 이상반응
이상반응이란 임상시험 중 시험대상자에게 발생하는 바람직하지 않고 의도되지 않은 증후, 증상, 질병을 말하며, 해당 임상시험의 치료법과 반드시 인과관계를 가져야 하는 것은 아니다. 시험자가 대상자에게 임상적으로 유의한 증상 및 변화가 있다고 판단되는 경우 이상반응으로 판단하며, 모든 이상반응의 발생, 평가, 조치 등은 증례기록서에 기록해야 한다. 단, 임상시험용 의약품 투여 전 발생된 의학적 사건은 현병력으로 기록하며, 임상시험 종료 후 발생한 이상반응은 중대하고 임상시험용 의약품과 관련이 있는 경우에만 보고하도록 한다.
중대한 이상반응이란 임상시험용 의약품의 임의 용량에서 발생한 이상반응을 말한다. 또는 이상약물반응 중에서 1) 사망하거나 생명에 대한 위험이 발생한 경우, 2) 입원할 필요가 있거나 입원 기간 연장이 필요한 경우, 3) 영구적이거나 중대한 장애 및 기능 저하를 가져온 경우, 4) 태아에게 기형 또는 이상이 발생한 경우, 5) 이외에도 약물 의존성이나 남용의 발생 또는 혈액질환 등 그 밖에 의학적으로 중요한 상황이 발생하는 사례 중 어느 하나에 해당하는 경우를 말한다. 시험 기간 중 발생한 모든 중대한 이상반응 발생했을 때 시험책임자는 이를 인지한 즉시(최소 24시간 내에) 한국한의학연구원 담당 모니터요원에게 구두 또는 서면으로 보고해야한다.
2) 이상반응의 중증도 평가
이상반응 발생 시 중증도 평가기준에 의해 보고해야 한다. 경증은 임상시험 대상자의 정상적인 일상생활을 저해하지 않고, 최소한의 불편을 야기하며 임상시험 대상자가 쉽게 견딜 수 있는 경우를 말한다. 중등도는 임상시험 대상자의 정상적인 일상생활을 유의하게 저해할만한 불편을 야기하는 경우를 말한다. 마지막으로 중증은 임상시험 대상자의 정상적인 일상생활을 불가능하게 하는 경우를 말한다.
3) 시험치료법과 인과관계 평가
이상반응 발현 시 약물치료와의 관련성 여부는 ‘관련성이 명백함’, ‘관련성이 많음’, ‘관련성이 의심됨’, ‘관련성이 적음’, ‘관련성이 없음’, ‘평가 불가능’의 6가지 기준에 의해 시험자가 평가하며, 시험자의 의견을 기술한다.
7. 자료관리
임상시험 기본문서는 임상시험의 수행과 그로부터 얻어진 자료의 질에 대하여 개별적 또는 전체적인 평가가 가능하도록 해주는 문서를 말한다. 시험책임자는 임상시험 기본문서 및 약사법령 등에서 정한 임상시험 관련 문서를 보관해야 하며, 모든 책임은 시험책임자에게 있다.
임상시험 실시와 관련된 각종 자료 및 기록을 보존할 수 있는 보관 장소를 따로 준비해야 한다. 이들 문서가 사고 등에 의해 조기에 파손 또는 분실되지 않도록 잠금장치가 있는 장소에 문서 및 자료를 보관하고, 연구와 관련 없는 자의 접근이 제한된 컴퓨터에 저장하여 보안을 유지하도록 한다. 연구종료 후 시험자는 IRB 규정에 의거하여 증례기록서의 사본 및 임상시험 실시기관의 보관책임에 해당하는 기본문서를 별도로 보관한다.
본 임상연구를 위해 수집한 혈액, 분변 및 타액 검체는 시험대상자의 동의 없이는 타 연구에 활용할 수 없다. 획득한 인체유래물의 보관을 위해 대상자별 고유식별번호와 검체별 고유식별번호를 분리 보관하며, 익명화하여 관리하도록 한다. 대상자의 인체유래물은 인체유래물 연구 동의서에 기술되어 있는 대로 대상자의 동의를 얻어 분석하고 포괄적인 결과분석을 위해 인체유래물 동의취득일로부터 시험대상자가 ‘인체유래물 연구 동의서’에서 결정한 보존기간까지 보존된다.
8. 모니터링
본 임상연구의 모니터링은 임상시험이 IRB 승인된 계획서, 임상시험 관리기준 및 시행규칙의 규정에 따라 수행되는지 여부 확인을 위해 시행된다. 모니터링은 한국한의학연구원에서 지정한 모니터요원이 정기적으로 임상시험 실시기관을 방문하거나 전화를 통해 실시할 수 있다.
본 임상시험의 모니터링 방문은 개시방문, 정기 모니터링, 종료 모니터링으로 이루어지며, 첫 시험 대상자 등록 후 3주 이내 첫 모니터링 방문을 실시한다. 또한, 대상자 모집 진행 속도에 따라 정기 모니터링 방문을 실시하며 마지막 대상자 방문 종료 이후에 종료 모니터링을 실시한다.
III. 고 찰
본 임상연구는 기능성 소화불량 환자를 대상으로 시행하는 무작위 배정, 평가자 눈가림, 3군 비교, 평행설계, 공개, 다기관 임상시험으로 YJT, PWS 및 SST을 8주 동안 복용하여 약물별 및 변증별 효과 및 안전성을 탐색하고, 전통 한의학적 진단법 표준화 및 한의 변증의 바이오마커 발굴을 목적으로 한다.
기능성 소화불량의 발병 원인은 이질적이고 다요인적인 특징이 있다. 위장관계의 운동장애 및 내장기 과민성뿐만 아니라, 면역학적 활성, 장벽 기능부전, 유전적 요인, 장내 미생물의 변화 등이 기능성 소화불량 발생에 기여를 한다2. 뿐만 아니라 불안, 우울, 신체화 장애, 스트레스 등의 정신건강학적 요인도 영향을 미치는 것으로 알려져 있다5.
정밀의료는 개별 유전자(gene), 전사물(transcript), 단백질(protein), 대사산물(metabolite) 등의 오믹스(omics) 정보, 생활습관 및 외부 환경정보를 정량화하여 객관적이고 재현 가능한 방식으로 한 명 이상의 대상자들에게 맞춤치료를 제공하는 것이다33. 한의학은 개인의 체질을 중시하여 개별화된 치료를 원칙으로 하는 환자중심의학으로 ‘변증’이라는 진단도구를 사용하여 임상에서 치료를 하고 있으나, 표준화가 되어있지 않고 객관성이 부족하다는 단점이 있다34. 이를 보완하기 위해 현재 설진기18, 맥진기19, 복진기20 등의 다양한 한의학적 진단기기들이 개발되었으며, 본 임상연구에서는 진단기기를 통해 얻은 데이터와 다양한 바이오마커 정보를 통합하여 변증별 바이오마커를 탐색하고 전형적인 유형을 제시하고자 한다.
최근에 구강 및 장내 미생물이 기능성 소화불량 증상을 발생시키는 요인 중의 하나로 알려지게 되면서 본 임상연구에서도 바이오마커로 사용할 수 있는 미생물을 발굴하고자 한다2. 구강 미생물의 경우 Liu 등35의 연구에 따르면, phylum 수준에서 기능성 소화불량 환자에서 건강 대조군보다 침 속에 Spirochaetes가 풍부했으며, 상대적으로 Fusobacteria, TM7 그리고 Proteobacteria의 풍부도는 낮았다. Genus 수준에서 두 군 간 Kingella 및 Abiotrophia가, species 수준에서는 Intermedia가 유의적인 차이가 있어 질병의 진단 마커로 유용할 것임을 제시하였다35. Hadizadeh 등36의 연구에서 기능성 소화불량 증상 중에서도 복통이 있는 환자와 그렇지 않은 환자를 비교했을 때, 분변 내 Prevotella 속 (genus)이 풍부할수록 복통 강도가 감소한다고 보고하였다. Fukui 등37의 연구에서는 기능성 소화불량 환자에서 건강 대조군에 비해 phylum 수준에서 Firmicutes가, genus 수준에서 Streptococcus의 비율이 높았으며, Streptococcus가 풍부할수록 상부위장관 증상도 악화되는 양의 상관관계를 갖는다고 밝혔다.
장내미생물은 여러 대사체들을 생성하며, 이는 장의 산도(pH), 면역기능, 장벽 투과성 등 장 기능에 영향을 미친다38. Zhou 등38의 연구에서는 기능성 소화불량과 관련된 장내미생물 대사체로 짧은사슬지방산(short-chain fatty acids, ScFAs), 지질 (Lipid), tryptophan을 제시하였다. ScFAs의 경우 장내 산도를 조절하고, 병원균의 성장을 저해하며 장내 염증을 조절하고 장내 치밀 결합을 유지하여 장벽 투과성이 증가하지 않도록 한다39. 아미노산의 일종인 tryptophan은 뇌-장축(brain-gut axis)을 조절하고 장내 스트레스로 유도된 손상에 대하여 보호하는 역할을 한다40. 한편, Brown 등41의 연구에서 Bacteroides가 생산하는 sphingolipids가 풍부할수록 장내 염증 발생 위험도가 감소하고, 숙주의 sphingolipids는 염증성장질환 환자의 분변에서 증가했다고 보고하였다. 또한, 혈액 내 tumor necrosis factor-α(TNF-α), interleukin-10(IL-10), 그리고 interleukin-1β(IL-1β) 등의 염증성 사이토카인 (cytokine)이 불안 및 스트레스 반응 유도하여 위십이지장의 운동성을 저해하고 내장기 과민성을 증가시킨다는 사실이 밝혀진 바 있어42, 본 임상연구에서는 혈액 및 분변 샘플을 이용하여 대사체 profile 분석을 진행할 예정이다.
모든 사람은 99.5% 비율로 동일한 유전적 배열을 가지고 있으나 0.5%의 염기 차이로 서로 다른 특징을 보이는데, 이를 단일염기다형성(single nucleotide polymorphism, SNP)이라고 한다43. 이와 관련하여 SNP와 기능성 소화불량 증상 간 상관관계를 밝히고자 하는 연구들44,45이 선행되었다. Oshima 등44의 연구에 따르면 세포 내 신호 전달에 관여하는 G Protein Subunit Beta 3(GNB3)의 C825T 유전적 다형성에 따라 기능성 소화불량 증상과 위십이지장 운동에 영향을 주는 것으로 보고 있으며, TT 동형접합체를 가진 환자에게서 EPS 발생 위험도가 높다고 보고하였다. Du 등45의 연구에서는 GNB3, SCL6A4 5HTTLPR, 그리고 Cholecystokinin receptor (CCK1R)의 유전적 다형성과 기능성 소화불량 발생 간 상관관계에 대한 메타분석을 시행했으나, GNB3 외 나머지 유전자에서 그 상관관계를 입증할 수 없었다. Xiang 등46의 연구에서 기능성 소화불량에 대해 domperidone 치료에 반응하는 군과 그렇지 않은 비반응군의 dopamine D2 receptor TaqI 유전자의 다형성을 분석한 결과, 반응군에서는 CC 동형접합체가 51.35%로 가장 많았으며, 비반응군에서는 52.05% 비율로 C/T 이형접합체가 대부분을 차지했다. 본 임상연구에서도 혈액 샘플을 통해 소화효소, 담즙산, 기타 소화기능 및 약물대사 관련 SNP을 분석하고자 한다.
본 임상연구는 여러 바이오마커 정보와 전통 한의학의 변증 데이터를 통합하는 데 그 목적이 있다. 한의학의 대표적인 진단법 중 하나인 설진은 설질과 설태를 관찰하며, 인체 내부 기관의 각종 생리적, 병리적 변화를 알 수 있다18. 기능성 소화불량 환자와 건강 대조군의 설 특성을 비교 분석한 연구47에서 설질 영역에서는 두 군 간 통계적으로 유의한 차이는 없었으나, 설태 영역에서 기능성 소화불량 환자에서 건강 대조군에 비해 붉은색 비율이 낮게 나타났으며, 실제 혀의 설태 비율에서도 통계적으로 유의한 차이가 있었다.
맥진이란 요골동맥의 맥박을 촉진하여 환자의 질병 상태를 파악하여 치료에 적응하기 위한 한의학의 사진 중 하나다48. 맥진은 임상에서 빈번하게 사용되지만, 의사마다 촉진하는 방식이 다르고 과학적으로 증명된 바가 없어 객관성을 인정받지 못하고 있다48. 만성피로증후군을 동반한 기능성 소화불량증 환자에게 있어 맥진기의 진단적 유용성을 평가한 연구49는 있었으나, 기능성 소화불량 환자의 변증에 직접적으로 적용한 연구는 많지 않아 이와 관련된 추가적인 연구가 필요할 것으로 사료된다.
복진은 복부에 나타나는 각종 징후와 환자의 증상을 종합하여 압통, 복명음, 팽만, 냉감 등 전반적인 복부의 상태를 확인하는 한의학적 진단법 중 하나이다50. Kim 등51의 연구에 따르면 2000년에서 2016년 기간에 발표된 국내 복진 연구에서 가장 많이 적용한 적응증은 소화기 질환이며, 그 중에서도 기능성 소화불량이 41.18%로 가장 높은 비율을 차지하고 있어 유용한 진단적 가치가 될 것으로 사료된다.
YJT, PWS 및 SST은 임상에서 각각 비허증, 식적증, 간울증에 사용되고 있으며, 기능성 소화불량에 대한 효과를 밝히는 연구들이 활발하게 진행되고 있다. SST의 경우 이미 만성 위염 및 기능성 소화불량에 대한 체계적 문헌고찰 연구가 진행되었으며 기존 양약에 비해 기능성 소화불량의 증상 완화에 효과적이었다52. 최근에는 기능성 소화불량과 동반된 불안 및 우울에도 효과가 있다는 보고가 있어53 기능성 소화불량 환자의 삶의 질을 높이는데 기여할 것으로 사료된다. YJT은 위장 운동 기능부전 마우스 모델 연구26에서 장 통과 속도를 단축시키고 위 배출능을 증가시키며, mosapride 및 domperidone과 비슷한 수준의 위 배출능 효과를 보여주었다. 기능성 소화불량 마우스 모델을 이용한 연구에서 PWS 투약군이 생리식염수 투약군에 비해 위 배출능 및 장 운동의 추진력을 증가시켰으며, 장 운동 저하를 촉진시키는 leptin을 감소시키고 장 운동을 조절하는 cholecystokinin(CCK)를 증가시켰다54. 본 임상연구에서는 세 약물의 실험실적 근거를 기반으로 변증에 따라 세 약물의 기능성 소화불량에 대한 효과를 객관적으로 제시하고자 한다.
본 임상연구는 기능성 소화불량 한의 변증의 객관화와 약물별 및 변증별 효과 및 안전성 탐색에 기여하고자 하며, 추후 본 임상연구의 결과를 통해 기능성 소화불량에서 한약제제의 개별맞춤 투약 모델을 개발할 예정이다. 본 임상연구를 통해 바이오마커로 활용된 미생물 균주는 분리하여 기능성 소화불량에 사용할 수 있는 프로바이오틱스(probiotics)로서 유효성을 검증할 수 있으며, 추가 임상연구를 통해 개발된 투약 모델의 유효성을 검증하는 확증 연구를 진행하고자 한다.
감사의 글
본 임상연구는 한국연구재단 바이오⋅의료기술개발사업(NRF-2022M3A9E4017033)의 지원에 의해 이루어짐.