艾葉 추출물이 알코올성 위염에 미치는 효과
Effect of Artemisiae Argyi Folium Extract on Alcohol-Induced Gastritis
Article information
Abstract
Objective:
Alcohol is known to cause inflammation in the stomach by decreasing the protective substances of the gastric mucosa and increasing oxidative stress. The purpose of this study was to investigate the anti-inflammatory effect of Artemisiae Argyi Folium extract (AF) on alcohol-induced gastritis.
Methods:
The total polyphenol and flavonoid contents of AF were confirmed through an in vitro experiment. Radical scavenging activities were confirmed using DPPH and ABTS assays. In vivo experiments were conducted on mice divided into 5 groups (n=8): a normal group (Nor), an alcohol-induced gastritis group (Con), an alcohol-induced gastritis group administered 10 mg/kg sucralfate (SC), an alcohol-induced gastritis group administered 100 mg/kg AF (AFL), and an alcohol-induced gastritis group administered 200 mg/kg AF(AFH). The serum levels of reactive oxygen species (ROS) were determined, and protein expressions were confirmed in gastric tissues.
Results:
In alcohol-induced gastritis, AF alleviated damage to the gastric mucosa caused by alcohol. AF also decreased the serum ROS levels. Western blots showed that AF decreased the expression of NADPH oxidase and decreased the expression of the NF-κB pathway associated with inflammation. AF also decreased the expression of adhesion molecules and chemokine proteins, and increased the expression of anti-inflammatory proteins.
Conclusions:
AF not only reduced oxidative stress in alcohol-induced gastritis, but it also relieved gastric mucosal inflammation by regulating the expression of the NF-κB pathway.
I. 서 론
위(胃)는 주요 소화기관 중 하나이며, 위의 상피세포가 손상되어 발생하는 염증성 소화기 질환을 위염이라고 한다1. 위염은 소염제 등 약물의 과다복용, 불규칙한 식습관 및 스트레스 등에 의해 위의 방어기전이 약해지거나 산의 분비가 증가하여 발생하며, 특히 위 점막을 손상시키는 공격인자 중 하나인 알코올은 위장의 출혈 및 염증을 유발하여 급성 위염을 유발하는 주요 원인으로 알려져 있다2. 알코올은 위 점막의 방어물질 감소, 산화적 스트레스 및 히스타민 분비를 증가시켜 위 내의 염증을 악화시키며, 장기간 음주는 위장 장애 및 만성 위염까지 유발시킬 수 있어 알코올을 남용하지 않는 것이 중요하다2,3. 현재에는 위염 치료를 위하여 과도한 위산 분비에 의한 점막 손상을 막기 위한 제산제, 산 분비 억제제, proton pump inhibitors(PPIs) 및 H2 수용체 길항제 등이 사용되고 있으나 이러한 약물들에서 발기 부전, 부정맥, 과민증 및 여성형 유방 등의 여러 부작용이 나타나고 있어 위염 치료를 위한 새로운 치료제를 찾는 것이 중요하게 여겨지고 있다4,5.
艾葉(Artemisiae Argyi Folium)은 국화과 식물로써 동아시아 전체에 거쳐 분포하는 것으로 알려져 있다. 예로부터 艾葉은 습진과 같은 피부질환이나 자궁출혈, 월경과다, 월경불순 및 폐경기 질환과 같은 부인과 질환 및 헐액응고약 등의 목적으로 사용되어 왔으며, 소염 및 진통완화 효능이 있는 것으로 알려져 널리 사용되어 왔다6. 또한, 艾葉에는 트리테르페노이드, 플라보노이드 및 탄닌 등과 같은 성분이 다량 포함되어 있어 우수한 항산화 효능을 나타내며, 그 외에도 다양한 연구를 통해 항염증 및 간보호 등의 효과가 있는 것으로 밝혀졌다7-9.
이에 본 연구에서는 알코올로 유발한 위염 동물 모델에 대한 艾葉 추출물의 효과 및 그 기전을 확인하기 위하여 NADPH oxidase, 염증 및 항염증성 단백질과 adhesion molecule 및 chemokine 단백질 발현을 확인하였으며, 유의한 결과를 얻었기에 보고하는 바이다.
II. 재료 및 방법
1. 재 료
1) 시 료
본 실험에서 사용한 艾葉은 옹기한약국(Daegu, Korea)에서 구입하였으며, 생약규격집에 맞추어 관능검사한 후 약전규격에 적합한 것만을 사용하였다. 艾葉 200 g 분쇄하여 증류수 2,000 mL 첨가한 후 열탕 추출기를 사용하여 2시간 추출하였다. 얻어진 추출물은 감압 농축장치로 농축 후, 동결 건조기를 이용해 완전 건조시켰으며, 얻어진 파우더(AF, yield 13.2%)는 -80 °C에서 보관하였다.
2) 시 약
본 실험에 사용된 sucrose octasulfate aluminum complex(sucralfate), 2-Diphenyl-1-picrylhydrazyl(DPPH), 2,2’-azino-bis(3-ethylbenzothiazoline-6-sulphonic acid)(ABTS), potassium persulfate, gallic acid, Folin-Ciocalteu’s phenol reagent, sodium carbonate, 2-Mercaptoethanol, quercetin, potassium phosphate monobasic, potassium phosphate dibasic, methanol, phenylmethanesulfonyl fluoride(PMSF) 및 Bromophenol blue는 Sigma-Aldrich Co.(St. Louis, MO, USA)에서 구입하여 사용하였으며, aluminum chloride 및 L-ascorbic acid는 Alfa Aesar(Wardhill, CA, USA)에서 구입하여 사용하였다. Potassium acetate 및 sodium carbonate는 Daejung chemicals & metals Co., Ltd. (Siheung, Korea)에서 구입하였고, 2’,7’-Dichlorofluorescein diacetate(DCFDA)는 Molecular Probes(Eugene, OR, USA)에서 구입하였으며, phosphoric acid, hydrochloric acid 및 glycerin는 Duksan Company(Asan, Korea)에서 구입하였다. 또한, protease inhibitor mixture solution 및 ethylenediaminetetraacetic acid(EDTA)는 Wako Pure Chemical Industries, Ltd.(Osaka, Japan)에서 구입하였다. 1차 항체 Gp91phox(NOX2), p47phox, p22phox, nuclear factor-κ B p65(NF-κBp65), phospho-inhibitor of nuclear factor κ B α(p-IκBα, inhibitor of nuclear factor κ B α(IκBα), inducible nitric oxide synthase (iNOS), cycloxygenase-2(COX-2), tumor necrosis factor-α(TNF-α), interleukin-6(IL-6), intracellular adhesion molecule-1(ICAM-1), vascular cell adhesion molecule-1(VCAM-1), monocyte chemotactic protein-1(MCP-1), interleukin-4(IL-4), interleukin-10(IL-10), Histone 및 β-actin은 Santa Cruz Biotechnology, Inc.(Dallas, TX, USA)에서 구입하였으며, 2차 항체 Goat anti-rabbit 및 goat anti-mouse IgG HRP-conjugated는 Gene Tex, Inc. (Irvine, LA, USA)에서 구입하였다. ECL Western Blotting Detection Reagents는 Cyanagen Srl(Bologna, Italy)에서 구입하여 사용하였으며, 단백질 정량을 위한 BCA protein assay kit는 Thermo Scientific (Waltham, MA, USA)에서 구입하였다.
3) 실험 동물
5주령 수컷 ICR mouse(DBL, Chungbuk, Korea)를 구입하여 1주일 동안 실험실 환경에 적응시킨 후 실험을 진행하였다. 동물 사육실 조건은 conventional system으로 온도 22±2 °C, 습도 50±5%, 명암주기 (light: dark cycle)는 12시간 주기로 조절하였고, 사료(조단백질 18% 이상, 조지방 5.0% 이상, 조섬유 5.0% 이하, 조회분 8.0% 이하, 칼슘 1.0% 이상, 인 0.85% 이상, 칼륨 0.55% 이상, 나트륨 0.25% 이상, 마그네슘 0.15% 이상, NIH-41, Zeigler Bros, Inc., Gardners, PA, USA)와 물을 충분히 공급하였다. 본 연구는 동물실험의 윤리적, 과학적 타당성 검토 및 효율적인 관리를 위하여 대구한의대학교 동물실험윤리 위원회(Institutional Animal Care and Use Committee: IACUC)의 승인(승인번호: DHU2022-061)을 받아 진행되었다.
2. 방 법
1) Total polyphenol 및 total flavonoid 함량 측정
Total polyphenol 함량은 Rama 등10의 참고하여 측정하였다. 시료 100 μL에 10% Folin-Ciocalteu’s phenol reagent 500 μL 및 7.5% sodium carbonate 400 μL를 혼합하여 실온에서 30분간 반응시킨 후 UV 분광광도계(Infinite M200, Tecan Group Ltd., Männedorf, Switzerland)를 이용하여 765 nm에서 흡광도를 측정하였다. 표준물질은 gallic acid를 사용하였으며, 표준 검량선을 구하고 시료 추출물의 total polyphenol 함량을 산출하였다.
Total flavonoid 함량은 Jiao 등11의 방법을 참고하여 측정하였다. 시료 100 μL, 10% aluminum chloride solution 20 μL, 1 M potassium acetate solution 20 μL, methanol 300 μL 및 증류수 560 μL를 혼합하여 실온에서 30분간 반응시킨 후 UV 분광광도계를 이용하여 415 nm에서 흡광도를 측정하였다. 표준물질로는 quercetin을 사용하였으며, 표준 검량선을 구하여 추출물의 total flavonoid 함량을 산출하였다.
2) DPPH radical 소거 활성 측정
AF의 DPPH radical 소거능은 Blois법12을 참고하여 측정하였다. 농도별로 희석한 시료 100 μL와 60 μM DPPH 용액 100 μL를 혼합하여 30분간 암소상태로 방치한 후 UV 분광광도계를 이용하여 540 nm에서 흡광도를 측정하였다. 양성대조군으로 L-ascorbic acid를 사용하였으며, 50%의 radical이 소거되는 농도를 IC50으로 나타냈다.
3) ABTS radical 소거 활성 측정
AF의 ABTS radical 소거능은 Re 등13의 방법을 참고하여 측정하였다. 7.4 mM ABTS용액과 2.4 mM potassium persulfate를 혼합하여 실온의 암소 상태에서 약 16시간 이상 방치하여 ABTS+을 형성시킨 후 415 nm에서 흡광도 값이 0.70±0.02이 되게 ethanol로 희석하였다. 농도별로 희석한 시료 5 μL와 희석된 ABTS 용액 95 μL를 혼합하여 15분 동안 방치한 후 UV 분광광도계를 이용하여 415 nm에서 흡광도를 측정하였다. 양성대조군으로 L-ascorbic acid를 사용하였으며, 50%의 radical이 소거되는 농도를 IC50으로 나타냈다.
4) 알코올성 위염 유발 및 동물 처치
실험군은 정상군(Nor), 알코올성 위염 유발 군(Con), sucralfate 10 mg/kg+알코올성 위염 유발 군(SC), AF 100 mg/kg+알코올성 위염 유발 군(AFL), AF 200 mg/kg+알코올성 위염 유발 군(AFH) 총 5군으로 각 8마리씩 분리하였다. 18시간 절식 후, 각 약물을 증류수 10 mL/kg에 농도에 맞게 희석하여 경구투여 하였으며, 1시간 후 50% ethanol을 0.55 mL 경구투여하여 알코올성 위염을 유발하였다. 1시간 후 Isoflurane(Telangana, India)로 마취하여 복대정맥에서 혈액을 채취하였으며, 위 조직을 적출하였다. 채취한 혈액에서 혈청을 분리하였으며, 혈청과 위 조직은 -80 °C에서 보관하였다.
5) 위 점막 손상도 측정
적출한 위 조직은 saline으로 세척한 후 고정하여 광학 디지털 카메라(DSCHX50V, Sony, Tokyo, Japan)를 이용하여 촬영하였다. 손상된 위 점막 측정은 iSolution Lite×64(IMT I-Solution Inc., Burnaby, BC, Canada) 프로그램을 이용하여 실제 손상 부위의 면적을 측정한 후, 위 전체 면적과 비교하여 비율로 표시하였다.
위 손상비율=위 손상 면적/위 전체 면적×100
6) ROS 측정
Reactive oxygen species(ROS) 값은 다음과 같이 측정하였다14. 샘플 10 μL, 50 mM phosphate buffer 190 μL 및 1.25 mM DCFDA 50 μL를 혼합한 후, UV 분광광도계(Infinite F200, Tecan Group Ltd., Männedorf, Switzerland)를 이용하여 0분부터 매 5분씩 emission 파장 530 nm와 excitation 파장 485 nm를 이용하여 30분간 형광값의 변화를 측정하였다. ROS의 수준은 Normal군과의 상대적인 비로 나타냈다(represented as 1).
7) 위 조직 Western blotting
간 조직의 세포질을 얻기 위해 10 mM KCl, 10 mM HEPES(pH 7.8), 2 mM MgCl2, 1 mM DTT, 0.1 mM PMSF, 0.1 mM EDTA, protease inhibitor mixture solution을 첨가한 buffer A를 넣고 조직 분쇄기(tissue grinder)(Biospec Product, Bartlesville, OK, USA)로 분쇄한 후 10% NP-40을 첨가하여 아이스 위에서 30분간 정치하였으며, 원심분리(12,000 rpm, 4 °C, 2분)하여 세포질을 포함하고 있는 상층액을 분리하였다. 핵을 얻기 위해 10% NP-40가 더해진 buffer A에 두 번 헹구고 100 μL의 buffer C(50 mM HEPES, 50 mM KCl, 0.3 mM NaCl, 0.1 mM EDTA, 1 mM DTT, 0.1 mM PMSF, 10% glycerol)를 첨가해 재부유시킨 후 10분마다 vortex를 3번 하였다. 그 후 원심분리(12,000 rpm, 4 °C, 10분)하여 핵을 포함하고 있는 상층액을 얻어 -80 °C에서 각각 냉동 보관하였다. 위 조직 세포질의 NOX2, p47phox, p22phox, p-IκBɑ, IκBɑ, iNOS, COX-2, TNF-ɑ, IL-6, IL-4, IL-10, ICAM-1, VCAM-1, MCP-1 및 β-actin 단백질과 핵에서의 NF-κBp65 및 Histone 단백질 발현을 측정하기 위하여 12 μg의 단백질을 10-12% SDS polyacrylamide gel을 이용하여 전기연동 후, acrylamide gel을 nitrocellulose membrane으로 이동시켰다. 준비된 membrane에 각각의 1차 antibody (1:1000)를 처리하여 4 °C에서 overnight 시킨 다음 PBS-T로 6분마다 5회 세척하고, 각각 처리된 1차 antibody에 사용되는 2차 antibody(1:3000)를 사용하여 상온에서 2시간 반응시킨 후, PBS-T로 6분마다 5회 세척하였다. 단백질 발현을 확인하기 위하여 membrane을 enhanced chemiluminescence(ECL) 용액에 노출시킨 후, Sensi-Q2000 Chemidoc(Lugen Sci Co., Ltd., Seoul, Korea)에 감광시켜 단백질 발현을 확인한 후, 해당 band를 ATTO Densitograph Software(ATTO Corporation, Tokyo, Japan) 프로그램을 사용하여 정량하였다.
8) 통계분석
In vitro의 수치는 mean±SEM으로, in vivo의 수치는 mean±SD로 표시하였으며, SPSS(Version 26.0, IBM, Armonk, NY, USA)를 사용하여 one-way analysis of variance(ANOVA) test를 실시한 후 least-significant differences(LSD) test로 사후검정을 실시하여 각 군의 평균 차이에 대한 통계적 유의성을 *p<0.05, **p<0.01, ***p<0.001에서 검증하였다.
III. 결 과
1. Total polyphenol 및 total flavonoid 함량 측정
AF의 total polyphenol 및 total flavonoid 함량을 측정한 결과, total polyphenol 함량은 91.12±0.13 mg GAE/g으로 나타났으며, total flavonoid 함량은 24.21±0.45 mg QE/g으로 높은 total polyphenol과 total flavonoid 함량을 나타냈다(Table 1).
2. DPPH 및 ABTS radical 소거 활성 측정
DPPH 및 ABTS radical 소거법을 이용하여 AF의 항산화 활성을 측정하였다. AF의 DPPH radical 소거 활성을 측정한 결과, IC50=10.11±0.09 μg/mL로 나타났으며, ABTS radical 소거 활성은 IC50= 33.34±0.41 μg/mL로 높은 항산화 활성을 나타냈다(Table 2).
3. 위 점막 손상도 측정
알코올성 위염으로 인한 위 점막의 손상을 확인한 결과, Nor군(0.04±0.01%)에서는 위 점막 내의 어떠한 손상도 발견되지 않았으나 알코올성 위염을 유발한 Con군(4.58±1.07%)에서는 위 점막 내 넓은 범위에 거쳐 붉은 병변 및 출혈이 발견되었다. 반면 Con군 대비 SC군(3.52 ±0.55%)에서는 위 점막 내 병변이 감소한 것을 확인하였으며, AFL군(2.67±0.84%)과 AFH군(2.12±0.47%)에서 또한 Con군에 비해 위 점막 내 손상이 감소하였으며, AF 투여군에서 양성대조군인 SC군보다 더 뛰어난 개선 효과를 보였다(Fig. 1).
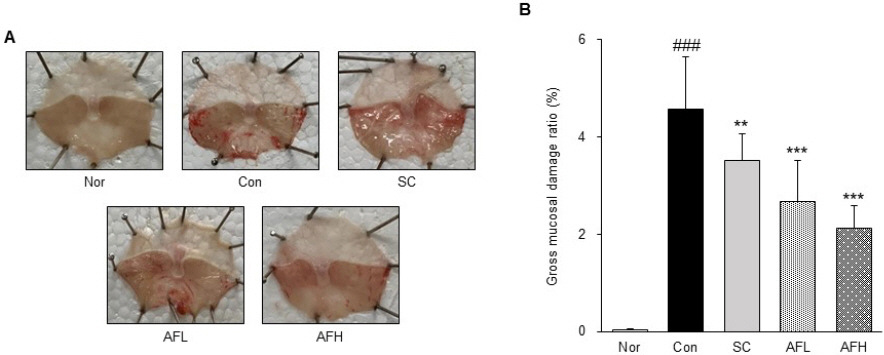
Optical changes of gastric mucosa in alcohol-induced gastritis.
(A) : a representative gross image. (B) : gastric mucosal damage ratio, Nor : normal group, Con : alcohol-induced gastritis group, SC : sucralfate 10 mg/kg and alcohol-induced gastritis group, AFL : AF 100 mg/kg and alcohol-induced gastritis group, AFH : AF 200 mg/kg and alcohol-induced gastritis group. AF : Artemisiae Argyi Folium extract. All date are expressed mean±SD (n=8). Significance : ###p<0.001 vs. Nor group and **p<0.01, ***p<0.001 vs. Con group
4. ROS 측정
혈청 내에서 산화적 스트레스 바이오마커인 ROS의 수준을 확인하였다. 그 결과, Nor군 대비 Con군에서 32% 유의하게 증가하였으며, Con군 대비 SC군에서 10% 유의하게 감소하였다. 또한, Con군 대비 AFL군과 AFH군에서도 각각 13%, 21% 유의하게 감소하였으며, AFH군에서는 Nor군과 유사한 수치를 나타냈다(Fig. 2).
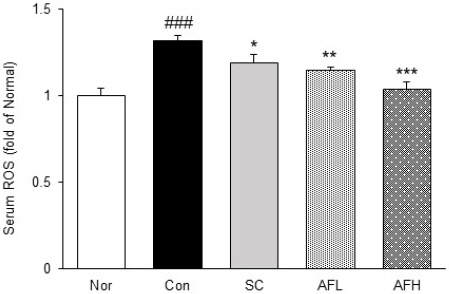
Levels of serum ROS in alcohol-induced gastritis.
Nor : normal group, Con : alcohol-induced gastritis group, SC : sucralfate 10 mg/kg and alcohol- induced gastritis group, AFL : AF 100 mg/kg and alcohol-induced gastritis group, AFH : AF 200 mg/kg and alcohol-induced gastritis group. AF : Artemisiae Argyi Folium extract. All date are expressed mean±SD (n=8). Significance : ###p<0.001 vs. Nor group and *p<0.05, **p<0.01, ***p<0.001 vs. Con group
5. 위 조직 Western blotting
1) 위 조직 내 NADPH oxidase 발현량 분석
위 조직 내에서 NADPH oxidase인 NOX2, p47phox 및 p22phox의 발현을 확인하였다. NOX2의 발현은 Nor군 대비 Con군에서 37% 유의하게 증가하였으며, Con군 대비 SC군에서 14% 유의하게 감소하였고, AFL군과 AFH군에서 각각 22%, 25% 유의하게 감소하였다. 또한, p47phox와 p22phox의 발현은 Nor군 대비 Con군에서 각각 61%, 42% 유의하게 증가하였으며, Con군 대비 SC군에서 각각 22%, 20% 유의하게 감소하였다. AFL군과 AFH군에서는 p47phox의 발현이 각각 18%, 26% 유의하게 감소하였으며, p22phox의 발현은 각각 25%, 29% 유의하게 감소하였다. Con군 대비 AFH군에서 NOX2와 p22phox의 발현이 유의하게 감소하여 Nor군과 유사한 수치를 나타냈다(Fig. 3).
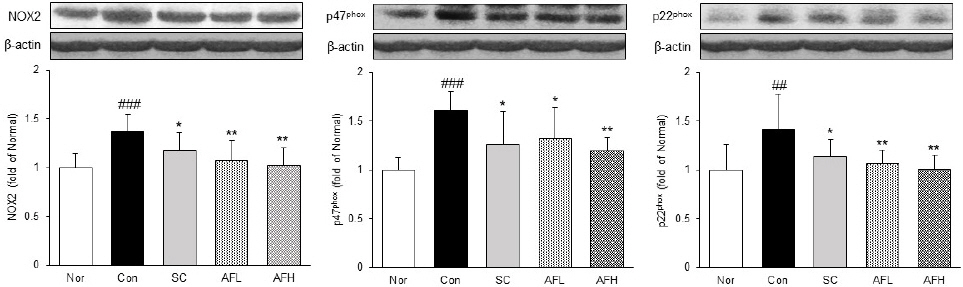
Expression of NADPH oxidase in gastric tissue.
Nor : normal group, Con : alcohol-induced gastritis group, SC : sucralfate 10 mg/kg and alcohol-induced gastritis group, AFL : AF 100 mg/kg and alcohol-induced gastritis group, AFH : AF 200 mg/kg and alcohol-induced gastritis group. AF : Artemisiae Argyi Folium extract. All date are expressed mean±SD (n=8). Significance : ##p<0.01, ###p<0.001 vs. Nor group and *p<0.05, **p<0.01 vs. Con group
2) 위 조직 내 NF-κBp65 및 p-IκBɑ 발현량 분석
위 조직 내에서 NF-κBp65 및 p-IκBɑ의 발현을 확인하였다. NF-κBp65 및 p-IκBɑ의 발현은 Nor군 대비 Con군에서 각각 32%, 33% 유의하게 증가하였고, Con군 대비 SC군에서 21%, 18% 유의하게 감소하였으며, AFL군에서 또한 20%, 18% 유의하게 감소하였다. AFH군에서는 Con군 대비 각각 22%, 25% 유의하게 감소하여 Nor군과 유사한 수치를 나타냈다(Fig. 4).

Expression of NF-κBp65 and p-IκBɑ in gastric tissue.
Nor : normal group, Con : alcohol-induced gastritis group, SC : sucralfate 10 mg/kg and alcohol-induced gastritis group, AFL : AF 100 mg/kg and alcohol-induced gastritis group, AFH : AF 200 mg/kg and alcohol-induced gastritis group. AF : Artemisiae Argyi Folium extract. All date are expressed mean±SD (n=8). Significance : ###p<0.001 vs. Nor group and **p<0.01, ***p<0.001 vs. Con group
3) 위 조직 내 염증매개인자 및 염증성 cytokine 발현량 분석
위 조직 내에서 염증매개인자 iNOS, COX-2와 염증성 cytokine TNF-ɑ, IL-6의 발현을 확인하였다. iNOS와 COX-2의 발현은 Nor군 대비 Con군에서 48%, 56% 유의하게 증가하였으며, Con군 대비 SC군에서 각각 21%, 25% 유의하게 감소하였다. 또한, AFL군에서는 Con군 대비 각각 26%, 22% 유의하게 감소하였으며, AFH군에서는 32%, 35% 유의하게 감소하여 Nor군과 유사한 수준으로 나타났다. TNF-ɑ와 IL-6의 발현은 Nor군 대비 Con군에서 각각 39%, 52% 유의하게 증가하였으며, Con군 대비 SC군에서는 19%, 23% 유의하게 감소하였고, AFL군에서는 각각 21%, 19% 유의하게 감소하였다. 또한, AFH군에서는 각각 26%, 30% 감소하여 Nor군과 유사한 수준을 나타냈다(Fig. 5).
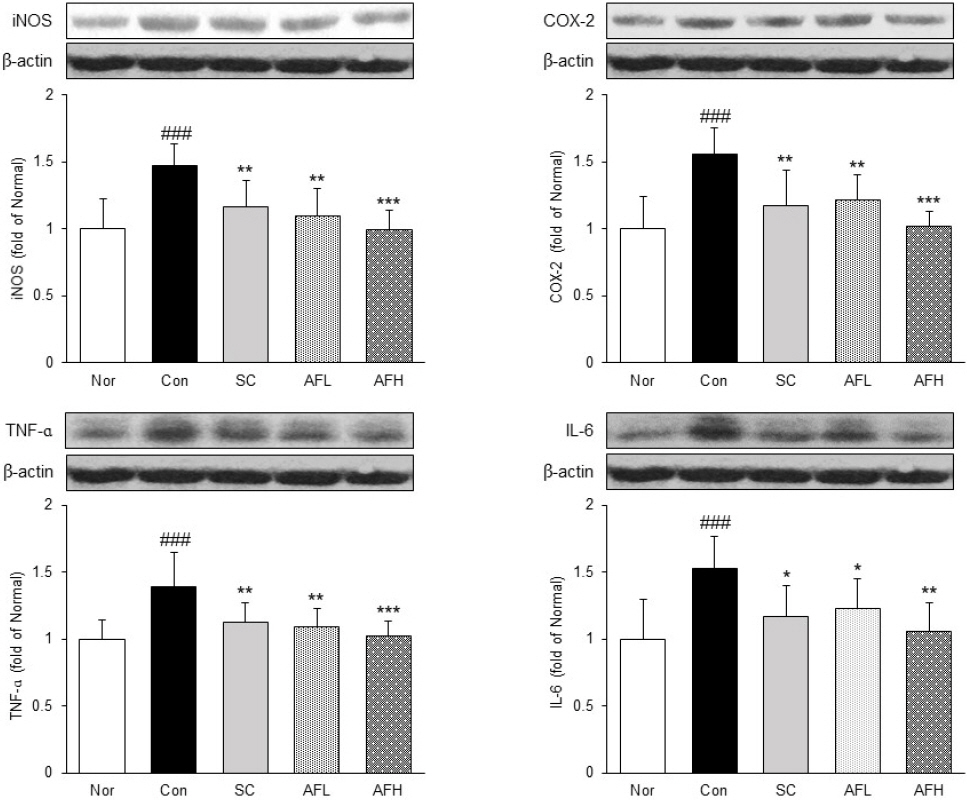
Expression of inflammatory protein in gastric tissue.
Nor : normal group, Con : alcohol-induced gastritis group, SC : sucralfate 10 mg/kg and alcohol-induced gastritis group, AFL : AF 100 mg/kg and alcohol-induced gastritis group, AFH : AF 200 mg/kg and alcohol-induced gastritis group. AF : Artemisiae Argyi Folium extract. All date are expressed mean±SD (n=8). Significance : ##p<0.01, ###p<0.001 vs. Nor group and *p<0.05, **p<0.01, ***p<0.001 vs. Con group
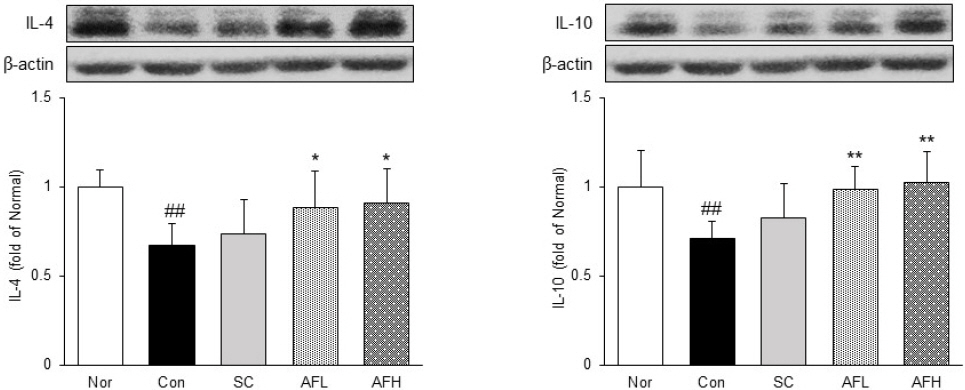
4) 위 조직 내 항염증성 cytokine 발현량 분석
위 조직 내에서 항염증성 cytokine IL-4와 IL-10의 발현을 확인하였다. IL-4와 IL-10의 발현은 Nor군 대비 Con군에서 각각 39%, 52% 유의하게 감소한 반면에 Con군 대비 SC군에서는 IL-4와 IL-10 모두 증가하는 경향을 나타냈으며, AFL군에서는 각각 21%, 19% 유의하게 증가하였다. 또한, AFH군에서는 Con군 대비 각각 26%, 30% 유의하게 증가하였으며, IL-10의 발현이 Nor군의 수준까지 증가한 것을 확인하였다(Fig. 6).

Expression of anti-inflammatory protein in gastric tissue.
Nor : normal group, Con : alcohol-induced gastritis group, SC : sucralfate 10 mg/kg and alcohol-induced gastritis group, AFL : AF 100 mg/kg and alcohol-induced gastritis group, AFH : AF 200 mg/kg and alcohol-induced gastritis group. AF : Artemisiae Argyi Folium extract. All date are expressed mean±SD (n=8). Significance : ##p<0.01 vs. Nor group and *p<0.05, **p<0.01 vs. Con group
5) 위 조직 내 adhesion molecules 및 chemokine 발현량 분석
위 조직 내에서 adhesion molecules인 ICAM-1, VCAM-1 및 chemokine인 MCP-1의 발현을 확인하였다. ICAM-1과 VCAM-1 발현은 Nor군 대비 Con군에서 각각 35%, 37% 유의하게 증가한 반면 Con군 대비 SC군에서 각각 23%, 20% 유의하게 감소하였다. 또한, Con군 대비 AFL군에서는 각각 24%, 20% 유의하게 감소하였으며, AFH군에서 또한 각각 26%, 25% 유의하게 감소하였다. MCP-1의 발현은 Nor군 대비 Con군에서 32% 유의하게 증가하였으며, Con군 대비 SC군에서 11% 유의하게 감소하였고, AFL군과 AFH군에서 각각 20%, 23% 유의하게 감소하였다(Fig. 7).
Expression of adhesion molecule and chemokine in gastric tissue.
Nor : normal group, Con : alcohol-induced gastritis group, SC : sucralfate 10 mg/kg and alcohol-induced gastritis group, AFL : AF 100 mg/kg and alcohol-induced gastritis group, AFH : AF 200 mg/kg and alcohol-induced gastritis group. AF : Artemisiae Argyi Folium extract. All date are expressed mean±SD (n=8). Significance : ##p<0.01, ###p<0.001 vs. Nor group and *p<0.05, **p<0.01, ***p<0.001 vs. Con group.
IV. 고 찰
위염은 위 점막에 발생하는 염증성 질환으로써 전 세계 인구에서 나타나는 흔한 질환이지만 그 유병률이 높게 나타나 심각한 건강 문제로 자리잡고 있다15. 이에 본 연구에서는 알코올에 의해 유발된 위염에 대한 艾葉 추출물(AF)의 위 점막 보호 효과 및 그에 대한 작용 기전을 조사하였다.
艾葉은 예로부터 소염 및 진통완화를 목적으로 사용되어 왔으며, 플라보노이드, 탄닌 등과 같은 항산화 물질을 다량 함유하고 있어 항산화 효능 또한 뛰어난 것으로 알려져 있다7. 이에 본 연구에서는 in vitro 실험을 통해 AF의 항산화 활성을 측정하였으며, 그 결과 total polyphenol 함량 91.12±0.13 mg GAE/g, total flavonoid 함량 24.21±0.45 mg NE/g으로 나타났으며, DPPH radical 소거 활성 IC50=10.11±0.09 μg/mL, ABTS radical 소거 활성 IC50=33.34±0.41 μg/mL로 뛰어난 항산화 활성을 나타냈다(Table 1, 2).
이를 토대로 알코올성 위염에 대한 AF의 위 점막 보호 효과를 확인하였다. 알코올은 위에서 운동성 장애 및 점막의 병변을 유발하며, 장기간 알코올의 섭취는 위 및 식도에서 암으로 진행될 가능성을 증가시키는 것으로 알려져 있다16. 이에 50% ethanol로 위염을 유발한 동물 모델을 이용하여 AF의 효과를 확인하였다. 일반적으로 많은 종류의 유효 성분들이 체내에 흡수되기까지 30분에서 그 이상까지의 시간이 걸리는 것으로 알려져 있다. 또한 같은 날 약물투여와 병증 유발을 실시하는 다수의 연구에서 약물투여 1시간 후 병증 유발을 실시하였다17-19. 이에 본 연구에서도 AF 경구투여 1시간 후 50% ethanol 투여하여 AF의 효과를 확인하였으며, 그 결과 증류수 투여 후 위염을 유발한 Con군과 비교하여 AF를 투여한 군에서 위 점막의 손상 면적이 유의하게 감소한 것을 확인하였다(Fig. 1).
알코올은 체내에서 산화촉진제와 항산화제 사이의 균형을 방해하여 산화적 손상을 초래하며, reactive oxygen species(ROS) 생성에 관여하여 단백질 및 DNA 손상을 유도하는 것으로 알려져 있다20. 또한, 이러한 ROS는 NADPH oxidase(NOX)에 의해서도 생성된다고 알려져 있다. NOX family 중 NOX2는 p22phox과 이종이량체 복합체 형태로 존재하며, 외부의 다양한 자극에 의해 p47phox과 같은 세포질 단백질 인자에 의해 활성화되어 신호 전달, 혈관 신생 및 세포 사멸 등 다양한 생리적 과정에 참여하는 것으로 알려져 있다21. 이에 본 연구에서는 혈액 내 ROS 수준을 확인하였으며, western blot을 통해 위 조직 내에서 NOX2, p47phox 및 p22phox의 발현을 확인하였다. 그 결과, AF는 위염으로 인해 증가한 혈액 내 ROS 수준을 유의하게 감소시켰고, 위 조직 내에서 NOX2, p47phox 및 p22phox의 발현을 유의하게 감소시켰으며, 이러한 결과는 양성대조군으로 사용한 sucralfate 투여군 보다 AF 투여군에서 더 우수하게 나타났다(Fig. 2, 3).
또한, 위 조직 내에서 염증성 단백질과 adhesion molecule 및 chemokine 단백질 발현을 확인하였다. 주요한 염증 전사인자인 NF-κB는 염증반응, 면역, 세포사멸, 세포증식 등 다양한 생리기능에 관여하는 것으로 알려져 있다. NF-κB는 정상적인 상태에서는 IκBɑ와 결합하여 불활성 상태로 세포질에 존재하다가 oxidative stress 및 외부의 여러 자극에 의해 NF-κB 전사 유도가 일어나게 되는데, 그 과정에서 IκBɑ는 인산화되어 NF-κB와 분리되며, 분리된 NF-κB는 핵으로 들어가 cytokine(TNF-ɑ, IL-6 등), chemokine(MCP-1 등), adhesion molecule(ICAM-1, VCAM-1 등) 및 유도효소(iNOS, COX-2 등)의 발현을 유도하여 염증반응을 일으킨다22,23. 본 연구에서는 western blot을 통해 위 조직 내에서 염증 반응과 관련이 있는 NF-κBp65, p-IκBɑ, iNOS, COX-2, TNF-ɑ, IL-6, ICAM-1, VCAM-1 및 MCP-1의 발현을 확인하였다. 그 결과, AF를 투여한 모든 군에서 알코올성 위염에서 염증으로 인해 증가한 염증 반응 관련 단백질들의 발현이 유의하게 조절되었으며, 이러한 결과는 양성대조군인 sucralfate 투여군 보다 AF 투여군에서 더 우수하게 나타났다(Fig. 4, 5, 7).
본 연구에서는 추가적으로 항염증성 cytokine으로 알려진 IL-4와 IL-10의 발현을 확인하였다. IL-4와 IL-10은 단핵세포와 대식세포에서 cytokine 및 chemokine의 분비를 억제하는 항염증 가능을 가지는 것으로 알려져 있으며, 특히 IL-10은 활성화된 호중구 및 대식세포를 비활성화시켜 다양한 cytokine의 생성을 감소시켜 염증을 완화시키고, 항염 효과를 증진시키는 물질들의 표현을 향상시키는 것으로 알려져 있다24,25. 본 연구 결과 AF는 IL-4 및 IL-10의 발현을 유의하게 증가시켰으며, 특히 IL-10의 발현이 정상군의 수준까지 증가한 것을 확인하였다(Fig. 6).
이러한 결과는 艾葉 추출물은 알코올성 위염에서 산화적 스트레스 감소에 영향을 끼칠 뿐만 아니라 NF-κB 경로 및 adhesion molecule, chemokine의 발현을 조절함으로써 위 점막의 염증을 완화시키는 것으로 판단된다.
V. 결 론
본 연구에서는 艾葉 추출물이 알코올성 위염에 미치는 효과와 그 기전을 확인하였다. 먼저, ICR mouse에게 艾葉 추출물을 경구투여한 후 알코올성 위염을 유발하였으며, 위 조직 내에서 NADPH oxidase, 염증 및 항염증성 단백질과 adhesion molecule 및 chemokine 단백질 발현을 확인하였으며, 그 결과는 다음과 같았다.
1. 艾葉 추출물의 total polyphenol 함량은 91.12±0.13 mg GAE/g으로 나타났으며, total flavonoid 함량은 24.21±0.45 mg NE/g으로 나타났다. 또한, 艾葉 추출물의 DPPH radical 소거 활성은 IC50=10.11±0.09 μg/mL, ABTS radical 소거 활성은 IC50=33.34±0.41 μg/mL로 뛰어난 항산화 활성을 나타냈다.
2. 艾葉 추출물은 알코올에 의해 유발된 위염에서 위 점막의 병변을 유의하게 감소시켰다.
3. 艾葉 추출물은 알코올에 의해 유발된 위염에서 혈청 내 ROS 수준을 유의하게 감소시켰으며, 위 조직 내 NOX2, p47phox 및 p22phox의 발현을 유의하게 감소시켰다.
4. 艾葉 추출물은 알코올에 의해 유발된 위염에서 염증성 단백질인 NF-κBp65, p-IκBɑ, iNOS, COX-2, TNF-ɑ 및 IL-6의 발현을 유의하게 감소시켰다.
5. 艾葉 추출물은 알코올에 의해 유발된 위염에서 항염증성 단백질인 IL-4 및 IL-10의 발현을 유의하게 감소시켰다.
6. 艾葉 추출물은 알코올에 의해 유발된 위염에서 adhesion molecule 단백질인 ICAM-1, VCAM-1과 chemokine인 MCP-1의 발현을 유의하게 감소시켰다.
이러한 결과는 艾葉 추출물은 알코올성 위염에서 산화적 스트레스 감소에 영향을 끼칠 뿐만 아니라 NF-κB 경로 및 adhesion molecule, chemokine의 발현을 조절함으로써 위 점막의 염증을 완화시키는 것으로 판단되며, 이러한 결과를 통해 艾葉이 알코올로 인한 위염을 치료할 수 있는 새로운 소재로서의 가능성이 있다고 판단된다.
감사의 글
이 연구는 2022년도 정부(과학기술정보통신부)의 재원으로 한국연구재단의 지원을 받아 수행되었습니다(No. 2018R1A5A2025272).

