解肝煎이 Thioacetamide로 유발된 간섬유화에 미치는 영향
Effect of Haegan-jeon on Thioacetamide-Induced Liver Fibrosis
Article information
Abstract
Objective:
To investigate the protective effects of Haeganjeon on a thioacetamide (TAA)-induced liver fibrosis mouse model and to determine the Haegan-jeon signaling pathway.
Methods:
Mice were randomly divided into 4 groups: Normal group (Nor), TAA-induced liver fibrosis group (Con), TAA-induced liver fibrosis group administered 50 mg/kg silymarin (S50), TAA-induced liver fibrosis group administered 200 mg/kg Haegan-jeon (H200). The liver fibrosis mouse model was established by intraperitoneal injection with TAA three times a week for 8 weeks. During the 8 weeks, mice were orally administered silymarin and Haegan-jeon every day. At the end of the study, serum was collected to measure the levels of AST, ALT, ammonia, and myeloperoxidase (MPO). Liver tissue was harvested and analyzed by western blotting and Masson’s trichrome staining.
Results:
Administration of Haegan-jeon suppressed the increase in serum levels of AST, ALT, ammonia, and MPO due to TAA-induced liver fibrosis. Compared to the Con group, the H200 group showed increases in antioxidant-related factors (Nrf2, HO-1, catalase, and GPx-1/2) and decreases in inflammatory-related factors (NF-κB p65, p-IκB-α, Cox-2, iNOS, TNF-α, and IL-1β) in western blots. The H200 treatment inhibited the expression of α-SMA and Collagen I.
Conclusions:
Haegan-jeon showed a hepatoprotective effect induced by activation of antioxidant-related factors, such as Nrf2, and it regulated the inflammation response by suppression of NF-κB.
I. 서 론
간은 현대사회에 있어 산업화에 따른 유독물질과 공해물질에 의해 끊임없이 해독작용에 시달리고 있다. 또한 스트레스, 흡연, 음주, 바이러스, 지질과산화 등으로 인해 간손상이나 간암과 같은 간질환의 발병률이 증가하고 있다1. 만성 간손상이 발생하면 간세포의 cytokine 분비가 증가되고 간 성상 세포(hepatic stellate cell)를 자극하여 활성화시킨다2. 활성화된 간 성상 세포는 근섬유모세포로 분화되어 세포 외 기질(extracellular matrix)의 생성을 증가시키고, 콜라겐 침착과 조직 손상을 유도해 간섬유화를 유발한다3. 간섬유화는 초기에는 가역적이지만 지속되면 궁극적으로 간경변증을 초래하는데, 간경변까지 이어지게 되면 돌이킬 수 없으므로 간섬유화를 치료하는 것이 중요하게 여겨지고 있다4.
Thioacetamide(TAA)는 동물모델에서 간섬유화를 유도하는 데 일반적으로 사용되고 있는 간독소 물질이다5. TAA 자체로는 간에 독성이 없으나 활성산소종(Reactive oxygen species, ROS)인 thioacetamide-S-oxide를 매개로 하여 공유결합에 의해 간 세포의 손상과 괴사가 유발된다6. 간섬유화의 유발에 사용되는 물질에는 TAA 외에도 Dimethylnitrosamine(DMNA), Carbon tetrachloride(CCl4)와 같은 물질도 있지만 TAA의 경우 다른 독성물질보다 재생 결절과 간섬유화가 더 뚜렷하며 조직소견이 사람과 더 유사하게 유발된다는 이점이 있다7. 이러한 이유로 TAA는 간손상이나 간섬유화와 같은 간질환 연구에서 실험동물의 유발에 주로 사용된다8,9.
현재 解肝煎의 효능에 대한 연구로는 동물모델에서 스트레스에 미치는 영향10, 항산화 활성과 간세포 산화적 손상에 대한 보호효과11 등이 보고되어 있다. 이에 본 연구에서는 in vitro 평가를 통해 解肝煎 추출물의 항산화 활성을 확인하고 TAA로 유도한 간섬유화 동물모델을 통해 간보호 효과를 확인하였으며 유효한 결과를 얻었으므로 이에 대해 보고하는 바이다.
II. 재료 및 방법
1. 재 료
1) 시 료
실험에 사용한 解肝煎의 구성 한약재는 옹기한약국(Daegu, Korea)으로부터 구매하였고, 생약규격집에 맞추어 약전규격에 합격한 것을 사용하였으며, 이를 Table 1에 기재하였다. 약재 중량에 10배수의 증류수를 넣은 다음 약탕기를 사용해 100 °C에서 2시간 동안 추출하였다. 추출물을 여과한 뒤 회전 감압농축기로 농축하였으며, 이를 동결 건조해 8.18 g의 解肝煎 열수 추출물(수율 5.2%)을 얻은 뒤 실험에 사용하기 전까지 -80 °C에서 보관하였다.
2) 시 약
본 실험에 사용된 thioacetamide(TAA), Folin- Ciocalteu’s phenol reagent, gallic acid, quercetin, 2-Diphenyl-1-picrylhydrazyl(DPPH), 2,2’-azino-bis (3-ethylbenzothiazoline-6-sulphonic acid)(ABTS), potassium phosphate monobasic, potassium phosphate dibasic은 Sigma-Aldrich Co.(St. Louis, MO, USA)에서 구입하여 사용하였고, sodium carbonate와 potassium acetate는 DAEJUNG(Gyeonggi, Korea)에서 구입하였다. Aluminum chloride는 Alfa Aesar (Ward Hill, MA, USA)에서 구입하였다. 1차항체로 사용한 nuclear factor erythroid-2-related factor 2 (Nrf2), heme oxygenase 1(HO-1), Catalase, glutathione peroxidase-1/2(GPx-1/2), phospho-IκBα(p-IκBα), IκBα, nuclear factorκB p65(NF-κB p65), cyclooxygenase 2(Cox-2), inducible nitric oxide synthase(iNOS), tumor necrosis factor-α(TNF-α), interleukin-1β(IL-1β), β-Actin 및 Histone은 Santa Cruz Biotechnology (Dallas, TX, USA)로부터 구입하여 사용하였고, α-smooth muscle actin(α-SMA), Collagen I은 Abcam(Cambridge, UK)에서 구입하여 사용하였으며, 2차항체는 GeneTex, Inc.(Irvine, CA, USA)에서 구입하여 사용하였다. Protease inhibitor mixture, ethylenediaminetetraacetic acid(EDTA)는 Wako Pure Chemical Industries, Ltd.(Osaka. Japan)에서 구입하여 사용하였으며, nitrocellulose membranes와 ECL western blotting detection reagents는 GE Healthcare(Arlington Height, IL, USA)로부터 구입하여 사용하였다. 단백질 정량을 위한 BCA protein assay kit는 Thermo Scientific (Waltham, MA, USA)에서 구입하였다.
3) 실험 동물
7주령 웅성 C57BL/6 mice(대한바이오링크, Eumsung, Korea)를 구입하여 7일간 사육실 환경에 적응시킨 후 실험을 진행하였다. 동물 사육실 조건은 온도 22±2 °C, 습도 50±5%, 명암주기(light : dark cycle) 12시간으로 조절하였으며 사료(조단백질 18% 이상, 조지방 5.0% 이상, 조섬유 5.0% 이하, 조회분 8.0% 이하, 칼슘 1.0% 이상, 인 0.85% 이상, 칼륨 0.55% 이상, 나트륨 0.25% 이상, 마그네슘 0.15% 이상, NIH-41, Zeigler Bros, Inc., Gardners, PA, USA)와 물을 충분히 공급하였다. 본 연구는 동물실험의 과학적, 윤리적 타당성 검토 및 효율적 관리를 위하여 대구한의대학교 동물실험윤리 위원회(Institutional Animal Care and Use Committee : IACUC)의 승인을 받아 진행되었다(승인번호 : DHU2021-034).
2. 방 법
1) 총 폴리페놀 및 총 플라보노이드 함량 측정
총 폴리페놀 함량은 Folin Ciocalteu’s의 방법12을 참고하여 측정하였다. 解肝煎 추출물 100 μL에 10% Folin-Ciocalteu’s phenol reagent 500 μL 및 7.5% sodium carbonate 400 μL를 혼합하고, 암소상태에서 30분간 반응시킨 후 분광광도계(Infinite M200 pro, Tecan, Männedorf, Switzerland)를 사용하여 765 nm에서 흡광도를 측정하였다. 표준물질로 gallic acid를 사용하였으며 표준 검량선을 구하고 解肝煎 추출물의 total polyphenol(mg gallic acid equivalent(GAE)/g) 함량을 산출하였다.
총 플라보노이드 함량은 Jiao와 Wang의 방법13을 참고하여 측정하였다. 解肝煎 추출물 100 μL에 methanol 300 μL, 10% aluminium chloride solution 20 μL, 1 M potassium acetate solution 20 μL 및 증류수 560 μL를 혼합하고, 암소상태에서 30분간 반응시킨 후 분광광도계를 사용하여 415 nm에서 흡광도를 측정하였다. 표준물질로 quercetin을 사용하였으며 표준 검량선을 구하고 解肝煎 추출물의 total flavonoid(mg quercetin equivalent(QE)/g) 함량을 산출하였다.
2) DPPH와 ABTS radical 소거 활성 측정
DPPH free radical 소거 활성은 Blois의 방법14에 따라 측정하였다. 60 μM DPPH 용액 100 μL에 농도별로 희석한 解肝煎 용액 100 μL를 혼합하고 30분간 암소상태로 반응시켰다. 분광광도계를 사용하여 540 nm에서 흡광도를 측정한 뒤 radical을 50% 감소시키는 시료의 농도를 IC50 값으로 나타내었다.
ABTS radical 소거 활성은 Re 등의 방법15에 따라 측정하였다. 7 mM ABTS 용액과 2.4 mM potassium persulfate를 혼합하고 암소상태에서 16시간 이상 방치하여 ABTS+를 형성시킨 후 415nm에서 흡광도 값이 0.70±0.02가 되도록 ethanol로 희석하였다. 희석한 ABTS 용액 95 μL와 농도별로 희석한 解肝煎 용액 5 μL를 혼합하여 15분간 반응시켰다. 분광광도계를 사용하여 30 °C, 415 nm에서 흡광도를 측정한 뒤 radical을 50% 감소시키는 시료의 농도를 IC50 값으로 나타내었다.
3) 간섬유화 유발 및 동물 처치
실험군은 정상군(Nor), TAA 유발군(Con), TAA 유발 및 silymarin 50 mg/kg 투여군(S50), TAA 유발 및 解肝煎 추출물 200 mg/kg 투여군(H200) 총 4군으로, 각각 9마리씩 무작위로 분리하였다. 모든 동물은 매일 일정한 시간에 1회/1일 체중을 측정한 후 경구투여를 통해 약물을 처치하였다. 정상군을 제외한 3군은 약물처치 1시간 30분 후에 생리식염수에 녹인 thioacetamide(TAA)를 8주간(1주 100 mg/kg, 2-3주 200 mg/kg, 4-8주 400 mg/kg) 3회/1주로 복강투여 하였다. 실험종료 후 동물을 마취하여 심장에서 혈액을 채취한 뒤 혈청을 분리하였으며 간조직을 적출하여 이를 -80 °C에서 보관하였다.
4) 체중변화와 간 무게 측정
실험 종료 직전 실험동물의 최종 무게를 측정하였고, 1회/1일 측정한 실험동물의 체중 변화량을 확인하였으며, 부검 시 적출한 간의 무게를 측정하여 체중 변화량과 체중당 간 무게 비율을 산출하였다.
(1) 체중변화량(body weight change, g)
Body weight change(g) : Final body weight(g) - Initial body weight(g)
(2) 체중당 간 무게 비율(liver weight ratio, %)
Liver weight ratio(%) : Liver weight(g)/Final body weight(g)×100
5) 혈중 AST, ALT, ammonia 및 MPO 측정
혈중 aspartate aminotransferase(AST)와 alanine aminotransferanse(ALT) level은 assay kit(Asanpharm Co., Ltd, Seoul, Korea)의 프로토콜에 따라 측정하였다. 혈중 ammonia와 myeloperoxidase(MPO) level은 각각 ammonia assay kit(Abcam, Cambridge, UK), MPO colorimetric activity assay kit(BioVision, CA, USA)의 프로토콜에 따라 측정하였다.
6) 간 조직 western blotting
간 조직의 세포질 부분을 얻기 위해 10 mM HEPES(pH 7.8), 10 mM KCl, 2 mM MgCl2, 1 mM DTT, 0.1 mM EDTA, 0.1 mM PMSF 및 protease inhibitor cocktail을 첨가한 buffer A를 넣고 tissue grinder(BioSpec Product, Oklahoma, USA)로 분쇄한 후 아이스 위에서 30분간 정치시켰다. 그 후, 10% NP-40 용액을 첨가하여 12,000 rpm으로 2분간 원심분리하여 세포질을 포함하고 있는 상층액을 분리하였다. 핵을 얻기 위해 10% NP-40가 더해진 buffer A에 두 번 세척하고 100 μL의 buffer C(50 mM HEPES, 50 mM KCl, 300 mM NaCl, 1 mM DTT, 0.1 mM EDTA, 0.1 mM PMSF, 1%(v/v) glycerol, protease inhibitor cocktail)를 첨가해 재부유 시킨 뒤 10분마다 3번 vortex 하였다. 4 °C에서 12,000 rpm으로 10분간 원심 분리한 후 핵을 포함하고 있는 상층액을 얻었으며, -80 °C에서 각각 냉동 보관하였다. 간 조직 세포질에서 HO-1, Catalase, GPx-1/2, p-IκB-α, IκB-α, Cox-2, iNOS, TNF-α, IL-1β, α-SMA, Collagen I 및 β-Actin의 발현과, 핵에서 Nrf2, NF-κB p65 및 Histone의 발현을 측정하기 위하여 12 μg의 단백질을 8~14% SDS-polyacrylamide gel을 이용하여 전기영동 후, acrylamide gel에서 분리된 단백질을 nitrocellulose membrane으로 이동시켰다. 준비된 membrane에 각각의 1차 antibody(1:1000)를 처리하여 4 °C에서 overnight 시킨 다음 PBS-T로 6분마다 5회 세척하고, 각각 처리된 1차 항체에 사용되는 2차 항체(1:3000)를 사용하여 상온에서 1시간 30분 반응시킨 후, PBS-T로 6분마다 5회 세척하였다. 그 후 enhanced chemiluminescence(ECL) 용액에 노출시켜 Sensi-Q2000 Chemidoc(Lugen Sci Co. Ltd, Seoul, Korea)를 이용해 단백질 발현을 확인하였으며, 해당 band를 ATTO Densitograph Software (ATTO Corporation, Tokyo, Japan) 프로그램을 사용하여 정량하였다. 각각의 단백질 수준을 정상군의 단백질 수준으로 나눈 후 상대적 비로 나타내었다(represented as 1).
7) 조직학적 관찰
Masson’s trichrome(MT) 염색을 위해 간 조직을 10% neutral buffered formalin에 고정시킨 후 graded alcohol로 탈수시키고, 파라핀으로 포매하여 표본을 제작한 후 microtome으로 5 μm 두께의 조직 절편을 제작하였다. 절편을 weigert iron hematoxylin에서 7분간 염색하였으며, 세척한 뒤 iebrich scarlet-acid fuchsin에서 2분 동안 염색하였다. 그 후, phosphotungstic-phosphomolybdic acid에서 7분 동안 배양하고, aniline blue로 10분 동안 염색하였으며, 1% 아세트산에서 3분 동안 고정하여 광학현미경(Olympus BX51 Microscope(Olympus Co., Ltd., Tokyo, Japan)을 이용하여 조직의 특이 병변 유무를 관찰하였다.
8) 통계분석
In vitro의 수치는 mean±standard error of mean (SEM)으로, in vivo의 수치는 mean±standard deviation(SD)로 표시하였다. SPSS(Version 26.0, IBM, Armonk, NY, USA)를 사용하여 one-way analysis of variance(ANOVA) test를 실시한 후 least-significant differences(LSD) test로 사후검증을 실시하여 각 군의 평균 차이에 대한 통계적 유의성을 *p<0.05, **p<0.01, ***p<0.001에서 검증하였다.
III. 결 과
1. 총 폴리페놀과 총 플라보노이드 함량 측정
解肝煎의 총 폴리페놀과 총 플라보노이드 함량을 측정한 결과, 폴리페놀 함량은 49.33±1.76 mg GAE/g으로 나타났으며, 플라보노이드 함량은 10.76 ±0.50 mg QE/g으로 나타났다(Table 2).
2. DPPH와 ABTS radical 소거 활성 측정
解肝煎의 항산화 활성을 확인하기 위해 DPPH free radical 소거능과 ABTS radical 소거능을 측정하였다. 解肝煎의 DPPH와 ABTS에 대한 IC50값은 각각 37.47±1.62 μg/mL, 70.97±1.46 μg/mL로 나타났다(Table 3).
3. 체중과 간 무게의 변화
실험 종료 후 체중 변화를 확인한 결과, 정상군(6.98±0.34 g)에 비하여 TAA 유발군(0.73±0.33 g)에서 체중 증가량이 현저히 낮은 것으로 확인되었다. 반면 TAA 유발군에 비해 S50군(0.72±0.36 g)과 H200군(0.70±0.27 g)에서는 유의한 변화는 나타나지 않았다(Fig. 1A). 간 무게를 확인한 결과, 정상군(3.18±0.09 g)에 비해 TAA 유발군(3.81±0.11 g)에서 유의하게 증가하였다. 반면 S50군(3.60±0.13 g)과 H200군(3.66±0.06 g)에서는 간 무게가 TAA 유발군에 비해 작게 나타났지만 확연한 차이는 나타나지 않았다(Fig. 1B).

Body weight change and liver weight.
Nor : normal mice, Con : TAA-induced liver fibrosis mice, S50 : TAA-induced liver fibrosis and treated with silymarin 50 mg/kg mice, H200 : TAA-induced liver fibrosis and treated with Haegan-jeon 200 mg/kg mice. All data are expressed as mean±SD (n=9). Significance : ###p<0.001 versus Nor group. (A) : body weight, (B) : liver weight.
4. 혈중 AST, ALT, Ammonia 및 MPO 측정
간기능 지표로 알려진 AST와 ALT를 혈청에서 확인한 결과, 정상군 대비 TAA 유발군에서 약 6.6배, 2.5배 유의하게 증가하였으며 解肝煎 추출물을 투여한 군에서 각각 30%, 32% 유의하게 감소한 것이 확인되었다. 또한 혈청 내 존재하는 ammonia와 MPO의 수치를 확인한 결과 TAA 유발에 의해 약 1.7배, 4.6배 유의하게 증가한 수치가 解肝煎 추출물을 투여한 군에서 각각 23%, 48%로 유의하게 감소하였다(Table 4).
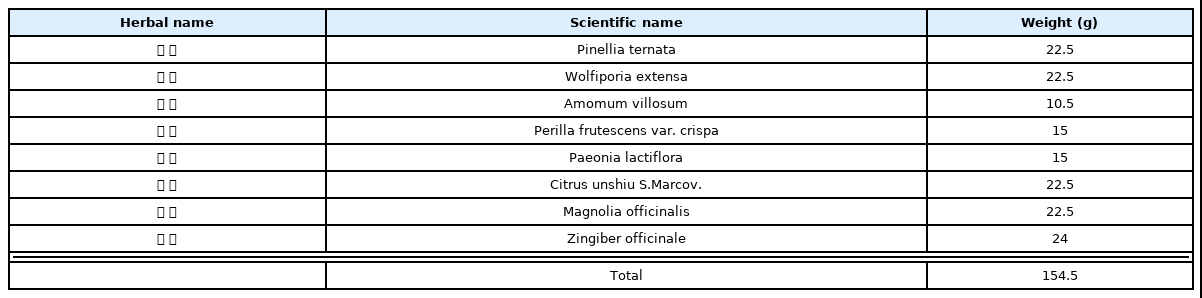
5. 간 조직 내 항산화 관련 단백질 발현량 분석
항산화 관련 단백질인 Nrf2, HO-1, Catalase 및 GPx-1/2의 발현량을 간 조직 내에서 분석하였다. 핵 내 Nrf2의 발현량은 정상군 대비 TAA 유발군에서 30% 유의하게 감소하였다. TAA 유발군에 비해 S50군에서 발현량 증가에 대해 유의성이 나타나지 않았으나 H200군에서 37% 유의하게 증가하는 것으로 나타났다. 또한 세포질 내 HO-1, Catalase 및 GPx-1/2 단백질의 발현을 확인한 결과 정상군 대비 TAA 유발군에서 각각 27%, 41%, 31%의 유의한 감소를 보였다. 이 중 HO-1의 경우 유의성은 나타나지 않았지만 TAA 유발군에 비해 H200군에서 발현이 36% 증가하는 경향을 보였으며, 그 외 Catalase와 GPx-1/2 단백질은 33%, 52% 유의하게 발현이 증가하였다(Fig. 2).
Analysis of antioxidant-related protein expression in liver tissue.
Nor : normal mice, Con : TAA-induced liver fibrosis mice, S50 : TAA-induced liver fibrosis and treated with silymarin 50 mg/kg mice, H200 : TAA-induced liver fibrosis and treated with Haegan-jeon 200 mg/kg mice. All data are expressed as mean±SD (n=9). Significance: #p<0.05, ##p<0.01 versus Nor group, *p<0.05 versus Con group.
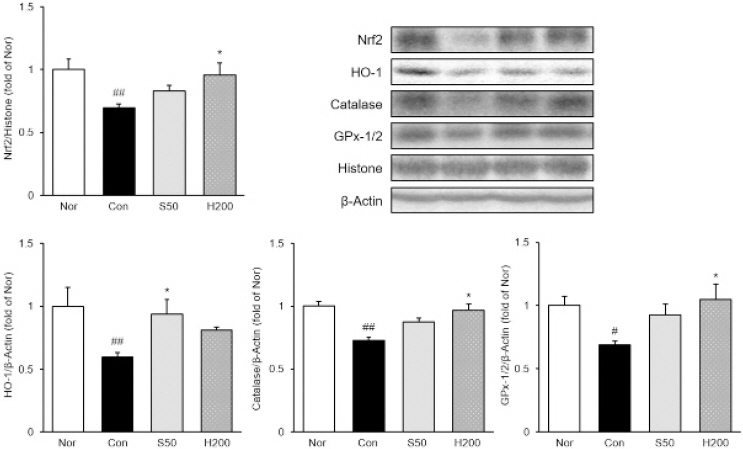
6. 간 조직 내 p-IκB-α와 NF-κB p65 발현량 분석
세포질 내 p-IκB-α의 발현량은 정상군 대비 TAA 유발군에서 67% 유의하게 증가하였으며, TAA 유발군 대비 H200군에서 약 29% 유의하게 감소하였다. 또한 핵 내 NF-κB p65의 발현량은 정상군 대비 TAA 유발군에서 48% 유의하게 증가하였으며, TAA 유발군 대비 H200군에서 약 21% 유의하게 감소하였다. 이는 양성 대조군인 S50군과 유사한 수준으로 억제시킨 것으로 나타났다(Fig. 3).
Analysis of p-IκB-α and NF-κB p65 expression in liver tissue.
Nor : normal mice, Con : TAA-induced liver fibrosis mice, S50 : TAA-induced liver fibrosis and treated with silymarin 50 mg/kg mice, H200 : TAA-induced liver fibrosis and treated with Haegan-jeon 200 mg/kg mice. All data are expressed as mean±SD (n=9). Significance : ##p<0.01, ###p<0.001 versus Nor group, *p<0.05 versus Con group.
7. 간 조직 내 염증 관련 인자 발현량 분석
염증유발 관련 인자인 Cox-2, iNOS, TNF-α및 IL-1β의 세포질 내 발현량을 확인한 결과 정상군 대비 TAA 유발군에서 모든 인자의 발현이 유의적으로 증가하였다. TAA 유발군 대비 H200군의 발현량을 비교한 결과 TNF-α의 경우 유의성은 나타나지 않았지만 감소하는 경향을 보였으며, 이를 제외한 Cox-2, iNOS 및 IL-1β의 경우 각각 30%, 24%, 32%로 유의한 발현 억제효과를 나타냈다(Fig. 4).

Analysis of inflammatory-related protein expression in liver tissue.
Nor : normal mice, Con : TAA-induced liver fibrosis mice, S50 : TAA-induced liver fibrosis and treated with silymarin 50 mg/kg mice, H200 : TAA-induced liver fibrosis and treated with Haegan-jeon 200 mg/kg mice. All data are expressed as mean±SD (n=9). Significance : #p<0.05, ##p<0.01, ###p<0.001 versus Nor group, *p<0.05, **p<0.01, ***p<0.001 versus Con group.
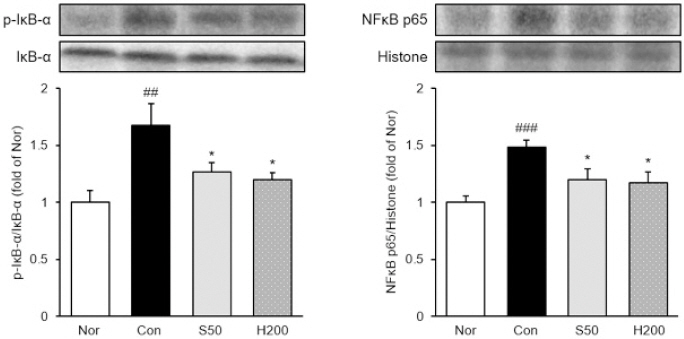
8. 간 조직 내 섬유화 관련 인자 발현량 분석
α-SMA의 경우 정상군 대비 TAA 유발군에서 발현이 2배 이상 크게 증가하였으며, TAA 유발군 대비 H200군에서 약 23% 유의하게 감소한 것으로 나타났다. Collagen I 또한 정상군 대비 TAA 유발군에서 66% 유의하게 증가하였으며, H200군에서 약 30% 유의하게 감소하였다. 이는 양성 대조군으로 사용된 S50군과 유사한 결과를 나타냈다(Fig. 5).
Analysis of fibrosis-related protein expression in liver tissue.
Nor : normal mice, Con : TAA-induced liver fibrosis mice, S50 : TAA-induced liver fibrosis and treated with silymarin 50 mg/kg mice, H200 : TAA-induced liver fibrosis and treated with Haegan-jeon 200 mg/kg mice. All data are expressed as mean±SD (n=9). Significance : ###p<0.001 versus Nor group, *p<0.05, **p<0.01 versus Con group.
9. 조직학적 관찰
MT 염색 결과 정상군에 비하여 TAA 유발군 에서는 넓은 범위에 걸쳐 교원섬유가 침착된 것이 확인되었으며, H200군에서는 TAA 유발군에 비하여 교원섬유의 침착 및 조직학적 섬유화 변화가 완화되었다(Fig. 6).
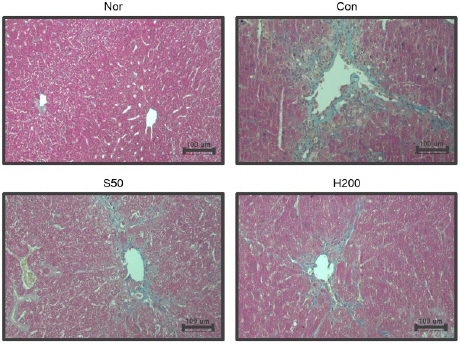
Histopathological analysis.
Liver histological analysis through Masson’s trichrome (MT) staining (Original magnification×200). Nor : normal mice, Con : TAA-induced liver fibrosis mice, S50 : TAA-induced liver fibrosis and treated with silymarin 50 mg/kg mice, H200 : TAA-induced liver fibrosis and treated with Haegan-jeon 200 mg/kg mice.
IV. 고 찰
간섬유화는 반복적이고 만성적인 간손상의 상처치유 반응으로, 간 성상 세포의 활성화로 인한 세포 외 기질(extracellular matrix), 특히 교원질의 과잉 축적에 의해 발생한다. 간섬유화는 가역적이지만 지속되면 간경변이나 간암까지 이르러 회복이 불가한 상태까지 도달하게 되므로 섬유화 상태에서 치료하는 것을 중요시 여기고 있다16. 간질환의 치료에 많이 사용되고 있는 물질로는 silymarin이 대표적인데, 이는 국화과에 속하는 Milk thistle (Silybum marianum)의 주성분인 flavonolignan류 물질로 항산화, 항섬유화 및 항염증 효과를 가지는 것으로 알려져 있다17. 하지만 silymarin은 위장관에서 약 20-50%만 흡수되어 생체이용률이 낮고, 몇몇 시험에서 설사, 소화불량, 복통, 메스꺼움과 같은 부작용이 보고된 바 있다18. 따라서 간보호 및 치료효과를 가지는 새로운 안정적 소재의 탐구가 필요한 것으로 보여진다. 解肝煎은 景岳全書의 新方八陳 중 和陳에 11번째에 속하는 처방으로 구성약재에는 半夏, 茯苓, 沙仁, 蘇葉, 芍藥, 陳皮, 厚朴이 있고 조제 시 生薑을 함께 넣고 달인다. 解肝煎의 주치는 “治暴怒傷肝, 氣逆脹滿, 陰滯等證, 如兼肝火者宜用化肝煎”이라 하였으며, 임상에서 肝 기능 장애와 손상을 치료할 목적으로 사용된다고 알려져 있다19. 본 연구에서는 in vitro 평가를 통한 解肝煎의 항산화 활성에 대해 확인하였고, in vivo 평가로 thioacetamide(TAA)를 사용하여 유도한 간섬유화 동물모델에 대한 解肝煎의 보호효과와 그 기전에 대해 탐색하였다.
본 연구에서 양성대조군의 투여물질로 사용된 silymarin의 경우 항산화 작용을 가지는 것으로 보고되어있다(Toal polyphenol; 233.37±7.53 mg GAE/g, Total flavonoid; 21.04±0.67 mg QE/g, DPPH IC50; 27.85±0.98 μg/mL, ABTS IC50; 12.34±0.21 μg/mL)20. In vitro 평가에서 解肝煎의 총 폴리페놀 함량과 총 플라보노이드 함량을 각각 gallic acid와 quercetin을 통하여 확인하였다. 解肝煎의 총 폴리페놀 함량은 49.33±1.76 mg GAE/g으로 gallic acid의 함량이 silymarin보다 약 184 mg 적은 것으로 나타났고, 총 플라보노이드 함량은 10.76±0.50 mg QE/g으로 quercetin의 함량이 silymarin보다 약 10 mg 적은 것으로 나타났다(Table 2). 또한 DPPH와 ABTS assay를 실시하고 IC50값을 산출하여 解肝煎의 radical 소거능을 평가한 결과 DPPH free radical의 경우 37.47±1.62 μg/mL로, ABTS radical의 경우 70.97±1.46 μg/mL로 silymarin에 비해서 radical 소거능은 낮게 나타났다(Table 3).
In vivo 평가에서 사용된 동물모델은 7주령의 C57BL/6 mice로 정상군(Nor), TAA 유발군(Con), TAA 유발 및 silymarin 50 mg/kg 투여군(S50), TAA 유발 및 解肝煎 200 mg/kg 투여군(H200)으로 나누어 해당약물을 8주간의 실험기간 동안 매일 경구투여 하였다. 정상군을 제외한 모든 군은 TAA를 8주간(1주 100 mg/kg, 2-3주 200 mg/kg, 4-8주 400 mg/kg) 3회/1주로 복강투여 하여 간섬유화를 유발하고, 실험 종료 후 모든 동물의 혈청과 간 조직을 얻어 분석하였다.
Aspartate aminotransferase(AST)와 alanine aminotransferase(ALT)는 독성물질, 바이러스 및 감염 등에 의해 간 손상이 발생할 때 간세포 손상 정도에 비례하여 간 조직에서 순환계로 방출된다. 따라서 AST와 ALT는 대부분의 간질환에서 간 손상 지표로써 여겨지고 있다21. 뿐만 아니라 혈중 ammonia 수치가 상승하면 간 성상 세포를 활성화시켜 섬유화를 악화시키며22, 호중구 염증성 효소인 myeloperoxidase(MPO)의 과잉 생산은 조직의 지질과산화의 주요 원인이 되고 호중구 침윤에 의해 염증매개체를 방출하여 간세포 및 조직손상을 유발하는 것으로 알려져 있다16. 따라서 동물실험 종료 후 채취한 혈청에서 AST, ALT, ammonia 및 MPO 수준을 확인한 결과 Nor군 대비 Con군에서 모두 유의하게 증가하였고, 解肝煎을 투여한 군에서 모두 유의하게 감소하였다. 특히 ALT와 MPO의 경우 양성대조군인 S50군과 유사한 정도의 감소효과를 나타낸 것으로 확인되었다(Table 4).
Western blot을 통하여 간 조직의 항산화, 염증관련 인자 및 섬유화 관련 인자의 단백질 발현 정도를 확인하였다. Nuclear factor erythroid-2-related factor 2(Nrf2)는 전사인자로써 항산화 작용의 주요 인자이다. 산화 스트레스에 노출되면 세포질에 존재하던 Nrf2가 핵으로 이동하여 antioxidant response element(ARE)에 결합하고 heme oxygenase-1(HO-1), Catalase, glutathione peroxidase-1/2(GPx-1/2)와 같은 항산화 효소의 생성을 유도한다. 또한 Nrf2 신호전달 경로의 활성화는 많은 질환에서 유익한 효과를 가지는 것으로 보고되고 있으며, 특히 간질환의 개선에 효과를 나타내는 것으로 보고되어있다23. 간 조직에서 Nrf2의 발현을 확인한 결과 핵 내 Nrf2 전사는 TAA 유발에 의해 감소되었으며, 解肝煎의 투여 시 유의하게 증가한 것으로 확인되었다. 또한 세포질 내에서 항산화 효소 HO-1, Catalase 및 GPx-1/2의 발현을 확인한 결과 모든 인자가 TAA 유발에 의해 발현이 감소되었으며, 解肝煎을 투여하였을 때 항산화 효소 중 Catalase와 GPx-1/2의 발현이 유의하게 증가한 것으로 확인되었다(Fig. 2). Nuclear factor-kappaB(NF-κB)는 염증조절과 세포사멸에 관여하며 p65와 p50이라는 두 개의 소단위로 구성된 이종 이량체이다. 자극이 없는 상태에선 NF-κB의 핵 내 전이를 방지하는 IκB-α와 결합한 상태로 세포질에 존재하지만 자극이 발생하면 IκB-α의 인산화 및 분해가 일어나고 NF-κB가 핵 내로 전이된다. 이때 inducible nitric oxide synthase(iNOS), cyclooxygenase-2(Cox-2) 및 염증성 cytokine과 같은 염증 유발물질이 생성되므로 NF-κB의 활성화를 억제시키는 것이 염증 조절의 핵심요소로 여겨지고 있다24. 세포질의 p-IκB-α와 핵 내 NF-κB p65의 발현을 확인한 결과 정상군 대비 TAA 유발군에서 두 인자모두 유의하게 증가한 것이 확인되었고, 解肝煎의 투여는 이를 유의하게 억제시켰으며 silymarin 투여군보다 우수한 억제효과를 나타냈다(Fig. 3). 또한 Cox-2, iNOS, tumor necrosis factor-α(TNF-α) 및 interleukin-1β(IL-1β)의 발현은 정상군 대비 TAA 유발군에서 모두 유의하게 증가하였고, 解肝煎을 투여하였을 때 Cox-2, iNOS 및 IL-1β의 발현이 유의하게 감소하였다(Fig. 4). 반복적인 간손상과 회복에 의한 간 성상 세포의 활성화는 Collagen I과 같은 세포 외 기질의 침착을 촉진하는 인자인 α smooth muscle actin(α-SMA)의 발현을 증가시켜 섬유화를 악화시킨다25. 간조직에서 α-SMA와 Collagen I의 발현을 확인한 결과 두 인자 모두 정상군 대비 TAA 유발군에서 매우 유의적으로 증가하였고, 解肝煎의 투여 시 인자의 발현이 유의적으로 감소된 것이 확인되었다(Fig. 5).
Masson’s trichrome(MT) 염색은 간섬유화 정도를 평가하는 일반적 방법으로 임상 및 간질환 연구에서 콜라겐의 침착을 파란색으로 염색하여 현미경으로 관찰할 수 있기 때문에 많이 사용되고 있다26. MT 염색 결과 정상군에서는 콜라겐 침착이 확인되지 않았지만 TAA 유발군에서 혈관 주변에 교원섬유의 침착과 섬유화로 인한 조직 변화가 나타난 것이 확인되었다. 반면 解肝煎의 투여는 이러한 변화를 완화시켜 섬유화 및 손상 정도를 크게 개선하였다(Fig. 6).
결과를 종합해 보면 解肝煎 추출물은 양성 대조물질인 silymarin에 비해 항산화 활성은 낮았지만 TAA 유발 간섬유화 동물모델에서 Nrf2 신호전달 경로를 통해 항산화 작용을 활성화시켰고, NF-κB의 핵 내 전이를 조절하여 염증 유발인자의 발현을 억제하였으며 섬유화 인자들이 발현되는 것을 억제시켜 간 보호효과를 나타냈다.
Masson’s trichrome(MT) 염색은 간섬유화 정도를 평가하는 일반적 방법으로 임상 및 간질환 연구에서 콜라겐의 침착을 파란색으로 염색하여 현미경으로 관찰할 수 있기 때문에 많이 사용되고 있다26. MT 염색 결과 정상군에서는 콜라겐 침착이 확인되지 않았지만 TAA 유발군에서 혈관 주변에 교원섬유의 침착과 섬유화로 인한 조직 변화가 나타난 것이 확인되었다. 반면 解肝煎의 투여는 이러한 변화를 완화시켜 섬유화 및 손상 정도를 크게 개선하였다(Fig. 6).
본 연구에서 평가된 解肝煎 추출물은 silymarin에 비해 항산화 활성은 낮게 나타났다. 하지만 기존 알려진 보고에 따르면 解肝煎은 radical 소거를 통해 지질 과산화 반응을 차단하여 세포의 손상 및 괴사를 조절하고, 산화적 손상을 효과적으로 방어한다고 알려져 있다19. 解肝煎 추출물은 결과적으로 TAA 유발 간섬유화 동물모델에서 Nrf2 신호전달 경로를 통해 항산화 작용을 활성화 시켰고, NF-κB의 핵 내 전이를 조절하여 염증 유발인자의 발현을 억제하였으며 섬유화 인자들이 발현되는 것을 억제시켜 간 보호효과를 나타냈다.
V. 결 론
본 연구에서는 in vitro 평가를 통해 解肝煎 추출물의 항산화 활성을 확인하였으며, TAA로 유발한 간섬유화 동물모델에서 解肝煎 추출물의 간보호 효과 및 그 기전에 대해 탐색하여 다음과 같은 결과를 얻었다.
1. 解肝煎 추출물의 총 폴리페놀 함량은 49.33±1.76 mg GAE/g으로, 총 플라보노이드 함량은 10.76±0.50 mg QE/g으로 나타났다. DPPH free radical 소거능은 IC50=37.47±1.62 μg/mL, ABTS radical 소거능은 IC50=70.97±1.46 μg/mL로 항산화 활성이 우수한 것으로 확인되었다.
2. 혈청 내 AST, ALT, ammonia 및 MPO의 수준을 확인한 결과, 정상군 대비 TAA 유발군에서 유의하게 증가하였고, 解肝煎을 투여한 군에서 모든 수치가 유의하게 감소하였다.
3. 간 조직에서 항산화 관련인자 Nrf2, HO-1, Catalase 및 GPx-1/2의 발현을 확인한 결과, 핵 내 Nrf2의 발현이 TAA 유발군에 비해 解肝煎 투여군에서 유의하게 증가하였으며, 세포질의 Catalase와 GPx-1/2의 발현이 TAA 유발군에 비해 解肝煎 투여군에서 유의하게 증가하였다.
4. 염증관련 전사인자 NF-κB p65의 핵 내 전이와 세포질에서 p-IκB-α의 발현이 解肝煎의 투여에 의해 유의하게 감소하였으며, 염증관련인자 Cox-2, iNOS, TNF-α, IL-1β의 발현이 解肝煎을 투여한 군에서 억제된 것을 확인하였다.
5. 섬유화 관련인자 α-SMA와 Collagen I의 발현은 解肝煎의 투여에 의해 유의하게 감소하였다.
6. Masson’s trichrome 염색을 통해 콜라겐 침착을 확인한 결과 TAA 유발군에서는 콜라겐 침착과 섬유화에 의한 조직변화가 나타났지만 解肝煎을 투여한 군에서 크게 개선된 것으로 확인되었다.
결론적으로 解肝煎은 우수한 항산화 효과를 가지며 TAA로 유발한 간섬유화 C57BL/6 mice 모델에서, Nrf2 경로의 활성화를 통한 항산화 작용과 NF-κB의 핵 내 전이 억제로 인한 염증 조절을 통해 간 보호효과를 나타내었다. 따라서 解肝煎은 간섬유화 치료 및 간보호를 위한 새로운 소재로 적합할 것으로 사료된다.
감사의 글
본 성과물은 2022년도 정부(과학기술정보통신부)의 재원으로 한국연구재단(No. 2018R1A5A2025272)의 지원에 의해 수행되었습니다.