로바젯정으로 유발된 간수치 상승 환자의 한방 치료 증례 보고
A Case Report on Korean Medical Treatment of a Patient with Abnormal Liver Function Induced by Rovazet
Article information
Abstract
Objective
This study evaluated a clinical case of a patient with Rovazet-induced abnormal liver function treated with intradermal acupuncture.
Method
A 59-year-old woman with abnormal liver function induced by Rovazet ceased taking the drug and instead received intradermal acupuncture treatment. After 15 days, clinical symptoms and laboratory test results were evaluated.
Results
Aspartate aminotransferase and alanine aminotransferase levels decreased, and clinical symptoms such as nausea and fatigue improved after treatment with intradermal acupuncture and cessation of the Rovazet.
Conclusion
This study meaningfully examined a clinical case of a patient with abnormal liver function induced by a lipid-lowering agent, which is uncommon in Korea. Unfortunately, the lack of clear evidence and the use of only one case are limitations of the study.
I. 서 론
약인성 간 손상(DILI)은 드물지만 다양한 약물과 식이 보조제에 노출된 후 발생할 수 있는 간 질환 중 하나이다1. DILI의 발병률은 인구 100,000명당 연간 2.7~19명으로 추정되고2, 그 중 많은 부분이 예측할 수 없는 방식으로 발생하기 때문에 유병률은 여전히 부분적으로만 알려져 있다. 약물의 종류와 상관없이 일일투여량이 100 mg을 초과하는 경우나 약물이 사이토크롬 P450 효소에 의해 간에서 대사되어 반응성 대사물질을 형성하거나 미토콘드리아와 담즙산 수송 펌프 기능의 이중 억제 특성을 가지는 경우에 DILI를 유발할 위험이 크다3.
Low 등4의 연구에서는 동양과 서양에서 DILI를 유발하는 약물을 체계적 문헌 고찰로 정리하여 분석하였다. 우선, DILI를 유발하는 약물 계통의 순위를 보면 동양에서는 항결핵제(26.6%), 한약 대체 약물(25.3%), 항생제(15.7%), 향정신제(8.2%), 비스테로이드성 소염진통제(4.8%)의 순서로, 서양에서는 항생제(34.9%), 심혈관제(17.3%), 향정신제(13.1%), 비스테로이드성 소염진통제(12.5%), 한약 대체 약물(6.7%)의 순서로 DILI를 빈번하게 유발한다고 보고하였다. 다음으로, 개별 약물의 경우 동양에서는 항결핵제인 아이소나이아지드, 리팜피신, 피라진아미드(25.4%), 항간질약인 페니토인(3.5%), 항생제인 세팔로스포린(2.9%)의 순서였으며, 서양에서는 아목시실린 클라불란산칼륨 복합산(11.3%), 니메수리드(6.3%) 및 이부프로펜(6.1%)의 순서로 DILI를 빈번하게 유발한다고 보고하였다.
DILI가 의심될 경우 초기 관리에서 가장 중요한 것은 관련 약물을 중단하는 것이다. 원인 약물을 중단하면 대부분의 DILI에서 일반적으로 수 주 이내에 치료나 특별한 조치 없이 자발적으로 회복하지만, 경우에 따라 약물을 중단했음에도 불구하고 간 손상이 계속 진행되거나 악화될 수 있다.5
DILI의 한의학적 치료 방법에 대해 살펴보면, 안 등6, 신 등7은 생간탕(生肝湯)류의 한약을, 이 등8, 손9, 김 등10은 청간탕(淸肝湯)류의 한약을 활용하였으며, 박 등11은 사상체질방인 태음조위탕(太陰調胃湯)으로 치료하였다. 한약 이외에 활용된 치료 방법으로는 침 치료와 뜸 치료가 있었으나9,10, 대부분의 연구에서 한약 단독 투약으로 DILI를 치료하였다.
본 증례보고에서는 고지혈증 치료제인 로바젯정으로 유발된 간수치 상승 환자에게 피내침 요법을 시행한 후 간수치 및 임상 증상에서 호전을 보인 사례가 있어 이를 보고하고자 한다. 본 연구는 부산대학교 한방병원의 임상시험심사위원회(Institutional Review Board)를 통해 심의면제를 받았다(IRB No. E2021013).
II. 증 례
1. 성별/연령 : 여/59세
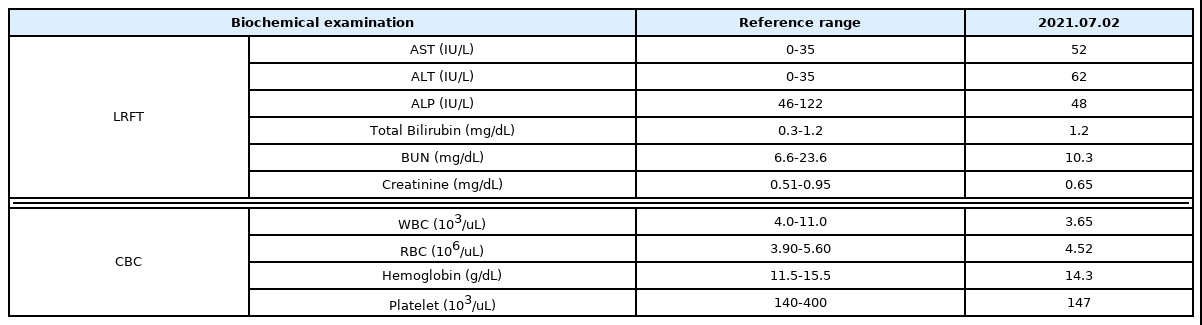
2. 발병일 : 2021년 6월 10일 시행한 혈액검사 상 AST(aspartate aminotransferase) 46 IU/L, ALT (alanine aminotransferase) 46 IU/L으로 간수치 상승 확인함.
3. 과거력
(1) 고지혈증 : 2021년 4월 경 시행한 혈액검사 상 진단 하고 2021년 4월 10일부터 고지혈증 치료제(제품명 : Rovazet Tab.) 복용 시작.
(2) 담낭절제술 : 2013년 8월 경 간 초음파 상 담낭용종 진단 하 2013년 9월 2일 복강경 담낭절제술 시행.
(3) 장상피 화생 : 2020년 12월 경 상부소화관내시경 상 진단.
4. 가족력 : 특이사항 없음.
5. 사회력 : 음주 및 흡연 이력 없음
6. 현병력 59세 여자 환자로서 2013년 9월 경 담낭 용종으로 담낭절제술 시행하신 분으로 2020년 12월경에 시행한 혈액검사 상 간수치가 정상 범위였으나 2021년 4월 10일 로컬 의원에서 고지혈증 진단 하 처방받은 고지혈증 치료제(Ezetimibe 10 mg/Rosuvastatin calcium 5 mg, 제품명 : Rovazet Tab.) 복용 시작 후 2021년 6월 10일 시행한 혈액검사 상 AST 46 IU/L 및 ALT 46 IU/L로 경미한 간수치 상승 확인되었다. 이후 2021년 6월 15일 오심, 피로감에 대한 치료를 위하여 ⃝⃝한방병원 소화기클리닉에 입원하였으며 입원 중 2021년 7월 2일 양방 가정의학과 협진 통해서 시행한 혈액검사 상 AST 52 IU/L, ALT 62 IU/L로 간수치의 지속적인 상승이 확인되었다.
7. 望聞問切
1) 체격(體格) : 162.7 cm/43.8 kg
2) 식욕(食慾) 및 소화(消化) : 불량, 식후 비만감과 오심 및 애기 증상. 밥 1/2공기 3식
3) 소변(小便) : 정상.
4) 대변(大便) : 보통. 1회/일 보통변(Bristol Gr.4) 경향
5) 수면(睡眠) : 불량. 간헐적 야간뇨와 별무원인으로 3회 각성 및 천면 경향, 재입면난 있음
8. 초진 검사 결과 및 임상 증상 2021년 6월 10일 외부 병원에서 시행한 혈액검사 상 AST 46 IU/L, ALT 46 IU/L이었고, 2021년 7월 2일 시행한 혈액검사 상 AST 52 IU/L, ALT 62 IU/L, ALP(alkaline phosphatase) 48 IU/L, Total Bilirubin 1.2 mg/dL이었다. 또한 CBC 및 백혈구 백분율 결과 백혈구는 3650 uL, lymphocyte 46.0%이었고 그 외의 적혈구, 혈소판, 중성구, 단핵구 등은 전부 정상범위 안으로 나타났다. 혈청학적으로 Anti-HBs Ab는 양성이었으며, HBsAg, Anti-HCV Ab, Anti-HAV Ab I gM은 음성이었다(Table 1). 임상 증상을 살펴보면, 2021년 6월 15일 본 병원 입원 당시 지속적인 피로감을 Visual Analogue Scale(VAS) 7 수준으로 호소하였으며 오심을 VAS 3 수준으로 호소하였다. 황달이나 소변이상은 나타나지 않았다.
III. 치료 내용 및 경과
2021년 7월 2일 AST, ALT 상승이 확인된 후 다음 날인 7월 3일부터 복용중인 약물 중 간수치 상승의 원인으로 의심되는 고지혈증 치료제(약물명 : Rovazet) 복용을 중단하도록 하였다. 또한 2021년 7월 5일부터 7월 19일까지 15일간 하루 1회 완골(腕骨, SI4), 양릉천(陽陵泉, GB34), 지양(至陽, GV9) 혈위에 피내침 요법을 시행하였다. 피내침은 동방메디컬에서 제작된 0.18 mm×1.0 mm 크기로, 매일 오전 8시 30분에 부착하여 1시간 유침 후 제거하였다. 입원일로부터 7월 19일까지 어떠한 형태의 한약도 투약하지 않았다.
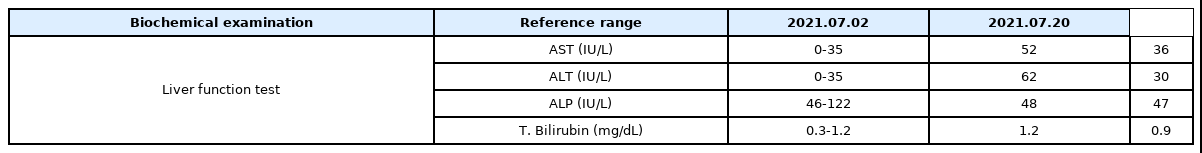
2021년 7월 20일 시행한 혈액 검사에서 AST 36 IU/L, ALT 30 IU/L, ALP 47 IU/L, Total Bilirubin 0.9 mg/dL으로 ALT 수치에서 호전을 보였다(Table 2). 또한 입원 시에 호소하였던 지속적인 피로감은 VAS 5로 경감되었으며 오심은 VAS 0-1로 호전을 보였다. 황달이나 소변이상 등의 간 손상을 시사하는 임상증상은 추가적으로 발생하지 않았다(Fig. 1).
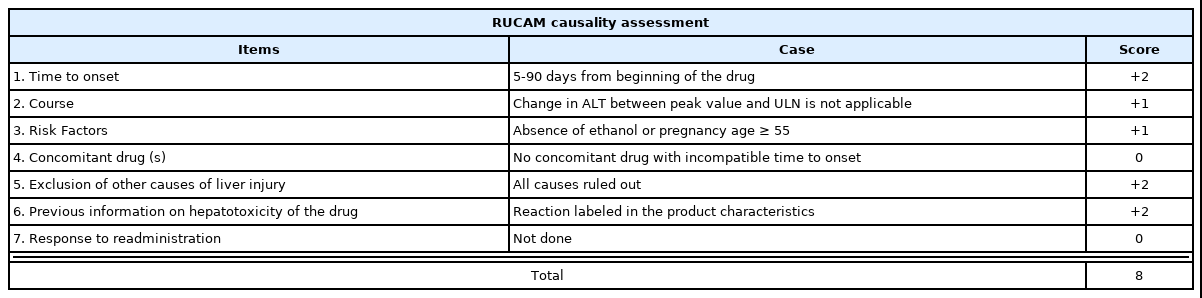
환자 진술 상 간 질환이나 담도질환 및 음주력 등 약물 이외의 원인이 배제되고, 2021년 4월 10일부터 2021년 7월 2일까지 약 3개월간의 약물 복용력을 확인할 수 있었다는 점과 최초 복용일로부터 5~90일 내에 간수치 상승이 확인되었고, 복용중인 약물 중 로바젯정 외에 ALT 수치 상승을 일으킬 가능성이 있는 다른 약물이 없다는 점, 그리고 약물 복용 중단 후 30일 이내에 50% 이상의 ALT 감소가 이루어졌다는 점으로 보아 RUCAM score 8점으로 해당 약물로 인해 간수치가 상승했을 가능성이 높은 것으로 판단된다(Table 3).
Ⅳ. 고찰 및 결론
간은 신장과 함께 외부에서 들어온 물질이나 체내에서 생성된 노폐물을 대사, 배설하는 주된 기관이다. 간에서 약물이 대사되는 과정은 간세포 내로 유입, 간세포 내 대사 및 간세포 밖으로 유출되는 세 가지 과정으로 나눌 수 있는데 대부분의 약물은 세포내 대사 과정에서 사이토크롬 P450에 의해 친수성 물질이 되어 간세포막에 존재하는 수송 단백에 의해 안전하게 제거된다. 하지만 일부 약물에서 간 내 대사과정 중 반응성 대사산물이 형성되는데 이것이 DILI의 주된 원인으로 작용한다12. 그 기전을 살펴보면, 간독성 약물은 정상 간세포 내 칼슘 항상성을 파괴하는데 이로 인해 간세포 표면에서 액틴 원섬유가 분해되면 세포막이 수포화 및 파열되어 세포 용해되고, 담관 소관 옆의 액틴 원섬유가 분해되면 융모 돌기가 소실되고 운반 펌프가 중단되어 내인성 담즙산이 축적되는 과정을 통해 간에 손상을 줄 수 있다. 또한 헴을 함유하는 사이토크롬 P450 효소가 약물과 공유결합을 하여 기능이 없는 부산물을 만드는데, 이 효소-약물 부산물이 소포를 통해 세포 표면으로 이동하여 표적면역원 역할을 하면 세포용해성 T세포와 사이토카인이 연관된 면역반응을 자극하여 TNF-α 수용체 등에 의해 세포자멸사 경로가 활성화되어 간세포가 파괴된다13.
DILI의 가장 흔한 임상적 증상은 황달, 오심, 피로, 복부 불편감 또는 통증을 동반하는 “급성 바이러스 간염 유사” 증후군이지만, 급성 담즙정체나 만성 간염 또는 드물게 간 경변, 정맥 폐쇄성 질환 및 신생물과 같은 다른 간 질환을 일으킬 수도 있다14.
DILI는 진단하기 위해 필요한 특정 바이오마커나 임상증상, 실험실 검사 결과 또는 병리학적 조직 소견 등이 없다. 그렇기 때문에 주로 바이러스성 간염이나 알코올 간질환, 자가면역성 간염, 췌장 담도 질환 등과 같은 간 손상을 일으킬 수 있는 다른 질환들을 배제한 후 약물 투여 후 발병하는 시간적 관계와 약물 중단 후 호전되는 현상 등을 종합하여 임상적으로 추정하게 된다. 이러한 과정을 통해 임상적으로 DILI가 의심되는 경우 보다 객관적으로 평가하기 위하여 Council for International Organizations of Medical Sciences(CIOMS)의 평가 도구인 Roussel-UCLAF causality assessment method (RUCAM)와 1997년에 발표된 Clinical Diagnostic Scale(CDS) 등이 활용되고 있다. 그 중 가장 많이 사용되는 평가 도구는 RUCAM으로 체계적이고 객관적인 항목으로 구성되어 있어 의심되는 약물과의 인과관계를 평가하는 데 유용하다3. RUCAM 항목에 따른 총점은 -5점~14점의 범위 내에 산정될 수 있으며, 총점에 따른 해당 약물과 간 손상의 인과관계는 다음과 같다. 0점 이하일 경우 간 손상의 원인에서 해당 약물을 제외할 수 있고, 1~2점일 경우 해당 약물로 인한 간 손상의 가능성이 없으며, 3~5점 일 경우 해당 약물로 인한 간 손상의 가능성이 있다고 판단되고, 6~8점일 경우 해당 약물로 인한 간 손상의 가능성이 높으며, 9점 이상일 경우 해당 약물로 인한 간 손상의 가능성이 매우 높다고 판단된다15(Table 4).
본 환자는 로바젯정을 복용하기 시작한 지 약 2개월 경과한 후 시행한 혈액 검사에서 간 수치의 상승이 확인되었으며 2009년 경 담낭절제술을 받은 이력 외에 간염이나 췌장담도질환 등의 병력이나 음주력이 없는 환자이다. 환자는 2021년 6월 10일 시행한 혈액검사 상 AST 46 IU/L 및 ALT 46 IU/L으로 경미한 상승 보였으나 일시적일 수 있다고 판단하여 약 한 달 후인 7월 2일에 재검사하였으며 그 결과 AST 52 IU/L, ALT 62 IU/L로 지속적인 상승을 보였다.
환자 진술에 따르면 2020년 12월 경 정기 검진 당시 혈액검사 상 간수치 이상소견이 없었고, ALT의 상승이 특징적으로 나타났으며 바이러스성 간염이나 자가면역성 간염 등을 의심할 만한 소견이 없었기 때문에 임상적으로 약인성 간손상의 가능성을 고려하여 간수치 상승이 처음 나타난 검사 시점으로부터 3개월 이내에 새로 복용을 시작한 약물을 확인하였다. 2020년 12월부터 2021년 6월 10일 사이에 복용한 약물은 Lorazepam 1 mg, Dimenhydrinate 100 mg, Betahistine hydrochloride 48 mg, Ezetimibe 10 mg/Rosuvastatin calcium 5 mg 이며 그 중 3개월 이내에 새로 복용을 시작한 약물은 Ezetimibe 10 mg/Rosuvastatin calcium 5 mg(제품명 : Rovazet) 이었다.
로바젯정은 간 콜레스테롤 합성 억제 효과가 있는 HMG-CoA 환원 효소 억제제인 rosuvastatin과 콜레스테롤의 장내 흡수를 억제하는 ezetimibe의 두 가지 지질 저하제를 결합한 고지혈증 치료제이다. 이 약물은 고전적으로 고지혈증 치료제로 활용되어 온 rosuvastatin 단독요법(rosuvastatin의 2배 용량 포함)에 비해 성인의 저밀도 지단백 콜레스테롤(LDL-C) 및 총 콜레스테롤을 감소시키는 효과가 우수하다는 임상시험 결과가 다수 보고되어 현재 고지혈증 환자에게 상당히 높은 빈도로 처방되고 있다16. 이상반응으로 비인두염, 소화불량, ALT 상승, 부종, 근육통 등이 보고된 바 있는데 국내 시판조사에서 보고된 약물 유해반응을 살펴보면, ALT 증가가 약 0.55%로 가장 많이 나타났고 근육통이 0.42%, 변비 및 AST 증가가 0.16%로 나타났다. 또한, Ballantyne CM17 등의 임상 연구에 따르면, Ezetimibe가 간 기능의 생화학적 이상을 유발하고 치료군의 1% 미만에서 혈청 트랜스아미나제 활성을 정상 범위의 상한치의 3배 이상 증가시키는 것으로 나타났다는 결과가 있고, 보고된 Ezetimibe 유발 간 손상 사례는 대부분 Statin과 병용하였을 때 발생하였다18.
본 환자의 경우 2021년 4월 10일부터 2021년 7월 2일 두 번째 검사 시점까지 약 3개월간 해당 약물을 복용하였기 때문에 두 번째 검사 후 해당 약물을 간수치 상승의 주된 원인으로 보고 복용을 중단하였다. 복용 중단 후 간수치는 정상화 되었으며 RUCAM으로 인과성 평가하였을 때 8점으로 가능성이 높은 것(probable)으로 판단되었다(Table 3). 다만, 본 증례에서 통상적인 DILI의 생화학적 검사 기준이 ALT 정상 상한치의 2배 이상이라는 점을 고려했을 때 환자의 ALT 상승 정도는 기준에 미치지 못하여 DILI로 명확히 진단하기에는 제한이 있었다.
한편, 본 증례에서는 약물로 인한 간손상의 회복을 촉진하기 위하여 한방치료요법 중 피내침 요법을 사용하였다. 완골(腕骨, SI4)혈은 수태양소장경의 원혈(原穴)로, ≪通玄指要賦≫에 따르면 淸濕熱하여 황달을 치료하는 효능이 있고, 양릉천(陽陵泉, GB34)은 족소양담경의 하합혈(下合穴)로 담즙 배출이 원활하게 될 수 있도록 도와주고 간의 소설 기능을 촉진시킨다. 또한 지양(至陽. GV9)혈은 비장, 간장 등의 소화계통의 기능을 원활하게 하여 황달을 치료하는 효능이 있다19. 본 환자는 임상적으로 황달 증상이 나타나지는 않았지만 간 손상이 이루어지고 있는 상태로, 일종의 간염 상태라고 볼 수 있어 해당 혈위를 배합하여 치료에 활용하였다.
약물로 인한 간손상은 일반적으로 원인약물을 중단하는 것만으로도 수일~수주 이내에 호전될 수 있고, 약인성 간손상에 대해 침치료 효능을 평가한 기존 연구는 부재하였으며, 또한 증례 보고의 한계로 인해, 본 증례에서 시행된 피내침 요법의 효과가 임상 증상과 간 수치의 호전에 어느 정도 기여했는지에 대한 명확한 평가는 힘들다고 판단된다.
그러나 본 증례는 ezetimibe 와 rosuvastatin을 혼합한 고지혈증 치료제로 유발된 간수치 상승 사례로 발생률이 1% 미만으로 흔하지 않은 사례이며, 국내에서 기존에 보고된 한방치료를 적용한 DILI 사례들은 대부분 한약 위주의 치료가 이루어진 것에 비해 본 증례에서는 간수치 상승 환자에게 피내침 요법을 시행하여 DILI 환자에게 보다 부담이 적고 간편하며 부작용이 적어 임상적으로 활용하기 용이한 치료 방안을 제시하였기에 보고하는 바이다.
감사의 글
본 연구는 2020년도 부산대학교 병원 임상연구비 지원으로 이루어 졌음.