Crizotinib과 한방치료를 병행하여 호전된 ROS1 양성 재발성 폐암 환자 1례
A Case Report on ROS1-positive Recurrent Non-small-cell Lung Cancer Treated with Crizotinib and Korean Medicine
Article information
Abstract
Objectives
This study examined the case of a patient with ROS1-positive recurrent non-small-cell lung cancer treated with crizotinib and traditional Korean medicine.
Methods
The patient was treated with crizotinib from January 20 2021 to May 22 2021, together with Haedogyangpye-tang and Haengso-tang. The tumor size was measured using computed tomography (CT), and adverse events were evaluated according to the National Cancer Institute’s Common Terminology Criteria for Adverse Events (NCI-CTCAE) version 5.0.
Results
After four months of combined treatment, the sizes of the lymph nodes in the porta hepatis, hepatoduodenal, retrocrural, aortocaval, and para-aortic areas had decreased, and no lymph nodes larger than 1 cm in diameter were observed. The side effects of chemotherapy also improved.
Conclusions
This case study suggests that traditional Korean medicine may alleviate the side effects of chemotherapy, improve quality of life, and complement chemotherapy itself.
I. 서 론
전 세계적으로 폐암은 사망률 1위를 차지하는 종양으로 폐암의 발생률은 매년 증가하고 있다1. 2019년 발표된 국내 통계에 따르면, 폐암은 사망률 1위를 기록했으며, 2014-2018년 사이 발생한 폐암 환자의 5년 상대 생존률은 32.4%로 예후가 불량하다2.
폐암은 약 85% 정도로 대부분을 차지하는 비소세포폐암과 소세포폐암으로 구분되며 폐암의 병기와 조직검사 결과에 따라 치료 방법이 결정된다. 하지만 약 40% 이상의 비소세포 폐암환자의 경우 진단 당시 이미 전이가 진행된 4기로 발견되기 때문에 진단 이후의 중앙 생존 기간은 보통 1년 이하이다3.
최근 비소세포폐암에서 진단과 치료를 위한 최소 침습 기술의 발전과 방사선 치료의 발달 및 종양의 병리와 분자생물학적 연구의 수행 등과 같은 발전이 이루어졌다. 유전자 돌연변이형에 따라 Epidermal growth factor receptor(EGFR), Anaplastic lymphoma kinase(ALK), ROS proto-oncogene 1 receptor tyrosine kinase(ROS1), Programmed cell death protein 1 (PD-1) 등으로 나눌 수 있으며, 각각에 대한 표적치료제가 개발되어 비소세포폐암의 치료에 획기적인 발전을 가져왔으며, 유전학적 특성을 파악하는 것은 치료에 있어 중요한 지침이 되었다4.
ROS1 변이는 전체 비소세포폐암의 약 1-2%에서 발견된다. ROS1 재배열을 가진 비소세포폐암 환자는 젊은 나이의 비흡연자 또는 가벼운 흡연자에서 잘 나타나는 특징을 가진다5. 또한 ROS1 양성 폐암의 경우 약제 내성 돌연변이가 번번히 발생하고 중추신경계 전이가 높다는 보고가 있다6.
현재 ROS1 양성 비소세포폐암에서 미국 FDA가 승인한 치료제로는 Crizotinib과 Entrectinib이 유일하며, 일반적으로 1차 표준요법으로는 Crizotinib 사용이 권고된다. ROS1 양성 비소세포폐암에서의 Crizotinib의 치료 반응률은 72%, 무진행 생존 기간의 중앙값은 19.2개월, 전체 생존 기간의 중앙값은 51.4개월이었다7,8.
그러나, 이러한 획기적인 치료의 발전에도 불구하고 일정한 치료기간 이후 항암제의 내성이 유발되거나, 질병이 진행되어 치료를 중단하거나 설사, 피부발진, 구내염, 복통, 피부건조감 등의 부작용을 호소하는 한계점이 존재한다9.
한방치료는 항암 치료의 부작용을 감소시키고 폐암 환자의 삶의 질을 개선하며, 생존율 향상에 기여할 수 있다10. Traditional Chinese Medicine(TCM) 메타 분석 연구결과에 따르면 비소세포폐암 환자에게 한약치료를 병용할 경우, 항암 화학요법 단독 치료에 비해 독성을 감소시키고 암치료효과를 증진시켰으며 항암제에 의한 부작용을 크게 줄이고 신체활동지수의 호전에 효과가 있었다.11
본 증례는 ROS1 양성 재발성 비소세포폐암 환자로 Crizotinib을 복용 후 간헐적인 기침, 설사, 구내염 등의 부작용을 호소하여 한방치료를 병행한 결과 환자가 호소하는 부작용을 완화하고 삶의 질을 개선하였고, 전산화단층촬영(Computed Tomography, CT)상 Partial Response(PR)를 나타냈기에, 한방치료의 병행이 항암치료로 인한 부작용 감소 및 삶의 질 개선과 함께 종양활성화 억제에 효과를 보였다고 판단되어 보고하는 바이다.
II. 본 론
1. 환 자 : 최⃝⃝, 남, 만 58세, 166 cm, 67 kg
2. 치료기간 : 2021년 1월-2021년 5월
3. 진단 시 조직검사 및 병기
1) 최초진단 : 2018년 7월
2) 조직검사 및 병기 : Non small cell lung carcinoma (NSCLC), adenocarcinoma, RML, qT2aN2M0, Immunochemistry상 EGFR, ALK protein negative, Ros-1(2+), PD-L1 : 90%
4. 과거력 및 가족력
1) 과거력 : DM(-), HTN(-). Emphysema(2011년 진단 이후 특별한 처치는 받지 않고 경과 관찰 중)
2) 가족력 : 여동생(폐암)
5. 현병력 상기환자는 2018년 1월부터 시작된 체중감소와 간헐적 숨참, 기침 증상이 발생하여 ⃝⃝병원에서 2018년 7월 시행한 CT, 조직검사 결과 폐조직의 RML adenocarcinoma가 확인되어 Non small cell lung carcinoma(T2N2M0)로 진단되었으며, 병리검사상 EGFR, ALK protein negative, ROS-1 (2+), PD-L1 : 90%가 확인되었다. 이후 2018년 8월 수술치료를 받았으며, 2018년 9월부터 2018년 10월까지 Paclitaxel/Cisplatin을 통한 항암화학치료, 방사선치료 병용요법을 받았고 경과관찰 하는 도중 2020년 4월 간전이가 발견되어 부분 간 절제술을 시행했다. 이후 경과관찰 중 2021년 1월 경 간문부, 대동맥 주변 림프절 재발 소견으로 Crizotinib을 통한 항암화학치료와 더불어 2021년 1월 20일 본원에 입원하여 한방치료를 병행하였다.
6. 주소증
1) 간헐적인 기침 : 2018년 7월 진단이후 간헐적인 Numeric Rating Scale(이하 NRS) 3점 정도의 돌발성 기침을 하루 평균 5회 정도 지속적으로 호소하셨으나, 2021년 1월 재발 이후 NRS 5점 정도의 간헐적인 기침을 하루 평균 8회 정도 호소하는 상태로 내원하였다.
2) 설 사 : 누적된 항암치료로 인하여 NRS 4점 정도의 설사를 하루 평균 5회 호소하였다.
3) 구내염 : 누적된 항암치료의 영향으로 입술~입 안 속 점막에 염증이 생겨 NRS 3점 정도의 출혈, 통증을 호소하였다.
4) 신체활력도 저하 : 깨어 있는 시간 중 침상에 누워있는 시간이 50% 미만이었으며 항암치료로 인해 기력저하와 함께 식욕저하를 호소하였다. Eastern Cooperative Oncology Group(이하 ECOG) Gr 2으로 측정되었다.
7. 望聞問切
1) 體 格 : 166 cm, 67 kg
2) 食慾 및 消化 : 항암치료를 시작하며 식욕이 저하되었으며, 소화력은 양호.
3) 小 便 : 특이사항 없음, 하루 평균 3~4회 소변 봄.
4) 大 便: 설사양상, 5회/1일 배변 시 항문의 작열감, 후중감 동반.
5) 睡 眠 : 밤에 간헐적인 설사증상으로 수면불량
6) 脈 診 : 脈沈細, 微澁
7) 舌 診 : 紅舌, 裂紋, 苔白微黃
8) 口 渴 : 있음, 喜冷飮
9) 腹 診 : 臍左右壓痛(天樞(ST25))
10) 診 斷 : 폐암이 진행하며 정상적인 肺의 生理的 기능을 잃게 되었으며, 또한 누적된 항암제의 독성으로 인하여 체내의 正氣가 계속적으로 손상되는 脾肺兩虛의 상태에 있었으며, 宣發肅降 기능실조로 熱毒, 濕痰, 氣滯, 血瘀 등의 邪氣가 體內에 축적된 상태로 진단하였다.
8. 치료방법
1) 한방치료
(1) 한약치료
① 해독양폐탕(解毒養肺湯, Haedogyangpye-tang) : 폐기능 개선, 신체 전반적인 면역력 개선, 설사, 구내염 등의 증상을 개선시킬 목적으로 1일 3회(매 식후 1시간) 120 cc씩 꾸준히 복용하였다(Table 1).
② 행소탕(杏蘇湯, Haengso-tang) : 기침 증상 개선을 위한 목적으로 증상이 심해지는 기간에 맞춰 1일 3회(매 식후 1시간) 꾸준히 복용하였다(Table 2).
(2) 약침치료 : 행인약침(1 vaial에는 30 g의 행인에서 추출한 추출물이 들어있다.)을 일주일에 2~3차례 나누어 肺兪(BL13), 中府(LU1), 雲門(LU2), 복부 혈자리(上脘(CV13), 中脘(CV12), 天樞(ST25), 氣海(CV6), 關元(CV4)) 위주로 자입하였다.
(3) 침치료 : 폐기능, 신체 면역력 개선과 더불어 기침증상, 항암으로 인한 설사 증상 개선을 위해 1일 1회 兩側 足三里(ST36), 陰陵泉(SP9), 太衝(LR3), 合谷(LI4), 太淵(LU9), 內關(PC6), 少府(HT8), 三陰交(SP6), 天樞(ST25), 中脘(CV12) 穴位에 20~25분간 유침하였으며, 0.25×30 mm(동방침)의 호침을 사용하였다.
2) 병행한 현대의학적 치료
(1) 항암화학요법 : 2021년 1월 7일부터 Crizotinib 250 mg bid로 복용하였다.
9. 치료 평가
1) 종양의 위치, 크기 및 변화는 abdomen Computed tomography(CT)를 통해 평가하였다.
2) Response Evaluation Criteria In Solid Tumors (RECIST) : 고형종양에서의 치료반응에 대한 객관적 평가기준으로 고형암 치료법을 평가하는 임상시험에서 대부분 사용되는 평가기준이다. RECIST version 1.1에 따르면 종양에 대한 치료반응은 Complete Response(CR), Partial Response (PR), Progressive Disease(PD), Stable Disease (SD)로 나누어 평가한다12,13. 본 증례에서는 이에 근거하여 종양에 대한 치료반응을 평가하였다.
3) National Cancer Institute Common Terminology Criteria for Adverse Event(NCI-CTCAE) : NCI-CTCAE는 암환자에게 사용한 치료로 인한 부작용의 정도를 정량화, 표준화시킨 평가도구로 1등급에서 5등급까지로 분류하고 있다. Grade 1은 무증상이거나 증상이 경미하여 경과관찰을 요하는 상태, Grade 2는 중등도의 부작용으로 원활한 일상생활에 제약이 있는 상태, Grade 3는 당장의 생명의 위협은 없으나 중증의 상태로 일상생활이 불가한 상태이며 Grade 4는 생명의 위협이 있는 상태로 긴급한 치료가 필요한 상태이며 Grade 5는 부작용으로 인한 사망에 이른 것을 의미한다. 본 증례에서는 NCI-CTCAE version 5.0에 의하여 치료에 따른 간기능, 신장기능, 골수억제기능의 부작용을 평가하였다14.
4) Eastern Cooperative Oncology Group(ECOG) : ECOG는 암환자의 움직임과 활동 정도 파악을 위해 개발된 측정도구로 환자의 상태를 0~5점으로 구분하여 환자의 의학적 상태를 포괄적으로 반영한다. Grade 0은 질병 이전의 상태로 제한 없이 활동할 수 있는 상태, Grade 1은 경미한 증상이 있으나 거의 완전한 거동이 가능한 상태, Grade 2는 낮 시간 동안 50% 미만으로 누워 지내는 상태로 자신을 돌볼 수 있고 직장 생활은 불가능한 상태, Grade 3은 낮 시간 동안 50% 이상 누워 지내는 상태로 최소한의 자신은 돌볼 수 있는 상태, Grade 4는 완전히 누워 지내는 상태로 전혀 자신을 돌볼 수 없는 상태, Grade 5는 사망 상태를 의미한다15.
5) Numeric Rating Scale(NRS) : NRS는 수치평가척도로써 환자의 고통정도를 숫자로 계량화하는 방법이다. 수집이 편리하고 환자의 주관적 호소를 객관적 지표로 나타낼 수 있다는 장점이 있어 자주 사용된다. 0~10점까지 숫자통증등급을 활용하여 통증 없음 0, 경도 1~4, 중간정도 5~6, 심함 7~10으로 구분하여 통증을 객관적으로 평가한다. 본 증례에서는 주증상인 기침, 설사 및 구내염에 대해 평가가 이루어졌다.
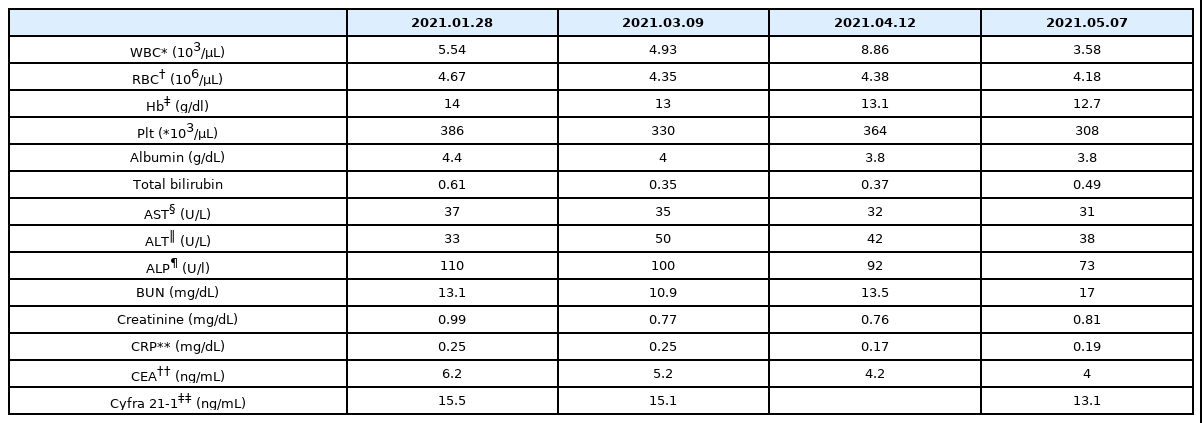
6) 혈액검사(Blood Test) : 치료기간 동안 시행된 통합의학치료의 안전성을 검사하기 위하여 본원 임상병리검사실에서 간 기능 검사 및 신장기능검사를 시행하였고, 폐암 관련 종양표지자인 CEA(Carcinoembryonic antigen)와 CYFRA 21-1(Cytokeratin 19 fragment)을 측정하여 병용투여기간 동안의 변화를 관찰하였다. 또한 WBC, CRP 수치 등 염증반응과 관련된 항목의 변화를 관찰하였다.
10. 치료 경과
1) 종양의 변화
(1) 복 부 : 2020년 12월 30일 전산화단층촬영(Computed Tomography, CT)상 porta hepatis, hepatoduodenal, retrocrural, aortocaval and para-aortic area에 metastic LNs가 관찰되었으며 이전보다 크기가 증가하였으나, 2021년 2월 20일까지 Crizotinib과 한방치료를 병행한 이후 촬영한 전산화단층촬영(Computed Tomography, CT)상 이전에 보였던 LNs 들의 크기가 현저히 작아졌으며, 단경 1 cm 이상 커진 LNs가 보이지 않았고 복부에 새롭게 관찰되는 병변이 없어 RECIST 1.1에 근거하였을 때 부분반응(Partial Response)로 판단되었다. 2021년 4월 15일까지 Crizotinib과 한방치료를 병행한 이후 촬영한 CT상 기존의 크기가 줄어든 LNs은 여전히 안정상태로 유지되었으며, 또한 질병의 진행을 시사할 만한 새로운 병변이 보이지 않아 RECIST 1.1에 근거하였을 때 안정병변(Stable Disease)로 판단되었다(Fig. 1).

Comparison of computed tomography (CT) images before and after treatment.
A (2020/12/30) : 1. No change of Hepatic resection site. 2. Increased metastic LNs in the porta hepatis, hepatoduodenal, retrocrural, aortocaval and para-aortic area.
B (2021/2/20) : 1. No specific findings in the liver, pancreas, adrenal gland, kidney, GI tract. 2. Decreased previously seen LNs around the portal vein and IVC, No lymph nodes larger than 1 cm in diameter were seen.
C (2021/4/15) : 1. No specific findings in the liver, pancreas, adrenal gland, kidney, GI tract. 2. No change of decreased LNs around the portal vein and IVC.
(2) 흉 부 : 2020년 12월 30일과 2021년 2월 20일 및 2021년 4월 15일의 전산화단층촬영(Computed Tomography, CT)상 radiation fibrosis 및 diffuse emphysema가 관찰됐으나, 특별한 변화는 없었으며 암의 재발소견은 관찰되지 않았다(Fig. 2).

Comparison of computed tomography (CT) images before and after treatment.
A (2020/12/30) : 1. No change in radiation fibrosis of right lung. 2. Both lungs diffuse emphysema.
B (2021/2/20) : 1. No change in radiation fibrosis of right lung. 2. Both lungs diffuse emphysema.
C (2021/4/15) : 1. No change in radiation fibrosis of right lung. 2. Both lungs diffuse emphysema.
2) 독성의 부작용 : NCI-CTCAE version 5.0으로 평가했을 때 한방치료로 인한 부작용은 발생하지 않았다. 치료기간 중 AST, ALT의 간 기능 수치는 경미한 상승을 보였으나, 이후 정상범위를 유지하여 우려할만한 간 독성은 발생하지 않았으며 BUN, Creatinine 등의 신장 기능 수치도 정상범위로 유지되어 신 독성은 발생하지 않았다. 또한 WBC, CRP도 입원기간동안 정상범위로 유지되어 염증반응을 보이지 않았다(Table 3).
3) 종양표지자 감소 : 폐암의 종양표지자는 CEA, CYFRA 21-1으로 정상범위는 각각 0~5, 0~3.3이다. 본 증례의 환자에서 치료 전과 후를 비교 하였을 때 CEA는 점차 감소하여 6.2에서 4로 정상범위 안으로 줄어들었으며, CYFRA 21-1은 15.5에서 13.1으로 저하된 것을 감안했을 때 항암치료와 더불어 한방치료가 종양표지자 감소에 긍정적 역할을 한 것으로 생각할 수 있다(Table 3).
4) 증상의 변화
(1) 환자는 2021년 1월 내원 당시 NRS 5점 정도의 간헐적인 기침을 하루 평균 8회 정도 호소하였으나, 본원에서 한방치료로 해독양폐탕(解毒養肺湯), 행소탕(杏蘇湯)을 1일 3회 꾸준하게 복용하며 1일 1회씩 약침치료, 침 치료를 병행하며 치료 1개월 이후에는 NRS 4점 정도의 간할적인 기침을 하루 평균 6회 정도로 증상이 경감되었으며, 3개월 이후에는 기침을 호소하는 횟수가 줄어들어 하루 평균 4회 NRS 2점의 통증을 호소하였다. 이후 치료 4개월 이후부터는 하루 평균 2회 NRS 1점의 통증을 호소하며 점차 개선되었다(Fig. 3).
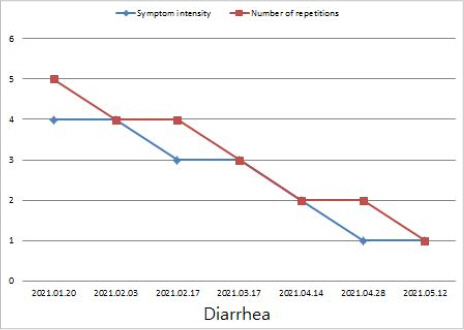
(2) 내원 당시 누적된 항암치료로 유발된 NRS 4점 정도의 설사증상을 하루 평균 5회 가량 호소하였으나, 한방치료로 해독양폐탕(解毒養肺湯)을 1일 3회씩 꾸준하게 복용하며 1일 1회씩 약침치료, 침 치료를 병행한 결과 치료 1개월 이후에는 NRS 3점 정도의 설사를 하루 평균 4회 정도로 증상이 경감되었으며, 3개월 이후에는 NRS 2점 정도의 설사를 하루 평균 2회 호소하였다. 이후 치료 4개월 이후부터는 NRS 1점 정도의 설사를 하루 평균 1회 호소하며 점차 개선되었다(Fig. 4).
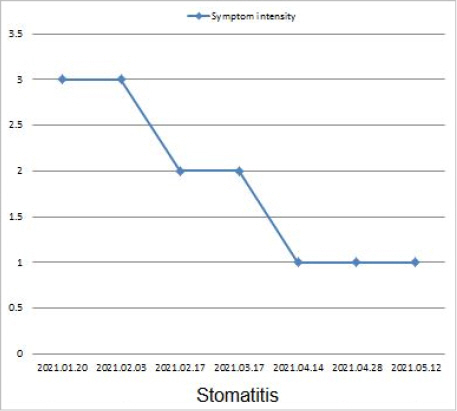
(3) 누적된 항암치료의 영향으로 입술~입 안 속 점막에 염증이 생겨 NRS 3점 정도의 출혈, 통증을 호소하였다. 신체활력도 또한 저하되어 2021년 1월 내원당시 기력저하와 함께 식욕저하를 호소하며 ECOG Gr 2으로 측정되었다. 한방치료로 2021년 1월 20일부터 5월 22일까지 해독양폐탕(解毒養肺湯)을 1일 3회씩 복용하며, 1일 1회씩 약침치료, 침 치료를 병행한 결과 구내염으로 인한 출혈, 통증의 정도가 점차 감소하다 4개월 이후에는 NRS 1점으로 통증이 경감되었으며, 출혈 또한 사라졌다. 신체활력도 또한 점차적으로 개선되어 2021년 5월에는 ECOG Gr1으로 개선되었다(Fig. 5).
III. 고 찰
전 세계적으로 폐암은 사망률 1위를 차지하는 종양으로 폐암의 발생률은 매년 증가하고 있으나1, 2019년 발표된 국내 통계에 따르면 폐암 환자의 5년 상대 생존률은 32.4%였으며, 약 40% 이상의 비소세포폐암환자의 경우 진단 당시 이미 전이가 진행된 4기로 발견되기 때문에 진단 이후의 중앙 생존 기간은 보통 1년 이하로 예후가 불량하다3.
비소세포폐암에서 사용하는 항암제 관련 연구결과에 따르면 수술 후 시스플라틴을 근간으로 하는 항암화학요법을 시행한 경우 사망위험이 감소한 결과가 도출되어 현재는 시스플라틴을 근간으로 하는 병용항암화학요법이 널리 사용되고 있다16.
일반적으로 항암화학요법을 받는 비소세포폐암 환자의 경우, 대부분의 환자들이 암성 통증을 경험한다고 알려져 있으며 통증 다음으로 기침, 호흡곤란 등 호흡기계 증상을 많이 호소하는데, 이러한 증상은 환자의 삶의 질과 연관성이 크기 때문에 폐암 환자의 치료에 있어 중요한 부분을 차지한다17.
한편, 항암제의 효과를 증진시키며 부작용을 줄이려는 목적으로 종양의 병리와 분자생물학적 연구를 진행한 결과 폐암의 발생을 유발하는 특이분자 변이를 치료 목표로 하는 표적 치료가 활발히 연구되어 진행성 비소세포폐암의 치료에 획기적인 발전이 이루어졌다. 혈관내피성장인자를 차단하는 재조합 단일클론 항체인 Bevacizumab, EGFR의 저분자 억제제인 Erlotinib, Gefitinib 및 Afatinib 그리고 ALK, ROS1 및 MET를 표적으로 하는 저분자 억제제인 Crizotinib 등이 대표적인 표적치료제로 개발되어 있다18.
그러나 Crizotinib의 경우 기존 항암화학요법에 비해 일반적으로 부작용은 적지만, 가장 흔한 부작용으로 시각장애, 설사, 구역, 구토, 식욕감소, 피로 등이 있으며, Crizotinib 투여 후 약 38-76%에서 Alanine aminotransferase(ALT)/Asparate aminotransferase (AST) 상승이 발생했으며, 6-16% 정도의 환자에서 Grade 3 이상의 간독성이 발생했다는 보고가 있다19.
현재 비소세포폐암 치료 대강은 환자와 종양의 특성을 고려한 치료 및 치료의 부작용을 최소화하여 암을 안정시키거나 무진행 생존기간과 전체 생존기간을 연장시키고 암으로 인한 증상을 완하고 삶의 질을 향상시키는 것을 목표로 해야 한다. 하지만 서양의학적 접근만으로는 상기 조절에 한계가 존재하여 보완대체치료에 대한 연구가 필요하다20.
한의학은 전통적으로 조화롭고 균형 잡힌 인체를 강조하므로, 한방치료는 신체 전반적인 면역을 안정화시키는 역할을 하여 폐암환자의 삶의 질 개선은 물론 항암제로 인한 부작용 완화에 도움이 될 가능성을 가지고 있다.
비소세포폐암환자의 삶의 질 개선에 대한 TCM의 효과를 보고한 체계적 문헌고찰에서는 분석된 11가지의 처방 중 6가지 처방이 비소세포폐암환자의 항암화학요법과 병행 시에 삶의 질을 유의미하게 개선하는 것으로 분석되었다21. 또한 TCM의 복용 특성과 폐암환자의 생존율을 조사한 연구에서는 한약복용군이 비복용군에 비하여 낮은 사망률(p<0.001)을 나타냄을 확인할 수 있었다22.
韓醫學에서 肺癌은 咳嗽, 胸痛, 喀血, 體重減少, 發熱, 胸悶, 氣短 등의 증상이 나타나는 肺脹, 肺咳, 肺積, 肺癰 등의 범주에 속한다고 볼 수 있는데 그 발병기전으로는 正氣가 상하여 肺氣가 虛해지면 肺의 고유 기능인 宣發肅降 기능실조로 熱毒, 濕痰 등의 邪氣가 축적되고 오래되면 氣滯, 血瘀의 병기를 거치면서 결국 積을 이루게 된다. 치료에 있어서는 滋陰生津, 益氣養陰, 益氣健碑, 滋陰溫陽 등 扶正培本을 위주로 하고, 化痰軟堅, 淸熱解毒, 活熱化瘀 등의 치법을 겸하는데, 肺癌의 初期에는 解毒去邪, 中期에는 攻補兼治, 末期에는 補虛扶正의 치법을 주로 사용한다23.
본 증레는 2018년 7월 폐조직의 RML adenocarcinoma가 확인되어 Non small cell lung carcinoma(T2N2M0)로 진단되었으며, 병리검사상 EGFR, ALK protein negative, Ros-1(2+), PD-L1 : 90%가 확인되었다. 이후 2018년 8월 수술치료를 받았으며, 2018년 9월부터 2018년 10월까지 Paclitaxl/Cisplatin을 통한 항암화학치료, 방사선치료 병용요법을 받았고 경과관찰 하는 도중 2020년 4월 간전이가 발견되어 부분 간 절제술을 시행했다. 이후 경과관찰 중 2021년 1월 경 간문부, 대동맥 주변 림프절 재발 소견으로 Crizotinib을 통한 항암화학치료를 진행하고 있었으며, 내원 당시 간헐적인 기침과 더불어 항암화학치료로 유발된 설사, 구내염, 전반적인 신체활력도 저하가 있었다. 이에 2021년 1월 20일 본원에 입원하여 종양의 활성화를 억제시키고, 항암화학요법의 부작용을 완화시킬 목적으로 한방치료로 해독양폐탕(解毒養肺湯), 행소탕(杏蘇湯)을 1일 3회 꾸준하게 복용시켰으며, 1일 1회씩 약침치료, 침 치료를 병행하여 시행하였다.
해독양폐탕(解毒養肺湯)은 중의(中醫) 처방의 가감방이며, 근거 기반 지침에 의한 처방은 아니나 문헌 근거24로 장덕한방병원에서 경험적으로 쓰는 처방이며, 正氣虛損, 邪氣侵入의 상황에 활용할 수 있는 처방으로 본 증례의 경우 진행성 폐암으로 五臟六腑의 모든 氣를 주관하는 肺에 병이 생긴 것으로 呼吸기능과 더불어 인체의 생명활동을 유지하는 정상적인 肺의 生理的 기능을 잃게 되어 正氣虛의 상태에 놓였으며, 宣發肅降 기능실조로 熱毒, 濕痰, 氣滯, 血瘀 등의 邪氣가 축적되었다. 또한 누적된 항암제의 독성으로 인하여 체내의 正氣가 계속적으로 손상되는 상태에 있었다. 黃芪는 항암제의 부작용으로 나타나는 백혈구 감소증의 회복을 입증하는 실험 연구가 보고된 바가 있으며25, 白朮은 MeOH 추출물의 농도 의존적인 종양세포증식 저해 효과 및 분리 정제된 白朮 화합물의 항암효과가 입증되었다26. 石斛의 LPS로 자극된 대식세포주 RAW264.7 세포에 대한 염증성 cytokine의 조절 가능성을 확인하였고27, 桔梗의 colon 26-M3.1을 대상으로 한 면역활성 및 종양전이 억제 효과가 입증되었다28. 또한 冬蟲夏草의 생리활성 물질인 cordycepin의 항암활성에 대한 연구가 활발히 이루어지고 있으며, 다양한 치료적 가능성이 제시되고 있으며29, 山豆根 추출물의 COX-2 발현 억제, PGE2 생성 감소효과를 통한 인체 폐암세포의 증식에 대한 억제 효과를 확인했으며30, 楡根皮의 면역세포의 증식을 자극하는 mitogen 역할 및 T 세포에 의한 면역증강 효과를 통한 항암효과를 확인했다31. 위와 같은 병인론적 관점과 현대의 연구동향에 근거하여 해독양폐탕(解毒養肺湯)을 처방했으며, 益氣健脾, 滋陰潤肺, 淸熱解毒, 化痰祛瘀의 효과를 통해 正氣의 회복을 도모하여 肺의 生理的 기능을 회복시키고, 濕痰, 氣滯, 血瘀 등의 邪氣를 제거하여 기침, 설사 등의 제반 부작용을 제거하는 방향으로 치료 목표를 설정하였다.
행소탕(杏蘇湯)은 危亦林의 저서 ≪世醫得效方≫에 처음 기재된 방제로 ≪東醫寶鑑⋅咳嗽⋅寒嗽≫ 중에서 “治傷風寒 咳而痰盛”한다고 기재되어 있으며 風寒을 解表하는 蘇葉과 降氣平喘하는 杏仁이 主가 되는 방제이다. 杏蘇湯은 기관표면 상피세포(HTSE)에 30분 처리 시 뮤신분비를 유의성 있게 감소시켰으며, 이를 통해 기도 점액분비를 감소시키는 효능이 있음을 유추할 수 있다32. 따라서 본 증례의 경우 뮤신분비 조절을 통한 객담제거 및 기침증상 개선을 목적으로 처방하였다.
足三里(ST36), 太衝(LR3), 合谷(LI4), 內關(PC6), 三陰交(SP6) 등의 穴位에 침치료를 시행하여 폐암환자의 통증, 식욕부진, 오심, 설사, 긴장감, 삶의 질 저하 등에 대한 개선을 보고한 연구를 참고하여,33 1일 1회 兩側 足三里(ST36), 陰陵泉(SP9), 太衝(LR3), 合谷(LI4), 太淵(LU9), 內關(PC6), 少府(HT8), 三陰交(SP6), 天樞(ST25), 中脘(CV12) 穴位에 침치료를 시행하였다.
행인약침은 amygdalin, emulsin 등의 물질을 함유하고 있으며, 이들 성분으로 인하여 호흡중추 와 기침중추에 대해 진정, 진해작용을 가지며 암세포에 대한 사멸효과를 가지고 있어 폐암을 포함한 다른 종류의 암환자의 항암제로도 이용되고 있다34. 따라서 본 증례의 경우 기침증상 개선은 물론 삶의 질 개선을 목적으로 일주일에 2~3차례 나누어 肺兪(BL13), 中府(LU1), 雲門(LU2), 복부 혈자리(上脘(CV13), 中脘(CV12), 天樞(ST25), 氣海(CV6), 關元(CV4)) 穴位에 약침치료를 시행하였다.
본 증례의 경우 내원 당시 호소했던 간헐적인 기침과 더불어 항암화학치료로 유발된 설사, 구내염, 전반적인 신체활력도 저하는 해독양폐탕(解毒養肺湯), 행소탕(杏蘇湯)을 1일 3회 꾸준하게 복용시키며, 1일 1회씩 약침치료, 침 치료를 병행하여 시행한 결과 점차적으로 호전되어 내원 당시 NRS 5점 정도의 간헐적인 기침을 하루 평균 8회 정도 호소하였으나, 치료 4개월 이후부터는 하루 평균 2회 NRS 1점의 통증을 호소하며 점차 개선되었고, 내원 당시 누적된 항암치료로 유발된 NRS 4점 정도의 설사증상을 하루 평균 5회 가량 호소하였으나, 치료 4개월 이후부터는 NRS 1점 정도의 설사를 하루 평균 1회 호소하며 점차 개선되었다. 또한 누적된 항암치료의 영향으로 생긴 구내염은 내원 당시 NRS 3점 정도의 출혈, 통증을 호소하였으며, 신체활력도 또한 저하되어 2021년 1월 내원 당시 기력저하와 함께 식욕저하를 호소하며 ECOG Gr 2으로 측정되었다. 그러나 한방치료를 시행한 이후 점차 개선되다가 치료 4개월 이후에는 구내염의 경우 NRS 1점으로 통증이 경감되었으며, 출혈 또한 사라졌다. 신체활력도 또한 점차적으로 개선되어 2021년 5월에는 ECOG Gr1으로 개선되었다. 치료기간 중 AST, ALT의 간 기능 수치는 경미한 상승을 보였으나, 이후 정상범위를 유지하여 우려할만한 간 독성은 발생하지 않았으며 BUN, Creatinine 등의 신장 기능 수치도 정상범위로 유지되어 신 독성은 발생하지 않았다. 또한 WBC, CRP도 입원기간 동안 정상범위로 유지되어 염증반응을 보이지 않았다. 종양표지자인 CEA는 점차 감소하여 6.2에서 4로 정상범위 안으로 줄어들었으며, CYFRA 21-1은 15.5에서 13.1으로 저하된 것을 감안했을 때 한방치료의 효과뿐만 아니라 안전성을 확인하였다. 종양의 크기 또한 지속적으로 감소하여 CT상 복부에 재발되어 새롭게 관찰되던 간문부, 대동맥 주위 림프절들의 크기가 지속적으로 감소했으며, 흉부는 특별한 변화는 없었으며 암의 재발소견은 관찰되지 않았다.
결론적으로 본 증례의 경우 Crizotinib을 복용하는 ROS1 양성 재발성 비소세포폐암 환자에게 한방치료를 병행하여 항암치료로 인한 부작용을 완화시키고 삶의 질을 개선시켰으며, 항암치료에 보완적인 치료효과를 통해 종양의 크기 감소에 도움을 줄 수 있음을 보여준다. 비록 대조군이 없는 1례에 불과하며 항암화학치료와 한방치료가 병용되었기에 특정 약물의 작용이나 치료방법에서 각각의 약리 작용 및 효과를 명확히 구분하기는 어렵지만, 단독으로 항암제를 투여하거나, 방사선 치료를 시행하는 것보다 한방치료를 병행하는 것이 더욱 효과적인 치료가 될 수 있는 가능성을 보여준 것으로 생각된다.