금은화가 HUVEC에서 죽상동맥경화증 관련 염증인자 발현 억제에 미치는 영향
The Effect of Lonicera Japonica Thunberg on Inflammatory Factor Expression Associated with Atherosclerosis
Article information
Abstract
ABSTRACT
Objective
The purpose of this study was to investigate the effect of Lonicera Japonica Thunberg (LJT) on the inflammatory factor expression associated with atherosclerosis in human umbilical vein endothelial cells (HUVECs).
Methods
After treatment with LJT in HUVEC which is treated with TNF-α, we measured the expression levels of biomarkers (MCP-1, ICAM-1, VCAM-1, KLF2, and eNOS), mRNA (CCL2, ICAM1, VCAM1, KLF2, and NOS3), and the proteins (MCP-1, ICAM-1, VCAM-1, KLF2, eNOS, ERK, JNK, and p38).
Results
1. Compared to the control, LJT significantly reduced MCP-1 and VCAM-1 levels at concentrations of 100, 200, and 400 μg/ml and ICAM-1 expression at 200 and 400 μg/ml compared to the control. It increased KLF2 levels at all three concentrations, but not significantly, while eNOS expression was significantly increased at 400 μg/ml.
2. LJT was seen to significantly reduce the expression of CCL2, ICAM1, and VCAM1 mRNA at concentrations of 100, 200, and 400 μg/ml compared to the control. In contrast, significantly increased KLF2 and NOS3 mRNA levels were observed at 400 μg/ml and at 200 and 400 μg/ml, respectively.
3. Compared to the control, LJT significantly reduced the protein expression of MCP-1 and VCAM-1 at 200 and 400 μg/ml and of ICAM-1 at 400 μg/ml. In addition, it increased both KLF2 and eNOS protein levels at 200 and 400 μg/ml. Although LJT did not have an effect on ERK expression in comparison with the control, it significantly reduced JNK levels at 200 and 400 μg/ml and p38 levels at 400 μg/ml.
Conclusions
These results suggest that LJT has an effect on the inhibition of inflammatory factor expression associated with atherosclerosis in HUVECs which could contribute to the prevention of cardiovascular and cerebrovascular diseases.
Ⅰ. 서 론
2019년 사망원인통계에 의하면 우리나라의 주요 사망원인 중 심장 질환과 뇌혈관 질환이 각각 2, 4위로 전체 사망원인의 17.8%를 차지하고 있다1. 전세계적으로도 심뇌혈관질환은 가장 흔한 사망 원인으로 연간 1,700만 명이 사망하며 이는 전체 사망의 약 30%에 해당하는 수치이다2. 죽상동맥경화증은 심뇌혈관질환의 주요 원인으로 순환계의 여러 부위에 영향을 주는데, 관상동맥의 죽상경화증은 흔히 협심증과 심근경색증을 일으키며, 중추신경계에 혈액을 공급하는 동맥의 죽상경화증은 흔히 뇌졸중과 일과성 뇌허혈을 일으킨다3.
죽상동맥경화증의 발생은 혈관 내막의 손상과 함께 시작되어 염증반응이 주요 기전으로 작용한다. 혈중에 축적된 LDL(Low density lipoprotein)- cholesterol이 혈관 내막으로 들어가 산화 LDL- cholesterol로 변화하게 되면 혈관내피세포를 자극하여 ICAM-1, VCAM-1, MCP-1 등의 물질이 분비된다. 이로 인해 단핵구를 포함한 백혈구들이 혈관내피에 부착하여 내피 아래로 유입되며 단핵구는 내피 하에서 대식세포로 변해 지질을 흡수하여 거품세포가 된다. 내피 하에 과잉으로 축적된 거품세포 등에서 다양한 cytokine이 분비되며 이는 중막의 평활근세포를 내막으로 이동 및 증식하게 해 죽상경화성 플라크를 형성하게 된다. 이러한 기전으로 관상동맥에 죽상경화가 진행되면 혈관내강이 협착되어 허혈을 일으키거나 플라크의 파열로 혈전이 생겨 색전증을 일으키는 등 심뇌혈관질환을 유발하는 주요 요인으로 작용한다3,4.
금은화는 인동과(Caprifoliaceae, 忍冬科)에 속한 인동덩굴(Lonicera japonica Thunberg, 忍冬)의 꽃봉오리를 건조한 것으로 性이 寒하고 味는 甘하며 淸熱解毒, 凉散風熱하는 효능이 있어 癰腫疔瘡, 喉痺, 丹毒, 熱毒血痢, 風熱感冒 등을 치료하는데5 이는 현대적으로 해석하면 항염증효과가 있는 것으로 볼 수 있다. 최근에는 금은화 추출물에 대한 실험연구가 많이 진행되어 다양한 효능이 보고되고 있는데, 항균6, 항바이러스7, 항암8,9효과와 더불어 항염증효과10-13에 대한 연구가 지속적으로 보고되고 있으며, 죽상동맥경화증과 관련한 연구로는 금은화가 항산화작용으로 LDL의 산화를 억제하고 혈소판 응집을 억제하는 효과를 나타내 죽상동맥경화의 예방 및 치료 소재로의 개발 가능성을 시사한 연구14가 보고된 바 있다. 그러나 금은화가 죽상동맥경화의 주요 발생 기전인 혈관 염증 반응에 미치는 영향에 관한 연구는 아직까지 없는 실정이다. 이에 본 저자는 금은화가 죽상동맥경화증 관련 염증인자 발현을 억제하는 효과를 확인하기 위해 본 연구를 진행하였다.
본 연구는 Human umbilical vein endothelial cell(HUVEC)을 금은화 추출물로 처리한 후 TNF-α를 처리하여 염증반응을 유도한 뒤 원심분리하여 얻은 상등액에서 MCP-1, ICAM-1, VCAM-1, KLF2, eNOS 등의 바이오마커 생성량, 원심분리하여 얻은 세포에서 MCP-1, ICAM-1, VCAM-1, KLF2, eNOS, ERK, JNK, p38 등의 단백질 발현량, CCL2, ICAM1, VCAM1, KLF2, NOS3 등의 유전자 발현량을 측정하여 금은화가 죽상동맥경화증 관련 염증인자 발현 억제에 미치는 영향을 조사하였으며, 이에 유의적인 결과를 얻었기에 보고하는 바이다.
Ⅱ. 연구 방법
1. 재 료
1) 시 료
본 연구에서 사용된 금은화(Lonicera japonica Thunberg, 이하 LJT로 표기)는 경상북도 영천에서 재배되었으며, 약초 전문회사인 ㈜두손애약초에서 검수된 제품을 구입하여 사용하였다.
2) 시 약
본 연구에서 사용된 시약은 gelatin solution (Sigma-Aldrich, U.S.A.), dulbecco’s phosphate buffered saline(D-PBS : Welgene, Korea), tumor necrosis factor-α human(TNF-α : Sigma-Aldrich, U.S.A.), EGM™-2 endothelial cell growth medium-2 bullekit™(Lonza, U.S.A.), trypan blue(Sigma-Aldrich, U.S.A.), trypsin-EDTA solution(Welgene, Korea), EZ-cytox(Daeilab, Korea), human VCAM-1 ELISA kit(Komabiotech, Korea), human ICAM-1 ELISA kit(Komabiotech, Korea), human MCP-1 ELISA kit (Komabiotech, Korea), KLF2 ELISA kit(Mybiosource, U.S.A.), eNOS ELISA kit(Mybiosource, U.S.A.), accupower cyclescript RT premix(Bioneer, Korea), total RNA prep kit(Intronbio, Korea), DEPC-DW (Bioneer, Korea), RIPA lysis and extraction buffer (Thermo Fisher, U.S.A.), SYBR Green(Qiagen, Germany), pierce™ BCA protein assay Kit(Thermo Fisher, U.S.A), protease inhibitor cocktail(Sigma- Aldrich, U.S.A.), phosphatase inhibitor cocktail 3(Sigma-Aldrich, U.S.A.), phosphatase inhibitor cocktail 2(Sigma-Aldrich, U.S.A.), miracle-star™ western blot detection system(Intron Biotechnology, Korea), bovine serum albumin(BSA : Gendepot, U.S.A.), secondary antibody(Jackson immunoresearch, U.S.A.), primary antibody(Cell Signaling, U.S.A.) 등이다.
3) 기 기
본 연구에서 사용된 기기는 freeze dryer(ilShinbiobase, Korea), rotary vacuum evaporator(EYELA FDU-540, Japan), clean bench(Vision scientific, Korea), CO2 incubator(Sanyo, Japan), vortex mixer(Vision scientific, Korea), autoclave(Sanyo, Japan), deep-freezer(Sanyo, Japan), centrifuge(Vision scientific, Korea), plate shaker(Lab-Line, U.S.A.), ice-maker(Vision scientific, Korea), micro plate reader(Molecular Devices, U.S.A.), alpha cycler 1 PCRmax(PCRmax, U.K.), luminex(Millipore, U.S.A.), nanodrop(Thermo Fisher, U.S.A.), mini trans-Blot(Bio-RAD, U.S.A.), real time PCR(Qiagen, Germany), chemidoc fusion FX (Vilber Lourmat, France) 등이다.
2. 방 법
1) 시료 추출
LJT 50g에 증류수 500 ml를 넣은 후 100 ℃에서 3시간 동안 추출하였고, 추출물을 여과지로 여과하고 rotary vacuum evaporator를 이용해 감압농축한 뒤 freeze dryer를 사용해 동결건조를 진행하였다. 동결건조 후, 6.52 g(수득률 : 13.04%)의 LJT 분말을 얻었으며, -20 ℃에 보관하면서 사용하였다.
2) 세포 배양
Human umbilical vein endothelial cell(HUVEC)을 0.2% gelatin solution으로 코팅된 plate에 EGM™-2 singlequots™ kit와 EGM™-2 medium으로 혼합된 배지를 사용해 5% CO2, 37 ℃의 조건이 일정하게 유지되는 세포배양기를 통해 배양하였고, 2-3일을 주기로 계대 배양해 본 실험을 진행하였다.
3) 세포생존율 측정
48 well plate 안에 HUVEC을 1×105 cells/well로 분주한 다음 24시간 동안 배양하였다. 24시간 후, LJT를 100, 200, 400, 600 μg/ml의 농도로 처리하였고 다시 24시간 동안 배양하였다. 그 후 배양액 100 μl당 EZ-Cytox 용액 10μl를 첨가해 세포배양기에서 30분 동안 반응시켰다. 반응 후 450 nm에서 흡광도의 변화를 측정해 대조군에 대한 세포생존율을 백분율로 나타내었다.
4) 바이오마커 생성량 측정
HUVEC을 6 well plate에 1×106 cells/well로 분주한 다음 24시간 동안 배양하였다. 배양 후 LJT를 100, 200, 400 μg/ml의 농도로 각각 처리한 후 1시간 뒤, TNF-α 10 ng/ml를 추가해 12시간 동안 배양하였다. 배양액을 1200 rpm에서 5분간 원심분리해 얻은 상등액을 standard와 함께 96 well plate에 각각 100 μl씩 넣은 뒤 37 ℃에서 2시간 동안 반응시켰다. 반응 후, washing buffer를 이용해 세척 작업을 4회 진행한 후, detection antibody 100 μl를 넣고 다시 37 ℃에서 2시간 동안 반응시킨 후 세척하였다. 세척한 후, HRP conjugate를 100 μl씩 넣고 37 ℃에서 30분 동안 반응시키고 세척한 다음 substrate reagent를 100 μl씩 넣고 37 ℃에서 15분 동안 반응시키고 100 μl의 stop solution을 추가해 micro reader를 이용해 450 nm에서 흡광도를 측정했으며, standard curve를 기준으로 절대값으로 나타내었다.
5) 유전자 발현량 측정
(1) RNA 추출
HUVEC을 6 well plate에 1 well당 1×106 cells로 분주한 다음 24시간 동안 배양하였다. 배양 후 LJT를 100, 200, 400 μg/ml의 농도로 각각 처리한 후 1시간 뒤, TNF-α 10 ng/ml를 추가해 12시간 동안 배양하였다. 이 후, 1200 rpm에서 5분간 원심분리해 얻은 세포에 chloroform 200 μl와 easy blue 1 ml를 넣고 vortexing 해준 후, 13000 rpm, 4 ℃에서 10분간 원심분리하였다. 상층액 400 μl를 400 μl의 binding buffer와 실온에서 1분간 반응시킨 후 반응액 700 μl를 column에 주입해 13000 rpm에서 30초간 원심분리하였다. Column에 washing buffer A를 700 μl 넣고 13000 rpm에서 30초 동안 원심분리 후, washing buffer B를 700 μl 넣고 동일하게 원심분리 하였다. Column의 하단부를 1.5 ml tube로 교체한 후, column에 30 μl의 elution buffer를 넣고 1분간 반응시킨 후 13000 rpm에서 1분간 원심분리하여 total RNA를 추출하였다.
(2) cDNA 합성
역전사 반응은 RT premix kit의 mixture(dNTPs mixture, reaction buffer, RNase inhibitor, oligo dT15 primer, stabilizer)에 total RNA를 1 μg 넣은 후 DEPC-DW를 최종 부피가 20 μl가 되도록 첨가하였다. 이 혼합액을 잘 섞은 뒤, 45 ℃에서 1시간 반응시켜 first-strand cDNA를 합성하였고, 95 ℃에서 5분간 방치해 M-MLV RT를 불활성화 시키고 합성이 완료된 cDNA들을 PCR(polymerase chain reaction)에 사용하였다.
(3) 유전자 증폭
합성이 완료된 cDNA들을 증폭시키기 위해 real-time PCR을 진행했으며, real-time 전용 tube에 DEPC-DW 5 μl, SYBR Green 10 μl, 각 primer 2 μl, cDNA 1 μl씩 넣어 95 ℃에서 2분간 반응시켰고 그 후 95 ℃에서 5초, 62.5 ℃에서 30초를 총 40회 반복하여 유전자를 증폭시켰다. 유전자 발현량은 대조군에 비해 계산하였고, 사용된 primer들의 sequence는 Table 1과 같다(Table 1).
6) 단백질 발현량 측정
HUVEC을 6 well plate에 1×106 cells/well로 분주한 후 24시간 동안 배양하였다. 배양 후 LJT를 100, 200, 400 μg/ml의 농도로 각각 처리한 후 1시간 뒤, TNF-α 10 ng/ml를 추가해 12시간 동안 배양하였다. 그 후, 1200 rpm에서 5분간 원심분리해 얻은 세포를 D-PBS로 2회 세척하였고 세포 pellet에 phosphatase inhibitor Ⅱ, Ⅲ, protease inhibitor cocktail Ⅰ이 포함된 RIPA buffer를 넣어서 단백질을 추출하였다. 추출한 단백질은 BCA protein assay kit를 이용해 정량하였고, sample loading buffer와 섞은 후 95 ℃에서 5분 동안 반응시켜 준비하였다. 준비된 단백질은 10% acrylamide gel을 이용해 SDS- PAGE하여 크기별로 분리하였고, PVDF membrane으로 이동시켰다. 단백질이 옮겨진 membrane을 3% BSA에 담그고 2시간 동안 상온에서 반응시켰다. TBS-T buffer를 이용해 세척한 후 primary antibody를 넣고 4 ℃에서 16시간 반응시켰다. 다시 3회 세척한 후 secondary antibody를 넣고 상온에서 1시간 반응시켰으며, 다시 세척한 후 ECL solution을 통해 단백질을 발색시켰다. 그 후, chemidoc fusion FX를 이용해 단백질 발현량을 분석하였다.
7) 정상군, 대조군 및 실험군 설정
세포생존율 측정 시에는 HUVEC에 어떠한 처리도 하지 않은 군을 대조군, HUVEC에 LJT를 100, 200, 400, 600 μg/ml의 농도로 각각 처리한 군을 실험군으로 두었다.
바이오마커 생성량, 유전자 발현량 및 단백질 발현량 측정 시에는 HUVEC에 어떠한 처리도 하지 않은 군을 정상군, HUVEC에 TNF-α 10 ng/ml를 처리한 군을 대조군으로 두었으며, HUVEC에 LJT를 100, 200, 400 μg/ml의 농도로 각각 처리한 후 1시간 뒤 TNF-α 10 ng/ml를 처리한 군을 실험군으로 두었다.
3. 통계처리
연구 결과는 SPSS 21.0을 이용해 mean±standard deviation 으로 나타내었고, ANOVA를 사용해 다중 비교하였으며 Tukey’s HSD test를 통하여 p<0.05 수준에서 유의성을 검정하였다.
Ⅲ. 연구 결과
1. 세포생존율
세포생존율을 측정한 결과, 대조군이 100.00±5.76%로 나타났을 때, LJT 100, 200, 400, 600 μg/ml의 농도에서 각각 100.54±1.07%, 100.29±2.65%, 98.54± 3.69%, 90.56±3.67%로 나타나 600 μg/ml의 LJT 처리군에서 90% 이하의 세포생존율을 보였다(Fig. 1).

Cell viability of LJT in HUVEC.
HUVEC were treated by 100, 200, 400, and 600 μg/ml of LJT for 24 hours. Treated cells were reacted by an EZ-Cytox for 30 minutes and then absorbance was measured at 450 nm using a micro plate reader. Cell viability was calculated as percentage (%) compared to the control. The results were presented as the mean±standard deviation from 3 separate trials.
2. 바이오마커 생성량
1) MCP-1
MCP-1의 바이오마커 생성량을 측정한 결과, 정상군에서 19.17±1.64 pg/ml, 대조군에서 162.91±1.71 pg/ml가 나타났을 때, LJT 100, 200, 400 μg/ml의 농도에서 각각 144.65±7.32 pg/ml, 133.82±4.35 pg/ml, 111.42±7.37 pg/ml로 나타나 농도 100 μg/ml 이상의 LJT 처리군에서 대조군에 비해 유의적인(* : p<0.05, ** : p<0.01, *** : p<0.001) 감소를 보였다(Fig. 2A).

Effect of LJT on MCP-1 (A), ICAM-1 (B) and VCAM-1 (C) levels in HUVEC.
HUVEC were treated 100, 200, and 400 μg/ml of LJT with 10ng/ml of TNF-α for 12 hours. MCP-1, ICAM-1, VCAM-1 levels were measured using an ELISA kit. The results were presented as the mean±standard deviation from 3 separate trials (Significance of results, * ; p<0.05, ** ; p<0.01, *** ; p<0.001 compared to control).
2) ICAM-1
ICAM-1 바이오마커 생성량을 측정한 결과, 정상군에서 82.14±6.61 pg/ml, 대조군에서 215.03±10.12 pg/ml가 나타났을 때, LJT 100, 200, 400 μg/ml의 농도에서 각각 201.84±12.24 pg/ml, 152.80±8.71 pg/ml, 124.39±9.46 pg/ml로 나타나 농도 200 μg/ml 이상의 LJT 처리군에서 대조군에 비해 유의적인(** : p<0.01, *** : p<0.001) 감소를 보였다(Fig. 2B).
3) VCAM-1
VCAM-1 바이오마커 생성량을 측정한 결과, 정상군에서 29.16±3.42 pg/ml, 대조군에서 254.60±10.13 pg/ml가 나타났을 때, LJT 100, 200, 400 μg/ml의 농도에서 각각 225.32±7.92 pg/ml, 199.35±13.05 pg/ml, 164.55±13.47 pg/ml로 나타나 농도 100 μg/ml 이상의 LJT 처리군에서 대조군에 비해 유의적인(* : p<0.05, ** : p<0.01, *** : p<0.001) 감소를 보였다(Fig. 2C).
4) KLF2
KLF2 생성량을 측정한 결과, 정상군에서 144.00± 12.12 pg/ml, 대조군에서 96.24±8.88 pg/ml가 나타났을 때, LJT 100, 200, 400 μg/ml의 농도에서 각각 102.14±9.29 pg/ml, 102.91±14.51 pg/ml, 112.35±10.22 pg/ml로 나타나 농도 100 μg/ml 이상의 LJT 처리군에서 대조군에 비해 증가를 보였지만 유의성은 나타나지 않았다(Fig. 3A).
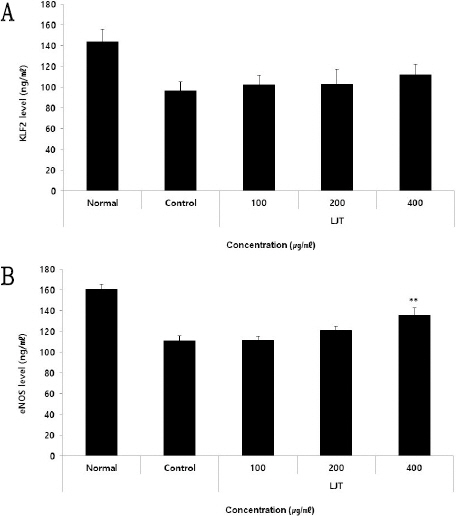
Effect of LJT on KLF2 (A), eNOS (B) levels in HUVEC.
HUVEC were treated 100, 200, and 400 μg/ml of LJT with 10ng/ml of TNF-α for 12 hours. KLF2, eNOS levels were measured using an ELISA kit. The results were presented as the mean±standard deviation from 3 separate trials (Significance of results, ** ; p<0.01 compared to control).
5) eNOS
eNOS 생성량을 측정한 결과, 정상군에서 160.99± 4.63 pg/ml, 대조군에서 110.82±5.21 pg/ml가 나타났을 때, LJT 100, 200, 400 μg/ml의 농도에서 각각 111.71±3.77 pg/ml, 121.22±3.69 pg/ml, 135.90±6.85 pg/ml로 나타나 농도 400 μg/ml의 LJT 처리군에서 대조군에 비해 유의적인(** : p<0.01) 증가를 보였다(Fig. 3B).
3. 유전자 발현량
1) CCL2
CCL2 유전자 발현량을 측정한 결과, 정상군에서 0.10±0.01, 대조군에서 1.00±0.01가 나타났을 때, LJT 100, 200, 400 μg/ml의 농도에서 각각 0.86±0.07, 0.78±0.02, 0.50±0.01로 나타나 농도 100 μg/ml 이상의 LJT 처리군에서 대조군에 비해 유의적인(* : p<0.05, *** : p<0.001) 감소가 나타났다(Fig. 4A).
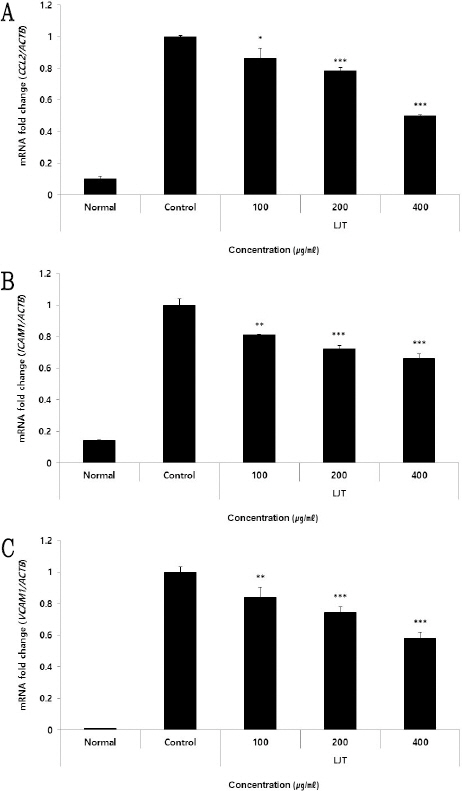
Effect of LJT on CCL2 (A), ICAM1 (B), VCAM1 (C) mRNA expression levels in HUVEC.
HUVEC were treated 100, 200, and 400 μg/ml of LJT with 10 ng/ml of TNF-α for 12 hours. The mRNA expression levels were measured with a qRT-PCR (quantitative real-time PCR). The results were presented as the mean±standard deviation from 3 separate trials (Significance of results, * ; p<0.05, ** ; p<0.01, *** ; p<0.001 compared to control).
2) ICAM1
ICAM1 유전자 발현량을 측정한 결과, 정상군에서 0.14±0.00, 대조군에서 1.00±0.04가 나타났을 때, LJT 100, 200, 400 μg/ml의 농도에서 각각 0.81±0.00, 0.72±0.02, 0.66±0.03로 나타나 농도 100 μg/ml 이상의 LJT 처리군에서 대조군에 비해 유의적인(** : p<0.01, *** : p<0.001) 감소가 나타났다(Fig. 4B).
3) VCAM1
VCAM1 유전자 발현량을 측정한 결과, 정상군에서 0.01±0.00, 대조군에서 1.00±0.03가 나타났을 때, LJT 100, 200, 400 μg/ml의 농도에서 각각 0.84±0.06, 0.75±0.03, 0.58±0.03로 나타나 농도 100 μg/ml 이상의 LJT 처리군에서 대조군에 비해 유의적인(** : p<0.01, *** : p<0.001) 감소가 나타났다(Fig. 4C).
4) KLF2
KLF2 유전자 발현량의 측정 결과, 정상군에서 1.75±0.12, 대조군에서 1.00±0.08가 나타났을 때, LJT 100, 200, 400 μg/ml의 농도에서 각각 1.01±0.02, 1.02±0.06, 1.13±0.04로 나타나 농도 400 μg/ml의 LJT 처리군에서 대조군에 비해 유의적인(* : p<0.05) 증가가 나타났다(Fig. 5A).

Effect of LJT on KLF2 (A), NOS3 (B) mRNA expression levels in HUVEC.
HUVEC were treated 100, 200, and 400 μg/ml of LJT with 10 ng/ml of TNF-α for 12 hours. The mRNA expression levels were measured with a qRT-PCR (quantitative real-time PCR). The results were presented as the mean±standard deviation from 3 separate trials (Significance of results, * ; p<0.05, ** ; p<0.01, *** ; p<0.001 compared to control).
5) NOS3
NOS3 유전자 발현량을 측정한 결과, 정상군에서 2.45±0.15, 대조군에서 1.00±0.04가 나타났을 때, LJT 100, 200, 400 μg/ml의 농도에서 각각 1.03±0.03, 1.14±0.04, 1.30±0.06로 나타나 농도 200 μg/ml 이상의 LJT 처리군에서 대조군에 비해 유의적인(** : p<0.01, *** : p<0.001) 증가가 나타났다(Fig. 5B).
4. 단백질 발현량
1) MCP-1
MCP-1 단백질의 발현량 측정 결과, 정상군에서 0.22±0.03, 대조군에서 1.00±0.09가 나타났을 때, LJT 100, 200, 400 μg/ml의 농도에서 각각 1.00±0.07, 0.62±0.06, 0.46±0.05로 나타나 농도 200 μg/ml 이상의 LJT 처리군에서 대조군에 비해 유의적인(*** : p<0.001) 감소가 나타났다(Fig. 6A).

Effect of LJT on MCP-1 (A), ICAM-1 (B), VCAM-1 (C) protein expression levels in HUVEC.
HUVEC were treated 100, 200, and 400 μg/ml of LJT with 10 ng/ml of TNF-α for 12 hours. The protein expression levels were measured using a western blot. The results were presented as the mean±standard deviation from 3 separate trials (Significance of results, *** ; p<0.001 compared to control).
2) ICAM-1
ICAM-1 단백질의 발현량 측정 결과, 정상군에서 0.07±0.03, 대조군에서 1.00±0.09가 나타났을 때, LJT 100, 200, 400 μg/ml의 농도에서 각각 0.98±0.07, 0.98±0.07, 0.62±0.05로 나타나 농도 400 μg/ml의 LJT 처리군에서 대조군에 비해 유의적인(*** : p<0.001) 감소가 나타났다(Fig. 6B).
3) VCAM-1
VCAM-1 단백질의 발현량 측정 결과, 정상군에서 0.51±0.06, 대조군에서 1.00±0.05가 나타났을 때, LJT 100, 200, 400 μg/ml의 농도에서 각각 1.01±0.02, 0.64±0.09, 0.56±0.04로 나타나 농도 200 μg/ml 이상의 LJT 처리군에서 대조군에 비해 유의적인(*** : p<0.001) 감소가 나타났다(Fig. 6C).
4) KLF2
KLF2 단백질의 발현량 측정 결과, 정상군에서 3.78±0.17, 대조군에서 1.00±0.09가 나타났을 때, LJT 100, 200, 400 μg/ml의 농도에서 각각 0.95±0.20, 2.13±0.23, 3.87±0.39로 나타나 농도 200 μg/ml 이상의 LJT 처리군에서 대조군에 비해 유의적인(*** : p<0.001) 증가가 나타났다(Fig. 7A).
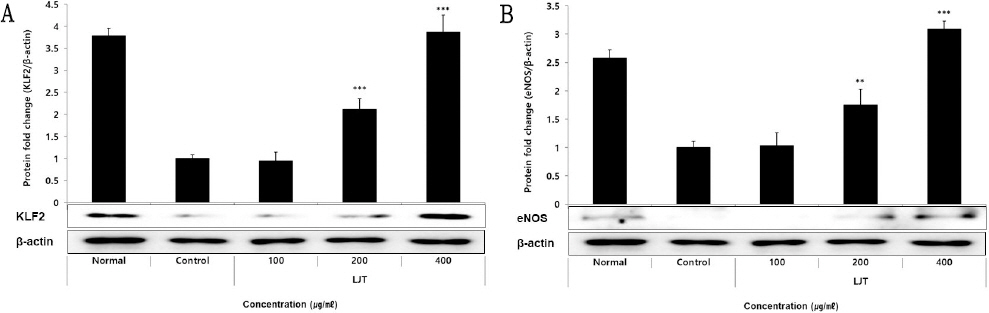
Effect of LJT on KLF2 (A), eNOS (B) protein expression levels in HUVEC.
HUVEC were treated 100, 200, and 400 μg/ml of LJT with 10 ng/ml of TNF-α for 12 hours. The protein expression levels were measured using a western blot. The results were presented as the mean±standard deviation from 3 separate trials (Significance of results, ** ; p<0.01, *** ; p<0.001 compared to control).
5) eNOS
eNOS 단백질의 발현량 측정 결과, 정상군에서 2.58 ±0.14, 대조군에서 1.00±0.11가 나타났을 때, LJT 100, 200, 400 μg/ml의 농도에서 각각 1.03±0.23, 1.75±0.28, 3.09±0.14로 나타나 농도 200 μg/ml 이상의 LJT 처리군에서 대조군에 비해 유의적인(** : p<0.01, *** : p<0.001) 증가가 나타났다(Fig. 7B).
6) ERK
ERK 단백질의 발현량 측정 결과, 정상군에서 0.28±0.02, 대조군에서 1.00±0.08가 나타났을 때, LJT 100, 200, 400 μg/ml의 농도에서 각각 1.02±0.06, 1.02± 0.06, 1.00±0.07로 나타나 모든 농도의 LJT 처리군에서 대조군에 비해 차이가 나타나지 않았다(Fig. 8A).
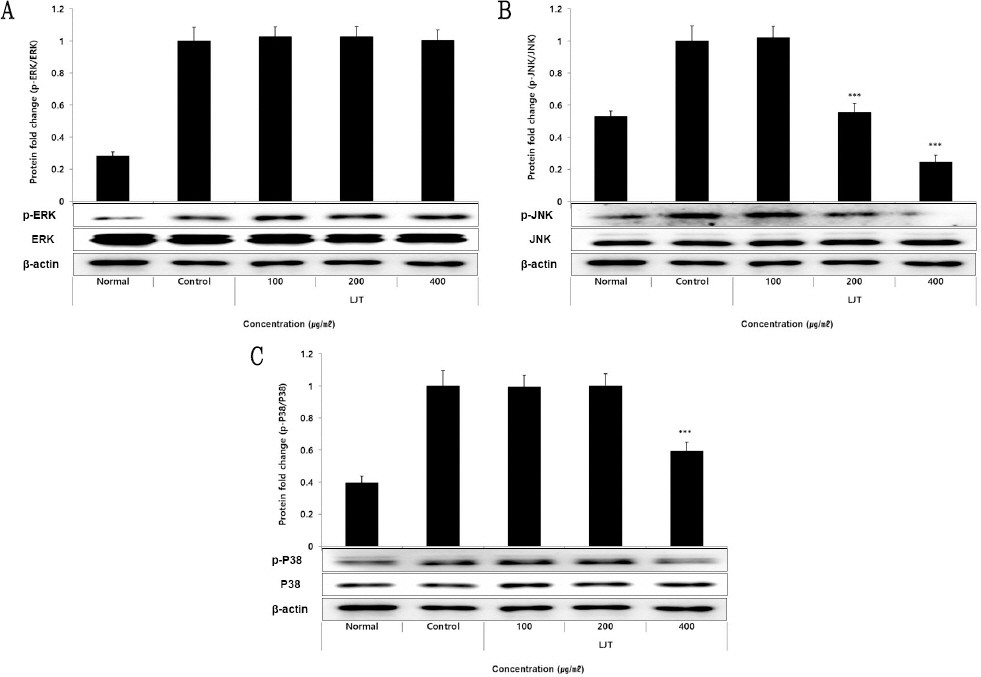
Effect of LJT on ERK (A), JNK (B), p38 (C) protein expression levels in HUVEC.
HUVEC were treated 100, 200, and 400 μg/ml of LJT with 10 ng/ml of TNF-α for 12 hours. The protein expression levels were measured using a western blot. The results were presented as the mean±standard deviation from 3 separate trials (Significance of results, *** ; p<0.001 compared to control).
7) JNK
JNK 단백질의 발현량 측정 결과, 정상군에서 0.53 ±0.03, 대조군에서 1.00±0.09가 나타났을 때, LJT 100, 200, 400 μg/ml의 농도에서 각각 1.02±0.07, 0.55±0.06, 0.24±0.05로 나타나 농도 200 μg/ml 이상의 LJT 처리군에서 대조군에 비해 유의적인(*** : p<0.001) 감소가 나타났다(Fig. 8B).
8) P38
P38 단백질의 발현량 측정 결과, 정상군에서 0.40 ±0.04, 대조군에서 1.00±0.10가 나타났을 때, LJT 100, 200, 400 μg/ml의 농도에서 각각 0.99±0.07, 1.00±0.08, 0.59±0.06로 나타나 농도 400 μg/ml 이상의 LJT 처리군에서 대조군에 비해 유의적인(*** : p<0.001) 감소가 나타났다(Fig. 8C).
Ⅳ. 고 찰
국내 주요 사망원인 중 심장질환과 뇌혈관질환은 2009년 각각 3위, 2위에서 2019년 각각 2위, 4위로 꾸준히 높은 순위를 차지하고 있다1. 이러한 심뇌혈관질환을 일으키는 주요 원인으로는 죽상동맥경화증이 있는데, 죽상동맥경화증이란 동맥벽에 콜레스테롤 등이 침착해 혈관 내경이 좁아져 혈류장애를 초래하는 혈관 질환이다15. 죽상동맥경화증이 시작되는 기전에 관해서는 몇 가지 가설이 있는데, 그 중에서도 죽상동맥경화증을 촉진하는 지단백이 여러 위험인자들과 함께 혈관 내피 하에 과다하게 축적되고 산화되어 염증반응을 일으키는 과정을 통해 발생한다는 가설이 유력하게 인정받고 있다16.
혈중의 LDL-cholesterol이 혈관 내피 하에서 산화 LDL-cholesterol로 변형되면 세포 독성을 나타내고 내피세포를 자극하여 다양한 chemokine 및 cytokine들을 분비해 단핵구, T림프구 등의 백혈구를 내막으로 끌어들인다. 단핵구는 내피 하에서 대식세포로 분화하고 산화 LDL을 흡수해 거품세포가 되며 거품세포가 응집되어 내막에 fatty streak이 형성된다. 거품세포와 함께 내피 손상부위에 접착, 응집된 혈소판으로부터 분비된 PDGF(Platelet- derived growth factor)는 중막의 평활근세포를 내막으로 유입 및 증식시켜 죽상경화성 plaque를 형성하게 된다4. 과잉으로 축적된 거품세포가 apoptosis를 일으키면 내막에 지방이 축적되며 지방핵을 이루게 되고 점점 커지면서 콜라겐 등의 결합조직이 축적되어 지방핵과 섬유뚜껑이라는 구조를 띠게 된다. 섬유뚜껑이 파열되면 혈관 내 혈전이 생성되거나 죽종 내로 출혈하여 혈관 내경이 급격히 좁아지게 되어 불안정형 협심증, 심근경색증, 뇌경색 등 인체에 치명적인 질환이 나타나게 된다15.
현재 죽상동맥경화증에 대한 약물 치료는 혈중의 지질 농도 개선을 목표로 하여 다양한 약물들이 사용되고 있는데17 HMG-CoA reductase 억제제인 statin계 약물이 대표적이며, 이차적으로 피브린산 유도체, 니코틴산, 에제티미브 등이 사용되고 있다18. Statin은 이상지질혈증 치료에 일차적으로 쓰이는 약물로써 혈중의 LDL-cholesterol 농도는 감소시키는 한편 HDL-cholesterol 농도는 증가시키는 효과가 있으나 속쓰림, 복통, 소화장애 등 위장관계통의 부작용과 함께 치명적인 간독성, 근육독성 등을 유발할 수 있다는 보고가 있다18-21. 또한 피브린산 유도체 등 이차적 약물 역시 소화장애, 복통, 간독성 등 다양한 부작용을 야기하여 이들을 대체할 천연물 기원의 치료제에 대한 관심이 높아지고 있다18.
금은화의 항염증효과에 대한 기존의 연구들을 살펴보면, 윤 등11은 금은화 추출액이 LPS(Lipopolysaccharide)로 유도된 대식세포에서 염증 관련 요소인 NO와 PGE2의 생성을 억제하여 항염증 효과를 나타낸다고 보고하였으며, 주 등12은 cerulein으로 급성 췌장염을 유발한 흰쥐에 금은화 추출물을 투여한 결과 TNF-α, IL-6 등 염증인자 생성을 억제하여 항염증 효과가 있다고 보았다. 또한 이 등13은 Dextran Sulfate Sodium로 궤양성 대장염을 유발한 생쥐에 금은화-감초 복합 추출물을 투여하였고 TNF-α, NF-κB 등 염증 매개 물질의 생성을 억제하여 궤양성 대장염 완화 효과가 있음을 보고하였다. 이러한 연구 결과들을 바탕으로 저자는 금은화가 죽상동맥경화증의 주요 원인인 혈관 염증을 억제하는 효과가 있을 것으로 판단하고 이를 실험을 통해 검증하고자 하였다.
본 연구에서는 금은화의 항염증작용을 알아보기 위해 HUVEC에 금은화 추출물(LJT)을 처리한 뒤 TNF-α를 처리하여 염증반응을 유도한 후 원심분리하여 얻은 상등액에서 MCP-1, ICAM-1, VCAM-1, KLF2, eNOS 등의 바이오마커 생성량, 원심분리하여 얻은 세포에서 MCP-1, ICAM-1, VCAM-1, KLF2, eNOS, ERK, JNK, p38 등의 단백질 발현량, CCL2, ICAM1, VCAM1, KLF2, NOS3 등의 유전자 발현량을 측정하였다.
HUVEC은 인간 제대정맥에서 유래한 혈관내피세포로 죽상동맥경화나 혈관 신생 과정에 관한 연구에 세포실험 모델로 주로 사용되며22, HUVEC에 염증 매개 물질인 TNF-α를 처리하면 세포 내의 MCP-1, ICAM-1, VCAM-1 등 염증 관련 물질의 분비는 증가하고 KLF2와 eNOS의 양은 감소한다23.
먼저 LJT의 안전성을 확인하기 위해 HUVEC에 LJT를 처리한 후 세포생존율을 측정한 결과 100, 200, 400, 600 μg/ml의 농도에서 각각 100.54±1.07%, 100.29±2.65%, 98.54±3.69%, 90.56±3.67%의 생존율이 나타났다(Fig. 1). 이를 토대로 90% 이하의 생존율을 보인 600 μg/ml의 농도는 제외하고 100, 200, 400 μg/ml 의 농도에서 실험을 진행하였다.
MCP-1(Monocyte Chemoattractant Protein-1)은 백혈구 유주와 염증반응에 있어 중요한 역할을 하는 chemokine의 일종으로 혈관 신생을 촉진하며 주로 단핵구에 화학주성을 일으키는 인자이다24. MCP-1에 의해 유인된 단핵구는 세포부착분자인 ICAM-1(Intercellular Adhesion Molecule 1)과 VCAM-1(Vascular cell Adhesion Molecule 1) 등에 의해 혈관 내피에 부착하게 되고 혈관 내피세포층을 통과하여 혈관 내벽 안에서 염증반응을 일으키게 되며 이는 죽상동맥경화를 유발한다3. KLF2(Krüppel- like Factor 2)는 내피세포 전사인자로 단핵구의 활성을 억제해 염증반응을 차단하여 죽상동맥경화의 유발을 저해하는 역할을 한다25. eNOS(endothelial Nitric Oxide Synthase)는 혈관내피세포에 존재하며 NO를 합성하고 이로부터 합성된 생리적 수준의 NO는 혈관 평활근과 반응하여 혈관을 이완시키고 백혈구의 활성과 내피유착을 감소시키며 free radical을 분해해 LDL-cholesterol이 산화되지 않게 해주는 효과가 있어 죽상동맥경화의 유발을 저해하는 역할을 한다26.
HUVEC에 LJT를 100, 200, 400 μg/ml의 농도로 처리하고 TNF-α를 추가하여 염증반응을 유발한 뒤 원심분리하여 얻은 상등액에서 바이오마커 생성량을 분석하였다. MCP-1(Fig. 2A), VCAM-1(Fig. 2C)은 농도 100 μg/ml 이상에서 대조군에 비해 유의적인 감소를 보였으며 ICAM-1(Fig. 2B)은 농도 200 μg/ml 이상에서 대조군에 비해 유의적인 감소를 보였다. KLF2는 농도 100 μg/ml 이상에서 대조군에 비해 증가가 나타났지만 유의성은 나타나지 않았으며(Fig. 3A), eNOS는 농도 400 μg/ml 이상에서 대조군에 비해 유의적인 증가를 보였다(Fig. 3B).
또한 HUVEC에 LJT를 100, 200, 400 μg/ml의 농도로 처리하고 TNF-α를 추가하여 염증반응을 유발한 뒤 원심분리하여 얻은 세포에서 단백질 발현량을 분석하였다. MCP-1(Fig. 6A), VCAM-1(Fig. 6C)은 농도 200 μg/ml 이상에서 대조군에 비해 유의적인 감소를 보였고, ICAM-1은 농도 400 μg/ml 이상에서 대조군에 비해 유의적인 감소를 보였으며(Fig. 6B), KLF2(Fig. 7A)와 eNOS(Fig. 7B)는 농도 200 μg/ml 이상에서 대조군에 비해 유의적인 증가를 보였다.
LJT는 MCP-1, ICAM-1, VCAM-1의 세포 밖 바이오마커 생성 및 세포 내 단백질 발현을 유의하게 저해하였으며 KLF2, eNOS의 세포 밖 바이오마커 생성 및 세포 내 단백질 발현을 촉진시켰다. 이는 LJT가 단핵구 및 세포부착분자의 활성 및 침착을 억제해 죽상동맥경화증의 발생을 억제하는 효과가 있음을 시사한다.
본 연구에서는 또한 각 염증 매개 물질의 생성에 직접 관여하는 유전자의 발현량을 조사하였다. CCL2 유전자의 번역과정을 통해 MCP-1이 발현되며, ICAM1 유전자를 통해 ICAM-1, VCAM1을 통해 VCAM-1, KLF2을 통해 KLF2, NOS3를 통해 eNOS가 발현된다. HUVEC에 LJT를 100, 200, 400μg/ml의 농도로 처리하고 TNF-α를 추가한 뒤 원심분리하여 얻은 세포에서 유전자 발현량을 분석하였다. CCL2(Fig. 4A), ICAM1(Fig. 4B), VCAM1 (Fig. 4C)은 모두 농도 100 μg/ml 이상에서 대조군에 비해 유의적인 감소를 보였으며, KLF2는 농도 400 μg/ml 에서 대조군에 비해 유의적인 증가를 보였고(Fig. 5A), NOS3는 농도 200 μg/ml 이상에서 대조군에 비해 유의적인 증가를 보였다(Fig. 5B).
이를 통해 LJT가 CCL2, ICAM1, VCAM1 유전자 발현을 억제함으로써 MCP-1, VCAM-1, ICAM-1의 발현을 감소시키고, KLF2, NOS3 유전자 발현을 촉진시킴으로써 KLF2, eNOS의 발현을 증가시켜 항염증효과를 나타냄을 알 수 있었다.
MAPKs(Mitogen-activated protein kinases)는 진핵세포에서 세포질 내의 신호를 핵의 DNA로 전달하는 단백질 인산화효소로, 사람에게는 ERK (Extracellular signal-regulated kinase)와 JNK(c-Jun amino terminal kinase), p38(p38 protein kinase)의 3가지 아형이 존재한다27. 이들은 전사인자로 작용해 세포의 성장, 분화, 사멸 등을 매개하며28 스트레스, cytokine에 의한 세포 반응 조절에 중요한 역할을 한다27. 염증과 관련해서 ERK는 NF-κB를 활성화시켜 TNF-α, IL-6와 같은 염증매개물질의 합성을 유도하며29 JNK는 IKK(I-κB kinase)를 활성화시켜 I-κB를 인산화하여 NF-κB를 활성화시키고30, TNF-α, CCL2 등의 proinflammatory factors의 합성을 유도하며31, p38은 mRNA 수준에서 TNF-α, IL-1의 전사를 조절한다32,33. 따라서 MAPKs의 활성화 감소는 proinflammatory factors의 합성을 저해하여 염증반응을 억제하는 효과가 있다는 것을 의미한다.
HUVEC에 LJT를 100, 200, 400 μg/ml의 농도로 처리하고 TNF-α를 추가한 뒤 원심분리하여 얻은 세포에서 ERK, JNK, p38 단백질 발현량을 분석하였다. ERK는 대조군에 비해 차이가 나타나지 않았으며(Fig. 8A) JNK는 농도 200 μg/ml 이상에서 대조군에 비해 유의적인 감소가 나타났고(Fig. 8B) p38은 농도 400 μg/ml에서 대조군에 비해 유의적인 감소가 나타났다(Fig. 8C).
이는 LJT가 세포 내 MAPKs 신호경로를 억제하여 NF-κB의 활성화 및 proinflammatory factors의 합성을 저해해 염증반응을 차단하여 죽상동맥경화증의 발생을 억제하는 효과가 있음을 시사한다.
이상의 결과들을 종합해 볼 때, LJT는 혈관내피세포에서 chemokine 및 세포부착분자의 생성을 저해하여 단핵구의 내막으로의 유입 및 침착을 억제하고, MAPKs 신호경로를 억제하여 proinflammatory factors의 합성을 저해해 혈관 내 염증반응을 억제하는 효과가 있었다. 죽상동맥경화증은 혈관 내 염증반응이 주요 기전으로 작용해 발생하므로, LJT가 죽상동맥경화증의 발생을 억제하는 효과가 있을 것으로 사료된다. 다만 본 연구는 세포 수준에서 수행된 실험이라는 점, 양성 대조군을 설정하지 않아 LJT가 기존에 사용되고 있는 다른 약제들보다 죽상동맥경화 관련 항염증효과가 우수한지를 확인하기 어렵다는 점 등의 한계점이 있다. 향후 동물 모델의 in vivo 실험을 통한 연구와 양성 대조군을 설정하여 다른 약제보다 우월성을 입증하는 등 LJT의 죽상동맥경화증 예방 효과에 대한 추가적인 연구가 필요할 것으로 사료된다.
Ⅴ. 결 론
금은화(LJT)의 죽상동맥경화증 관련 염증인자 발현 억제 효과를 알아보기 위해 인간 제대정맥 내피세포인 HUVEC에 LJT를 처리한 후 TNF-α를 처리하여 염증반응을 유도한 뒤 MCP-1, ICAM-1, VCAM-1, KLF2, eNOS 등의 바이오마커 생성량 및 단백질 발현량, ERK, JNK, p38 등의 단백질 발현량, CCL2, ICAM1, VCAM1, KLF2, NOS3 등의 유전자 발현량을 측정하였고 그 결과 다음과 같은 결론을 얻었다.
1. LJT는 실험이 진행된 400 μg/ml 이하의 농도에서 세포독성을 보이지 않았다.
2. LJT는 MCP-1, VCAM-1 바이오마커 생성량을 농도 100 μg/ml 이상에서 대조군에 비해 유의적으로 감소시켰으며, ICAM-1 바이오마커의 생성량을 농도 200 μg/ml 이상에서 대조군에 비해 유의적으로 감소시켰다. 또한 KLF2 바이오마커의 생성량을 농도 100 μg/ml 이상에서 대조군에 비해 증가시켰지만 유의성은 나타나지 않았으며, eNOS 바이오마커의 생성량을 농도 400 μg/ml에서 대조군에 비해 유의적으로 증가시켰다.
3. LJT는 CCL2, ICAM1, VCAM1 유전자 발현량을 농도 100 μg/ml 이상에서 대조군에 비해 유의적으로 감소시켰다. 또한 KLF2 유전자 발현량을 농도 400 μg/ml에서 대조군에 비해 유의적으로 증가시켰고 NOS3 유전자 발현량을 농도 200 μg/ml 이상에서 대조군에 비해 유의적으로 증가시켰다.
4. LJT는 MCP-1, VCAM-1 단백질 발현량을 농도 200 μg/ml 이상에서 대조군에 비해 유의적으로 감소시켰으며, ICAM-1 단백질 발현량을 농도 400 μg/ml에서 대조군에 비해 유의적으로 감소시켰다. 또한 KLF2, eNOS 단백질 발현량을 농도 200 μg/ml 이상에서 대조군에 비해 유의적으로 증가시켰다. LJT는 ERK 단백질 발현량에 영향을 미치지 않았고, JNK 단백질 발현량을 농도 200 μg/ml 이상에서 대조군에 비해 유의적으로 감소시켰으며, p38 단백질 발현량을 농도 400 μg/ml에서 대조군에 비해 유의적으로 감소시켰다.
이상의 결과로 볼 때, LJT는 HUVEC에서 죽상동맥경화증 관련 염증인자 발현 억제에 효과가 있다고 사료되며, 향후 죽상동맥경화증 및 심뇌혈관질환의 예방 및 치료에 사용될 수 있도록 추가 연구가 필요하리라 사료된다.
