근육세포주에서 당 흡수 및 대사 조절에 대한 황기탕 에탄올 추출물의 효과
Effects of a Hwanggi-tang Ethanol Extract on Glucose Uptake and Metabolism in Murine Myotubes
Article information
Abstract
Objectives
The aim of this study was to evaluate the effects of Hwanggi-tang on glucose digestion, uptake, and metabolism in murine C2C12 myotubes.
Methods
Hwanggi-tang was prepared according to the Dong-ui-bo-gam (≪東醫寶鑑≫) prescription by 70% ethanol extraction. The effect on glucose digestion was examined by determining the inhibitory effect of Hwanggi-tang on α-glucosidase activity. We also compared and verified the gene and protein expression of genes related to glucose uptake in C2C12 myotubes treated with Hwanggi-tang or insulin. Glucose metabolism was assessed by the expression levels of associated enzymes.
Results
Hwanggi-tang caused a dose-dependent inhibition of α-glucosidase activity, induced glucose uptake by activation of the PI3K/Akt/mTOR pathway in the insulin signaling pathway, and promoted glucose oxidation and β-oxidation.
Conclusions
Hwanggi-tang exerts an anti-diabetic effect on murine myotubes by inhibiting glucose digestion and inducing glucose uptake and consumption.
I. 서 론
당뇨병은 인슐린의 분비나 기능 결핍으로 인해 발생하는 대사성 질환으로 고혈당을 특징으로 한다. 고혈당의 증상으로는 다뇨증, 다음증, 체중감소가 있고 때로는 다식증과 시야 혼탁을 동반하기도 한다. 만성적인 고혈당은 장기간에 걸쳐 손상 및 기능장애를 유발하고 안구, 콩팥, 신경, 심장, 혈관과 같은 장기의 기능 부전도 초래한다1.
당뇨병의 다뇨증, 다음증, 다식증에 대한 한의학적 진단명으로는 消渴이 있다2. 消渴은 현대의학의 당뇨병과 완전히 일치되지는 않지만 증상 면에서 많은 유사성을 가지고 있고 예후와 합병증에서도 비슷한 부분을 많이 찾을 수 있다3.
消渴에 사용하는 한의학 처방 중 黃芪湯은 ≪東醫寶鑑⋅雜病篇⋅消渴門≫에 수록되어 있으며4, 원출전은 1264년 宋나라 楊士瀛이 지은 ≪仁齋直指≫로 “治諸渴疾”이라고 기록되어 있다5.
黃芪湯을 사용한 당뇨병 관련 기존 연구를 찾아볼 수는 없으나 구성약물 중 가장 많이 사용된 약재인 乾地黃 알코올 추출물의 항당뇨 효능 연구는 보고되어 있다6. 이외의 구성약재인 黃芪, 天花紛, 麥門冬, 五味子, 甘草에 대해서도 다양한 조건에서 항당뇨 효능을 확인한 연구가 보고되어 있다7-11.
본 실험연구에서는 문헌적 근거와 개별 약재의 실험적 결과를 바탕으로 黃芪湯의 항당뇨 효과와 기전을 확인하고자 하였다. 이에 저자는 黃芪湯 에탄올 추출물이 α-glucosidase 활성, 세포 내로의 당 흡수, glucose transporter type 4(GLUT4)의 세포막 이동, Protein kinase B(PKB : Akt)/mammalian target of rapamycin(mTOR) 신호 전달체계, 당 흡수 관련 단백질 및 유전자 발현에 미치는 영향을 관찰하여 유의한 결과를 얻었기에 보고하는 바이다.
II. 실험 방법
1. 재 료
1) 약재 추출
대학한약국(Iksan, Korea)에서 구입한 한약재는 ≪東醫寶鑑≫의 黃芪湯 1첩 분량대로 혼합하였다(Table 1). 이후 70% 에탄올(ethanol) 700 mL로 2회 환류 추출한 후 감압 농축과 동결 건조과정을 거쳐 추출물 5.45 g을 얻었다.
2) 세포 및 시약
C2C12, L6-GLUT4myc 근원세포(myoblast)는 American Type Culture Collection(Manassas, VA, USA)에서 구매하여 Welgene(Gyeongsan, Korea)의 Dulbecco’s Modified Eagle’s Medium(DMEM), low glucose 배지로 배양하였고, fetal bovine serum (FBS), horse serum은 GE Healthcare(Marlborough, MA, USA)의 HyClone™ Characterized FBS, New Zealand Origin과 HyClone™ Donor Equine Serum, U.S. Origin을 사용하였다. 3-(4,5-dimethylthiazol-2-y) -5-(3-carboxymethoxyphenyl) -2-(4-sulfophenyl)-2H- tetrazolium, inner salt(MTS) 용액은 Promega(Madison, WI, USA)의 CellTiter 96® AQueous One Solution Cell Proliferation Assay를 사용하였다. 2-[N-(7- nitrobenz-2-oxa-1,3-diazol-4-yl)amino]-2-deoxy-glucose(2-NBDG)는 Invitrogen(Carlsbad, CA, USA)제품을 사용하였고, α-glucosidase, acarbose, PIPES buffer(0.1 M phosphate buffer, pH 6.9), Penicillin-Streptomycin, 4-Nitrophenyl α-D-glucopyranoside (p-Nitrophenyl α-D-glucopyranoside, pNPG)는 Sigma- Aldrich(St. Louis, MO, USA)제품을 사용하였다.
2. 방 법
1) α-glucosidase 활성 억제 측정
농도별 黃芪湯 추출물의 α-glucosidase 활성 억제는 Zhang 등12의 방법을 보완하여 실험하였다. 96 well plate에 120 μL의 0.1 M phosphate buffer (pH 6.9)와 20 μL의 α-glucosidase(0.5 unit/mL)를 넣고, 1.95~1,000 μg/mL의 黃芪湯 추출물 10 μL를 처리하였다. 黃芪湯 추출물을 처리하지 않은 군(Normal) 외에 대조군(Control)에는 acarbose(0.02 μg/mL)를 처리하였다. 혼합액은 37 °C에서 15분간 반응시킨 후 5 mM pNPG 20 μL를 추가하고 다시 37 °C에서 15분간 반응시켰다. 이후 0.2 M sodium carbonate 80 μL로 반응을 정지시킨 다음, microplate reader(Titertek Multiskan; Flow Laboratories, McLean, VA, USA)를 사용하여 405 nm에서 흡광도(Absorbance405)를 측정하였다. 활성 억제도 계산에 사용된 수식은 다음과 같다.
% Inhibition=
2) 세포 배양 및 myotube 분화
C2C12, L6-GLUT4myc 근원세포는 10% FBS와 100 U/mL penicillin, 100 μg/mL streptomycin을 포함한 DMEM배지로 5% CO2, 37 °C 환경에서 배양하였다. 근원세포 상태였던 각 세포가 융합(confluent)되면, 2% horse serum으로 배지를 교체하여 근관세포(myotube)로 분화를 유도하였다. 분화 시작 후에는 매일 배지를 교체하였으며, 5-6일간 분화 후 실험에 사용하였다.
3) MTS 용액을 이용한 세포생존율 측정
96 well plate에 분화된 C2C12 근육세포(myotube, 2*104 cells/mL)와 黃芪湯 추출물을 농도별(100, 250, 500, 1,000, 2,000 μg/mL)로 처리한 후 24시간 동안 배양하였다. 각 well에 5 mg/mL MTS 용액을 20 μL씩 넣고 1시간 동안 배양한 후 microplate reader를 이용하여 490 nm에서 흡광도를 측정하였다. 세포생존율은 黃芪湯 추출물을 처리하지 않은 군(Normal)의 세포생존율 100%에 대한 黃芪湯 추출물 처리군의 상대적 생존율을 계산하였다.
4) C2C12 근육세포에서 당 흡수 정도와 기전 측정
C2C12 근육세포에서 당 흡수 정도 측정은 Jung 등13의 방법을 보완하여 사용하였다. 분화가 완료된 C2C12 근육세포를 phosphate buffered saline(PBS)으로 세척한 후 serum-free low-glucose DMEM으로 1시간 배양하였다. 2-NBDG(100 μM)와 농도별(100, 250, 500, 1,000 μg/mL) 黃芪湯 추출물을 처리하여 다시 1시간 배양하였고, 대조군으로는 黃芪湯 추출물을 처리하지 않은 군(Normal)과 인슐린(100 nM) 처리군을 사용하였다.
당 흡수 기전을 확인하기 위해 1,000 μg/mL 농도의 黃芪湯 추출물 처리군에 당 흡수 경로 상의 adenosine monophosphate activated protein kinase (AMPK), phosphoinositide 3-kinase(PI3-K), sirtuin family1(Sirt1), mTOR에 대한 억제제를 각각 추가하여 실험하였다. 형광강도는 microplate reader로 excitation wavelength 465 nm, emission wavelength 540 nm에서 측정되었다.
5) Immunofluorescence staining
세포막에서 GLUT4의 발현을 측정하기 위해 Wang 등14의 방법을 보완하여 사용하였다. 분화가 끝난 L6-GLUT4myc 근육세포(myotube)를 glass- bottomed plate에 옮겨 黃芪湯 추출물(1,000 μg/mL) 또는 인슐린(100 nM)을 처리하고 다시 1시간 배양하였다. 그 후 Krebs-Ringer bicarbonate HEPES buffer(KRBH)(120 mM sodium chloride, 5 mM potassium chloride, 2 mM calcium chloride, 1 mM magnesium chloride, 5.5 mM HEPES, 1 mM D-glucose, pH 7.4±0.15)로 5분씩 3회 세척한 후 5% serum이 포함된 KRBH를 사용하여 4 °C에서 10분간 blocking 하였다. KRBH를 제거하고 희석한 anti-myc 항체를 4 °C에서 1시간 동안 반응 시킨 후 KRBH로 5분씩 3회 세척하였다. 3% formaldehyde를 넣어 4 °C에서 20분 고정시킨 후 KRBH로 5분씩 3회 세척하였다. Fluorescein isothiocyanate(FITC)가 축합된 2차 항체를 4 °C에서 40분간 반응시킨 후 KRBH로 5분씩 3회 세척하였다. 그 후 즉시 형광현미경을 이용하여 黃芪湯 추출물을 처리하지 않은 군(Normal)과 비교 관찰하였다.
6) Western blot analysis
분화가 끝난 C2C12 근육세포에 黃芪湯 추출물을 처리하였고, 대조군으로는 黃芪湯 추출물을 처리하지 않은 군(Normal)과 인슐린(100 nM) 처리군을 사용하였다. 이후 PBS로 2회 세척한 다음, PRO-PREP™(iNtRON, Sungnam, Korea) 200 μL를 첨가하여 20분간 용해(lysis)시킨 후 13,000 rpm에서 10분간 원심분리하여 세포막 성분 등을 제거하였다. 단백질 농도는 bovine serum albumin(BSA)을 표준화하여 Protein Assay Kit(Bio-Rad, Hercules, CA, USA)을 사용하여 정량하였다. 20 μg의 세포 용해물(lysate)을 6-12% mini gel SDS-PAGE로 변성 분리하고, 이를 polyvinylidene difluoride(PVDF) membrane(Bio-Rad, Hercules, CA, USA)에 200 mA로 2시간 동안 transfer하였다. 이후 3% BSA가 함유된 tris-buffered saline and Polysorbate 20(TBST : TBS + 0.1% Tween20) 용액으로 상온에서 1시간 동안 membrane의 blocking을 실시하였다. 1차 항체를 TBST 용액에 희석하여 상온에서 3시간 반응시킨 후 TBST로 15분씩 3회 세정한 다음, horse radish peroxidase(HRP)가 결합된 2차 항체를 1 : 2,000으로 희석하여 상온에서 1시간 반응시켰다. 다시 TBST로 3회 세정하여 ECL 기질(Amersham Biosciences, Little Chalfont, UK)과 1분간 반응시킨 후 ImageQuant. LAS 4000 mini(GE healthcare, Marlborough, MA, USA)를 사용하여 발현량을 측정하였다.
7) RNA 분리 및 quantitative reverse-transcription PCR(qRT-PCR)
분화가 끝난 C2C12 근육세포에 黃芪湯 추출물을 처리한 후 PBS로 2회 세척하고, easy BLUE™ (iNtRON, Sungnam, Korea) 1 mL를 가하여 실온에서 교반하였다. 대조군으로는 黃芪湯 추출물을 처리하지 않은 군(Normal)과 인슐린(100 nM) 처리군을 사용하였다. 클로로포름(chloroform) 200 μL를 넣어 다시 교반하고 13,000 rpm, 4 °C에서 10분간 원심분리하여 상층액 400 μL를 분리하였다. 분리된 상층액에 이소프로판올(isopropanol)을 동량 가하고 다시 원심분리하여 얻어진 RNA 펠렛에 murine leukemia virus(MuLV) 역전사효소(murine leukemia virus reverse transcriptase), 1 mM dNTP 0.5 μg을 넣어 cDNA를 합성하였다. qRT-PCR은 power SYBR® Green PCR master mix로 사용자 매뉴얼에 기재된 방법대로 진행하였다. StepOnePlus Real-Time RT-PCR System과 StepOne software v2.3(Applied Biosystems, Foster City, CA, USA)을 사용하여 β-actin mRNA를 기준으로 상대적 발현량을 측정하였다.
8) 통계분석
통계분석은 쉐페검증(Scheffe’s test)으로 일원배치 분산분석(one-way analysis of variance)을 시행하였다. 모든 실험은 3회 이상 반복적으로 실행하였고, 실험 결과는 각 군에 따라 SPSS statistics 22 software(SPSS Inc. Chicago, IL, USA)로 평균치± 표준오차(mean±SE)를 구하여 신뢰수준 P<0.05에서 통계적 유의성을 확인하였다.
III. 결 과
1. 黃芪湯의 α-glucosidase 활성 억제에 대한 영향
黃芪湯 추출물의 농도에 따른 α-glucosidase 활성 억제 정도를 확인하였고, IC50 값은 62.5 μg/mL로 측정되었다(Fig. 1A). 대조군(Control)으로 사용한 acarbose는 0.02 μg/mL 농도에서 50%의 억제효과를 나타내었다. 이를 통해 in vitro 상에서 黃芪湯 추출물을 일정 농도 이상으로 처리하면 acarbose와 유사한 α-glucosidase 활성 억제를 보이는 것으로 확인되었다.

Inhibitory potentials of HGT on α-glucosidase.
(A) Inhibitory activities of HGT on α-glucosidase were measured by our screening system. Acarbose (0.02 μg/mL) was used as reference drug (Control). Each value represents the mean±SE. (B) A Lineweaver-Burk plot of HGT towards the substrate pNPG at different concentrations.
추가로 농도별 pNPG와 黃芪湯 추출물을 사용하여 α-glucosidase 활성 억제 기전 확인을 위한 실험을 진행하였다. 농도별 Lineweaver-Burk plot을 확인한 결과 x축, y축 상의 교차점이 모두 없는 것을 확인하였다(Fig. 1B). 이는 저해제가 효소-기질 복합체에만 작용하는 무경쟁적 저해제(불경쟁적 저해제, uncompetitive inhibitor)로 작용하는 것을 의미한다. 따라서 黃芪湯 추출물의 α-glucosidase 억제는 경쟁적 저해제(competitive inhibitor)로 작용하는 acarbose15와 다른 기전을 경유한다는 것을 확인하였다.
2. 黃芪湯의 세포생존율에 대한 영향
黃芪湯 추출물이 C2C12 근육세포의 생존율에 미치는 영향을 확인하기 위해 MTS 용액을 이용한 proliferation assay를 시행하였다. 실험은 MTS 용액을 농도별 黃芪湯 추출물을 24시간 동안 처리한 세포에 첨가하여 배양하는 방식으로 진행하였다. 실험 결과, 黃芪湯 추출물은 2,000 μg/mL에서 C2C12 근육세포에 대한 독성이 나타났고(Fig. 2), 이후의 실험은 1,000 μg/mL 이하에서 진행하였다.
3. 黃芪湯의 당 흡수에 대한 영향
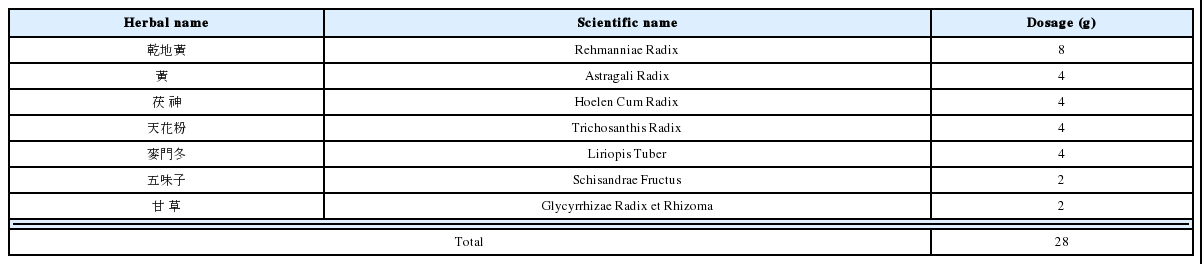
C2C12 근육세포에서 당 흡수 정도를 측정하기 위해 분화된 세포에 농도별(100, 250, 500, 1,000 μg/mL) 黃芪湯 추출물을 처리하였다. 黃芪湯 추출물 처리 후 세포 내로 유입되는 2-NBDG의 양은 黃芪湯 추출물을 처리하지 않은 군(Normal)에 비해 각 실험농도에서 148.98%, 181.06%, 193.74%, 251.33%로 나타나 농도 의존적인 증가를 보였으며, Normal군과 유의한 차이가 있었다(Fig. 3).
4. 黃芪湯의 당 흡수 기전에 대한 영향
黃芪湯 추출물의 당 흡수 촉진 기전을 알아보기 위해 1,000 μg/mL의 黃芪湯 추출물과 당 흡수 경로 각각에 작용하는 억제제를 사용하여 실험하였다. 억제제로는 Compound C(CC, AMPK 억제제), LY294002(LY, PI3-K 억제제), Nicotinamide(NA, Sirt1 억제제), Rapamycin(RA, mTOR 억제제)이 사용되었다. 黃芪湯 추출물로 유도된 당 흡수 증가는 LY와 RA 처리 시 유의하게 억제되었고, CC와 NA 처리 시에는 억제되지 않았다. 억제제 단독 처리와 비교했을 때 LY와 RA는 유의적인 상승이 나타나지 않았고, CC와 NA는 유의적인 상승이 나타났다. 그러므로 黃芪湯 추출물은 PI3-K와 mTOR를 경유하는 기전을 통해 당 흡수를 촉진하는 것으로 추정된다(Fig. 4).

Effects of inhibitors on HGT induced 2-NBDG uptake in C2C12 myotubes.
Absorbed 2-NBDG was measured with a microplate reader. To investigate the mechanism of HGT on glucose uptake, C2C12 myotubes were incubated in DMEM with 1,000 μg/mL HGT in the absence or presence of several inhibitors with 100 μM 2-NBDG for 1 hour. Each value represents the mean±SE. *P<0.05 : significant. CC : Compound C, LY : LY294002, NA : Nicotinamide, RA : Rapamycin.
5. 黃芪湯의 GLUT4 세포막 이동에 대한 영향
근육세포에서 黃芪湯 추출물의 당 흡수 촉진을 확인하기 위해 GLUT4를 안정적으로 발현하는 L6-GLUT4myc 근육세포를 이용하였다. GLUT4의 세포막 이동을 위해 L6-GLUT4myc 근육세포에 각각 100 nM의 인슐린과 1,000 μg/mL의 黃芪湯 추출물을 처리한 후 형광현미경을 사용하여 세포막으로 이동한 GLUT4myc을 관찰하였다. 관찰 결과, 인슐린을 처리한 세포와 黃芪湯 추출물을 처리한 세포 모두에서 黃芪湯 추출물을 처리하지 않은 군(Normal)에 비해 세포막의 GLUT4 발현량이 더 많은 것을 확인하였다(Fig. 5).
6. 黃芪湯의 Akt/mTOR 신호 전달체계에 대한 영향
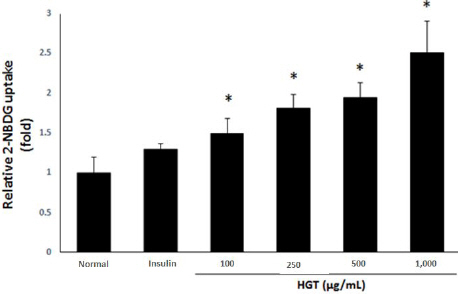
黃芪湯 추출물이 근육세포에서 에너지대사 조절과 당 흡수 관련 신호 전달을 하는 Akt/mTOR 신호 전달체계에 미치는 영향을 알아보기 위해 western blot을 시행하였다. 실험 결과, Akt/mTOR 신호 전달체계상의 당 흡수 관련 신호 전달 인자인 insulin receptor substrate 1(IRS-1), mTOR(Fig. 6A, 6C-1, 2)와 에너지대사 조절 인자인 Akt(Fig. 6B, 6D)의 인산화 발현량이 농도 의존적으로 증가함을 확인하였다.
Effects of HGT on protein expression and phosphorylation of IRS-1, mTOR and AKT in C2C12 myotubes.
C2C12 myotubes were preincubated in DMEM with low glucose for 1 hour. After then incubated in DMEM with HGT at different levels of concentration and 100 nM insulin for 1 hour. Each value represents the mean±SE. *P<0.05: significant. (A) p-IRS-1, p-mTOR (B) p-AKT were examined by western blot. (C) p-IRS-1, p-mTOR was relation to β-actin as calibrator. (D) p-AKT was relation to t-AKT as calibrator.
7. 黃芪湯의 당 흡수 관련 단백질 발현에 대한 영향
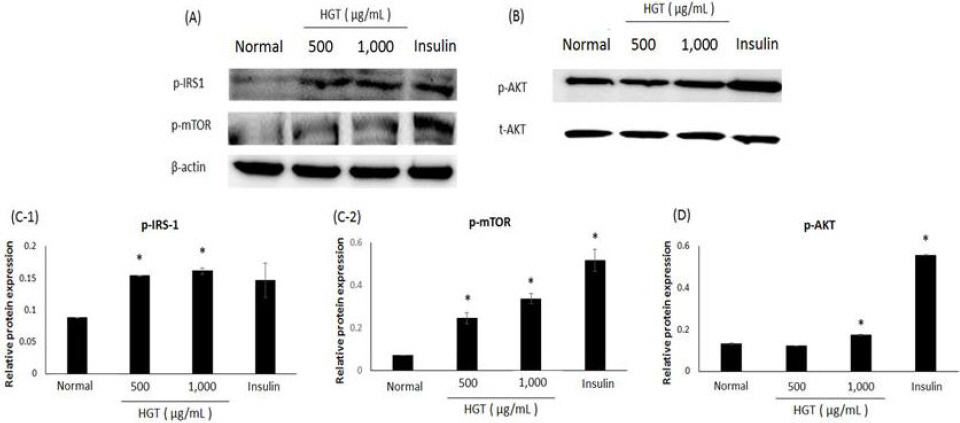
黃芪湯 추출물이 C2C12 근육세포에서 당 흡수 관련 단백질 발현에 미치는 영향을 알아보기 위해 C2C12 근육세포에 농도별 黃芪湯 추출물을 처리한 후 24시간 배양한 다음, western blot을 시행하였다. 실험 결과, 黃芪湯 추출물 처리 시 GLUT1과 GLUT4, Insulin Rα, PI3-K는 농도 의존적으로 발현량이 증가하였고, protein tyrosine phosphatase 1β(PTP1β)는 농도 의존적으로 발현량이 감소하였다(Fig. 7).
Effects of HGT on expression of Insulin Rα, GLUT1, GLUT4, PI3-K and PTP1β in C2C12 myotubes.
C2C12 myotubes were preincubated in DMEM with low glucose for 1 hour. After then incubated in DMEM with HGT at different levels of concentration and 100 nM insulin for 24 hours. Each value represents the mean±SE. *P<0.05: significant. (A) Insulin Rα, GLUT1, GLUT4, PI3-K, PTP1β were examined by western blot. (B) Insulin Rα, GLUT1, GLUT4, PI3-K, PTP1β was relation to β-actin as calibrator.
8. 黃芪湯의 당 흡수 관련 유전자 발현에 대한 영향
黃芪湯 추출물이 C2C12 근육세포에서 당 흡수 관련 유전자 발현에 미치는 영향을 확인하기 위해 qRT-PCR을 시행하였다. 1,000 μg/mL 黃芪湯 추출물 처리군은 黃芪湯 추출물을 처리하지 않은 군(Normal)에 비해 glucose transport에 필요한 GLUT1과 GLUT4의 발현이 2배, 4.13배로 증가하였고, glucose oxidation에 필요한 glucokinase(GK)와 citrate synthase (CS)의 발현은 28.3배, 1.76배 증가하였으며, β-oxidation에 필요한 acyl-CoA oxidase(ACO)와 carnitine palmitoyl transferase 1α(CPT1α)의 발현은 9.3배, 2.52배로 증가하였다(Fig. 8).
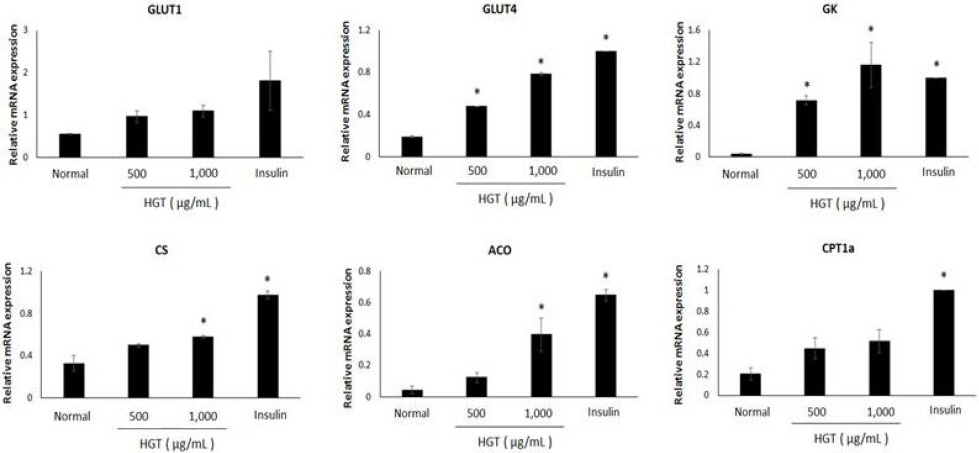
Effects of HGT on mRNA expression of genes involved in glucose transport (GLUT1, 4), glucose oxidation (GK, CS) and β-oxidation (ACO, CPT1α) in C2C12 myotubes.
C2C12 myotubes were preincubated in DMEM with low glucose for 1 hour. After then incubated in DMEM with HGT at different levels of concentration and 100 nM insulin for 6 hours. Each value represents the mean±SE. *P<0.05 : significant.
IV. 고 찰
2018 국민건강통계에 따르면 만 30세 이상 당뇨병 유병률은 12.4%이며, 진단기준에 당화혈색소 6.5% 이상을 포함할 경우 이는 13.8%까지 증가한다16. 당뇨병은 2017년 우리나라 사망원인 순위 중 6번째를 차지했으며, 의료비 지출로는 같은 해 주요 만성질환 진료비 17조 8천억원 중 12%인 2조 2천억원을 차지하였다17. 하지만 당뇨병 치료자에서 당화혈색소가 6.5% 미만으로 조절되는 비율은 25.8%로 조사되어 의학적, 사회적 심각성에도 불구하고 관리의 어려움이 있다는 것을 알 수 있다16.
당뇨병은 췌장 β 세포의 인슐린 분비가 결핍되어 발생하는 1형 당뇨와 인슐린 저항성과 함께 인슐린 분비 반응이 부적절하여 발생하는 2형 당뇨로 나눌 수 있다. 1형 당뇨의 경우 췌장 β 세포의 기능 회복이나 외부 인슐린 공급으로 관리가 가능하지만 2형 당뇨의 경우 약물 요법을 통해 당의 소화 흡수 억제, 인슐린 분비 촉진 또는 효과 증강 등의 방법으로 혈중 포도당 농도를 조절하게 된다1,18.
한의학에서 消渴은 飮食, 情志, 房事나 기타 원인으로 인해 多飮, 多食而瘦, 多尿而數, 或混濁 或尿甛 등의 증상이 나타나는 병증으로 서양의학의 당뇨병, 요붕증, 갑상선기능항진증을 포괄한다2. ≪東醫寶鑑≫에서는 이러한 消渴의 증상을 ‘消渴, 消中, 消腎’의 세가지로 분류하고 傳變證, 不治證에 대해 기술했는데 내용을 살펴보면 당뇨병 환자의 임상증상 및 합병증과 유사한 점이 매우 많다3,19. 이 때문에 ≪東醫寶鑑⋅雜病篇⋅消渴門≫의 처방 및 본초를 이용한 항당뇨 실험연구가 다수 시행되어 왔다20.
黃芪湯은 唐나라 王燾의 ≪外臺秘要≫와 宋나라 楊士瀛의 ≪仁齋直指≫에 등장하는 처방으로 ≪東醫寶鑑≫의 처방과 구성 비율 및 약재에 약간의 차이가 존재한다21. 본 실험에서 사용한 黃芪湯은 ≪東醫寶鑑≫에 따라 生乾地黃 8 g, 黃芪 4 g, 白茯神 4 g, 天花粉 4 g, 麥門冬 4 g, 五味子 2 g, 甘草 2 g을 혼합하여 조제하였다. 生乾地黃은 국내에서 乾地黃이라 하며, 淸熱凉血, 養陰生津의 효능이 있고, 본 처방에서 가장 많은 용량으로 사용되었다. 이 외에 다른 약재를 살펴보면 淸熱生津의 효능이 있는 天花粉, 滋陰潤肺, 益胃生津, 淸心除煩의 효능이 있는 麥門冬, 斂肺滋腎, 生津斂汗의 효능이 있는 五味子가 추가되어 있다. 또한 처방명에도 등장하는 黃芪는 消渴의 要藥으로 ≪外臺秘要≫의 黃芪湯과 ≪醫學衷中參西錄≫의 玉液湯에서도 主藥으로 사용되고 있다. 상대적으로 소량이 사용되었고, 佐使藥의 역할을 하는 白茯神, 甘草는 각각 淡味로 心⋅脾 二經에 들어가 利水消腫하며, 味甘으로 諸藥을 조화시킨다22.
본 실험에서는 C2C12 근육세포를 사용하여 黃芪湯 에탄올 추출물이 α-glucosidase 활성에 미치는 영향, 인슐린 신호 전달체계를 통한 당 흡수에 미치는 영향 및 당 대사 조절 인자의 발현을 통해 당 소비에 미치는 영향을 확인하였다. 실험 결과, 黃芪湯 추출물은 당 흡수 조절 및 대사 조절 작용을 보였고, 이는 현재 임상에서 사용하는 α-glucosidase 억제제, 인슐린과 같은 항당뇨병제와 유사하였다.
α-glucosidase는 소장 점막에 존재하며 배당체를 가수분해하는 소화효소로 위장관의 음식물 속 이당류를 분해하여 당 흡수를 촉진시키고, 이는 식후 체내 혈당 상승에 중요한 역할을 한다. 당뇨병 환자는 상승한 혈당을 자체적으로 낮추기 어렵기 때문에 α-glucosidase의 활성을 억제하여 당의 소화 흡수를 막으면 식후 고혈당증을 예방할 수 있으며, 이를 위한 약물로 현재 임상에서는 acarbose와 voglibose 제제가 사용되고 있다23. In vitro 상에서 黃芪湯 추출물의 α-glucosidase 활성 억제능을 실험한 결과, α-glucosidase 활성은 농도 의존적으로 억제되었고, 62.5 μg/mL의 IC50값을 가지는 것을 확인하였다. 이를 통해 黃芪湯은 α-glucosidase의 활성 억제를 통해 식후의 급격한 혈당 상승을 방지할 수 있을 것이라 예상할 수 있다.
소화관에서 당 흡수가 이루어진 이후 혈당을 조절하기 위해서는 인슐린을 통한 세포 내로의 당 흡수가 필요하다. 당 흡수 촉진은 세포 내에 당을 저장하고 당 소비를 유도할 뿐만 아니라 혈당의 직접적인 강하를 일으켜 당뇨병 환자의 당 항상성 유지에 도움을 준다24. C2C12 근육세포와 2-NDBG를 이용한 이번 실험연구에서 黃芪湯 추출물은 정상인의 인슐린 작용과 유사하게 농도 의존적으로 세포 내로 당 흡수를 촉진하였다.
黃芪湯 추출물의 당 흡수 유도 기전을 알아보기 위해 인슐린 신호 전달체계상의 다양한 억제제 - LY294002(PI3-K 억제제), Compound C(AMPK 억제제), Rapamycin(mTOR 억제제), Nicotinamide (Sirt1 억제제)를 사용하였다. 각 억제제를 黃芪湯 추출물이 처리된 배지에 첨가하여 당 흡수 정도의 변화를 확인해본 결과, LY294002, Rapamycin을 첨가한 경우 세포 내로 유입된 2-NBDG의 양이 유의하게 감소하였다. 이를 통해 黃芪湯 추출물의 당 흡수 유도 효과는 인슐린 신호 전달체계의 PI3-K, mTOR 경로를 통해 활성화됨을 확인하였다.
GLUT4는 지방 및 골격근 조직에서 발현되는 당 수송체로, 평상시 세포 내부의 소포에 싸여 있다가 인슐린 자극에 의해 세포막으로 이동하여 세포 외에 존재하는 당을 세포 내로 수송한다25. 따라서 GLUT4의 발현은 黃芪湯 추출물이 L6-GLUT4myc 근육세포에서 당 흡수를 촉진하는 정도를 알아볼 수 있는 중요지표로 활용할 수 있다. L6-GLUT4myc 근육세포에 黃芪湯 추출물을 처리한 실험에서 인슐린을 처리했을 때와 유사하게 세포막의 GLUT4 발현량이 증가되는 것을 확인하였다(Fig. 5). 이는 黃芪湯 추출물이 인슐린처럼 GLUT4의 세포막 이동을 통해 당 흡수를 촉진할 수 있다는 것을 의미한다.
상기 결과와 같이 黃芪湯 추출물은 당 흡수 촉진에 있어서 인슐린과 유사한 효과를 보였고, 이와 관련하여 인슐린 신호 전달체계상의 단백질 인산화에 미치는 영향을 알아보기 위해 western blot을 실시하였다. 세포 내로의 당 흡수는 최상위 신호 전달 인자인 IRS-1의 인산화를 통해 시작되며, 이는 하위 인자이자 에너지대사 조절 인자인 PI3-K와 Akt의 인산화를 유도하여 GLUT family의 세포막 이동을 촉진한다26,27. 활성화된 PI3-K는 Akt의 인산화를 유도할 뿐만 아니라 mTOR의 인산화를 촉진하여 당 흡수, 세포 증식과 단백질 합성 등이 이루어지게 한다28. Western blot 결과, 黃芪湯 추출물은 이러한 인슐린 신호 전달 및 세포 대사 조절 인자인 IRS-1, mTOR, Akt의 인산화 발현량을 증가시키는 것으로 나타났다.
이어서 黃芪湯 추출물이 당 흡수 관련 단백질의 발현에 미치는 영향을 알아보기 위한 western blot을 실시하였다. 당 흡수를 위한 인슐린 신호 전달은 인슐린 수용체인 Insulin Rα에 인슐린이 결합하여야 발생하므로 Insulin Rα는 인슐린 신호 전달의 촉진 인자이다29. 한편 PTP1β는 IRS-1을 탈인산화 시키므로 PTP1β는 인슐린 신호 전달을 저해하는 억제 인자이다30. Western blot 결과, 黃芪湯 추출물은 농도 의존적으로 Insulin Rα의 발현량을 증가시켰고, PTP1β의 발현량을 감소시켰다. 이는 Insulin Rα에 인슐린이 결합하는 것을 유도하고 이어서 IRS-1의 인산화를 통한 당 흡수 과정이 촉진된다는 것을 의미한다. 또한 당 흡수 경로의 최종 산물인 GLUT Family 중 GLUT1과 GLUT4의 발현량도 증가되었는데, GLUT1은 적혈구와 내피세포를 포함한 신체 전반에서 나타나고, GLUT4는 지방조직 및 골격근 조직에서 주로 나타난다.
골격근과 같은 말초세포에서는 인슐린에 의한 당 흡수뿐만 아니라 에너지 생성을 통한 당의 소비도 발생한다. 에너지 생성 대사는 당 흡수를 통해 흡수한 당의 oxidation과 지방산의 β-oxidation 과정을 필요로 한다31. 黃芪湯 추출물을 처리한 C2C12 근육세포에 qRT-PCR을 시행한 결과, glucose oxidation에 관여하는 효소인 glucokinase와 citrate synthase의 발현량이 농도 의존적으로 증가하였으며, β-oxidation에 관여하는 acyl-CoA oxidase와 CPT1α의 발현량 또한 증가하였음을 확인하였다. 특히 1,000 μg/mL의 黃芪湯 추출물을 처리한 경우에는 100 nM의 인슐린을 처리한 경우보다 더욱 높은 glucokinase 발현량이 관찰되었다. 따라서 黃芪湯 추출물은 세포 대사에서 glucose를 분해하며 에너지를 생성하는 glucose oxidation을 촉진하는 작용이 있으며, 인슐린 저항성과 포도당 신생합성(gluconeogenesis)과 관련된 지방산의 β-oxidation을 촉진한다. 추가로 당 수송체인 GLUT1과 GLUT4의 mRNA 발현량을 확인한 결과, 黃芪湯 추출물 처리 시 농도 의존적으로 발현량이 증가하는 것을 확인하였다. 따라서 黃芪湯 추출물은 앞서 확인한 바와 같이 GLUT Family 발현 유도를 통해 당 흡수를 촉진할 수 있다.
본 실험연구에서 黃芪湯 추출물은 α-glucosidase 활성을 억제하고, GLUT4의 세포막 이동을 유도하였다. 또한 PI3K/Akt/mTOR 경로를 비롯한 인슐린 신호 전달체계를 활성화시켜 당 흡수를 유도하였으며, glucose oxidation과 지방산의 β-oxidation에 관여하는 효소의 유전자 발현을 통해 세포 내 에너지 대사를 촉진하였다.
결과적으로 黃芪湯 에탄올 추출물은 당의 소화 효소를 억제하고 근육세포에서 당의 세포 내 흡수 및 소비를 촉진한다. 이를 통해 黃芪湯은 消渴의 범주에 포함된 당뇨병에 치료 효과가 있다는 실험적 근거를 확인하였으며, 실제 임상 적용을 위한 추가적인 in vivo 연구 및 임상 연구가 필요할 것으로 생각된다.
V. 결 론
본 연구는 黃芪湯이 당의 소화와 대사에 미치는 영향을 확인하기 위한 실험으로 黃芪湯 70% 에탄올 추출물과 C2C12 근육세포주 등을 이용하였다. 실험을 통해 α-glucosidase 활성 억제, 2-NBDG 흡수, GLUT4의 세포막 이동, 인슐린 신호 전달체계 활성화, 당 흡수 관련 단백질 및 유전자 발현을 관찰하여 다음과 같은 결과를 얻었다.
1. 黃芪湯 추출물은 α-glucosidase 활성을 농도 의존적으로 억제하였다.
2. 黃芪湯 추출물은 C2C12 근육세포에서 PI3-K와 mTOR 기전을 통해 2-NBDG 흡수량을 농도 의존적으로 증가시켰다.
3. 黃芪湯 추출물은 L6-GLUT4myc 근육세포에서 GLUT4의 세포막 이동을 유도하였다.
4. 黃芪湯 추출물은 PI3-K/Akt/mTOR 경로 활성화와 당 흡수 관련 단백질 발현을 유도하여 인슐린 신호 전달체계를 직접적으로 활성화시켰다.
5. 黃芪湯 추출물은 당 대사와 관련된 glucose oxidation과 β-oxidation 관련 유전자 발현을 농도 의존적으로 증가시켜 당의 소비를 유도하였다.
이와 같은 결과를 통해 黃芪湯 에탄올 추출물은 근육세포에서 당의 소화, 세포 내로의 당 흡수 및 당 관련 대사를 조절하여 혈당 강하효과를 보이는 것으로 사료된다.