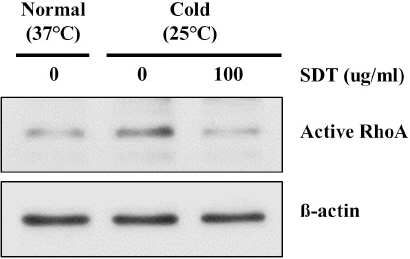
저온 노출된 혈관 세포 내 RhoA 단백질 활성화에 대한 십전대보탕의 억제 효과
Mitigative Effect of Sipjeondaebo-tang on RhoA Activation in Cold-Exposed Vascular Cells
Article information
Abstract
Objective
To investigate the vasodilatory effect of Sipjeondaebo-tang by inhibiting RhoA activity in vascular cells during cold exposure.
Methods
Human vascular endothelial cells and pericytes were pretreated with Sipjeondaebo-tang for 30 min, followed by incubation at 37 °C (control) or 25 °C (cold exposure) for 30 min. Activation of endothelin-1-mediated RhoA in pericytes was assessed by pretreating the cells with Sipjeondaebo-tang for 30 min, followed by incubation with endothelin-1 at 37 °C for 30 min. Western blotting was performed to measure the expression of active RhoA. Endothelin-1 and nitric oxide release from endothelial cells was examined with enzyme-linked immunosorbent assay kits. The formation of stress fibers and focal adhesion complexes was analyzed by immunocytochemistry.
Results
Cold treatment activated RhoA in both pericytes and vascular endothelial cells, whereas Sipjeondaebo-tang treatment inhibited this activation. Sipjeondaebo-tang treatment also reversed the cold-mediated production of endothelin-1 and nitric oxide. Cold exposure promoted the formation of stress fibers and focal adhesion complexes by increasing the expression of phospho-focal adhesion complex kinase, whereas Sipjeondaebo-tang treatment suppressed this response.
Conclusions
These findings suggested that Sipjeondaebo-tang inhibits cold-induced RhoA activation and its related pathway components, including endothelin-1 and nitric oxide, in vascular cells. Therefore, Sipjeondaebo-tang could be beneficial for the treatment of Raynaud’s phenomenon.
I. 서 론
정상적인 생리조건에서는 사람이 저온에 노출되면 교감신경계의 활성화를 통해 말초 혈관의 수축이 발생한다1. 이러한 저온 유도 혈관수축은 피부층 아래의 혈류량을 줄이고 몸 안쪽의 혈류를 상대적으로 늘려 체온의 손실을 예방하는 기능을 한다2,3. 레이노병 환자들은 저온에 대한 민감성이 높고 손과 발의 말초 혈관이 지속적으로 수축되어 혈류가 감소하고 추위를 느끼는 것이 특징이다4,5. 이러한 비정상적인 혈관 수축은 혈관을 구성하는 혈관내피세포, 혈관평활근세포 또는 혈관주위세포에 의해 이루어지며 주로 저온에 의한 RhoA 단백질 활성화에 의해 조절된다6-9. 혈관내피세포가 저온에 노출되면 RhoA 단백질이 활성화되며 레이노병환자의 혈장 내 혈관수축유도 단백질 중 하나인 endothelin-1 (ET-1)의 증가를 촉진한다10-14. 반면, 저온에 의해 활성화된 RhoA단백질은 혈관내피세포 내 혈관확장유도 단백질인 nitric oxide(NO)를 억제한다15-17. 또한, 저온 노출에 의해 혈관근육세포 및 혈관주위세포가 직접적으로 수축이 유도되는 동시에 혈관내피세포로부터 전달되는 ET-1에 의해 RhoA 단백질이 활성화되고 더욱 수축을 유도하게 된다10,12,18. 따라서, 저온노출에 의한 RhoA 단백질 활성화를 통해 혈관세포들이 수축하고 또한 ET-1과 NO의 양이 조절되므로, RhoA 단백질이 레이노병 환자들의 치료 타겟이 될 수 있음을 의미한다.
당귀사역가오수유생강탕, 우차신기환, 십전대보탕(SDT) 등의 한약들은 한의표준임상진료지침에 따라 성인 수족냉증 환자에게 처방되어 말초 혈액 순환을 개선하고 체온을 높여 주는 것으로 알려져 있다19-24. 수족냉증에 대한 비임상 연구결과들에 따르면 수족냉증 치료제인 당귀사역가오수유생강탕이나 우차신기환이 저온 노출에 의한 혈관세포 내 RhoA 단백질의 과도한 활성화를 억제하여 수족냉증 치료 효능을 보인다고 밝혔다6,25,26. 하지만, SDT의 수족냉증 치료 효능에 대한 비임상 연구가 전무하다. 이에 저자는 본 연구를 통해 SDT의 수족냉증 증상 개선 효능에 대한 분자세포생물학적 기전 규명을 통해 과학적 근거 제시를 하고자 하며, SDT가 저온 노출에 의한 RhoA 단백질 활성화를 완화하여 혈관세포의 수축을 억제할 것이라는 가설을 세웠다.
본 연구에서는 수족냉증 세포 모델을 활용했고6, 혈관내피세포(human dermal microvascular endothelial cells; HDMEC) 및 혈관주위세포(pericytes) 에서 저온노출에 의한 세포 수축 및 RhoA 단백질 활성화를 확인하고 SDT에 의한 세포 수축 보호 및 RhoA 단백질 활성화 억제를 하는 유의미한 결과를 얻었기에 보고하고자 한다.
II. 재료 및 방법
1. 재 료
1) 십전대보탕(SDT)
SDT는 ㈜한풍제약(Jeonju, Korea)에서 복합엑스제 형태로 제공받았으며 구성 약물은 다음과 같다; 복령 1.0 g, 천궁 1.0 g, 계지 1.0 g, 숙지황 1.0 g, 황기 1.0 g, 작약 1.0 g, 백출 1.0 g, 인삼 1.0 g, 당귀 1.0 g, 감초 0.5 g. SDT를 증류수에 녹여 실험에 사용하기 전까지 냉동보관 했다.
2) 세포 배양
HDMEC 세포와 pericytes 세포는 ScienCell Research Laboratories(Carlsbad, CA, USA)에서 구입했다. HDMEC 세포는 5% FBS(fetal bovine serum), 1% 혈관내피세포 성장인자, 1% penicillin/streptomycin 이 포함된 혈관내피세포전용 배지를 사용하여 배양했다. Pericytes는 5% FBS, 1% 혈관주위세포 성장인자, 1% penicillin/streptomycin 이 포함된 혈관주위세포전용 배지를 사용하여 배양했다. 배지 및 구성인자들은 모두 ScienCell Research Laboratories (Carlsbad, CA, USA)에서 구입했다.
2. 실험 방법
1) 저온 노출에 의한 세포 수축 및 SDT의 수축 억제 효능 평가
혈관세포를 60 mm dish에 배양하고 100% 포화되면 약처리를 진행했다. 대조군과 저온노출군은 증류수를 처리하고 저온+SDT처리군은 SDT를 30분간 상온에서 처리했다. 30분 동안 배양 후 저온노출군 및 저온+SDT처리군은 25 °C에 30분 동안 노출시켰고 대조군은 37 °C에 노출시켰다. ET-1에 의한 혈관주위세포 수축 및 SDT의 영향을 확인하기위해, 저온노출 대신 100 nmol/L의 ET-1(Sigma-Aldrich, Merk KGaA, Darmstadt, Germany)를 처리하여 30분 동안 상온에서 반응시켰다. 혈관내피세포를 배양한 배지는 ET-1과 NO의 생성량을 측정하기 위해 수집하여 냉동보관 했다.
2) Enzyme-linked immunosorbent assay(ELISA)
혈관내피세포로부터 생성된 ET-1과 NO를 ET-1 (ADI-900-020A)과 NO(ADI-K262-200) ELISA 키트를 이용하여 분석했다. ET-1 또는 NO에 대한 항체가 코팅되어 있는 96 wells plate에 대조군과 실험군의 배양 배지를 추가하고 1시간 동안 상온에서 반응시켰다. Well을 washing buffer로 세척하여 결합하지 않은 단백질들을 제거하고 HRP 라벨 된 ET-1 또는 NO 타겟하는 단일클론항체를 첨가하여 반응시켰다. 결합하지 않은 HRP 항체를 세척하여 제거하고 substrate solution로 반응시킨 후 stop solution을 이용하여 반응을 종료시켰고 반응 결과물을 450 nm 파장에서 흡광도를 측정했다.
3) Western blot analysis
혈관 세포 내 활성화된 RhoA 및 하위 수축 기전 관련 단백질들의 발현을 확인하기 위해 western blot을 수행했다. 세포 내 총 단백질을 추출하기 위해 RIPA 버퍼(R2002, Biosesang Co., Ltd., Seoul, Korea)를 이용하여 얼음 위에서 20분 동안 반응시켰다. 단백질은 Bio-Rad protein assay kit(500-0006, Bio-Rad GmbH, Munchen, Germany)를 이용하여 정량 했다. 동일한 양의 단백질을 sample buffer (EBA-1052, Daejeon, Korea)와 섞어 100 °C에서 10분간 끓였다. 단백질(20 ug)을 10-12% SDS-PAGE를 통해 크기별로 분류하여 nitrocellulose membrane으로 이동시키고 3% 소 혈청 알부민(in PBS-Tween20)으로 블로킹했다. 1차 항체로는 mouse-anti-active RhoA monoclonal(cat no. 26904, 1:1500, NewEast Biosciences, Malvern, PA, USA), rabbit anti-focal adhesion kinase(FAK)(cat no. 3285, 1:1,000)(Cell Signaling Technology, Danvers, MA, USA), rabbit- anti-phospho-FAK monoclonal(cat no. 8556, 1:1,000) (Cell Signaling Technology, Danvers, MA, USA), mouse-anti-ß-actin monoclonal(cat no. sc73615, 1:1,000, Santa Cruz Biotech, Santa Cruz, CA, USA)들을 사용했으며 항체와 membrane을 4 °C에서 16시간 동안 반응시켰다. HRP 표식 된 2차 항체(cat no. 7076 for mouse; cat no. 074 for rabbit, Cell signaling Technology, Danvers, MA, USA)는 상온에서 1시간 동안 반응시켰다. ECL 용액(DG-WP250, DoGen, Seoul, Korea)을 이용하여 암실에서 x-선 필름을 현상했다.
4) 면역세포화학염색
HDMEC의 저온에 의한 수축의 특징 중 하나인 focal adhesion complex를 측정하기 위해 6 wells plate에 coverslip을 넣어 그 위에 HDMEC 세포를 배양했다. 저온 노출 또는 약 처리 종료 후, 세포를 4% paraformaldehyde(Junsei Chemical Co., Ltd., Tokyo, Japan)로 고정시키고 항체를 투과시키기 위해 0.1% Triton X-100 solution(T8787; Sigma- Aldrich, Merck KGaA, Darmstadt, Germany)을 전처리했다. 세포를 mouse-anti-vinculin monoclonal 항체(cat no. ab18058, 1:50, Abcam, CA, USA)와 1차 반응시키고 추가로 세포 골격 확인을 위해 rhodamine- phalloidin(cat no. R415, Life Technology, Grand Island, NY, USA)으로 염색했다. 2차 항체로는 Alexa Fluor 488-conjugated goat anti-mouse IgG(cat. no. A-28175; 1:1,000; Thermo Fisher Scientific, Inc., Waltham, MA, USA)를 사용했다. Zeiss LSM5 PASCAL confocal laser scanning microscope system(Carl Zeiss AG, Oberkochen, Germany)를 이용하여 세포 내 2차 항체 표지 된 단백질을 확인했다.
5) Statistical analysis
통계분석은 GraphPad Prism 5(La Jolla, CA, USA)를 사용하여 수행했다. 그룹 간 평균 차이는 one-way ANOVA를 통해 분석했고 사후검정으로는 Tukey test를 이용했다. P<0.05는 통계적 유의성을 의미한다.
III. 결 과
1. 저온 노출 또는 ET-1 처리에 의한 pericyte 내 RhoA 활성화에 미치는 영향
저온에 의한 pericyte 수축은 RhoA 단백질 활성화에 의해 조절된다6. 또한 저온 노출된 혈관내피세포는 혈관 수축을 위해 ET-1을 생성하여 혈관평활근세포나 pericyte로 전달하여 수축을 유도한다. 따라서, 본 연구에서는 저온 노출 또는 ET-1에 의한 pericyte 내 RhoA 단백질 활성화를 SDT가 억제하는지를 확인했다. 저온 노출 또는 ET-1에 의해 pericyte 내 RhoA 단백질이 활성화 되었고 SDT 처리 농도가 증가함에 따라 RhoA 단백질 활성화가 억제됨을 확인했다(Fig. 1 A and B).
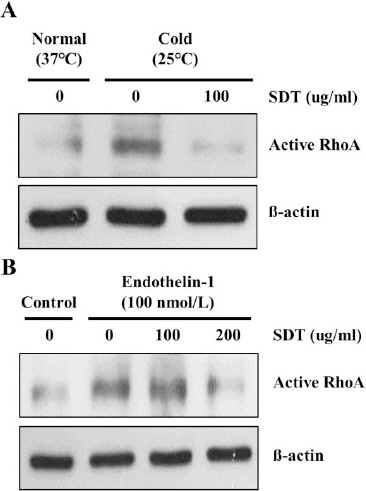
Inhibitory effect of SDT on cold- and ET-1-induced RhoA activation in pericytes.
(A) pericytes were pre-treated with SDT for 30 min and then exposed to cold condition (25 °C) (A) or ET-1 (B) for 30 min. Western blot analysis was performed to measure the expression of active RhoA. ß-actin was used as internal control.
2. 저온 노출에 의한 HDMEC 내 RhoA 활성화에 미치는 영향
저온 노출에 의한 RhoA 단백질 활성화는 혈관내피세포의 수축을 유도하며 dominant negative RhoA plasmid 주입을 통해 저온에 의한 혈관내피세포 수축을 억제할 수 있다6. 따라서, 저온에 의한 혈관수축 시 활성화 되는 RhoA 단백질을 억제하는 것은 가능성 있는 치료 전략임을 의미한다. 본 연구에서는 SDT가 저온에 의한 혈관내피세포 내 RhoA 단백질 활성화를 억제하는지를 확인했다. 저온 노출에 의해 활성화 형태의 RhoA 단백질의 발현이 증가했으며, SDT 처리를 통해 단백질의 발현이 억제됨을 확인했다(Fig. 2).
3. 저온 노출에 의한 혈관내피세포 ET-1 및 NO 생성에 대한 영향
저온에 의한 혈관 수축 시, 혈관내피세포는 혈관수축인자인 ET-1을 생성하고 혈관평활근세포 및 pericyte로 전달하여 수축을 유도한다6,13,14. 또한 혈관내피세포는 혈관이완인자인 NO를 생성하는데 NO의 생성은 RhoA 단백질의 활성화에 의해 억제되는 것으로 알려져 있다15,17. 따라서, 본 연구에서는 저온 노출에 의한 혈관내피세포의 ET-1과 NO생성량과 이에 대한 SDT의 영향을 확인했다. 저온 노출 시 ET-1의 생성량이 증가되지만 SDT 처리를 통해 저온에 의한 ET-1 생성을 억제했다(*P<0.05 vs Control group, #P<0.05 vs. Cold group)(Fig. 3). 또한 저온 노출에 의해 NO의 생성량이 감소함을 확인했으며, 이는 SDT 처리를 통해 회복됨을 확인했다(*P<0.05 vs Control group, #P<0.05 vs. Cold group)(Fig. 4).

Mitigative effect of SDT on cold-induced ET-1 production in HDMEC-cultured medium.
Production of endothelin-1 from HDMEC-cultured medium was measured by ELISA. Experiments were performed in triplicate. Bars indicate the mean±SD (*P<0.05 vs Control group; #P<0.05 vs Cold group).
4. 저온 노출에 의한 혈관내피세포 focal adhesion complex 및 stress fiber 생성에 대한 영향
RhoA 단백질 활성화는 FAK 단백질의 인산화를 증가시키고 이로 인해 혈관세포를 수축시키며 focal adhesion complex 및 stress fiber를 증가시키는 특징이 있다6. 면역세포화학염색 결과, 혈관내피세포를 저온에 노출시키면 focal adhesion complex 및 stress fiber를 형성하며 수축했고, 이를 SDT 처리를 통해 억제함을 확인했다(Fig. 5A). 또한, 저온 노출 시 혈관내피세포 내 인산화 된 FAK 단백질 발현이 증가했지만 SDT 처리를 통해 발현이 반대로 감소함을 확인했다(Fig. 5B).
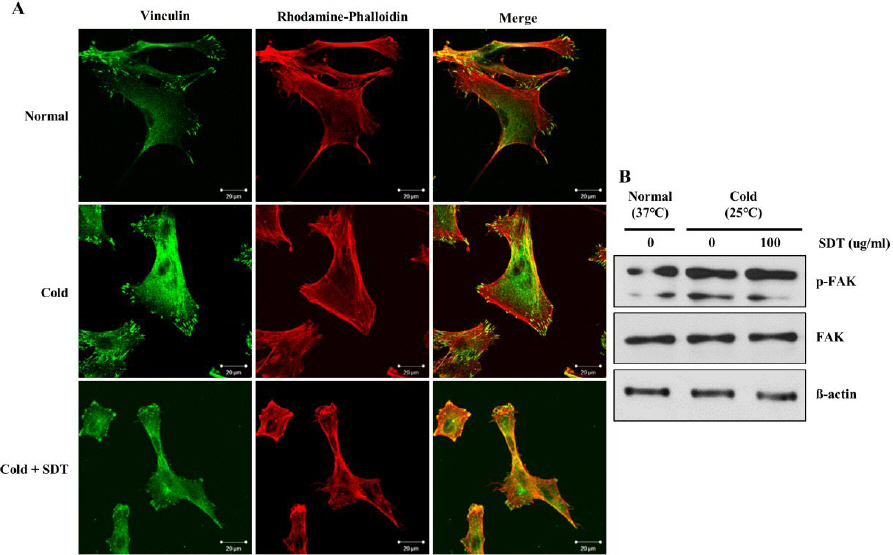
Inhibitory effect of SDT on cold-induced formation of stress fiber and focal adhesion complex in HDMEC.
(A) HDMEC were pre-treated with SDT for 30 min and then exposed to cold condition (25 °C) for 30 min. HDMEC was stained with vinculin as marker for focal adhesion complex. Stress fiber was detected by using rhodamine-phalloidin. Scale bar means 20 µm. (B) Total and phosphorylated forms of FAK were detected by western blotting. ß-actin was used as internal control.
IV. 고 찰
SDT는 한의의료기관에서 다용되고 있는 처방으로, 氣血을 보하는 효능뿐만 아니라, 저하된 신체생리기능을 회복시키고 면역력을 증진시키는 등 만성 허증 질환에 광범위하게 활용될 수 있다27. SDT 과립제제는 ‘병후 체력저하’, ‘피로권태’, ‘식욕감퇴(식욕부진)’, ‘도한(盜汗, 야간에 자는 동안 땀이 나지만 느끼지 못하고 깨어나면 땀이 그치는 증상)’, ‘손발이 차가움’, ‘빈혈’ 등의 적응증에 활용된다고 제시되어 있다28. 한의표준임상진료지침에 따르면 성인 수족냉증 환자에 대한 증상 개선을 위해 SDT를 처방하고 있고 현재 치료 효능 및 안전성에 대한 임상 시험이 진행되고 있지만, 이에 대한 분자생물학적 기전은 거의 밝혀지지 않았다.
SDT 은 망막증, 항산화, 항염증 등 다양한 질환에 대한 효능 및 기전이 밝혀져 있다29,30. Platelet derived growth factor(PDGF)는 잘 알려진 혈관수축인자이며 망막증을 촉진시키는 것으로 알려져 있는데 SDT가 PDGF에 의한 과도한 망막혈관생성을 억제한다고 보고되었다29. 또 다른 연구에 따르면 Raw 264.7 세포에 LPS를 처리하면 NO 생성량이 증가되며 SDT 처리를 통해 NO 생성이 감소되는 결과를 통해 항염증 효능을 검증했다30. 또한 Raw 264.7 세포에서 LPS 유도 시에는 NO 생성이나 iNOS mRNA 발현을 증가시키는데, LPS 유도 없이 SDT만으로는 NO 생성이나 iNOS mRNA 발현을 증가시키지 않는다고 보고된 바 있다31. 하지만 또 다른 연구에서는 LPS 유도 시 SDT의 저농도(0.25-2 mg/ml)에서는 iNOS protein 발현이 촉진되는데, 고농도(4 mg/ml)에서는 억제되었다고 하며, LPS 유도 없이 SDT만으로도 iNOS protein 생성이 유도되는 경향이 보인다고 하였다32. 따라서 NO 생성에 대한 실험연구가 더 필요하며, 그리고 혈관 관련 질환에 대한 효능 및 타겟 기전에 기반하여 혈관 기능 조절 인자들인 ET-1, RhoA 등과 관련된 실험연구에 대한 필요성을 느끼고 본 연구를 진행하게 되었다.
저온에 의한 혈관 세포 수축은 RhoA 단백질 활성 의존적이다7,8,33. 혈관내피세포에 저온을 노출시키면 RhoA 단백질이 활성화 되면서 세포가 수축되는 반면 dominant negative RhoA 단백질을 형질주입한 혈관내피세포는 저온 노출에 의한 세포 수축이 발생하지 않는다6. 그리고, 저온에 의한 혈관내피세포 및 혈관근육세포 수축은 활성화 형태의 RhoA 단백질 형질주입을 통해 재현된다6. 이러한 저온 노출에 의한 혈관내피세포 내 RhoA 단백질 활성화는 혈관 수축 인자 ET-1의 생성을 촉진하고 혈관 확장 인자 NO의 생성을 억제한다6,13,15. 따라서, RhoA 는 저온에 의한 혈관수축에 주요 조절인자이며 가능성 있는 치료 타겟임을 의미한다. 본 연구를 통해 SDT가 저온 노출에 의한 pericyte와 HDMEC 내 RhoA 단백질 활성화를 억제함을 밝혔다. 또한, SDT 처리는 저온에 의한 혈관 내피 세포의 ET-1과 NO 생성량 변화를 조절하는 것을 밝혔다. 그리고, 저온에 의한 HDMEC 내 stress fiber와 focal adhesion complex 형성을 SDT가 억제하는 결과를 얻었다. 본 연구를 통해 SDT가 저온 노출된 혈관 세포 내 RhoA 단백질 활성 억제를 통해 수족냉증 치료 효능을 보일 것이라는 결과를 얻었다.
Yamakawa 연구진은 SDT의 3D 고성능액체크로마토그래피 패턴에 대한 연구 결과를 발표했다34. 밝혀진 SDT 내 성분들로는 ferulic acid35,36, paeoniflorin37,38, cinnamic acid39, cinnamaldehyde40,41, formononetin42, ligustilide43 등이 있다. Ferulic acid 는 Rat 모델에서 ERL1/2와 MYPT1을 억제하여 대동맥, 장간막동맥, 관상동맥의 이완을 유도한다. Paeoniflorin은 모란 뿌리 껍데기에서 추출되는 성분으로서 혈관내피세포에서 NO 생성량을 높여 혈관 이완 효능을 보인다. Cinnamic acid 또한 혈관 내피 세포로부터 NO 생성을 유도하여 혈관을 이완시키는 효과를 보인다. Cinnamaldehyde는 NO 생성과 칼슘 배출 유도를 통해 혈관이완을 유도하는 것으로 알려져 있다. Formononetin은 혈관 내피 세포 내 NO 생성 촉진, 혈관 내피 세포 비의존적 칼슘채널 억제 또는 칼륨 채널 활성화를 통해 혈관 이완을 유도한다고 보고되었다. Ligustilide 또한 칼슘 채널을 조절하여 세포 내 칼슘을 배출함을 통해 혈관 이완을 유도한다. 따라서, SDT의 저온에 의한 혈관 세포의 수축이 이러한 성분들의 복합적 효능일 것이라 사료된다.
최근 수족냉증 기초 연구를 하기 위한 세포 모델과 동물 모델이 보고되었다6,26. 혈관 내피 세포 및 혈관 주위 또는 평활근 세포를 직접 저온에 노출시키면 혈관 세포가 수축함을 발견했고 이를 조절하는 기전은 RhoA 단백질임을 밝혔다6. 동물 모델에서는 쥐를 마취 후 꼬리를 25 °C에 노출시키고 조직면역학적 분석을 한 결과 저온 노출 시 혈관이 수축됨을 확인했다26. 이 실험 모델을 이용하여 수족냉증에 처방되는 당귀사역가오수유생강탕, 우차신기환 등에 대한 효능이 검증되었다. 본 연구는 저온에 의한 RhoA 단백질을 타겟하는 세포 모델을 이용하여 SDT의 치료 효능을 검증했지만, 동물 모델에서의 효능 및 부작용 등에 대한 추가 연구가 반드시 필요하다.
V. 결 론
SDT는 오랫동안 혈행개선 목적으로 사용되고 있지만 과학적 근거가 부족했다. 본 연구를 통해 SDT가 저온에 의한 혈관 세포 수축을 직접적으로 억제하며 이는 RhoA 단백질 활성화를 억제함으로서 나타난다는 결과를 밝혔다. 또한, SDT가 저온에 의한 RhoA 단백질 활성화 억제를 통해 HDMEC에 의한 ET-1 및 NO 생성량을 조절한다는 결과를 보였다. 따라서, SDT는 레이노병, 수족냉증 등 저온에 의한 혈관 수축 관련 증상을 치료하는 데 효과적일 것이라 사료된다.
감사의 글
본 연구는 보건복지부 한의약 근거창출 과제(HI13C0530) 연구비 지원으로 수행된 연구이다.