H2O2로 유발된 C6 신경교세포 사멸에 대한 총명공진단의 보호 효과
Protective Effects of Chongmyunggongjin-dan on H2O2-induced C6 Glial Cell Death
Article information
Abstract
Objectives
This study was conducted to identify the protective effects of Chongmyunggongjin-dan (CMGJD) on Hydrogen peroxide (H2O2)-induced apoptosis mechanisms in C6 glial cells.
Method
We used CMGJD after distilled water extraction, filtration, and lyophilization. The ROS scavenging effect was examined by fluorescence microscopy. Expression levels of proteins related to ROS generation were investigated by western blotting. Functional changes in organelles related to Reactive oxygen species (ROS) generation were investigated by immunoblotting and by verifying expression level of relevant enzymes.
Results
The CMGJD extract protected the cells against H2O2-induced morphological changes and DNA fragmentation, inhibited the increase of Heme_oxygenase-1(HO-1) and the decrease in catalase, protected against the loss of mitochondrial membrane potential, inhibited disturbances of lysosomal function, and induced an increase in peroxisomes.
Conclusion
CMGJD was confirmed to have a protective effect on H2O2-induced C6 glial cell death possibly by blocking the pathways causing damage to subcellular organelles, such as mitochondria, lysosomes, and peroxisomes. We assume that CMGJD will be effective for the prevention and treatment of ischemic stroke in a clinical environment.
Ⅰ. 서 론
허혈성 뇌손상(Brain ischemia)은 혈전으로 인한 혈관폐색, 심장질환에 기인한 색전, 혈관염, leukoaraiosis 등에 의해 뇌에 혈액 공급이 부족하게 되어 발생하며, 뇌경색, 간질 등의 신경질환과도 연관된다1.
허혈성 뇌손상은 흔히 중추신경세포의 손상을 야기하며2, 괴사(necrosis)와 glutamate에 의한 흥분독성, 이온통로를 통한 칼슘의 세포 내 유입, 활성산소에 의한 산화적 손상, acidosis 등 다양한 생체 내의 생화학적 기전이 단독 또는 복합적으로 작용하는 세포사멸(apoptosis)이 보고되었다3.
이 중 활성산소의 일종인 H2O2는 처음에 hydroxyl radical로 바뀌고, 이것이 물로 바뀌기 전에는 세포에 강력한 산화 스트레스를 주어 세포 손상을 가속화시키며, 이는 알츠하이머병, 파킨슨병 같은 신경변성 질환 및 노화 등과도 관련되어 있어4 항산화 기작을 통한 신경세포 보호가 허혈성 뇌 질환의 중요한 치료 목표가 된다.
공진단(供辰丹)은 精氣神을 補하고 臟腑의 虛損을 치료하는 처방으로, “供辰丹”이라는 처방명은 宋代 ≪是齋百一選方≫5에서 최초로 등장하였으며, ≪東醫寶鑑≫6에서는 危7의 ≪世醫得效方≫을 인용하여 ‘肝虛藥’으로 수록하고 있으며, 임상에서는 원방에 가감하여 활용하는 경우가 많아 본 연구에서도 聰明湯 계열의 약재와 신경 보호 효과 및 항산화 효과가 있다고 알려진 약재들을 가감하여 총명공진단(CMGJD)을 조제하여 사용하였다.
공진단 가미방에 관련된 실험 연구로 항산화 작용8,9, 항염증 효과10,11, 면역 증진 효과12, 간 보호 효과13,14, 퇴행성 신경질환의 회복 효과15,16, 항 피로 효과17, 생식력 회복 효과18와 관련된 연구가 보고 되었으나, 활성산소에 의한 신경교세포 사멸과 관련된 보호 효과 및 기전에 대한 연구는 부족한 상태이다.
이에 저자는 H2O2에 의한 C6 신경교세포 사멸에 있어 CMGJD의 보호 효과를 알아보기 위하여 C6 신경교세포에서 활성산소종에 의한 세포사멸 및 보호기전에 관련된 단백질 및 세포소기관의 기능 변화를 비교, 관찰한 바 유의미한 결과를 얻었기에 보고하고자 한다.
Ⅱ. 실험 방법
1. 재 료
1) 세포주
흰쥐 신경교세포주인 C6 신경교세포는 한국 세포주은행(KNCC, 서울대학교)에서 분양받아 5% CO2, 95% 대기 공기 및 37 ℃ 환경의 세포배양기에서 계대 배양하였다.
2) 약 재
약재는 원광대학교 전주한방병원(Jeonju, Korea)에서 구입하여 사용하였고, 총명공진단(CMGJD) 한 제의 분량은 다음과 같다(Table 1).
3) 시약 및 기기
Dulbecco’s modified eagle’s medium(DMEM), glucose-free DMEM, Fetal bovine serum(FBS), Phosphate buffered saline(PBS, pH7.4), 항생제 및 trypsin은 GIBCO BRL Co.(Grand Island, NY, USA)로부터 구입하여 사용하였다. Methylthiazol -2-yl-2. 5-diphenyl, tetrazolium bromide(MTT), Sodium dodecyl sulfate(SDS), H2O2, Dimethyl sulfoxide(DMSO), 2,7-dichlorofluorescein diacetate (DCF-DA), 4’, 6-diamidino-2-phenylindole(DAPI), JC-1 및 lysotracker는 Sigma Co.(St. Louis, Missouri, USA)로부터 구입하여 사용하였으며, ELISA reader는 Molecular Devices Co.(Sunnyvale, CA, USA)에서 구입하여 사용하였다. Bradford assay kit는 Bio-Rad Co.(Berkeley, CA, USA)에서, enhanced chemiluminescence kit(ECL kit)는 Thermo fisher Co.(Waltham, Massachusetts, USA)에서 구입하여 사용하였다. anti-LC3-I/II는 Cell signaling Co. (Danvers, Massachusetts, USA)에서 구입하여 사용하였으며, Lamp-1, PMP70, Catalase, HO-1, Cathepsin B, Cathepsin L, ACOX-1의 항체는 Santa Cruz Co. (Santa cruz, CA, USA)에서 구입하여 사용하였다.
2. 방 법
1) 시료의 제조
정선된 한약재를 증류수로 추출 후, 음건하고 Table 1의 CMGJD 약재 100 g을 계량하여 증류수 1000 ml로 냉각기를 부착한 환저라스크에서 3시간 끓인 후, 거즈로 여과하고, 3,200 rpm으로 20분간 원심분리 후 농축기(Rotary evaporater)로 농축한 다음, -80 ℃(Deep Freezer)에서 12시간 이상 동결건조기로 완전히 건조시켜 23.8 g(평균수율 23.8%)의 시료를 얻었다. 시료는 500 mg/ml이 되도록 phosphate-buffered saline(PBS, pH 7.4)으로 녹여 4 ℃에서 보관하고 실험 시에는 DMEM에 희석해서 사용하였다.
2) 세포주 배양
C6 신경교세포는 10% FBS가 포함된 DMEM (Glucose high, 4.5 g/L) 세포 배양액으로 5% CO2, 95% 대기공기 및 37 ℃ 세포배양기에서 10 cm 세포 배양판에 배양하였다. 24시간 간격으로 0.05%- trypsin/EDTA를 사용하여 계대배양 하였으며, 배양액을 교체한 후 log phase에 있는 세포를 사용하였다. 각 실험 조건에 따라 H2O2를 세포 배양액에 희석하여 처리하였고, CMGJD은 H2O2를 처리하기 30분 전 처리 후 실험을 수행하였다.
3) 세포생존율 측정
MTT 분석법으로 세포 생존율을 측정하였다. C6 신경교세포를 배양판에 1×105 cells/ml의 세포 배양액을 각각 분주하여 12시간 배양하여 부착시키고, 각 조건에 따라 처리한 후 배양기 안에서 일정 시간 배양하였다. CMGJD 및 H2O2를 30분 전 처리 후 실험을 진행하였으며, 배양 완료 4시간 전에 MTT 용액(5 mg/ml in PBS)을 배양액 부피의 1/10이 되도록 100 μl씩 첨가한 다음, 4시간 후 상층액을 제거하여 바닥에 부착된 불용성 formazan을 완전히 건조하였다. 불용성 formazan은 DMSO 용액으로 충분히 용해한 다음, 분광광도계 ELISA reader를 이용하여 545 nm 파장에서 흡광도를 측정하였고, 대조군과 비교하여 백분율(%)로 표시하였다.
4) 세포 내 활성산소종(ROS) 생성 측정 : DCF-DA 형광염색
세포 내 활성산소종(ROS)의 생성을 측정하기 위해 형광 probe인 DCF-DA와 반응시킨 후 형광현미경으로 관찰하였다. 각 시약을 처리한 후 세포를 얻기 전에 5 μM 농도의 DCF-DA를 처리하여 37 ℃에서 30분간 배양하여 형광현미경(IX71, Olympus, Tokyo, Japan)으로 형광 세기를 비교, 관찰하였다.
5) Western blot analysis
실험 완료 후 C6 신경교세포를 포집하여, 차가운 PBS로 2회 세척 후, RIPA 용액(50 mM HEPES pH 7.4, 150 mM NaCl, 1% deoxy-cholate, 1 mM EDTA, 1 mM PMSF, 1 μg/ml aprotinin)으로 4 ℃에서 30분간 반응시켰다. 용해 세포 부유액에 2 X sample buffer를 섞어 98 ℃에서 5분간 끓인 후 10%, 12% 및 15% SDS-PAGE를 시행하였다. 전기영동이 끝난 gel의 단백질을 nitrocellulose membrane으로 50 V, 2시간 transfer 후 blocking(5% skim milk)하여 상온에서 1시간 반응하여 비특이적 항체 결합을 예방하였다. 일차 항체들은 Antibody solution(TBST with 3% skim milk)에 1:3000으로 희석하여 nitrocellulose membrane과 상온에서 2시간 반응시켰다. 이후 2차 항체(Antibody solution 1:5,000으로 희석)와 상온에서 1시간 반응하였다. Nitrocellulose membrane은 TBS-T(tris-buffered saline + Tween 20)로 3회 세척 후 enhanced chemiluminescence kit(Thermo fisher Co.)를 사용하여 Chemidoc system (Bio Rad.)으로 발현량의 변화를 측정하였다.
6) 미토콘드리아 기능 장애 측정 : JC-1 형광염색
세포의 미토콘드리아 기능 장애 여부를 측정하기 위해 JC-1 염색 후 형광 변화를 형광현미경으로 관찰하였다. 각 시약 처리 후 세포를 얻기 전 1 μM 농도의 JC-1을 세포에 처리하여 37 ℃에서 30분간 배양한 후 PBS(pH 7.4)로 세척하고, 형광현미경 (Olympus)으로 관찰하였다.
7) 리소좀 기능 장애 측정 : Lysotracker 형광염색
세포의 리소좀 기능 장애 여부를 측정하기 위해 lysotracker 염색 후 형광 변화를 형광현미경으로 관찰하였다. 각 시약 처리 후 세포를 얻기 전 1 μM 농도의 lysotracker를 처리하여 37 ℃에서 30분간 배양한 후 PBS(pH 7.4)로 세척하고, 형광현미경으로 관찰하였다.
8) 면역형광염색(Immunofluorescence staining)
세포 내 단백질의 발현 위치와 양의 변화를 측정하기 위해 면역형광염색을 실시하였다. 세포는 배양판에 1×105 cells/ml의 세포 배양액을 각각 분주해서 24시간 배양 후 부착시키고, 각 조건에 따라 처리 후 배양하였다. 각 실험이 완료된 후 차가운 PBS로 2회 세척하고, 4% paraformaldehyde로 15분 동안 실온에서 반응시켜 세포를 고정하고, blocking(5% BSA with Triton X-100)하여 상온에서 1시간 반응시켜 비특이적 항체 결합을 예방하였다. Lamp-1 및 Cathepsin B 등에 대한 항체는 Antibody solution(PBST with 3% BSA)에 1:200으로 각각 희석하여 반응하였고, 이어서 2차 항체와 상온에서 1시간 반응하였다. PBST로 3회 세척 후 antifade prolong mounting solution(Molecular Probe)으로 mount하여 형광현미경으로 관찰하였다.
9) 지질대사체 변화량 조사 : GC-MS
긴사슬지방산의 양을 측정하기 위해 세포를 분쇄하고, Heneicosanoic acid를 사용하여 세포 내 지방산을 추출하였다19. 지방산은 KOH로 녹인 후 HCl를 첨가하여 중화시키고, 60 ℃에서 30분간 BCl3-MeOH로 반응한 후 GC-MS(Shimadzu)를 시행하고, 7890A /5975A(Agilent)로 분석하였다.
3. 통계처리
표시된 결과는 3회 이상의 독립적인 실험결과로서 통계처리는 One-way ANOVA test를 이용하여 처리하였으며, p-value가 최대치 0.05 미만의 경우를 유의한 것으로 판정하였다.
Ⅲ. 결 과
1. H2O2가 C6 신경교세포의 생존율에 미치는 영향
H2O2가 C6 신경교세포에 미치는 독성을 알아보기 위해 H2O2 처리 후 농도 및 시간에 따른 생존율을 측정하였다. 다양한 농도의 H2O2를 12시간 및 24시간 처리하여 생존율을 조사한 결과, 25, 50, 100, 200 및 400 μM 농도의 H2O2를 12시간 처리 시, 83.9, 73.9, 47.6, 22.0 및 22.6%의 세포생존율을 보였으며, 동일한 농도의 H2O2를 24시간 처리 시 72.1, 48.5, 20.6, 10.7 및 11.5%의 세포생존율을 각각 나타내어 농도 및 시간 의존적으로 생존율이 감소하였다(Fig. 1A).

Cell viability on H2O2-treated C6 glial cells.
A : Cells were treated with various concentration of H2O2 for several times. Cell viability was measured by MTT assay. Results were represented as the means ± S.D. of three independent experiments. * p<0.05, ** p<0.01 compared to control cells. B : Morphological changes in H2O2-treated cells. Images were taken using contrast microscopy.
또한, 100 μM 농도의 H2O2를 12시간 처리 시 대조군에 비하여 세포 수의 감소와 함께 형태변화가 동반되는 세포사멸이 관찰되었으며, 200 μM 농도의 H2O2를 12시간 처리 시 세포생존율의 급격한 저하와 함께 세포표면이 현저하게 손상되었다(Fig. 1B).
따라서 이후의 다른 모든 실험들은 100 μM 농도의 H2O2를 실험 목적에 따라 각각 다른 시간으로 처리하여 시행하였다.
2. CMGJD이 H2O2에 의한 C6 신경교세포의 생존율에 미치는 영향
CMGJD이 세포생존율에 미치는 영향을 알아보기 위해 C6 신경교세포에 다양한 농도의 CMGJD을 30분 전 처리 후 100 μM 농도의 H2O2를 12시간 처리하여 세포생존율을 측정한 결과, H2O2 100 μM에 의해 32.6%로 감소했던 세포생존율이 CMGJD을 농도별로 전 처리한 경우에는 점차 유의하게 증가하기 시작하여 CMGJD 0.25, 0.5 및 1 mg/ml 농도에서는 각각 76.1, 98.0 및 99.5%를 나타내어 농도 의존적으로 세포생존율이 증가하였다(Fig. 2).

CMGJD attenuates H2O2-induced cytotoxicity in C6 glial cells.
Cells were pretreated with various concentration of CMGJD for 30 min and followed by the addition of 100 uM H2O2 for 12 hrs. Then, the viability was measured by MTT assay. Results represented as the mean (%) ± S.D. of three independent experiments. * p<0.01, # p<0.05 by One-way ANOVA test, compared to treated group.
CMGJD 0.25, 0.5 및 1 mg/ml 농도를 C6 신경교세포에 단독으로 12시간 처리한 군에서는 각각 109.0±3.44, 98.5±3.11 그리고 108.0±.3.4%의 세포생존율을 보여 유의한 세포독성은 관찰되지 않았다(Fig. 2).
3. CMGJD이 H2O2에 의한 C6 신경교세포의 형태학적 변화 및 세포사멸에 미치는 영향
CMGJD이 세포의 형태학적 변화에 미치는 영향을 조사하기 위하여 세포의 형태를 위상차현미경으로 관찰하였다. C6 신경교세포는 100 μM 농도의 H2O2를 12시간 처리 시 세포 수의 현저한 감소와 함께 크기가 줄어들고 핵이 분절되었으나, 1 mg/ml의 CMGJD을 30분 전 처리 후 H2O2를 12시간 처리한 군에서는 세포 수의 감소가 억제되었으며, 대조군과 유사한 형태를 보였다(Fig. 3A).
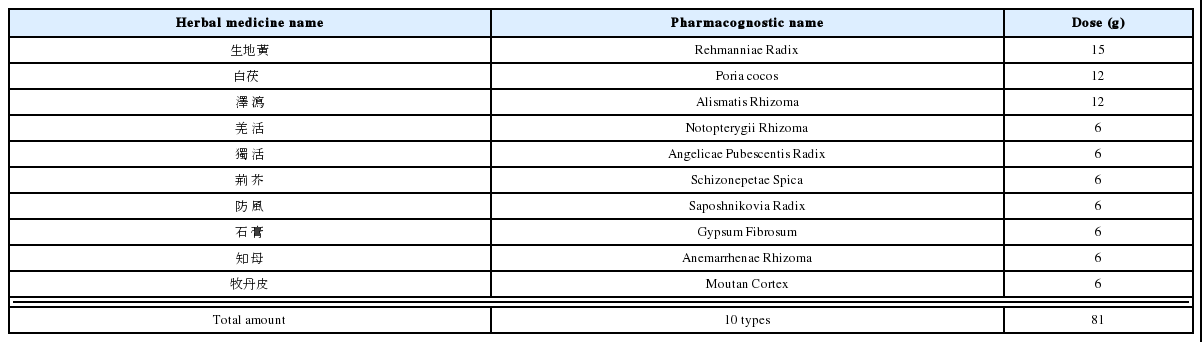
CMGJD protects H2O2-induced morphological change and DNA fragmentation of C6 glial cells.
Cells were pretreated with CMGJD (1 mg/ml) and added H2O2 (100 μM) for 12 hrs. Cells were stained with DAPI (5 μM) and cells were observed under microscopy (A) or fluorescent microscopy (B).
또한, 동일한 조건에서 세포핵을 DAPI로 형광염색한 후 형광현미경으로 확인한 결과, H2O2 처리 시 세포핵의 DNA가 응축되거나 분절되어 세포사멸이 초래되었으나 1 mg/ml의 CMGJD 30분 전 처리 시 세포핵의 응축 및 분절이 보호되었으며(Fig. 3B), 1 mg/ml의 CMGJD 12시간 단독 처리군에서는 유의한 세포 수의 감소나 형태 변화 및 세포핵의 응축이나 분절이 관찰되지 않았다(Fig. 3).
4. CMGJD의 H2O2에 의한 C6 신경교세포 사멸에서 활성산소종 제거 효과
CMGJD의 활성산소종 제거 효과를 조사하기 위하여 DCF-DA 형광염색을 통해 활성산소종의 양을 형광현미경으로 관찰하였다. C6 신경교세포에 100 μM 농도의 H2O2를 6시간 처리 시 현저하게 초록 형광이 증가하였으나, 1 mg/ml의 CMGJD을 30분 전 처리 후 동일한 농도의 H2O2를 6시간 처리한 군에서는 초록 형광이 현저하게 감소되어 대조군과 유사한 세포 형태를 보였으며, 1 mg/ml의 CMGJD 6시간 단독 처리군에서는 초록 형광이 관찰되지 않았다(Fig. 4).
5. CMGJD이 H2O2에 의한 C6 신경교세포 사멸에서 HO-1 및 Catalase 발현 변화에 미치는 영향
CMGJD의 활성산소종 조절 기전을 조사하기 위해 HO-1 및 Catalase의 발현 변화를 western blot analysis로 확인하였다. 다양한 농도의 H2O2를 C6 신경교세포에 10시간 처리 후 HO-1의 발현량을 조사한 결과 25, 50 및 100 uM 농도에서는 대조군에 비해 발현 증가가 크지 않았으나, 200 uM 농도에서는 현저하게 발현량이 증가하였다(Fig. 5A). 또한, 100 uM H2O2의 처리 시간을 다양하게 한 결과, Catalase의 발현량은 시간 의존적으로 감소하였다(Fig. 5B).
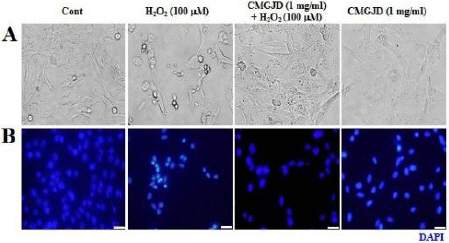
Effect of CMGJD on HO-1 and Catalase protein in H2O2-induced C6 glial cell death.
Cells were treated with 1 mg/ml CMGJD for 30 min and added 100 μM H2O2 in C6 glial cells for 6 hrs. Cell lysate was separated by SDS-PAGE, and immunoblotted for HO-1, Catalase, and β-actin.
그러나 1 mg/ml의 CMGJD을 30분 전 처리 후 100 uM 농도의 H2O2를 10시간 처리 시, 증가했던 HO-1의 발현량이 감소되었고, 감소했던 Catalase의 발현량은 대조군 수준으로 회복되었다(Fig. 5C).
6. CMGJD이 H2O2에 의한 C6 신경교세포 사멸에서 미토콘드리아 기능 장애에 미치는 영향
세포 내 활성산소종의 생성과 연관이 있는 미토콘드리아의 기능 장애 여부를 미토콘드리아 특이 형광염색제인 JC-1으로 조사하였다. 100 μM 농도의 H2O2를 C6 신경교세포에 6시간 동안 처리한 결과, 대조군(Fig. 6A)에 비하여 초록 및 황색 형광이 증가하였다(Fig. 6B).
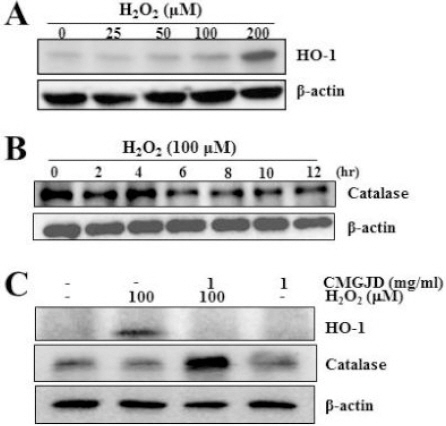
Effect of CMGJD on mitochondrial membrane potential loss in H2O2-induced C6 glial cell death.
Cells were treated with 1 mg/ml CMGJD for 30 min and added 100 μM H2O2 in C6 glial cells for 6 hrs. Then cells were incubated with 5 μM JC-1 for 30 min and observed under fluorescent microscopy. The data was one of the three independent experiments through each group.
A : control, B : H2O2 only, C : CMGJD only and D : CMGJD + H2O2 treated group.
그러나 1 mg/ml 농도의 CMGJD을 30분 전 처리 후 동일한 농도의 H2O2를 처리한 군에서는 대조군과 비슷한 붉은색 형광이 관찰되었으며(Fig. 6D), 1 mg/ml 농도의 CMGJD 6시간 단독 처리군에서도 대조군과 비슷한 붉은색 형광을 보였다(Fig. 6C).
7. CMGJD이 H2O2에 의한 C6 신경교세포 사멸에서 리소좀 기능 장애에 미치는 영향
리소좀에 미치는 영향을 조사하기 위하여 리소좀 특이 형광 염색제인 Lysotracker를 사용하였으며, Cathepsin-B, -L 및 Lamp-1의 발현 위치와 양적 변화를 면역형광염색 및 western blot analysis로 조사하였다. 먼저 다양한 농도의 H2O2를 C6 신경교세포에 8시간 동안 처리 후 각 단백질의 발현 변화를 확인한 결과 100 uM 농도의 H2O2 처리 시Cathepsin B의 발현이 증가하였으며(Fig. 7A, B), Lysotracker와 동시 염색 시 리소좀에 존재하던 puncta form의 Cathepsin B가 세포질로 분비됨을 확인하였다(Fig. 7A).
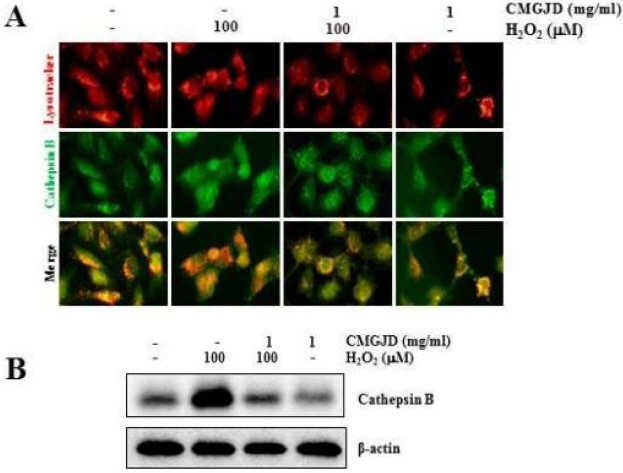
Effect of CMGJD on the expression and localization of Lysosomal Cathepsin B protein in H2O2-induced C6 glial cell death.
22 Cells were treated with 1 mg/ml CMGJD for 30 min and added 100 uM H2O2 in C6 glial cells for 6 hrs. Then cells were immunostained for lysotracker (red) and anti-Cathepsin B (green) and observed under fluorescent microscopy (A) and analyzed by Western blotting with anti-Cathepsin B and β-actin antibody (B).
그러나 1 mg/ml 농도의 CMGJD을 30분 전 처리 후 동일한 농도의 H2O2를 8시간 동안 처리한 실험군에서는 대조군과 비슷한 수준으로 Cathepsin B의 발현량이 회복되었으며, 리소좀 내에 puncta form으로 존재하여 대조군과 유사한 형태를 보였다(Fig. 7A. B). 또한, 1 mg/ml 농도의 CMGJD을 8시간 단독 처리한 군에서는 대조군과 비슷한 양상의 puncta form과 발현량을 보였다(Fig. 7 A, B).
Cathepsin L과 Lamp-1의 발현 변화를 조사한 결과, 다양한 농도의 H2O2를 8시간 동안 처리 시, Cathepsin L의 발현량은 변화가 없었으나 Lamp-1의 발현량은 증가하였으나(Fig. 8 A, B), 1 mg/ml 농도의 CMGJD을 30분 전 처리 후 100 uM 농도의 H2O2를 처리한 군에서는 대조군과 비슷한 수준으로 Lamp-1의 발현량이 감소되었으며, 1 mg/ml 농도의 CMGJD을 8시간 단독 처리한 군에서는 대조군과 비슷한 양상을 보였다(Fig. 8C).

Effect of CMGJD on the expression and localization of Lysosomal Cathepsin L and Lamp-1 protein in H2O2-induced C6 glial cell death.
Cells were treated with 1 mg/ml CMGJD for 30 min and added 100 uM H2O2 in C6 glial cells for 6 hrs. Then cells were immunostained for Cathepsin L (green) and Lamp-1 (red) and observed under fluorescent microscopy (A) and analyzed by Western blotting with anti-Lamp-1 and β-actin antibody (B and C).
8. CMGJD이 H2O2에 의한 C6 신경교세포 사멸에서 오토파지에 미치는 영향
H2O2가 오토파지 경로에 미치는 영향과 CMGJD의 보호 효과를 조사하기 위해 western blot analysis로 관련 단백질의 발현 변화를 확인하였다. 25, 50, 100 및 200 uM 농도의 H2O2를 12시간 처리 시, 100 uM 농도의 H2O2 처리군에서 LC3 II의 발현이 증가하였으며, 200 uM 농도의 H2O2 처리군에서는 LC3 II의 발현이 현저하게 증가되었다. NBR1은 H2O2 농도에 의존적으로 발현이 감소되었으며, p62의 발현 변화는 관찰되지 않았다(Fig. 9A).
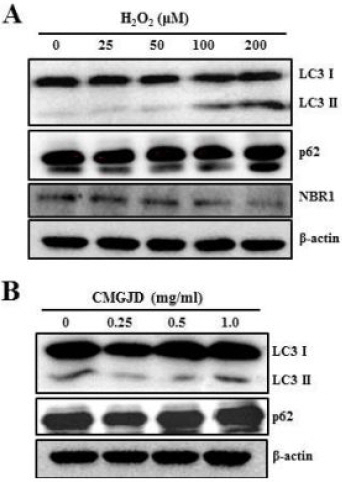
Effect of CMGJD on autophagy-related protein expression in H2O2-induced C6 glial cell death.
A : Cells were treated various concentration of H2O2 in C6 glial cells for 12 hrs. B : Cells were treated with 1 mg/ml CMGJD for 30 min and added 100 uM H2O2 in C6 glial cells for 12 hrs. Then cells were immunoblotted for LC3I/II, p62, NBR1 and β-actin.
또한, 1 mg/ml 농도의 CMGJD을 30분 전 처리 후 100 uM 농도의 H2O2를 12시간 처리한 군에서는 대조군과 비슷한 수준으로 LC3 I/II, p62 및 NBR1의 발현량이 유의하게 회복되지는 않았으며 (Fig. 9B), 1 mg/ml 농도의 CMGJD 12시간 단독 처리 시, LC3 I/II, p62 및 NBR1의 발현 변화는 없었다(Fig. 9C).
9. CMGJD이 H2O2에 의한 C6 신경교세포 사멸에서 지질대사체 변화에 미치는 영향
퍼록시좀의 기능 이상을 확인하기 위하여 western blot analysis와 GC-MS로 각각 조사하였다. 먼저, 다양한 농도의 H2O2를 10시간 동안 처리한 결과, 50 uM 농도의 H2O2에서 퍼록시좀 막구성 단백질인 PMP70의 양이 감소하기 시작하였으며, 특히, 100 uM 군에서는 PMP70의 양이 현저하게 감소하여 퍼록시좀의 수가 감소함을 시사하였다. 이때 ACOX1의 발현 변화는 관찰되지 않았다(Fig. 10A).
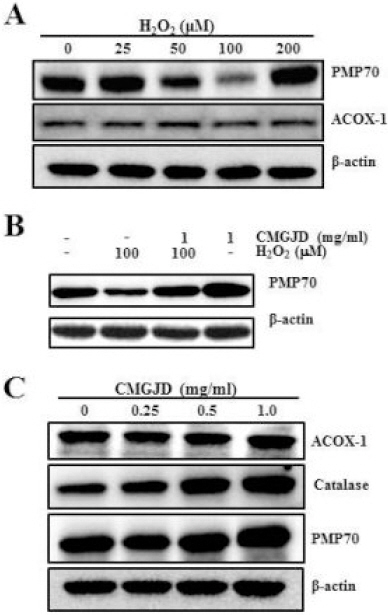
Effect of CMGJD on peroxisome-related protein expression in H2O2-induced C6 glial cell death.
A : Cells were treated various concentration of H2O2 in C6 glial cells for 10 hrs. B : Cells were treated with 1 mg/ml CMGJD for 30 min and added 100 μM H2O2 in C6 glial cells for 10 hrs. C : Cells were treated various concentration of CMGJD in C6 glial cells for 10 hrs. Then cells were immunoblotted for PMP70, ACOX1 and Catalase.
그러나 1 mg/ml 농도의 CMGJD을 30분 전 처리 후 100 μM 농도의 H2O2를 10시간 처리한 군에서는 H2O2 처리 시 발현이 감소했던 PMP70의 발현이 대조군 수준으로 증가하였으며(Fig. 10B), 특히, 1 mg/ml 농도의 CMGJD만을 다양한 농도로 10시간 처리했을 때 Catalase 및 PMP70의 양이 농도 의존적으로 증가하였다(Fig. 10C).
다음으로 퍼록시좀에서 대사되는 긴사슬체 지방산(VLCFA)의 지질대사체 양을 GC-MS로 조사하였다. 다양한 농도의 H2O2를 10시간 처리 시 C22:0, C24:0 및 C26:0의 양이 H2O2 농도 의존적으로 증가하였으나(Fig 11A), 1 mg/ml 농도의 CMGJD 30분 전 처리 시, 증가했던 긴사슬체지방산(VLCFA)의 지질대사체 양은 대조군 수준으로 감소되었다. 이때 1 mg/ml 농도의 CMGJD을 10시간 단독처리한 군에서는 긴사슬체지방산(VLCFA)의 지질대사체 양적 변화가 관찰되지 않았다(Fig. 11B).

Effect of CMGJD on amount of VLCFA in H2O2-induced C6 glial cell death.
A : Cells were treated with various concentrations of H2O2 in C6 glial cells for 10 hrs. B : Cells were treated with 1 mg/ml CMGJD for 30 min and added 100 μM H2O2 in C6 glial cells for 10 hrs. Relative Lipid amounts were analyzed by GC-MS and normalized with control.
Ⅳ. 고 찰
허혈성 뇌손상 시 신경세포나 신경교세포를 포함한 뇌 조직 전체가 경색, 위축, 괴사하며 혈관 손상에 동반되는 혈액-뇌 관문의 기능 상실로 단백 성분의 유출, 세포막 전위 상실, 세포 내 칼슘 농도 상승, 혈관인성 부종(vasogenic edema) 등이 병발한다1. 손상 시 뇌 조직은 괴사가 빠르게 진행되는 중심부와 선택적 괴사가 일어나는 변연부로 나눠지며 기능은 정지하나 가역적으로 전기 생리학적 세포 기능 회복이 가능한 변연부에 대한 치료가 중요하다20. 흥분성 아미노산이나 free radical이 손상에 관여한다는 점에서 항산화제나 흥분성 아미노산 수용체가 치료제로 응용되고 있으며, 인지질 전구체, 칼슘 통로 차단제, 백혈구 저해제, 혈액희석법 등도 연구되고 있다3.
허혈성 뇌손상에 대한 기전 및 한약재의 보호 효과를 위한 실험적 연구로는 C6 신경교세포에서 glutamate나 활성산소종(ROS) 혹은 활성질소종(RNS)에 의한 세포사멸에 대한 四物湯21, 炙甘草湯22, 右歸飮23 등에서 세포사멸 억제 및 항산화 효과를 보고한 바 있다.
세포사멸(apoptosis)은 외부 자극에 대해 세포에 이미 존재하는 일련의 과정에 의해 세포가 사멸하는 과정으로 특히 신경계와 면역계에서 세포의 생성, 분화 및 기능과 관련이 깊다24. 현재 많은 연구들이 glutamate에 의한 세포독성이 사멸의 주요 기전이라고 시사하고 있지만, 이외에 직접적인 산화적 손상(oxidative stress)도 중요한 기전의 하나로 논의되고 있다25. 그 대표적인 원인 물질은 활성산소종(Reactive oxygen species, ROS)이다. 생리적 방어 기전으로 superoxide dismutase(SOD), Catalase와 같은 효소들이 세포 내에서 생성된 활성산소종을 제거하나, 활성산소종이 과도한 상황에서는 방어체계를 초과하여 손상을 초래하기도 한다. SOD는 세포 내 superoxide anion을 H2O2로 변화시키고, H2O2는 Catalase에 의해 세포 내 무해한 물질로 변화된다26. 한편, Heme oxygenase(HO)의 아형 중 HO-1은 heat shock protein(HSP)의 일종으로 세포가 다양한 종류의 산화적 스트레스에 노출되면 유도되어 세포를 방어하고 염증을 조절한다27.
본 연구에서는 補腎陽, 益精髓하는 鹿茸, 補血活血하는 當歸, 固精强陰, 補益肝腎, 澀精하는 山茱萸, 開竅, 散結하여 通十二經하는 麝香의 공진단에 安神, 祛痰하는 遠志, 開竅, 醒神益智하는 石菖蒲, 寧心安神하는 白茯神으로 구성된 총명탕, 補心, 補脾, 安神하는 龍眼肉 및 ≪方藥合編≫28에 근거하여 大補元氣, 寧神益智하는 人蔘을 가공한 紅蔘과 滋陰, 補精하는 熟地黃, 降氣, 調氣하는 沈香을 더하여 총명공진단(CMGJD)을 조성하였다29.
관련된 연구로 공진단의 SOD-like activity, 전자 공여능 증진 및 항산화 물질들에 대한 연구8, 배뇨근 저활동성 래트 모델의 항산화 스트레스 관련 연구9, NOS 억제 및 NO 제거에 대한 연구10,13,18, 퇴행성 신경질환과 관련한 연구15, Acetylcholine esterase 억제에 대한 연구16 등이 있으며, 총명탕과 龍眼肉 역시 항산화 효과 및 뇌신경 보호 효과30, 퇴행성 뇌 신경질환에 대한 효과가 밝혀졌다31.
이에 구성 약재의 한의학적 효능 및 실험적으로 밝혀진 효과를 기반으로 CMGJD이 허혈성 뇌손상으로 야기된 신경세포 보호에 효과적일 것으로 기대되어 H2O2에 의한 C6 신경교세포 사멸에서 CMGJD의 보호 효과 및 세포 내 소기관과 관련된 구체적인 보호 기전을 밝혀, 다양한 허혈성 뇌 신경계 질환의 예방 및 치료 가능성을 확인하고자 하였다.
최근 활성산소종 제거제가 H2O2에 의해 유도된 세포사멸에서 효과적으로 사람 신경교종을 보호한다고 보고되었다32. 본 연구에서 H2O2를 직접 C6 신경교세포에 처리 시 세포 수의 감소 및 형태 변화가 동반되는 세포사멸이 유도되었는데, 여기에 CMGJD을 전 처리한 경우 활성산소종의 생성이 현저하게 억제되어, CMGJD이 활성산소 제거능을 가진 물질로 작용할 가능성을 시사하였다. 또한 CMGJD 전 처리 시 핵의 응축 및 분절이 억제되는 점으로 볼 때, 활성산소종에 의한 세포사멸로부터 C6 신경교세포를 보호함을 알 수 있었다.
C6 신경교세포에 H2O2를 처리했을 때 세포 내 HO-1의 발현 증가와 Catalase의 발현 감소가 유도되어, 세포 내 산화적 스트레스가 세포사멸을 유도했다고 판단되었다.
또한, 미토콘드리아의 막전위 손실은 초기 세포사멸의 한 기전이며, 미토콘드리아 막전위 손실은 활성산소종의 생성에 지대한 영향을 미친다33. 이와 관련하여, H2O2를 처리하면 미토콘드리아 막 손실에 의한 기능 장애가 유래됨을 JC-1 형광 염색으로 확인하였다.
오토파지는 리소좀의 단백질이나 세포 구성요소의 분해 및 재활용에 필요한 기전으로34, 해당 경로의 deregulation이나 조절 대립유전자의 돌연변이는 퇴행성 신경질환을 유발한다35. 세포질에서 Cathepsin 단백질이 관찰되면 리소좀 기능 장애를 의미하는데, 활성산소종에 의해 유발된 리소좀의 기능장애는 Cathepsin B의 세포질 분비를 유도하고 이것이 미토콘드리아의 기능장애를 일으킨다36. 또한, Lamp-1 단백질은 리소좀 막에 위치하여 세포 내 리소좀 수를 간접적으로 시사한다37.
본 연구에서도 C6 신경교세포에 H2O2를 처리했을 때 리소좀에 존재하는 Cathepsin B가 세포질로 분비되었고, Lamp-1의 발현이 증가하여 리소좀 기능 장애가 일어났다. 그러나 CMGJD 전 처리 시 Cathepsin B의 분비와 Lamp-1의 발현 증가가 대조군 수준으로 회복되었다. 또한, H2O2 처리 농도에 의존적으로 LC3 I이 분절되어 LC3 II가 증가하였는데, LC3는 오토파고좀(autophagosome)을 형성하고 오토파지를 유도한다38. 본 연구에서는 H2O2를 처리한 C6 신경교세포에서 p62의 발현 변화가 일어나지는 않았으나 NBR1의 발현 감소가 유도되었다. 그러나 CMGJD 처리 시 H2O2에 의한 LC3 I/II나, NBR1의 발현 변화는 보호하지 못하였다. 따라서 H2O2에 의해 오토파지 기전이 일부 유도되나, 이는 세포사멸과 관련된 기전에 영향을 미치지 못하며 CMGJD 역시 H2O2에 의한 세포 손상은 보호하나 오토파지와 관련된 기전에는 관여하지 않는다고 해석되었다.
퍼록시좀은 very long chain fatty acids(VLCFA), branched chain fatty acids(BCFA), D-amino acids, and polyamines의 분해, 활성산소종의 환원 및 plasmalogens의 합성을 담당하는 세포 내 소기관으로, 그 양과 기능이 세포 내 지질대사 및 활성산소종의 생성에 중요한 역할을 담당한다39. 본 연구에서는 퍼록시좀에 존재하는 단백질 PMP70의 발현량이 H2O2 농도 의존적으로 감소하여, 세포 내 퍼록시좀 수의 감소가 Catalase의 양적 변화를 초래하였다고 판단되었다. 이 때 지방산의 β-oxidation을 담당하는 ACOX-1의 발현 변화는 관찰할 수 없었다. 또한, 퍼록시좀 기능 확인을 위하여 GC-MS 방법으로 지질대사체, C22:0, C24:0 및 C26:0의 양을 측정한 결과, 3종류의 VLCFA의 양이 증가하였다. 즉, 퍼록시좀의 기능 저하에 의해 대사되지 못한 VLCFA의 양이 H2O2 농도에 의존적으로 증가한 것으로 퍼록시좀의 양적 감소와 비례하는 결과를 보였다. 그러나, CMGJD 전 처리 시 H2O2에 의한 퍼록시좀의 양적 감소 및 기능 저하에 의한 대사체 증가는 대조군 수준으로 회복되었다. 또한, CMGJD 단독처리 시에도 농도 의존적으로 Catalase와 PMP70의 양이 증가하였다. 이는 CMGJD에 의하여 퍼록시좀의 biogenesis나 fission이 초래되었을 가능성을 시사하는 것으로, 향후 이와 관련한 추가적인 실험연구가 요구된다. 또한, ACOX-1은 그 발현 변화뿐 아니라, 효소 활성 역시 중요하므로, H2O2 처리 및 CMGJD 전 처리에 의한 ACOX1의 활성 변화 여부의 확인이 요구된다.
이상의 결과를 요약하면, CMGJD은 H2O2에 의한 C6 신경교세포의 세포사멸 기전에서 HO-1의 발현 증가와 Catalase의 발현 감소를 억제하였고, 미토콘드리아 막전위 손실을 보호하였다. 또한, 리소좀의 기능 장애는 억제하였으나 LCI/II 및 NBR1에 의한 오토파지 기전에는 관여하지 않았다. 특히, 퍼록시좀의 양적 증가를 유도하여 활성산소종에 의한 세포 손상으로부터 보호하였다. 따라서 활성산소종에 의한 허혈성 뇌 질환의 예방 및 치료에 효과적으로 활용될 수 있을 것으로 기대된다.
Ⅴ. 결 론
총명공진단(CMGJD)이 H2O2에 의한 C6 신경교세포 사멸에 미치는 보호 효과 및 신호전달 기전을 알아보기 위하여 세포생존율 및 형태 변화, 활성산소 제거능, HO-1, Catalase, 미토콘드리아 및 리소좀 기능 장애, 퍼록시좀의 양적, 기능적 변화를 관찰하여 다음과 같은 결론을 얻었다.
1. CMGJD은 H2O2에 의한 C6 신경교세포의 생존율 감소를 농도 의존적으로 억제하였다.
2. CMGJD은 H2O2에 의한 C6 신경교세포 사멸에서 활성산소 제거 효과를 보였다.
3. CMGJD은 H2O2에 의한 C6 신경교세포 사멸에서 HO-1의 발현 증가와 Catalase의 발현 감소를 억제하였다.
4. CMGJD은 H2O2에 의한 C6 신경교세포 사멸에서 미토콘드리아 막전위 소실을 억제하였다.
5. CMGJD은 H2O2에 의한 C6 신경교세포 사멸에서 Lamp-1과 Cathepsin B의 발현 증가를 억제하였다.
6. CMGJD은 H2O2에 의한 C6 신경교세포 사멸에서 PMP70의 발현 감소 및 지질대사체 생성 증가를 억제하였다.
이상의 결과로 보아 CMGJD은 H2O2에 의한 C6 신경교세포 사멸에서 세포 내 소기관 미토콘드리아, 리소좀 및 퍼록시좀의 관련 단백질 발현을 조절함으로써 세포 보호 효과를 나타내었다.
감사의 글
이 논문은 2019년도 원광대학교 일반대학원 한의학과 박사학위 논문입니다.
이 논문은 2019학년도 원광대학교 교내 연구비지원으로 수행된 연구입니다.