재발 난소암에서 자음강화탕 투여를 통한 Liposomal Doxorubicin, Carboplatin병합요법 부작용 경감 효과 1례
Reduction of Adverse Effects from Jayeumganghwa-tang for Pegylated Liposomal Doxorubicin and Carboplatin in Recurrent Ovarian Cancer
Article information
Abstract
Objective
The aim of this study was to report the effects of herbal medicine Jayeumganghwa-tang on reducing the major side effects of doxorubicin and carboplatin in the treatment of ovarian cancer.
Methods
The clinical outcomes for a 61-year-old patient treated with Jayeumganghwa-tang for the side effects of doxorubicin and carboplatin combination were recorded by self-evaluation.
Results
In the treatment of adverse events caused by chemotherapy, the administration of Jayeumganghwa-tang showed a tendency to reduce their incidence and severity.
Conclusions
This study suggests that Jayeumganghwa-tang may be a promising treatment for reducing the side effects of chemotherapy in patients with ovarian cancer.
I. 서 론
난소암은 국내 여성에서 11번째로 많은 종양이며, 전체 여성암의 2.1%를 차지하고 있다1. 60% 이상이 전이된 후에 진단되는 것으로 보고되고 있으며2, 난소암으로 진단받은 여성의 평균 5년 생존율은 약 37.6%로 알려져 있다3.
현재 난소암의 화학적 치료는 주로 백금계 항암제가 사용되며, Doxorubicin과 Carboplatin병합요법은 재발 난소암 환자에게 사용되는 치료중의 하나이다4,5. 그러나 안트라사이클린계 항암제인 Doxorubicin은 심독성, 수족증후군, 탈모, 백혈구감소증 등의 부작용을 야기할 수 있으며6, 백금계 항암제인 Carboplatin은 신독성, 간독성을 비롯하여 신경독성 및 생식독성, 골수억제, 위장독성을 비롯한 다양한 독성을 유발할 수 있음이 보고되고 있다7.
이러한 항암제의 부작용에 대한 대안으로 한의학적 중재를 통한 암 치료 및 항암치료과정에서 나타나는 합병증의 치료에 관련한 연구 및 임상활용이 점점 늘어나고 있다.
종양에서 한약의 역할은 직접적인 항암효과와 함께, 이 외에도 암 자체와 암 관련 치료에 의한 부작용과 삶의 질 감소를 개선하는 데에도 있다. 여러 보고들을 통해 다양한 종양 치료 관련 부작용에서 한약의 효과가 보고되었고8-10, 항암치료를 받는 난소암 환자에서 한약이 삶의 질 개선 및 골수억제를 비롯한 부작용을 완화하며, 생존기간을 늘릴 수 있음이 보고된 바 있다11-13. 국내에서도 난소암 환자의 병기와 치료에 따른 한의학적 치료 권고안이 발표된바 있으며14, 한 연구에서도 자음강화탕의 투여가 Tamoxifen에 의한 상열감에 효과적이었다고 보고되었다15.
이러한 배경에서 저자들은 Doxorubicin에 Pegylated liposome처리를 통하여 약물전달 효율을 높인 Liposomal Doxorubicin, Carboplatin병용투여에 따른 흔한 부작용의 하나인 구내염과 안면부 상열감에 대한 지속적인 자음강화탕 투여를 통해 이러한 부작용을 경감시킬 수 있음이 시사된 1례를 보고하는 바이다.
II. 증 례
1. 대 상
본 증례는 2014년 6월 지역 대학병원에서 양측 난소종양으로 진단받고, 약 4년 2개월 동안 여러 항암요법과 한약치료를 경험하던 도중, Liposomal Doxorubicin, Carboplatin병용 요법에 의해 나타난 안면 상열감, 구내염, 피로 등의 증상을 개선하기 위해 2018년 10월 6일부터 2019년 2월 27일까지 당원에서 치료받은 김⃝⃝을 대상으로 작성되었다. 환자의 기본 정보는 다음과 같다.
1) 성 명 : 김⃝⃝, F/61
2) 진단명 : 난소암
3) 주소증 : 항암화학요법에 의한 안면 상열감 및 구내염, 피로 등
4) 내원일 : 2018년 10월 6일
5) 치료기간 : 2018년 10월 6일~2019년 2월 27일
6) 과거력 : 별무
7) 가족력 : 별무
8) 산과력 : 2-0-1-2
9) 월경력 : 폐경(만 46세)
10) 현병력 : 본 환자는 타원에서 2014년 6월, 복수(複數)의 검사를 진행하여 최종적으로 pet-CT검사를 시행한 결과 양측 난소종양(Stage IV)으로 진단되었다. 2014년 7월부터 2015년 1월까지 Carboplatin, Paclitaxel 병용요법(Neoplatin® 450 mg/Taxol® 30 mg)을 8주기 시행하였으며, 이 과정에서 2014년 9월, 복강전이에 대한 자궁, 난소난관, 대망, 림프절, 장, 복막 비장 절제술이 시행되었으며, 수술 후 소장간막에 잔류종양이 인정되었다. 이후 추적관찰중 2016년 9월, 재발이 인정되어 2016년 9월에서 2016년 12월까지 Carboplatin, Paclitaxel(Neoplatin® 450 mg/Taxol® 30 mg)병용요법이 6주기 시행되었다. 환자는 의사의 권유로 Bevacizumab 임상에 참여하였으며, 이에 유지요법으로서 Bevacizumab(Avastin® 400 mg)을 2016년 9월부터 2018년 4월까지 29회 투여받았다. 그러나 2018년 9월, 복막파종 및 간전이가 확인되어 Bevacizumab의 임상은 중단되고, Liposomal Doxorubicin, Carboplatin병용 요법(Caelyx® 20 mg/Neoplatin® 450 mg)을 받게 되었다고 한다. 이 환자는 2018년 9월의 Liposomal Doxorubicin, Carboplatin병용 요법 전까지의 항암요법 과정에서 간, 신장독성은 인정되지 않았다.
본 환자는 과거의 항암화학요법에 따라 구내염, 비출혈 등의 부작용을 경험한 바 있으며, 이에 한방의료기관을 통해 한약 엑기스제제 치료를 받아 좋은 경과를 얻었다고 하였다. 환자는 새로 시작된 Liposomal Doxorubicin, Carboplatin병용 요법에 의한 손발 저림, 감각장애, 구내염, 비강출혈, 소화장애에 대해 특히 구내염과 작열감에 대한 개선을 원하여 당원 내원하였다.
11) 계통적 문진
(1) 食慾및 消化 : 식욕 보통, 고기류 및 기름진 음식 먹을 시 소화불량
(2) 睡眠 : 淺眠 경향으로 수면 중 夜尿로 인해 2~3회 정도 각성
(3) 체 형 : 신장 170 cm, 체중 62.5 kg
(4) 顔 色 : 창백
(5) 舌 診 : 舌淡紅 齒痕 鏡面舌
(6) 脈 診 : 脈沈弱
(7) 기 타 : 手足煩熱, 上熱感, 간헐적鼻衄, 口乾, 口燥
2. 치료 방법
본 증례에서 저자들은 망문문절(望聞問切)을 통해 특히 手足煩熱, 上熱感, 간헐적鼻衄, 口乾, 口燥을 근거로 환자를 음허화동(陰虛火動)으로 변증하였고, 이를 바탕으로 환자는 2018년 9월부터 시작된 항암화학요법을 받는 과정에서 증상에 따라 건강보험제제인 신텍스자음강화탕(혼합단미엑스산)을 일 3회, 1포씩을 정량으로 복용하는 것을 원칙으로 처방하였다. 증상이 경미한 경우에는 복용을 일시 중단할 수 있도록 하였다. 이 과정에서 환자는 서양의학적인 증상완화 치료를 받지 않았음을 확인하였다.
3. 평가 방법
항암화학요법 주기에 따른 환자의 주관적인 증상을 자기기입식 NRS로 평가하였다. 증상이 없는 경우를 0점, 참을 수 없는 극심한 증상을 10점으로 두고, 환자의 현재 증상을 평가하도록 하였다. 이 과정에서 주 1회를 원칙으로 하는 규칙적인 내원을 통하여 경과를 관찰하고 환자의 자기평가기록준수 및 복약준수여부를 확인하였다. 본 환자에 대해서는 도중 자음강화탕 복용 외에 침구치료를 포함하여 별도의 치료는 시행하지 않았다.
III. 치료 결과
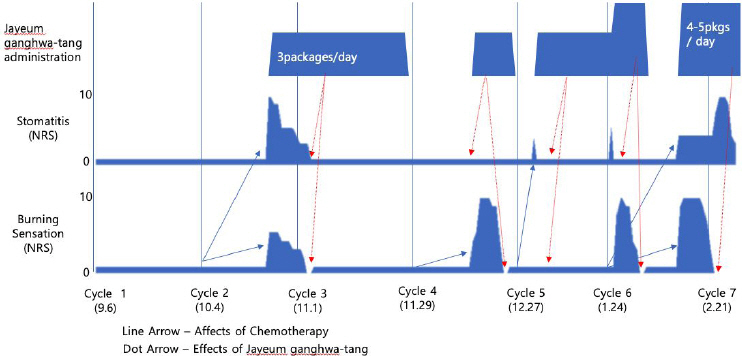
본 환자는 항암화학요법 시작 후 2주기를 지난 10월 23일에 최초로 항암요법과 관련한 구내염과 상열감을 경험하였다. 뒤이어 10월 28일부터 자음강화탕을 복용하게 되었고, 약 10일의 자음강화탕 투여로 구내염과 상열감의 소실이 확인되었다. 이후 환자는 11월 28일까지 지속적으로 자음강화탕을 복용하였는데, 도중 3주기 항암요법이 시행되었음에도 불구하고 구내염과 상열감에 대한 환자의 보고는 없었다. 환자는 4주기 항암요법에 맞추어 서는 한약 복용을 중단하였는데, 이에 다시 12월 17일 구내염과 상열감을 경험하게 되었다. 환자는 다시 12월 17일부터 12월 27일 까지 자음강화탕을 지속 복용하였으며, 이에 4주기 항암요법에 의한 부작용은 소실되는 경향을 보였다.
이러한 일련의 경과를 바탕으로 5주기 항암치료 시행 후 1월 3일 이래 환자에게 예방적으로 지속적으로 자음강화탕을 투여하도록 하였다. 이를 통해 5주기 항암에 따른 부작용을 관찰할 수 없었다. 그런데, 흥미롭게도 본 증례의 환자는 자음강화탕을 지속적으로 복용하고 있었음에도 6주기 항암요법 직후 뚜렷한 음허증상을 호소하였다. 이에 자음강화탕을 증량하여 복용하도록 하였고, 그 결과 증상의 개선을 관찰할 수 있었다.
하지만, 2월 1일 이후 자음강화탕을 복용중단한 이후, 다시 빠르게 항암관련 부작용이 나타남을 확인하였고, 이전 증량한 용량으로 자음강화탕을 다시 개시하였으나 증상의 해소가 지연되는 경향을 나타냈다. 환자는 2월 11일에 재개하여 2월 27일까지 지속된 자음강화탕 복용기간중간에 7주기 항암치료를 받았으나 항암부작용의 기간이 단축되는 경향이 나타냈다. 환자는 2019년 3월 시점에서 VAS 0-2점대를 유지하고 있다.
본 증례의 환자는 의사의 경과관찰 및 본인의 증상 평가에 따라 자음강화탕을 복용하여 대증적으로 구내염 및 안면부 상열감의 증상관리를 하였다. 환자는 2018년 9월 10일 초진 이후, 월 3-4회의 규칙적인 내원을 통해 진료와 복약에 잘 순응하는 경향을 나타냈다. 이 증례에서 환자는 항암화학요법의 시행과 관련하여 구내염 및 상열감이 나타나는 한편, 지속적인 자음강화탕의 투여에 따라 구내염 및 상열감이 감소되는 경과를 보였다. 또한, 경과에서 알 수 있듯 자음강화탕의 복용 중에는 구내염 및 상열감의 발생이 경감되는 경향을 보여, 자음강화탕이 약물의 부작용 기간을 단축시키고 중증도를 감소시킬 수 있음이 시사되었다.
이러한 증상의 변화를 통해 항암화학요법의 독성의 누적 및 한약의 작용과의 밀접한 관련성이 시사되었다. 항암화학요법의 누적과 자음강화탕 투여여부에 따른 환자 증상의 변화의 상관성에 관해서는 고찰에서 논의하였다.
IV. 고찰 및 결론
Doxorubicin과 Carboplatin의 부작용인 구강점막 독성, 말초신경병증을 비롯한 다양한 항암 치료의 부작용에 대한 대응에서 현재 서양의학적 치료는 구강위생관리를 비롯하여 냉동 요법, 저준위 레이저 요법, 구강세척제 등의 중재를 통해 접근하고 있다. 그러나 이에 대해 구강점막염의 예방 및 치료를 위한 근거기반의 치료옵션이 제한적이라는 견해가 있다17-19. 이와 관련하여 황기, 단삼, 복령 등 본초 및 보중익기탕, 황금탕 등 한약 처방들이 암 영역에서 암 치료 및 암 치료에 수반되는 독성의 감소에 효과적임을 시사하는 증거들이 늘어나고 있다16.
Doxorubicin과 Carboplatin은 구내염, 안면 작열감, 말초신경병증 등의 부작용을 야기하는 것으로 알려져있다. 구내염의 발생 기전은 항암화학요법에 의한 세포DNA의 손상에 의한 내인성손상관련 분자패턴(DAMPs)의 활성화와 염증 및 독성반응을 유발하는 것이며, 여기에는 NF-kB를 비롯한 여러 염증관련 인자들이 관여한다18. 항암화학요법에 의한 말초신경병증(CIPN)은 뉴런에 대한 세포 핵 및 미토콘드리아의 손상에 의해 발생하는 것으로 알려져 있다19.
구내염의 경우 항암화학요법 후 통상 4-5일후부터 초기 증상이 나타나며, 7-10일부터는 완연한 증상이 나타나 7-21일내 자연스럽게 소실되는 것으로 알려져 있다. 임상에서의 구내염의 평가에 대해서는 World Health Organization(WHO) 기준과 미국 National Cancer Institute(NCI)의 common terminology criteria for adverse events(CTCAE)가 널리 사용되고 있다20. 본 연구에서도 항암 주기 후 환자가 초기 증상을 호소하게 된 것이 항암 2주기 후 약 2주 후임을 고려하면 전형적인 양상으로 항암화학요법 후 구내염의 발생이 나타났음을 알 수 있다. 한편, 항암화학요법에 의한 말초신경병증은 항암요법 후 언제든 발생할 수 있으며, 항암화학요법의 누적에 따라 발생위험이 높아지는 것으로 보고되어 있다21,22.
이러한 항암화학요법 독성의 누적적 특성은 본 증례의 항암 3주기에서는 자음강화탕의 지속적 복용에 의해 구내염 및 신경병증의 발생이 예방되었으나, 6주기에서는 자음강화탕 복용에도 불구하고 발생한 높은 강도의 증상을 설명 할 수 있을 것으로 추정된다. 또한, 본 증례에서는 자음강화탕의 증량이 조절되지 않은 증상의 호전을 가져온 것을 확인할 수 있었는데, 이는 한약의 용량의존적인 작용을 시사한다.
한편, 자음강화탕 중단 후 시행한 5주기 항암요법에서 증상의 발생과 자음강화탕 투여에 의한 증상의 빠른 소실, 6주기 항암 요법에서 자음강화탕 중단 후의 증상 발생과 뒤이은 자음강화탕 투여에 의한 증상의 소실은 자음강화탕의 투여와 항암화학요법 부작용의 개선에 있어서는 밀접한 관련성이 있음을 보여주며, 한편으로는 자음강화탕의 효과 지속기간이 짧다는 것을 시사한다. 이에 대해서는 향후 자음강화탕의 항암화학요법의 부작용에 대한 효과에 있어 그 작용기전과 약리적 특성에 대한 추가적인 연구의 필요성을 제안한다.
항암제의 부작용에 대한 한약의 효과에 대한 연구들을 살펴보면 일본에서 진행된 연구들에서는 백금계 항암제에 의한 손발의 저림 등의 신경증상에 대한 우차신기환이 증상의 지속기간을 감소시키는 효과가 보고되고 있다23,24. 또한 위암 및 대장암 환자에게 반하사심탕을 투여했을 때 항암요법 유래 구강점막염에 대해 뚜렷한 효과를 나타냈고, 본 증례에서와 비슷하게 구내염의 지속기간을 감소시키는 효과가 보고되었다25.
본 증례에서는 환자의 주요 증상이 음허화동증의 번열(煩熱), 구건(口乾) 등과 유사하여, 이에 적합한 처방인 자음강화탕을 투여하였다. 자음강화탕은 작약, 숙지황, 천문동, 맥문동, 당귀, 백출, 지모, 황백, 감초로 조성된 처방으로서, 자음강화탕을 구성하는 작약, 당귀, 백출, 지모 등의 본초는 뚜렷한 항 염증 효과가 있음이 알려져있다26-29.
이러한 자음강화탕의 주요 조성 본초인 작약, 당귀, 백출, 지모를 비롯하여 청열제, 보익제 등 많은 본초 및 이를 함유한 한약이 보유한 염증 억제 작용은 특히 염증의 주요 활성 경로인 NF-kB에 대한 직간접적인 억제와 관여되어 있으며, 염증을 억제하는 것은 염증과 같은 세포의 스트레스성 사건의 진행에 따른 결과인 세포사멸을 억제할 수 있음이 알려져 있다30-32. 구내염과 말초신경병증의 발생 기전이 세포 손상 및 이에 수반되는 염증반응과 밀접한 관련을 가지며, 기존 연구에서 나타난 한약의 항암치료 부작용의 개선 효과의 하나가 항염증 효과임을 고려하면, 자음강화탕 투여를 통한 본 증례에서의 여러 증상의 개선에 있어 항염증 효과가 관여하였을 가능성이 있다33. 그러나 한약의 작용기전은 하나로 국한하기 어려우므로 본 증례에서의 자음강화탕의 효과를 설명하기 위해서는 추가적인 연구들이 필요할 것으로 사료된다.
본 증례는 다음과 같은 한계를 갖는다. 먼저, 적절한 대조군을 둔 임상연구가 아니므로 본 환자에서 나타난 임상적 개선 경과가 자음강화탕에 의한 것인지 확증하기 어렵다. 그러나 환자가 임의로 자음강화탕을 중단한 경우에는 증상의 악화가 동반되는 한편 6, 7주기에서 기존 치료주기에 비해 두드러지게 발현된 부작용에 있어 자음강화탕의 증량으로 증상의 소실을 경험하였으므로, 본 증례는 자음강화탕의 효과와 관련을 가질 것으로 추정할 수 있다. 또, 본 증례는 환자의 자기기입보고에 따른 연구이므로 구내염과 안면 작열감에 대한 더 객관적인 평가가 제한적이었다는 한계가 있다. 그러나 환자의 일일기록을 바탕으로 한약의 작용은 즉각적이지만, 단기지속적인 특성을 나타낼 수 있음을 관찰할 수 있었다는 강점이 있다.
또 한편으로 여러 연구들에서 항암요법과 병행한 한약투여가 암 환자의 생존 기간을 개선시킬 수 있음을 보이고 있으나, 여전히 한약과 항암제의 상호작용에 대해서는 아직 알려진 것이 많지 않은 실정이다34-38. 이에 본 증례에서 한약과 항암화학요법제와의 상호작용이 있었을 가능성을 완전히 배제하기는 어렵다. 이에 항암화학요법에 의한 독성감소에서의 자음강화탕의 효과와 안전성을 명확히 확립하기 위한 추가적인 연구들이 필요함이 제안된다.
결과적으로 저자들은 위 임상 사례를 바탕으로, 자음강화탕이 항염증작용을 비롯한 여러 한약의 약리적 효과를 통하여 구내염 및 안면 작열감의 중증도를 감소시켰을 것으로 추정하는 바이다. 연구자들은 항암부작용 완화에 있어 자음강화탕의 특성이 단기적일 수 있음을 시사하는 결과에 대해서는 향후 관심을 더욱 가질 주제가 될 수 있음을 제안한다. 또한, 자음강화탕의 Liposomal Doxorubicin, Carboplatin 병용요법에 의한 항암독성의 완화효과의 입증 및 항암요법과의 상호작용의 규명을 비롯해 난소암 치료에 있어 최적의 한약 처방의 도출을 위해서는 향후 다양한 연구의 축적이 필요할 것임을 제안한다.