FDY003의 항산화활성 및 표준화 연구
Study on Antioxidant Activity and Standardization of FDY003
Article information
Abstract
Objectives
FDY003 is a raw material for medicine consisting of a natural product that is expected to have the advantages of low side effects and high efficacy. In this study, we predict the efficacy and the standardization of the drug by method validation of anticipated index compounds and the measurement of antioxidant activity.
Methods
FDY003 is prepared by extracting and purifying 70% of ethyl alcohol (EtOH). The method validation of cordycepin and chlorogenic acid was determined by high-performance liquid chromatography-photo diode array (HPLC-PDA) and the content of FDY003 was calculated. In order to monitor the biological activity of FDY003, antioxidant activity was measured by 1,1-diphenyl-2-picrylhydrazyl (DPPH), 2,2-azino bis (3-ethylbenzothiazoline-6-sulfonic acid) (ABTS), and ferric-reducing antioxidant power (FRAP). The equivalent values of antioxidants such as trolox, ascorbic acid, gallic acid, and caffeic acid were measured by ABTS and FRAP.
Results
Chlorogenic acid and cordycepin were both found suitable for method validation in HPLC and FDY003 containing 9.92±0.50 and 17.97±0.27 μg/g, respectively. In DPPH, the electron donating ability (EDA) value of FDY003 was increased in a concentration dependent manner. FDY003 confirmed antioxidant activity by ABTS and FRAP.
Conclusions
FDY003 contains certain components including cordycepin and chlorogenic acid and has antioxidant ability by various mechanisms. Therefore, it is expected that FDY003 is capable of various physiological activities including anti-cancer activity.
I. 서 론
한약에 사용되는 주 원료는 식물, 동물 광물 등 다양한 천연물이다. 천연물에서 추출하였거나, 화학적 합성을 통한 단일성분의 의약품에 비해 천연물을 이용하여 조제되는 약은 특정성분으로서는 농도가 낮아 활성이 떨어질 수도 있지만, 낮은 농도의 특정 유효성분들의 조합을 통해 협동작용 (synergism)을 보여 효능을 증대 시키거나, 특정 독성성분들의 길항작용 (antagonism)을 통해 독성을 감소시킬 수 있기 때문에 여러 분야에 걸쳐 연구되고 있다. 특히 생리활성 중 항산화 활성은 활성산소를 억제하여 다양한 질환들의 유발을 감소시킬 수 있기 때문에 지속적인 연구가 진행되고 있다1-3. 활성산소는 현대사회의 복잡해진 환경적 요인과 환경오염, 자외선 등에서 비롯된 요인, 그리고 스트레스에 의한 요인 등으로 발생하게 되고 인체에서 활성산소가 생성되면 폐, 심장혈관계통, 콩팥, 간, 혈액, 피부, 눈 등 다양한 부위에서 질병 및 부상이 나타날 수 있다4. 활성산소에 대해 알려지면서 항산화에 대한 관심이 많아지고 다양한 제품에 항산화제가 사용되었지만, 안전성의 이유로 천연물에 포함된 항산화 물질에 대한 중요성이 높아지고 있다5. 화학적 합성을 통해 개발되어진 단일성분의 화합물 항산화제의 경우 고농도의 성분이 인체에 투여됨으로써 부작용을 일으킬 가능성이 있지만, 천연물의 경우 상대적으로 낮은 농도의 다양한 성분들이 흡수되어 부작용이 적기 때문이다. 또한, 한방에서는 전통적으로 천연물이 한약재로써 널리 사용되어져 왔고, 오랜 기간에 걸쳐 사용되어진 만큼 안전성이 입증되어 있다6.
FDY003은 금은화(Lonicerae Flos), 인진호(Artemisiae capillaris Herba), 동충하초(Cordyceps militaris)를 기반으로 기타 천연물들과 적절한 비율로 혼합하여 조제공정을 거쳐 추출한 한약 원료로써, 이미 한방병원에서 처방하고 있는 항암치료용 한약으로 항산화 활성을 통한 apoptosis 유발로 항암 효능이 뛰어나다고 알려져 있다7. FDY003에 포함된 금은화, 인진호, 동충하초는 전통적으로 오랜 기간에 걸쳐 사용되어 오면서 약재로써의 효능에 대해 잘 알려져 있을 뿐만 아니라, 최근에는 더 다양한 효능을 보이는 것으로 여러 연구를 통해 밝혀지고 있다. 금은화의 함유된 유효성분에는 caffeic acid와 quinic acid의 ester form인 chlorogenic acid가 있다8. 청열해독(淸熱解毒), 양혈지혈(凉血止血), 산풍열(散風熱)의 효능이 있다고 알려져 있고, 항염증, 혈소판 활성억제, 면역증강의 약리작용이 있다고 알려져 있으며9, 항산화 효과도 있다는 연구결과가 있다8. 또한 최근에는 U937 혈액암세포에 일으키는 효과에 대한 연구10와 쥐를 이용한 항 당뇨병 효과에 대한 연구가 보고되었다11. 인진호는 청리습열(淸利濕熱), 퇴황달(退黃疸)의 효능이 있는 것으로 알려져 있다. 또한 간 기능 향상, 지질저하, 혈압저하, 항미생물 등의 약리작용이 있다고 알려져 있다12. 인진호도 항산화에 대한 연구결과가 있으며13, 최근에는 인진호 추출물이 간암에 항암효과를 보인다는 세포실험14과, 영지와 함께 사용했을 때, 아토피피부염에 효과가 있다는 것을 동물실험15으로 증명한 연구도 보고되었다. 동충하초는 high performance liquid chromatography(HPLC)로 정량분석하면 cordycepin이 함유되어 있다는 연구결과가 있다16. 여러 종류의 동충하초 중에서 약으로써 효능이 있다고 밝혀진 것은 C. militaris와 C. sinensis가 있으며, 고대로부터 결핵, 천식, 자양강장제 등에 사용되어 왔다17. 동충하초는 면역을 억제한 쥐의 면역과 항산화를 높일 수 있다는 연구18와, 대식세포인 RAW264.7 세포주에서의 항염 효과19와 간암, 방광암 등 여러 암세포에 대한 항암 효과20에 대한 연구가 보고되어 있다.
본 연구에서는 이미 한방병원에서 처방중인 FDY003의 효능을 확인하기 위해 뛰어난 항산화능을 가지고 있는 대표적인 항산화제들과 비교하고 그 정도를 측정하였으며, 분석법 밸리데이션을 통해 선정된 지표성분의 정당성을 확인하여 품질관리에 기틀을 마련하고자 하였다.
II. 재료와 방법
1. 시료 및 기기
정량분석 실험에 사용된 Cordycepin, Chlorogenic acid 표준품은 SIGMA-ALDRICH社(미국, 미주리)에서 구입하였다. 이동상으로 사용된 Acetonitrile (ACN)과 Water는 HPLC Grade로 Honeywell社 (미국, 뉴저지)의 제품을 사용하였고, Formic acid는 Junsei Chemical社(일본, 도쿄)에서 구입하였다. 항산화 실험에 사용된 1,1-diphenyl-2-picrylhydrazyl (DPPH)는 ALFA ASEAR社(미국, 메사추세츠)에서 구입하였으며 2,2-azino bis(3-ethylbenzothiazoline-6 -sulfonic acid)(ABTS), Potassium persulfate, C2H3NaO2 ⋅3H2O, 2,4,6-Tri(2-pyridyl)-s-triazine(TPTZ), FeCl3⋅6H2O, Trolox, Ascorbic acid, Gallic acid, Caffeic acid는 SIGMA-ALDRICH社(미국, 미주리)에서 구입하였다. 동결건조기는 일신바이오베이스社(경기, 양주)의 Lyoph-Pride03 모델을 사용하였고 감압농축기는 EYELA社(일본, 도쿄)의 N-2110 모델이었다. Microplate reader는 Biotek社(미국, 버몬트)의 EPOCH2 모델을 사용하였으며 HPLC는 Shimadzu社 (일본, 교토)의 LC-20A, CBM-20A, LC-20AT, SIL-20AC, CTO-20AC, DGU-20A5R, SPD-M20A, LC-PDA 모델을 사용하였다.
2. 원료 및 추출
본 연구에 사용한 금은화, 인진호, 동충하초는 그린명품제약(경기, 남양주)에서 구입하였으며 자체적으로 검증 후 사용하였다. 금은화, 동충하초, 인진호를 총 300 g으로 분말화 한 후 3 L의 70% EtOH로 3시간 환류추출 하였다. 추출액을 여과한 후 감압농축기로 농축시킨 액을 1 L의 80% EtOH로 녹여내고 잘 섞이도록 1시간 동안 교반하고 냉침 후 여과하였다. 동일한 과정으로 90% EtOH 처리한 후 최종적으로 모든 용매를 증류수로 치환하여 동결건조 하였다. 건조가 완료된 분말은 실험 전까지 냉동보관 하였다. FDY003의 에탄올 추출물의 최종 수거율은 5.40%였다.
3. 분석법 밸리데이션
식품의약품안전처의 ‘의약품 등 시험방법 밸리데이션 가이드라인’, 생약(한약) 제제의 성분프로파일 설정 가이드라인’에 따라 특이성, 직선성, 검출한계(Limit of detection, LOD), 정량한계(Limit of quantification, LOQ), 정밀성, 정확성을 평가하였다. FDY003의 지표성분으로 선정된 Cordycepin 분석은 Zhou 등의 분석방법21을 응용하여 실시하였다. 이동상은 10% MeOH 을 사용하였으며 260 nm 의 파장을 이용하였다. Chlorogenic acid 분석은 송 등의 분석방법22을 응용하였으며, ACN(A)과 0.1% (v/v) formic acid 가 함유된 water(B)를 사용하여 (A)/(B)=10/90(0분)→15/85(10분)→17/83(20분)의 기울기 조건으로 330 nm에서 측정하였다. 컬럼오븐은 35 ℃로 하였다. 분석에 사용된 컬럼은 C18 ODS(25 cm * I.D 5.0 μm, Agilent, 미국, 캘리포니아) 이었고, 유속은 1 ml/min으로 유지하였다.
1) 특이성
FDY003를 HPLC로 성분분석하고 Cordycepin과 Chlorogenic acid 에 해당하는 peak의 머무름 시간(retention time, RT)과 해당 peak의 190~800 nm까지의 흡수 spectrum을 각각의 표준품들과 비교하였다.
2) 직선성, LOD, LOQ
Cordycepin 0.64, 1.28, 6.4, 12.8, 64 ppm 농도의 표준액과 Chlorogenic acid 0.265, 0.53, 2.65, 5.3, 26.5 ppm 농도의 표준액을 각각 증류수에 녹여 준비하고, 농도별 각 3회 반복 실험하였다. 검량선을 구하고, 검량선으로부터 직선성의 상관계수(R2)를 구하여 직선성을 확인하였다. LOD와 LOQ는 표준편차와 검량선의 기울기에 근거하는 방법으로 구하였으며, 식은 아래와 같다.
LOD=3.3* σ/S
LOQ=10* σ/S
σ : y 절편의 표준편차, S : 검량선의 기울기
3) 정밀성과 정확성
Cordycepin 4, 8, 16 ppm 농도의 표준액과 Chlorogenic acid 2.65, 5.3, 26.5 ppm 농도의 표준액을 증류수에 녹여 준비하였다. 농도별 각 3회 반복 실험하여 상대표준편차(RSD, %)를 구해 반복성을 측정하여 정밀성을 평가하였고, 회수율(%)을 구하여 정확성을 평가하였다.
4. 항산화 활성측정
1) DPPH
전자공여능(Electron Donating Ability, EDA) 을 측정하기 위하여 FDY003을 2.0, 1.0, 0.5, 0.25, 0.125, 0.0625 mg/ml의 농도로 준비하였다. EtOH에 용해시킨 0.2 mM의 DPPH 용액과 여러 농도의 FDY003을 동량으로 혼합한 후 37 ℃에서 30분간 반응시키고 517 nm의 microplate reader로 흡광도를 측정하였다13. 다음 식에 따라 Electron Donating Ability(EDA)를 계산하였다.
EDA(%)={(음성대조군 흡광도-시료의 흡광도) /음성대조군 흡광도}×100
2) ABTS
ABTS를 이용한 항산화 활성은 7.4 mM 농도의 ABTS 용액을 암소에서 하루 동안 방치하여 ABTS+를 형성시키고 732 nm 파장에서 흡광도 값이 1.5 이하가 나오도록 희석하였다. ABTS+ 용액 190 μl와 샘플 10 μl를 혼합하고, 실온에서 10분간 반응시킨 후, 750 nm 파장에서 흡광도를 측정하였다3. 샘플은 0.5, 1.0 mg/ml 농도의 FDY003이며 표준물질은 Trolox, Ascorbic acid, Gallic acid, Caffeic acid를 사용하였으며 모두 1.95, 3.91, 7.81, 15.63, 31.25, 62.50, 125.00, 250.00, 500.00, 1000.00 μg/ml의 농도를 사용하였다. 각각을 측정하여 표준곡선을 그리고 물질의 흡광도 값을 대입하여 계산하였다. 표준곡선의 R2 값은 0.95 이상을 유효값으로 설정하였다.
3) Ferric Reducing Antioxidant Power(FRAP)
철이온의 환원력을 측정하는 FRAP는 pH 3.6인 300 mM acetate buffer와 HCl 40 mM을 용매로 제조한 10 mM TPTZ solution, 20 mM FeCl3·6H2O solution을 10:1:1 비율로 혼합한 FRAP 용액 280 μl와 실험용 샘플 20 μl를 혼합하고 37 ℃에서 4분 배양 후 593 nm에서 흡광도를 측정한 방식을 사용하였다22. 표준물질로는 Trolox, Ascorbic acid, Gallic acid, Caffeic acid를 사용하였으며 ABTS와 동일한 농도로 하여 표준곡선을 그리고 농도별 FDY003의 흡광도 값을 대입하여 계산하였다. 표준곡선의 R2 값은 0.95 이상을 유효값으로 설정하였다.
III. 결 과
1. 분석법 밸리데이션
1) 특이성
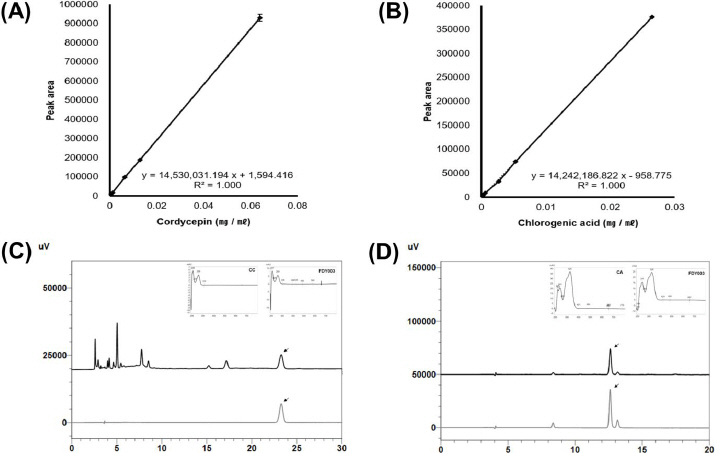
Cordycepin과 Chlorogenic acid는 각각 17.10, 12.62 min에서 retention time(RT)이 형성되었다. 해당 시간대 peak의 흡수 spectrum을 확인한 결과 두가지 지표성분 모두 각각의 표준품과 동일한 위치에서의 최대흡수 spectrum을 보여 동일한 물질로 간주하였다(Fig. 1).
2) 직선성, LOD, LOQ
직선성에서 Cordycepin과 Chlorogenic acid는 3회 반복 실험결과 모두 1.0의 R2값을 얻을 수 있었다(Fig. 1). y절편의 표준편차와 기울기 값을 이용해 계산한 결과 cordycepin의 LOD는 0.39 μg/ml 이었고, LOQ는 1.17 μg/ml이었다. Chlorogenic acid의 LOD는 0.11 μg/ml이었고, LOQ는 0.33 μg/ml이었다(Table 1).
3) 정밀성과 정확성
Cordycepin의 상대표준편차(relative standard deviation, RSD)는 4, 8, 16 ppm별 각각 0.90, 0.10, 1.84%이었으며, 회수율은 각 100.44, 99.67, 98.04% 였다. Chlorogenic acid의 RSD(%)는 2.65, 5.3, 26.5 ppm 별 각 3.30, 1.08, 0.24%이었으며, 회수율은 각 95.6, 102.5, 99.9%의 결과를 보였다. 모든 결과는 5% 이내의 오차범위로 지표성분으로 선정하기에 합당하였다(Table 2).
4) FDY003의 지표성분 함량
분석법 밸리데이션으로 지표성분으로서의 정당성을 확립한 후 해당 표준곡선에 FDY003의 분석 면적값을 대입하여 함량을 구하였다. Cordycepin 함량은 9.92±0.50 μg/g이었으며 Chlorogenic acid 함량은 17.97±0.27 μg/g이었다.
2. 항산화 활성
FDY003의 DPPH를 이용한 전자공여능 측정결과 0.0625, 0.125, 0.25, 0.5, 1.0, 2.0 mg/ml의 농도에서 각각 0±0%, 2.14±6.43%, 22.35±6.73%, 37.04±10.72%, 92.76±2.14%, 196.22±4.90%의 농도 의존적인 EDA값을 보였다(Fig. 2). ABTS 측정결과 FDY003 0.5 mg/ml, 1 mg/ml은 각각 Trolox 75±16.67 μg/ml, 228.33±18.93 μg/ml에 해당하는 항산화 활성을 가지고 있었으며(Fig. 3(A)), Ascorbic acid 15.97±2.70 μg/ml, 40.84±3.07 μg/ml(Fig. 3(B)), Gallic acid 1.39±0.70 μg/ml, 7.83±0.79 μg/ml(Fig. 3(C)), Caffeic acid 25.13±3.23 μg/ml, 54.81±3.66 μg/ml와 동일한 활성을 나타냈다(Fig. 3(D)). Trolox의 R2 값은 0.99, Ascorbic acid는 0.99, Gallic acid는 0.98, Caffeic acid는 0.99 로 높은 직선성을 보여 유효한 값으로 인정하였다(Fig. 3). FRAP 측정결과 FDY003 0.5 mg/ml, 1 mg/ml은 각각 Trolox 76.14±7.52 μg/ml, 179.47±3.94 μg/ml(Fig. 4(A)), Ascorbic acid 19.85± 4.10 μg/ml, 76.21±2.15 μg/ml(Fig. 4(B)), Gallic acid 4.95±0.49 μg/ml, 11.69±0.26 μg/ml(Fig. 4(C)), Caffeic acid 20.74±1.45 μg/ml, 40.74±0.76 μg/ml와 동일한 활성을 나타냈다(Fig. 4(D)). Trolox의 R2 값은 0.99, Ascorbic acid는 0.99, Caffeic acid는 0.99, Gallic acid는 0.99로 높은 직선성을 보여 유효한 값으로 인정하였다(Fig. 4).

DPPH radical scavenging ability of FDY003. FDY003 had electron donating ability in a concentration dependent manner in DPPH measurement.
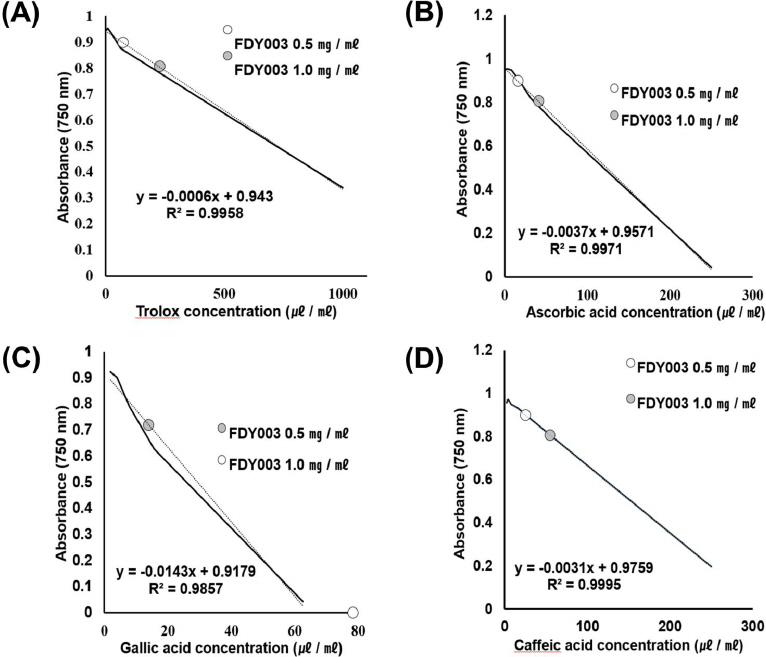
Anti-oxidation of FDY003 by ABTS assay. (A) Compare FDY003 with trolox equivalent, (B) Compare FDY003 with ascorbic acid equivalent, (C) Compare FDY003 with gallic acid equivalent, (D) Compare FDY003 with caffeic acid equivalent Black line was the standard curve for the antioxidant. White circle was 0.5 mg/ml and gray circle was 1.0 mg/ml of FDY003.
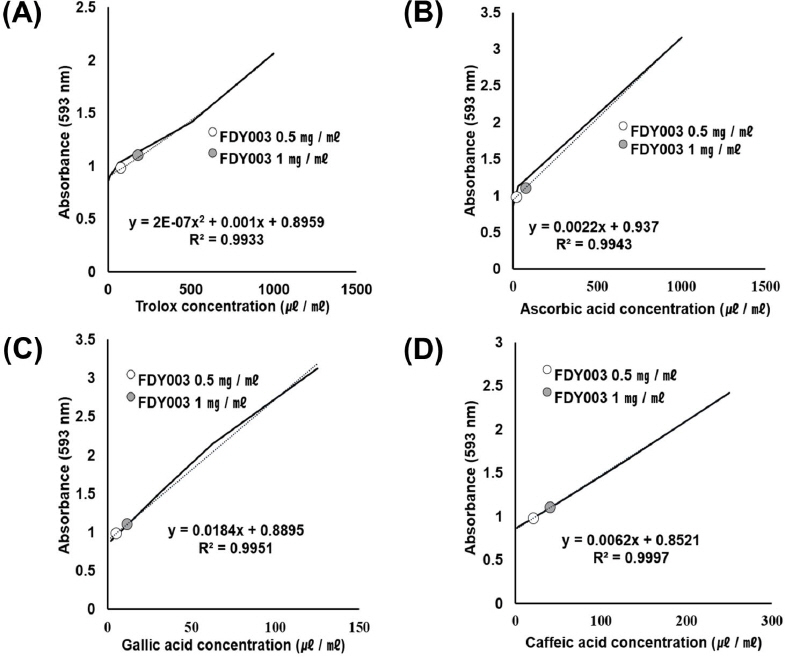
Anti-oxidation of FDY003 by FRAP assay. (A) Compare FDY003 with trolox equivalent, (B) Compare FDY003 with ascorbic acid equivalent, (C) Compare FDY003 with gallic acid equivalent, (D) Compare FDY003 with caffeic acid equivalent Black line was the standard curve for the antioxidant. White circle was 0.5 mg/ml and gray circle was 1.0 mg/ml of FDY003.
IV. 고찰 및 결론
한약에 대한 수요는 지속적으로 증가되고 있으며 이에 따라 한약도 근거중심으로 유효성, 안전성, 안정성과 관련된 연구가 요구되고 있다23. 이에 본 연구에서는 FDY003이라는 물질명을 가진 한약의 지표성분을 설정하고 그에 대한 정당성을 위하여 분석법 밸리데이션을 진행하였다. 정량분석 결과 FDY003은 Cordycepin 9.92±0.50 μg/ml, Chlorogenic acid 17.97±0.27 μg/ml를 함유하고 있었고 해당 성분들은 분석법 밸리데이션에서 모두 정당하게 확인되었다(Fig. 1). Cordycepin은 n-butanol로 추출하였을 때 81.98±1.37 mg/g로 가장 높은 추출율을 보인다는 보고24가 있었으며 금은화의 경우 Chlorogenic acid는 환류냉각기를 이용한 열수추출방식으로 80% EtOH로 80 ℃에서 2시간 추출했을 때, 동일한 방식에서 물, 20%, 40%, 60%, 100% EtOH의 추출용매만 달리해서 추출한 것에 비해 가장 높은 함량인 31.8 mg/g을 보인다는 보고가 있었다22. 하지만 본 연구 물질인 FDY003은 단일물질로서의 정제법으로 조제한 것이 아니라 다양한 유효성분들로 이루어진 한약이기 때문에 인체에 독성이 있는 유기용매를 제외하고 물과 주정만을 이용한 추출법으로 연구가 진행되었다. 해당 추출법으로 추출하여도 지표성분들이 정량분석이 가능한지 확인한 결과 모두 가능하였다. Cordycepin은 동충하초에서 직접적인 유효성분이자 지표성분으로 손색이 없다고 알려져 있으며 chlorogenic acid는 금은화의 지표성분으로써 자주 지목되는 성분이지만, 인진호에서도 추출되는 성분이기에 인진호와 금은화를 모두 함유하고 있는 FDY003에서 지표성분으로 선정하였다. 활성산소에 의한 산화스트레스는 암을 비롯하여 노화와 관련된 여러 질환의 발생기전에 관여하고 있다. 종양세포의 경우 여러 가지 항암치료법에 의해 apoptosis가 발생될 때 활성산소는 그를 방해하는 역할을 하기도 하여 활성산소를 제거하는 것은 암치료에도 도움이 된다25. 이러한 기전에 입각하여 FDY003은 한방병원에서 처방중인 항암약물로 항산화활성을 통해 암세포에게 apoptosis를 유발시킨다고 보고되어 있다7. 이에 본 연구에서는 항산화 활성을 측정하는 다양한 기법과 다양한 항산화제를 비교하여 FDY003의 항산화능 정도를 확인하려 하였다. DPPH radical 소거활성은 ascorbic acid, butylated hydroxyanisole(BHA) 같은 항산화력을 가진 물질들에 의해 환원되어 자색이 탈색되는 정도를 측정하는 방법이다. 활성라디칼에 전자를 공여하여 지방질 산화를 억제시키는 지표로 사용되고 또한 인체내에서 활성 라디칼 의한 노화를 억제하는 작용의 지표로도 이용된다26-29. FDY003은 농도의존적으로 EDA가 증가하여 항산화활성을 통해 약리활성을 보일 수 있다는 가능성이 있었다(Fig. 2). ABTS radical 소거활성은 화학적 반응에 의해 생성된 청록색의 ABTS radical cation이 시료 내의 항산화 물질로부터 수소를 제공받아 안정한 물질로 변화됨에 따라 탈색되는 성질을 이용하는 실험법이다. ABTS는 지용성 및 수용성 물질의 소거활성을 모두 측정할 수 있으며, DPPH에 비하여 pH 변화에 민감하게 작용되지 않아 정확도가 높다. DPPH는 free radical을 측정하며 ABTS는 cation radical을 측정하므로 두 종류의 radical 소거 활성을 모두 측정할 필요가 있다30,31. FRAP는 시료 중에 있는 환원력이 있는 물질이 Fe3+를 Fe2+로 환원시키고 이때 발생하는 흡광도를 측정하는 항산화측정법이다. radical 소거능을 측정하는 다른 항산화 측정법과는 기전상 차이가 있는 방법이다32,33. 본 연구에서 ABTS와 FRAP 측정의 결과값은 비슷한 경향을 보였다(Fig. 3, 4). 이전 보고와 같이 FDY003은 다양한 항산화능을 가지고 있어 항암 처방으로서의 가능성을 확인할 수 있었다.
한방산업이 발달함에 따라 안전한 양질의 약을 환자들에게 공급하기 위하여 한약의 품질관리의 필요성이 대두되고 있다. 동일한 처방을 조제시마다 동일하게 유지하기 위하여 지표성분의 함량검사는 필수적이며 그에 따라 지표성분설정이 우선시되어야 한다. 이에 본 연구에서는 FDY003이라는 한약의 지표성분을 설정하는 연구를 진행하였으며 또한 약의 3대 요소 중 하나인 유효성의 검증을 위한 모니터링으로 항산화 활성 실험을 진행하였다. 본 연구에서 FDY003은 생리활성이 있고, 지표성분의 설정이 가능한 것으로 판명되었다. 추가적으로 FDY003의 항산화능을 기반으로 항암활성뿐 아니라 다양한 항암 효능들을 세부적으로 연구 진행할 필요가 있으며 이러한 노력들은 효능에 대한 근거를 마련하는 한약의 과학화를 이끌고 나아가 한방산업의 발전에 기여할 수 있기를 기대한다.