항암화학요법으로 인한 증상에 대한 반하사심탕의 효과 : 체계적 문헌고찰
The Effect of Banhasasim-tang in the Treatment of Chemotherapy-induced Symptoms: A Systematic Review
Article information
Abstract
Objective:
The purpose of this study was to investigate (using a systematic review) the effect of Banhasasim-tang in the treatment of chemotherapy-induced symptoms.
Method:
A systematic review was conducted to identify the effect of Banhasasim-tang for chemotherapy-induced symptoms. Electronic databases were used, including such as PubMed, Cochrane, CNKI, Wanfang, CiNii, J-STAGE, NDSL, and OASIS. Among others, the main search terms included “cancer”, “Banhasasim-tang”, “Banxia Xiexin Tang”, and “Hangeshashin-to”. This study only included randomized controlled trials (RCTs).
Results:
A total of 14 RCTs were selected. They all identified the effect of Banhasasim-tang in the treatment of chemotherapy- induced symptoms such as nausea, vomiting, and diarrhea. In addition, five of the studies evaluated the preventive effect of Banhasasim-tang on the symptoms.
Conclusion:
An analysis of 14 RCTs showed that Banhasasim-tang for chemotherapy-induced symptoms might be effective not only for treatment but also for prevention. However, due to the low quality and number of the selected original articles, the significance of this conclusion is somewhat limited. It is hoped that more systematic and rigorous clinical trials will be conducted.
I. 서 론
암은 전 세계적으로 사망의 주요 원인 중 하나이며, WHO에서 제시하는 Globocan 2018에 따르면 2018년에는 약 960만 명이 암으로 인해 사망하였다1. 암이 전 세계 사망률의 16%를 차지하는 가운데2, 우리나라의 경우 2017년 기준 전체 사망자의 약 27.6%가 암으로 인한 사망으로 보고되었다3. 이에 따라 암을 치료하기 위해 방사선치료, 수술 치료 등 많은 치료법이 개발되었고, 그 중 약물을 이용한 항암화학요법은 20세기 초반부터 개발되기 시작하여4 현재에도 널리 활용되고 있는 항암요법이다.
항암화학요법은 높은 치료율을 나타내고 있지만, 이에 수반되는 부작용은 심각한 문제를 야기한다. 항암화학요법의 가장 대표적인 부작용에는 오심, 구토, 빈혈, 백혈구 및 혈소판 수 감소, 구내염, 설사, 탈모, 생식기능의 장애 등이 있다5. 이러한 부작용은 암환자의 건강 및 생활의 질, 그리고 항암화학요법의 순응도 등에 부정적인 영향을 주어6, 항암치료와 함께 부작용을 제어하는 것이 중요 과제로 대두되었다.
한편, 반하사심탕은 ≪傷寒論≫7 <辯太陽病脈證辨治下>편 149번 조문에 최초로 기록된 처방으로, 結胸, 心下滿, 痞의 증상이 진단의 핵심이다. ≪金匱要略≫8에도 ‘嘔而腸鳴 心下痞者 半夏瀉心湯主之’로 기록되어 있으며, 이는 반하사심탕을 오심, 구토, 위하수, 위궤양, 설사 등 현대 소화기 질환에 응용하는 주요 문헌적 근거이다9. 또한 반하사심탕은 和胃降逆, 開結除痞, 鎭吐, 解熱, 消炎 및 鎭痛 등의 작용이 있는 것으로 알려져 있다10.
이에 본 연구에서는 암환자의 삶의 질 등에 큰 영향을 미치는 항암화학요법으로 인한 증상에 대한 반하사심탕의 효과를 파악하기 위해 항암화학요법으로 인한 증상을 반하사심탕으로 치료한 무작위 임상연구를 대상으로 체계적 고찰하여 그 결과를 보고하고자 한다
II. 연구방법
1. 검색 엔진 및 문헌 검색 전략
검색 엔진은 영미권에서는 PubMed(https://www. ncbi.nlm.nih.gov/pubmed/), Cochrane library (https://www.cochranelibrary.com)를 사용하였다. 국내 논문 검색은 NDSL(National Digital Science Links, www.ndsl.kr)과 OASIS(Oriental medicine Advanced Searching Integrated System, https://oasis.kiom.re.kr), 중국에서는 CNKI(China National Knowledge Infrastructure, https://www.cnki.net/)와 Wanfang (http://www.wanfangdata.com.cn), 일본에서는 J-STAGE (Japan Science and Technology Agency, https://www.jstage.jst.go.jp)와 CiNii (https://ci.nii.ac.jp) 검색 엔진을 사용하였다.
영미권 검색 엔진 키워드는 ‘Cancer’, ‘Banhasasim-tang’, ‘Banxiaxiexintang’, ‘Banxiaxiexin-tang’, ‘Banxiaxiexin tang’, ‘Banxia xiexin tang’, ‘Banxiaxiexin’, ‘Banxia xiexin’, ‘pinellia heart-draining’, ‘DBXX’, ‘hange (shashinto)’, ‘TJ-14’ 등이었고, 국내 검색 엔진 키워드는 ‘암’, ‘반하사심탕’, ‘반하사심’이었다. 중국 검색 엔진 키워드는 ‘半夏泻心汤’, ‘癌’, ‘随机’이었고, 일본 검색 엔진 키워드로는 ‘癌’, ‘半夏瀉心湯’, ‘TJ-14’, ‘hange(shashinto)’를 사용하였다. 각 국가별 검색 엔진의 특성에 따라 검색 키워드를 조합하여 검색을 진행하였다.
검색은 2019년 8월 22일에 시행하였고, 검색 기간은 검색 엔진이 지원하는 개시 시점부터를 범위로 하였다. 언어에 대한 제한은 없었다.
2. 문헌 선정 및 자료 추출
일차적으로 선정된 문헌을 대상으로 선정 및 제외기준에 따라 문헌의 전문을 검토하여 최종 선정을 하였다. 최종 선정된 문헌에 관하여 미리 검토된 자료 추출 서식에 따라 자료를 추출하였다. 자료 추출 서식에는 환자의 질환, 성별 및 인원 수, 항암화학요법의 종류, 시험군의 중재(투여약물, 복용방법), 대조군의 중재(투여약물, 복용방법), 시험군과 대조군의 중재기간, 결과변수, 결과값, 이상반응 여부를 포함하였다.
3. 비뚤림 위험 평가
비뚤림 위험평가는 Cochrane group이 제작한 Risk of Bias(RoB)11 도구를 사용하여 수행되었다. 선택 비뚤림, 실행 비뚤림, 결과 확인 비뚤림, 탈락 비뚤림, 보고 비뚤림, 기타 비뚤림 등 각 항목에 대해 평가하여 low risk of bias(L), high risk of bias (H), unclear risk of bias(U)로 표기하였다.
III. 결 과
1. 문헌 선별
최초 246편의 문헌이 검색(PubMed 45편, Cochrane 61편, CNKI 63편, Wanfang 44편, CiNii 22편, J-STAGE 10편, NDSL 1편, OASIS 0편)되었으며, 15편의 중복 문헌을 제외하여 1차적으로 231편의 문헌이 선정되었다. 문헌의 제목과 초록을 검토하여 74편의 문헌이 본 연구 주제와 일치하지 않는 것으로 확인하여 배제하고, 2차적으로 157편의 문헌이 선정되었다. 이후 전문 검토를 통해 138편의 문헌을 배제(Non-RCT 문헌 116편, 암을 대상으로 하지 않은 문헌 14편, 반하사심탕 복합처방 문헌 3편, 반하사심탕을 경구로 복용하지 않은 문헌 3편, 대조군이 양약이 아닌 문헌 2편)하고 2차적으로 19편의 문헌이 선정되었다. 이 중 정확한 항암화학요법 종류를 밝히지 않은 문헌 4편, 증상의 변화를 관찰하기에 평가도구가 부족한 문헌 1편을 배제하여, 최종적으로 14편의 RCT 문헌이 선정되었다(Fig. 1).
2. 문헌 분석
1) 연구 대상 특성
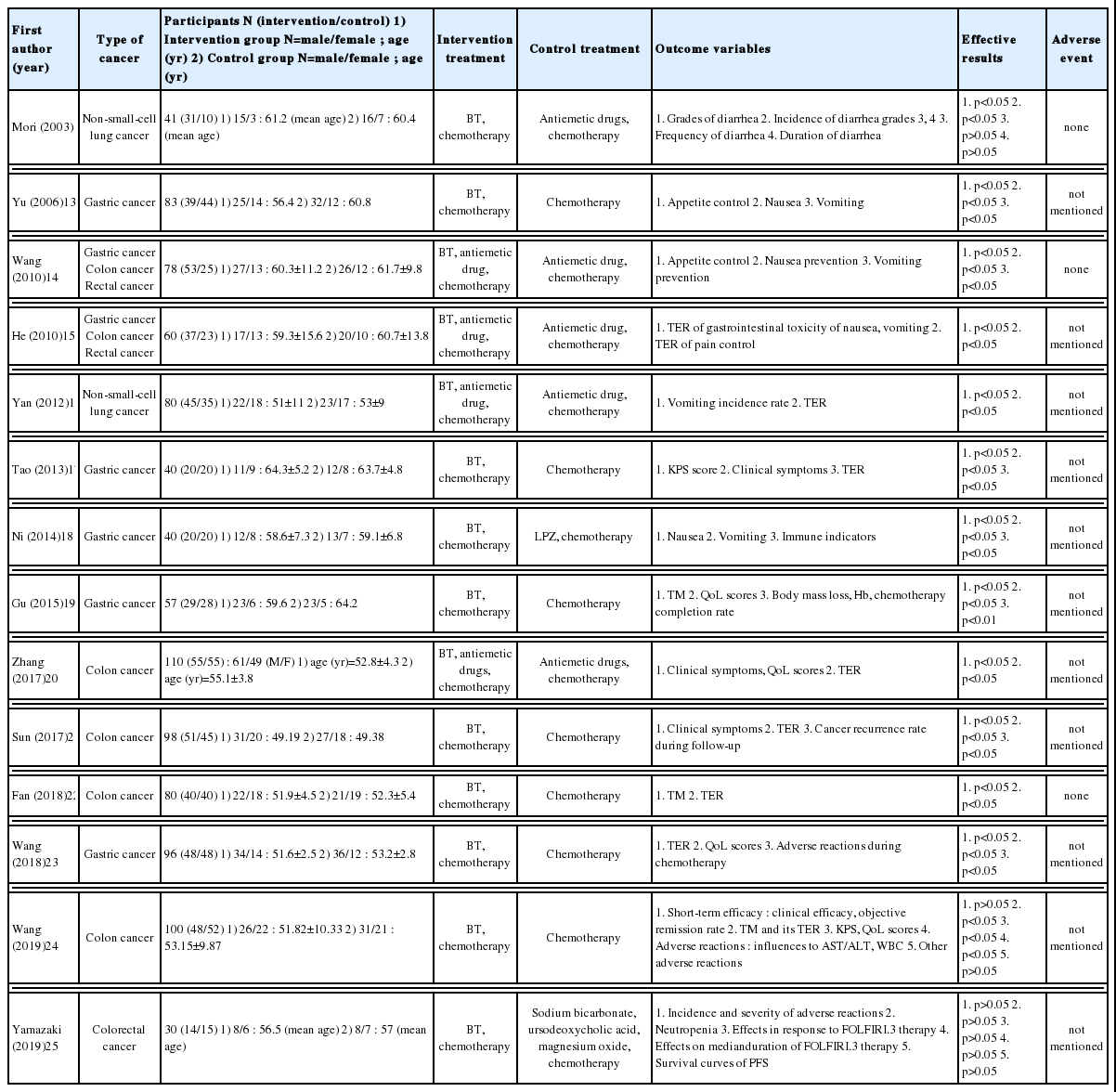
최종 선정된 14편의 문헌을 분석한 결과 암 종류 중에서는 비소세포폐암이 2편12,16, 위암이 5편13,17,18,23, 결장(직장)암이 5편20-22,24,25이었고, 위암과 결장(직장)암 환자를 동시에 모집하여 연구를 진행한 문헌이 2편14,15이었다. 변증을 같이 진단에 사용한 문헌은 5편으로, 변증은 脾胃濕熱 1편17, 寒熱錯雜 4편20-22,24이었다. 한편, 항암화학요법으로 인한 증상에는 식욕저하 4편13,14,16,18, 오심 구토 3편13-15, 설사 1편12, 암성 통증15 1편 등이 있었다(Table 1).
2) 치료 기간
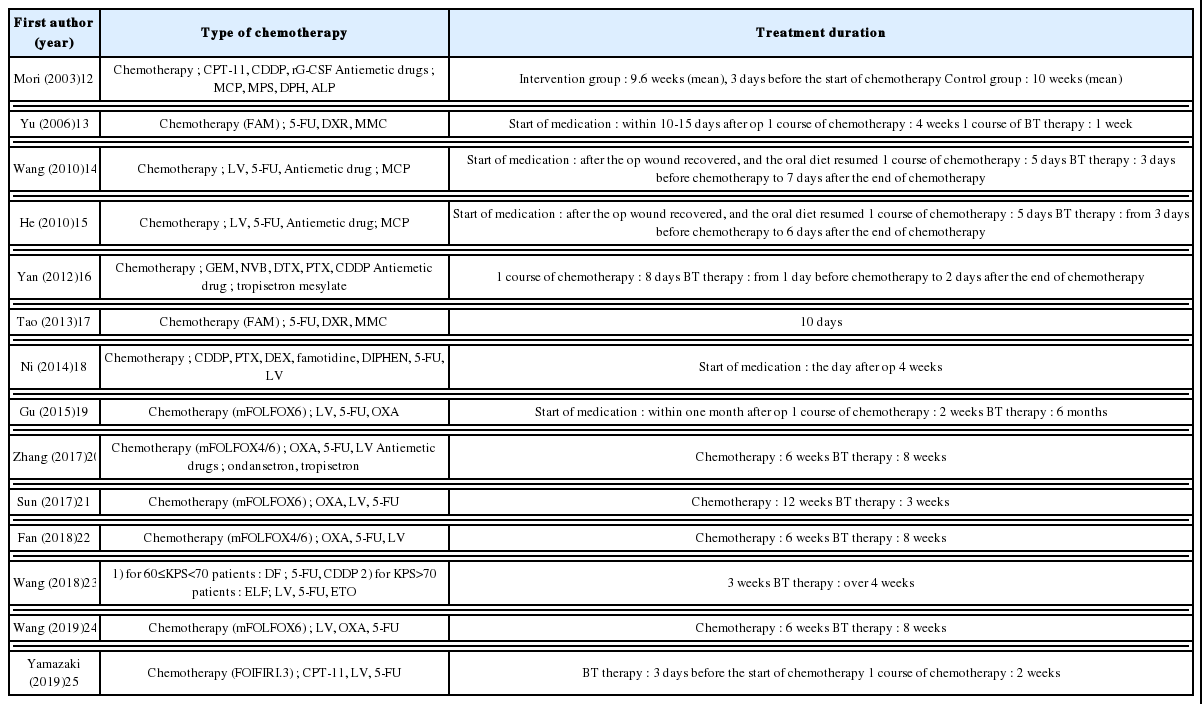
항암화학요법 치료 기간은 5일14,15, 8일16, 10일17, 2주19,25, 3주23, 4주13,18, 6주20,22,24, 9.6주12, 12주21 순으로 길었고 6주가 3편, 5일과 2주, 4주가 각 2편순으로 많았다(Table 2
3) 시험군 및 대조군 설계
14편 문헌 모두 시험군과 대조군에 항암화학요법을 동시에 시행한 연구였다. 이 중 대조군에만 항구토제를 투여하여 비교한 문헌은 2편12,15, 위장약을 투여한 문헌은 2편18,25, 항암화학요법만 단독 시행한 문헌은 7편13,17,19,21-24이었다.
항암화학요법 조합 중 FAM regimen(5-FU, DXR, MMC)은 2편13,17, mFOLFOX6 regimen(LV, 5-FU, OXA)은 5편19-22,24, mFOLFOX4 regimen(OXA, 5-FU, LV)은 2편20,22, DF regimen(5-FU, CDDP)은 1편23, ELF regimen(LV, 5-FU, ETO)은 1편23, FOLFIRI.3 regimen(CPT-11, LV, 5-FU)은 1편25이었다. 나머지는 항암화학요법 조합에 대해 별도로 언급하지 않았다.
4) 평가도구
선정 문헌에서는 평가도구로 총유효율(Total effective rate, TER), 항암화학요법 기간 중의 부작용, 변증 증후(Traditional medicine, TM), 임상 증상, 삶의 질(Quality of Life, QoL) 등을 사용하였다. 6편의 문헌16,17,20-23에서 총유효율을 보았고, 3편의 문헌23-25에서 항암요법기간 중의 부작용을 보았으며, 3편의 문헌19,22,24에서 변증 증후를 관찰하였고, 3편의 문헌17,20,21에서 임상 증상을 관찰하였다. 또한, 4편의 문헌19,20,23,24에서 삶의 질에 대한 관찰을 진행하였다.
6) 치료 결과
오심 구토를 평가한 연구는 3편13-15이었고, 모두 통계적으로 유의성이 있다고 나타났다(p<0.05). 특히 He15의 연구에서는 항암화학요법과 항구토제를 투여한 대조군에 비해 항암화학요법과 반하사심탕을 투여한 시험군에서 현저한 유효율을 보였다(p<0.05).
반하사심탕을 항암화학요법 시행 전에 투여한 연구는 총 5편이었다12,14-16,25. 그 중 Wang(2010)14, He15, Yan 등16의 연구에서는 오심 구토의 예방 효과를 평가하였으며, 모두 통계적으로 유의성이 있음이 확인되었다(p<0.05).
한편, Mori 등12의 연구에서는 설사의 발생률, 정도, 빈도 및 기간을 평가하였는데, 설사의 빈도 및 기간은 통계적으로 유의성이 없었고 (p>0.05), 3도와 4도의 설사의 발생률과 정도에서는 통계적 유의성이 나타났다(p<0.05).
반면, Wang 등(2019)24의 연구에서는 전체적인 임상 증후는 완화되었지만, 반응률(treatment response)을 조사하여 Complete response(CR), Partial response (PR), Stable disease(SD), Progressive disease(PD), Overall response rate(ORR) 등을 비교한 결과 대조군과 유의한 차이를 보이지 못했다(p>0.05).
7) 연구의 비뚤림 위험 평가
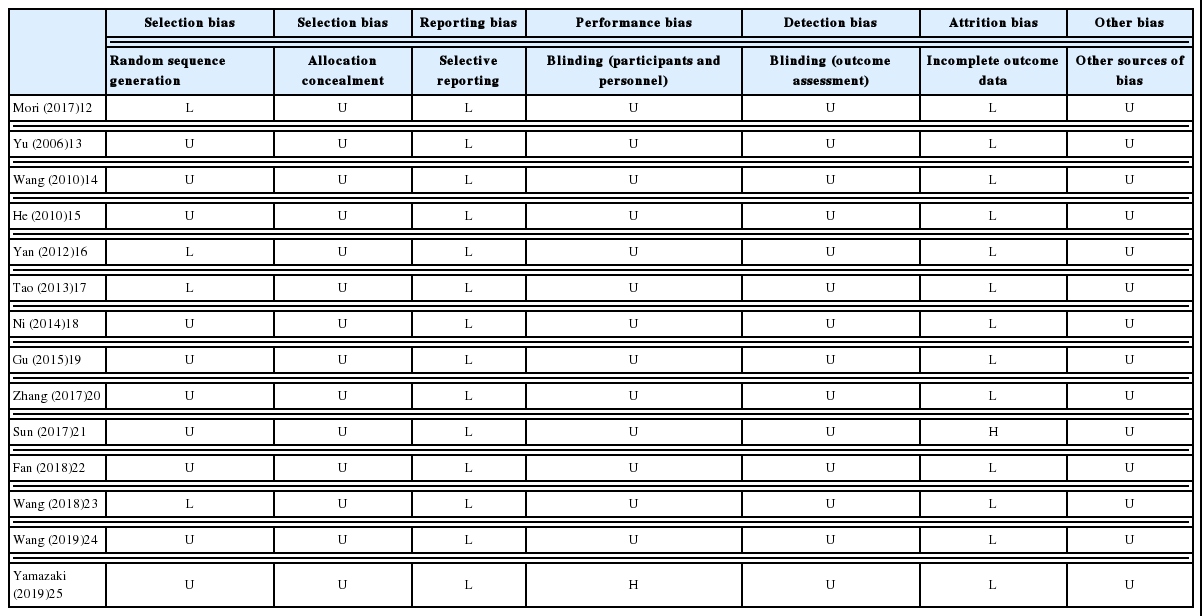
Cochrane의 RoB 도구를 활용하여 최종 선정된 14편의 문헌을 평가하였다. 선택 비뚤림에서 4편의 문헌12,16,17,23이 무작위 배정순서 생성에서 ‘낮음’에 해당하였고, 그 외 10편13-15,18-22,24,25이 ‘불확실’에 해당하였으며, 배정순서 은폐에서 14편 모두 ‘불확실’에 해당하였다. 보고 비뚤림에서는 14편 모두 ‘낮음’에 해당하였다. 실행 비뚤림에서 문헌 1편15이 ‘높음’에, 13편은 ‘불확실’에 해당하였다. 결과 확인 비뚤림은 14편 모두 ‘불확실’에 해당하였으며, 탈락 비뚤림은 1편21이 ‘높음’, 13편이 ‘낮음’에 해당하였다. 기타 비뚤림은 14편 모두 ‘불확실’에 해당하였다(Table 3
IV. 고찰 및 결론
항암화학요법을 받고 있는 암환자의 대부분이 다양한 부작용을 겪고 있지만, 아직까지 뚜렷한 효과를 보이는 예방법이나 치료법은 없는 실정이다. 한의학에서도 항암화학요법으로 유발되는 다양한 증상을 완화하기 위한 연구들이 보고되었다29-32. 하지만 대부분의 연구가 항암화학요법으로 인한 증상 중 한 두 가지만을 고찰한 것에 비해 본 연구는 항암화학요법으로 인한 부작용 증상을 포괄적으로 살펴보고자 하였다.
한편, 반하사심탕은 임상에서 급성위장염, 만성위염, 소화불량, 위궤양 등의 질환에 사용할 수 있는데33, Jeon 등34의 연구에서 반하사심탕의 소화기계통 증상만이 아닌 다양한 임상분야에 적용될 가능성을 시사했다.
이에 본 연구는 항암화학요법으로 인한 증상에 대한 반하사심탕의 효과를 확인하기 위하여 문헌 검색을 토대로 체계적 문헌고찰을 진행하였다. 항암화학요법에 반하사심탕을 병용 투여한 RCT 연구는 총 14편 확인되었으며, 이를 토대로 문헌 분석을 진행하였다.
그 중 2편12,16이 비소세포암 환자를 대상으로 한 연구였다. Mori 등12의 연구는 시험군에 항암화학요법과 반하사심탕을 병용하였고, Yan 등16의 연구는 시험군에 항암화학요법, 반하사심탕과 함께 항구토제를 투여하였다.
Wang(2010)14과 He15의 연구는 위암과 결장(직장)암 환자를 동시 모집한 연구이고, 항암화학요법, 반하사심탕, 항구토제를 병용 투여했다는 점에서 치료방법이 동일했다. 하지만 Wang(2010)14의 연구는 반하사심탕을 식욕저하와 오심 구토의 예방을, He15의 연구는 항암화학요법 후의 오심 구토와 암성 통증 억제에 대한 총유효율을 평가도구로 설정했다는 점에서 차이를 보였다.
위암 환자를 대상으로 한 문헌은 5편13,17-19,23이었다. 그 중 Yu 등13의 연구는 항암화학요법에 반하사심탕을 투여한 연구이고, Ni18의 연구는 항암화학요법에 반하사심탕과 위장약인 Lansoprazole을 병용 투여하여 비교한 연구이다. 한편, Yu 등13, Tao17, Gu19, Wang 등(2018)23의 연구들은 항암화학요법에 반하사심탕을 병용하여 시험군을 설정한 연구라는 공통점이 있다. 하지만 평가도구가 각각 식욕저하와 오심 구토13, KPS 점수, 임상 증상과 총유효율17, 변증 증후, 삶의 질 및 체중감소, 헤모글로빈, 항암화학요법 완성도19, 총유효율, 삶의 질과 항암화학요법 동안 발생한 부작용23이라는 차이가 있었다.
결장암 환자만을 연구대상으로 한 문헌은 총 4편20-22,24이었다. 그 중 Zhang 등20의 연구는 항암화학요법과 반하사심탕, 항구토제를 병용 투여하였고, Sun21, Fan22, Wang 등(2019)24의 연구는 항구토제를 투여하지 않았다. 그러나 세 연구의 평가도구 간의 차이가 있어 비교에 어려움이 있었다.
이와 같이 본 연구의 대상으로 선정된 문헌을 분석한 결과, 데이터의 이질성이 발생하여 메타분석을 시행하기 어려운 점이 있었다.
문헌 분석 결과 항암화학요법과 반하사심탕의 병용 치료는 대조군에 비해 식욕저하, 오심 구토, 설사 및 삶의 질 등의 평가도구에 대해 통계적으로 유의한 결과를 보였다.
식욕저하를 평가도구로 사용한 Yu 등13의 연구는 식욕저하에 대해 대조군의 완치율 40.9%에 비해 시험군에서 완치율 69.2%으로 차이를 보였고, Wang(2010)14의 연구 또한 대조군의 완치율이 28.9%인 것에 비해 시험군의 완치율은 52.5%로 나타났다.
한편, 오심 구토와 관련된 문헌 중 Yu 등13의 연구는 오심 구토 완치율이 대조군은 40.9%, 시험군은 71.8%라고 밝혔다. Wang(2010)14은 항암화학요법 시행 전에 반하사심탕을 투여한 결과, 오심의 완치율이 대조군은 55.3%, 시험군은 77.5%였고, 구토의 완치율은 대조군이 50.0%, 시험군이 62.5%로 확인되었다. He15의 연구도 오심 구토의 완전억제율이 대조군에서 36.7%, 시험군에서 76.7%로 드러났다. Yan 등16의 연구에서 구토발생률은 대조군과 시험군 각각 57.5%, 27.5%로 차이를 보였다. Ni18의 연구에서 치료 이후 구토가 없다고 답변한 대상자는 대조군 40.0%, 시험군 75.0%였다.
식욕저하, 오심 구토를 평가도구로 사용한 연구는 많았으나, 설사를 평가도구로 사용한 연구는 1편이었다. Mori 등12의 연구 결과 반하사심탕은 설사의 정도와 발생률에서는 유의한 완화 효과를 나타냈다(p<0.05). 하지만 설사의 빈도 및 기간은 유의하게 낮추지 못했다(p>0.05).
삶의 질을 평가도구로 관찰한 연구19,20,23를 확인한 결과, Gu19와 Zhang 등20의 연구 모두 치료 전후의 삶의 질이 대조군에서는 현저한 차이를 보이지 않았으나, 시험군에서 현저한 차이를 보였다고 밝혔다(p<0.05). Wang 등(2018)23의 연구에서 삶의 질이 올랐다고 답변한 환자의 비율이 대조군은 25.0%, 시험군 52.1%로 확인되었다.
본 연구에서 체계적 문헌고찰을 시행한 결과 반하사심탕과 항암화학요법의 병용은 암환자의 삶의 질을 효과적으로 향상시키고, 식욕저하, 오심 구토 및 설사 등의 부작용을 감소시키며 임상 효과를 갖는 것으로 보인다. 따라서 본 연구에서는 항암화학요법으로 인한 소화기계통 증상의 예방 및 치료에 반하사심탕 투여를 적극적으로 권장한다. 하지만 연구 중 발생한 반하사심탕의 부작용의 유무에 대해 언급한 문헌의 수가 적으므로 항암화학요법과 반하사심탕 병용투여의 안전성에 대한 추가적인 연구가 필요할 것으로 사료된다.
다만 암은 질병의 특수성으로 인하여 암 환자를 대상으로 한 RCT 연구가 이루어지기에는 많은 어려움이 따른다. 이중맹검으로 Terminal stage의 환자에게 위약을 배정하거나 추적관찰을 오랜 기간 시행하는 것이 현실적으로 제약을 많이 가지기 때문에 본 연구의 최종 선정된 RCT 문헌의 수가 적었다. 또한 반하사심탕의 임상적 활용이 소화기계통 증상에 국한되어 있어 항암화학요법으로 인한 제반 증상을 체계적으로 살펴볼 수 없었다는 점에서 제한점을 갖는다.
본 연구는 항암화학요법으로 인한 증상이 있는 환자를 대상으로 반하사심탕의 효과 입증을 위한 체계적 문헌고찰을 수행하였으며, 일부 한계가 있었지만 항암화학요법으로 인한 증상의 예방 및 치료에 반하사심탕의 유의한 효과를 확인했다는 점은 참고할 만한 가치가 있다고 사료된다. 향후에는 보다 많은 양질의 RCT 연구 수행이 이루어져 체계적 문헌고찰과 메타분석 연구가 수행되길 기대하는 바이다.
감사의 글
본 연구는 한국보건산업진흥원을 통해 보건복지부 「한의약선도기술개발사업」의 재정 지원을 받아 수행된 연구임(HB16C0023).