厚朴이 ob/ob 마우스의 대사성 염증과 인슐린 저항성에 미치는 영향 및 관련기전에 대한 연구
The Effect of Magnolia Bark on the Metabolic Inflammation and Insulin Resistance of ob/ob Mice
Article information
Abstract
Objective
This study was undertaken to investigate how magnolia bark extract affects ob/ob mouse in terms of metabolic inflammation and insulin resistance.
Methods
Leptin-deficient ob/ob mice were divided into 2 groups (n=5): a normal saline treatment (=control) and magnolia bark treatment. Wild type mice were the lean group (n=5). After 5 weeks, we measured fasting blood sugar (FBS) and conducted oral glucose tolerance tests (OGTTs) in each group. After 6 weeks, we measured body weight, epididymal fat pad weight, liver weight, serum glucose, serum insulin, and gene expression of tumor necrosis factor-α, interferon-γ, and interleukin-6. We characterized the phenotype of adipose tissue macrophages (ATMs) and analyzed fractions of the phenotype in each group by flow cytometry.
Results
In the magnolia bark group, fasting blood sugar, oral glucose tolerance levels, and insulin resistance (HOMA-IR) were significantly decreased. The population and proportion of ATMs among leukocytes in adipose tissue were significantly decreased in the magnolia bark group. The population and proportion of M1 type ATMs among ATMs were significantly decreased in the magnolia bark group. Gene expression of tumor necrosis factor-α was significantly decreased in the magnolia bark group.
Conclusions
These results support a positive effect of magnolia bark on metabolic diseases such as insulin resistance and metabolic inflammation in leptin-deficient ob/ob mice.
I. 서 론
비만은 지질대사 뿐 아니라, 당대사와 면역반응 등 인체 대사의 균형을 깨뜨리고 간, 이자, 근육, 심장, 관절, 중추신경계에 이르기까지 다양한 조직의 기능을 저해하는 질환으로 인식되고 있다1. 비만은 만성적인 염증상태를 유발하며, 이를 대사성 염증이라고 하는데, 지방조직에서 염증반응이 지속되면 지방세포의 분화가 저해되고, 대사기능에 이상이 발생 한다2. 또한 인슐린 저항성을 증가시키고, 혈관질환을 일으키는 등, 비만이 대사증후군으로 이행되는 과정에 중요한 단계이다3. 임상에서는 비만으로 인한 합병증을 예방할 목적으로 환자에게 항염증약물을 투여 한다4.
비만은 數食甘味, 穀氣勝元氣, 脾胃俱旺, 脾胃俱虛, 肝氣鬱結에 의해 濕, 痰의 병리적 산물이 정체된 상태이므로5, 痰濁, 濕熱, 瘀血을 해소하는 치료는 비만 자체에 대한 치료 일 뿐 아니라, 합병증의 발생을 줄이는 효과를 나타낼 것이다. 厚朴(Magnolia Bark)은 목련과(Magnoliaceae)에 속한 낙엽교목인 厚朴(Magnolia officinalis) 또는 일본목련(Magnolia ovobata)의 수피로, 性味는 溫, 苦辛하고 芳香이 있어, 行氣, 導滯, 燥濕하는 효능을 가지므로, 痰濕, 食積, 寒凝氣滯로 인한 병증에 널리 쓰인다6. 따라서 비만과 비만으로 유발된 대사증후군의 치료에 있어서 痰濕을 제거하여 積滯를 해소하고, 氣機를 소통시키려는 목적으로 응용할 수 있다. 그러나 이전까지 시행된 厚朴을 이용한 연구들 중에는 비만으로 유발된 대사성 염증과 인슐린 저항성에 미치는 영향에 대한 연구는 없었다.
이에 본 저자는 렙틴유전자 결핍 동물 모델(ob/ob mouse)에 厚朴 추출물을 경구 투여한 후, 체중과 내장지방의 무게, 혈당, 혈중 인슐린 농도, 인슐린 저항성, 지방조직 내 면역세포의 비율, 지방조직 내 염증반응과 관련된 유전자의 발현정도 등의 변화를 관찰하였고, 다음과 같은 유의한 결과를 얻었기에 보고하는 바이다.
II. 실험방법
1. 검체의 제조
厚朴(Magnolia Bark) 1,000 g을 80% 에탄올 1,500 ml에 넣어, heating mantle에서 2시간 동안 가열하여 추출한 후, applicator를 이용하여 500 ml 플라스크에 넣고 filter로 걸러냈다. 걸러진 여과액을 rotary evaporator로 건조시키고, 동결 건조된 厚朴 추출물을 실온에서 보관하였다. 厚朴의 최종 수거율은 5.68%였다.
2. 실험동물의 준비
실험에는 6번 염색체에 존재하는 렙틴 유전자의 열성 돌연변이로 인해 렙틴 결핍을 나타내는 C57BL /6J-Lep ob/ob mouse(중앙실험동물, Korea)와 렙틴 유전자가 발현되는 야생형의 C57BL/6J mouse(중앙실험동물, Korea)를 이용하였다. 5주령의 실험동물을 구매한 후, 40~70%의 습도가 유지되며, 낮과 밤이 12시간씩 교대되는 환경에서 1주일간 사육하여 적응기를 거친 후, 2주간 ob/ob mouse에서 비만이 유발되는지 확인하는 관찰기를 거쳤다. 실험동물 모두 일반 식이를 자유롭게 섭취하도록 하였다(Table 1).
3. 실험군 배정 및 연구 계획
야생형의 숫컷 C57BL/6J mouse 5마리를 정상군(lean group)으로 배정하였고, 렙틴유전자 결핍을 나타내는 C57BL/6J-Lep ob/ob mouse 5마리씩을 대조군(control group)과 厚朴투여군(Magnolia group)에 각각 배정하였다. 생후 8주 후부터, 대조군에는 생리식염수를 1일 1회 800 mg/kg의 용량으로 6주간 경구 투여하였고, 厚朴투여군에는 厚朴 추출물을 1일 1회 800 mg/kg의 용량으로 6주간 경구 투여하였다. 생리식염수와 厚朴 추출물의 투여에는 경구용 바늘(oral zonde)을 이용하였고, 투약은 매일 오전에 시행하였다.
4. 경구당부하 검사(Oral Glucose Tolerance Test, OGTT)
약물투여 5주 후에 실험동물의 tail vein에서 채취한 혈액으로 strip-operated blood glucose sensor (ACCU-CHEK Performa. Australia)기기를 이용하여 검사를 시행하였다.
실험동물을 14시간 동안 금식시킨 후 공복 시 혈당을 측정하였다. 체중 kg 당 2 g의 포도당을 D.W.에 녹여 각 실험동물에 경구 투여하고, 30분 후, 60분 후, 90분 후, 120분 후 혈당을 측정하였다. 가로축을 시간(분), 세로축을 혈당(mg/이)으로 하여 OGTT curve를 그리고, 각 측정값을 연결한 선의 아래 면적을 계산하여 AUC(area under the OGTT curve)값을 구하였다.
5. 인슐린 저항성 측정
약물투여 6주 후, 정상군과 대조군, 厚朴투여군을 모두 6시간동안 금식시키고, tail vein에서 혈액을 채취한 후, 혈당을 재고, Ultra Sensitive Mouse Insulin ELISA Kit(Crystal Chem INC, USA)를 이용하여 인슐린 농도를 측정 하였다. 측정한 혈당과 인슐린 농도를 가지고, HOMA-IR(Homeostatic model assessment of insulin resistance)을 이용하여 인슐린 저항성을 계산하였다. HOMA-IR은 다음의 공식을 이용하였다.
HOMA-IR=26×공복시 혈당(mg/dl)×공복시 인슐린(ng/ml)÷405
6. 지방조직에서 기질세포(Stromal Vascular Cell, SVC)의 분리
Phosphate buffered saline(Gibco, USA)에 혼합한 2% bovine serum albumin(Gibco, USA)용액에 실험동물에서 채취한 부고환지방조직을 넣은 다음, 1~2 mm의 크기로 자르고, collagenase(Sigma, USA)와 DNase I(Roche, USA)을 넣어 분쇄한 후, 100 μm 필터로 분쇄되지 않은 지방조직을 걸러내고, 1000 rpm으로 3분간 원심분리 하였다. 하층의 pellet을 phosphate buffered saline(Gibco, USA)에 혼합한 2% Fetal Bovine Serum(Sigma, USA) 용액에 넣고, 100 μm filter를 이용하여 불필요한 조직을 재차 제거한 후, 200×g에서 10분 동안 원심분리 하여 하층에 모인 기질세포를 수거하였다.
7. 지방조직 내 면역세포에 대한 Fluorescence Activated Cell Sorting(FACS) 분석
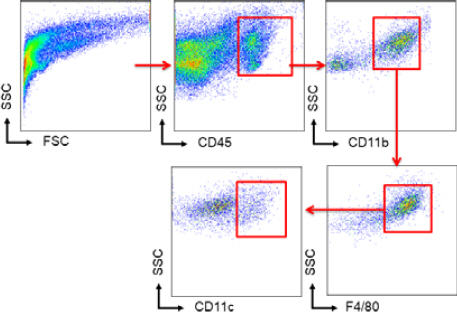
Cellometer(Nexcelom Bioscience LLC. USA)에 실험동물의 지방조직에서 분리한 기질세포의 각 샘플과 Fc Block(BD Pharmingen, USA)을 1:100의 비율로 넣고 10분간 반응시킨 다음, fluorophore-conjugated antibody를 넣고 얼음위에서 차광상태로 30분간 반응시켰다. 반응이 끝난 후, 2% FBS/PBS 용액으로 세척하고 1500 rpm으로 5분간 원심분리하고, FACS tube에 옮겨 FACSCanto(BD bioscience, USA)로 분석을 하고, 그 결과를 토대로 FlowJo(Tree star, inc, USA)를 이용하여 대식세포의 비율을 분석하였다.
CD45-APC(Biolgend, USA), CD11b-PerCP Cy5.5 (Biolgend, USA), F4/80-FITC Cy5.5(Biolgend, USA), CD11c-phycoerythrin(CD11b-PE, Biolgend, USA)를 antibody로 사용하였다.
8. 지방조직에서 RNA의 분리
약물투여 6주 후, 실험동물을 희생시킨 다음 개복하여 부고환 지방 조직을 분리하여 알루미늄 호일에 싼 후, 신속하게 액화질소에 담가 -70 °C에서 보관하였고, Mini RNA Isolation KitII™(ZYMO RESEARCH, CA, USA)를 이용하여 RNA를 분리하였다.
9. 염증성 물질의 유전자 발현 분석
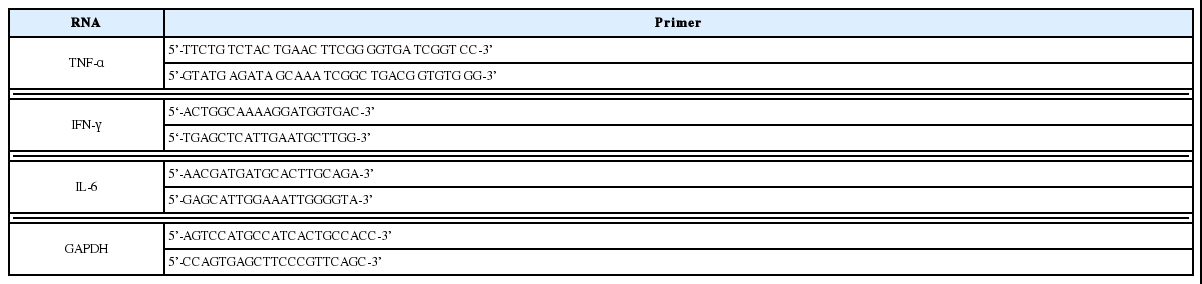
지방조직에서 Tumor Necrosis Factor-α(TNF-α), Interferon-γ(IFN-γ), Interleukin-6(IL-6)의 유전자가 발현되는 정도를 알아보기 위해, 실시간 정량 역전사 연쇄중합반응(quantitative Real time-polymerase chain reaction, qRT-PCR)을 시행하였다. qRT-PCR에 앞서 complementary DNA(cDNA)의 제작은 Advantage RT for PCR Kit(Clontech, USA)를 이용하였다. 각 반응에 사용한 primer의 염기 서열은 Table 2와 같고, GAPDH은 Housekeeping gene으로 사용하였다.
유전자 발현 분석은 SDS Software 2.4(Applied Biosystems®, USA)를 이용하였고, 이렇게 얻은 각각의 유전자에 대한 threshold cycle(CT)값을 EF-1α 기준으로 Relative Quantitation(RQ)값으로 환산한 후, fold change값을 계산하였다. fold change값은 정상군을 1로 산정하여 이에 대한 값으로 환산하여 표시하였다.
10. 통계 분석
통계 분석은 GraphPad PRISM statistical package ver 2.00(Graphpad software inc., San Diego, USA)를 이용하였고, 각 군 간의 비교는 one-way analysis of variance(ANOVA)에 이어 Tuckey’s post-hoc test로 사후 검정하였다. 각각의 수치는 평균±표준오차(mean±S.E.)로 표시하였으며, 양방 검정 유의도(Two-tailed p value)는 p값이 <0.05 수준일 때를 기준으로 하였다.
III. 결 과
1. 당대사의 변화
1) 혈당의 변화
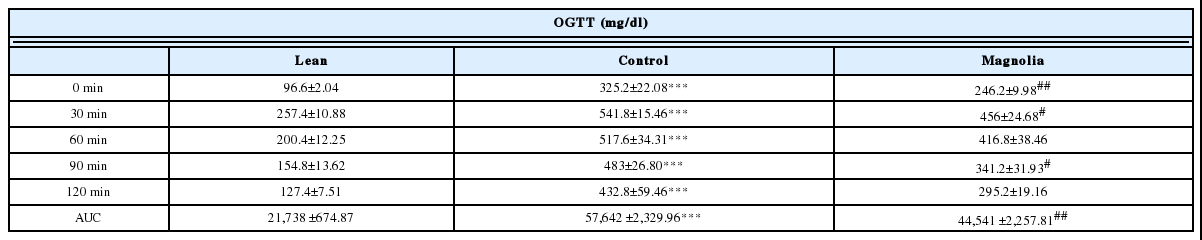
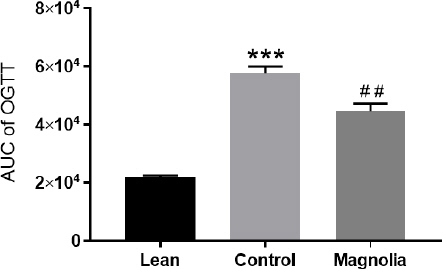
약물 투여 5주 후 실시한 경구당부하 검사에서, 대조군은 정상군에 비해 공복 시(p<0.001), 30분 후(p<0.001), 60분 후(p<0.001), 90분 후(p<0.001), 120분 후(p<0.001)의 혈당이 모두 유의하게 높았고, AUC (area under the OGTT curve)의 값도 대조군은 57,642±2,329.96으로 정상군의 21,738±674.87에 비해 유의하게 높았다(p<0.001). 厚朴투여군은 대조군에 비해, 공복시(p<0.01), 30분 후(p<0.05), 90분후(p<0.05) 혈당이 낮았고, AUC의 값도 44,541±2,257.81로 대조군에 비해 유의하게 낮았다(p<0.01)(Table 3, Fig. 1, 2).
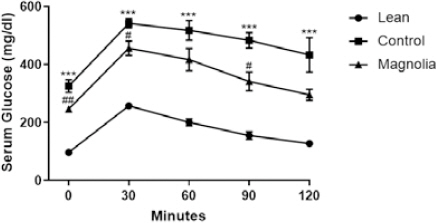
Oral glucose tolerance test of each experimental group.
* Significantly different from lean group (*** p<0.001)
# Significantly different from control group (# p<0.05, ## p<0.01)
2) 인슐린 저항성의 변화
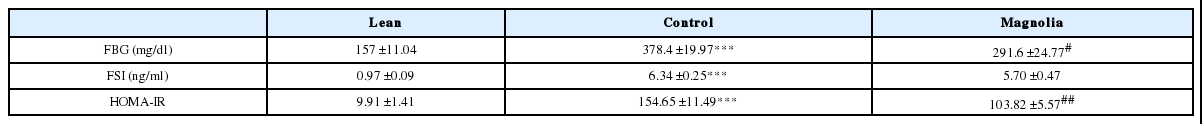
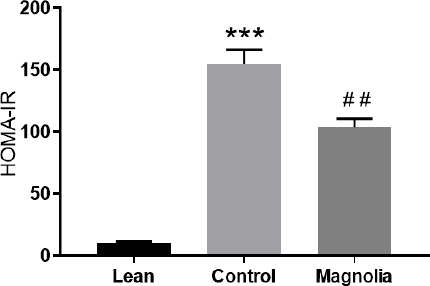
厚朴투여 6주 후 시행한 인슐린 저항성 검사에서 대조군의 공복혈당(FBG)은 378.4±19.97 mg/dl (p<0.001), 공복시 혈중 인슐린(FSI)은 6.34±0.25 ng/ml (p<0.001), HOMA-IR은 154.65±11.49(p<0.001)로 정상군에 비해 유의하게 높았다. 厚朴투여군의 FBG는 291.6±24.77 mg/dl로 대조군보다 유의하게 낮았고(p<0.05), FSI는 5.70±0.47 ng/ml로 유의한 차이가 없었지만, HOMA-IR는 103.82±5.57로 대조군에 비해 유의하게 낮았다(p<0.01)(Table 4, Fig. 3).
2. 지방조직 내 면역세포의 변화
1) Fluorescence Activated Cell Sorting(FACS) 분석
(1) CD45
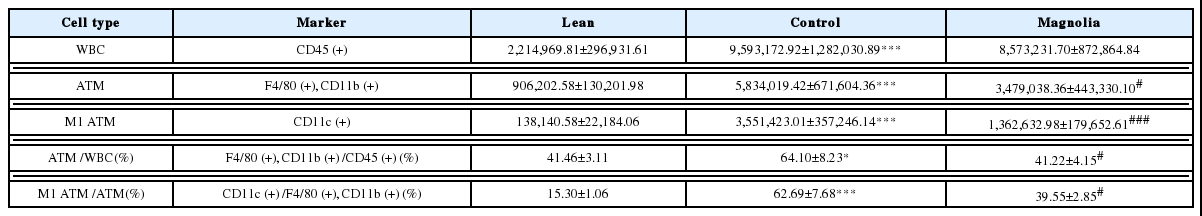
백혈구(white blood cell, WBC)의 공통항원으로 여겨지는 CD457를 가진 세포수는 대조군에서 9,593,172.92 ±1,282,030.89로 정상군의 2,214,969.81±296,931.61보다 유의하게 많았다(p<0.001). 厚朴투여군에서는 8,573,231.70 ±872,864.84로 대조군보다 적었으나 통계적 유의성은 없었다(Table 5, Fig. 4).
(2) F4/80, CD11b
지방조직 대식세포(adipose tissue macrophage, ATM)에 특이적인 표지자로 알려진 F4/80과 CD11b8,9를 가진 세포는 대조군에서 5,834,019.42±671,604.36으로 정상군의 906,202.58±130,201.98보다 유의하게 많았고(p<0.001), 厚朴투여군에서는 3,479,038.36±443,330.10으로 대조군보다 유의하게 적었다(p<0.05)(Table 5, Fig. 4, 5).
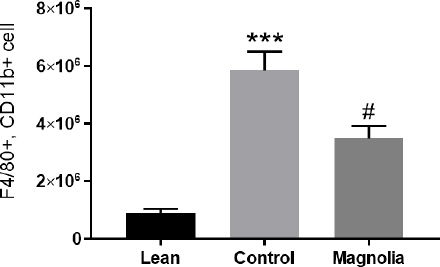
The number of F4/80 (+), CD11b (+) cells in each experimental group.
* Significantly different from lean group (*** p<0.001)
# Significantly different from control group (# p<0.05)
(3) CD11c
CD11c는 대식세포의 classic activation 단계인 M1형에서 발현되는 표면단백질로 알려져 있다10. CD11c를 가진 세포의 수는 대조군에서 3,551,423.01 ±357,246.14로 정상군의 138,140.58±22,184.06보다 유의하게 많았고(p<0.001), 厚朴투여군에서는 1,362,632.98 ±179,652.61로 대조군보다 유의하게 적었다(p<0.001) (Table 5, Fig. 4, 6).
2) 면역세포의 분포
(1) 백혈구 중 대식세포의 비율
전체 백혈구인 CD45 양성 세포 중에서 F4/80과 CD11b를 가진 세포가 차지하는 비율을 백분율로 계산해 본 결과, 대조군에서 64.10±8.23%로 정상군에서의 41.46±3.11%보다 유의하게 높았고(p<0.05), 厚朴투여군에서는 41.22±4.15%로 대조군보다 유의하게 낮았다(p<0.05)(Table 5, Fig. 7, 8).
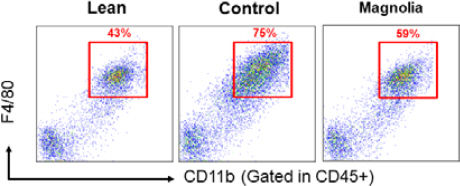
Fluorescence activated cell sorting of F4/80 (+), CD11b (+) cells in CD45+ cells in each experimental group.

The percentage of F4/80 (+), CD11b (+) cells in CD45 (+) cells in each experimental group.
* Significantly different from lean group (* p<0.05)
# Significantly different from control group (# p<0.05)
(2) 대식세포 중 M1형 대식세포의 비율
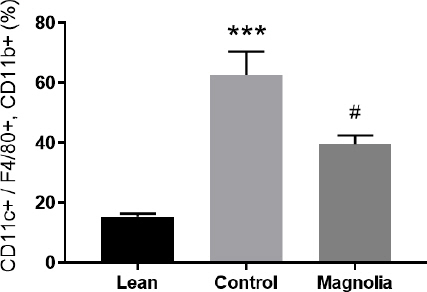
대식세포의 표지자인 F4/80, CD11b 양성 세포 중에서 M1형 대식세포를 나타내는 CD11c 양성 세포가 차지하는 비율을 백분율로 계산해 본 결과, 대조군은 62.69±7.68%로 정상군의 15.30±1.06%보다 유의하게 높았고(p<0.001), 厚朴투여군은 39.55±2.85%로 대조군보다 유의하게 낮았다(p<0.05)(Table 5, Fig. 9, 10).

Fluorescence activated cell sorting of CD11c (+) cells in F4/80 (+), CD11b (+) cells in each experimental group.
3. 염증성 물질의 유전자 발현 분석
1) Tumor Necrosis Factor-α(TNF-α)
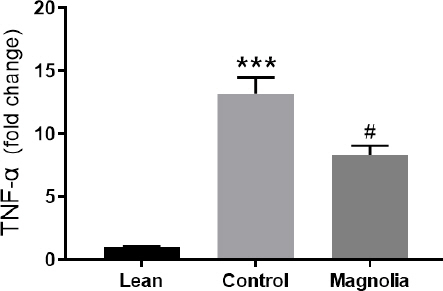
염증성 사이토카인 중, 대식세포를 활성화시키고, 활성화 된 대식세포에서 분비되기도 하는 TNF-α의 변화를 알아보기 위해, 지방조직에서 얻은 SVC에서 TNF-α의 발현 정도를 측정하고, 厚朴투여군과 대조군에서 측정한 값으로부터 정상군에 대한 fold change값을 계산하였다. 그 결과, 대조군에서 13.19±1.27로 정상군에서의 1.02±0.04보다 유의하게 높았고(p<0.001), 厚朴투여군에서는 8.30±0.64로 대조군보다 유의하게 낮았다(p<0.05)(Table 6, Fig. 11).
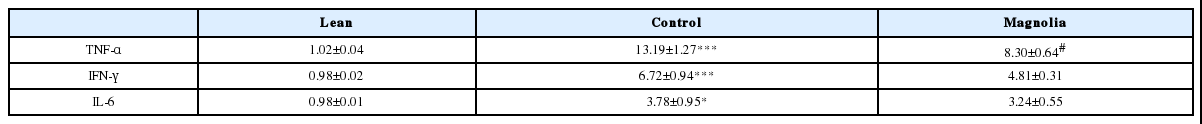
Gene Expression of Tumor Necrosis Factor-α, Interferon-γ and Interleukin-6 in Each Experimental Group
2) Interferon-γ(IFN-γ)
대식세포를 활성화시키는 작용을 하는 염증성 사이토카인으로 알려진 IFN-γ의 변화를 알아보기 위해, 지방조직에서 얻은 SVC에서 IFN-γ의 발현 정도를 측정하였고, 厚朴투여군과 대조군에서 측정한 값으로부터 정상군에 대한 fold change 값을 계산하였다. 그 결과, 대조군은 6.72±0.94로 정상군의 0.98±0.02보다 유의하게 높았고(p<0.001), 厚朴투여군은 4.81±0.31로 대조군보다 낮았으나, 통계적 유의성은 없었다(Table 6).
3) Interleukin-6(IL-6)
활성형의 대식세포에서 분비되는 염증성 사이토카인인 IL-6의 변화를 알아보기 위해, 지방조직에서 얻은 SVC에서 IL-6의 발현 정도를 측정하였고, 厚朴투여군과 대조군에서 측정한 값으로부터 정상군에 대한 fold change값을 계산하였다. 그 결과, 대조군은 3.78±0.95로 정상군의 0.98±0.01보다 유의하게 높았고(p<0.05), 厚朴투여군은 3.24±0.55로 대조군보다 낮았으나, 통계적 유의성은 없었다(Table 6).
IV. 고 찰
비만에 대한 연구가 진행되면서, 비만으로 인해 인슐린 저항성이 증가하고 대사 이상이 발생하는 과정에 염증반응이 중요한 역할을 한다는 것이 알려졌다4. 비만으로 인한 대사성 염증은 이소성 지방축적(ectopic fat deposition)을 가속화하고, 지방세포의 분화를 저해하며2, 지방세포에서 아디포사이토카인을 비정상적으로 분비 시킨다11. 특히 지방조직에 침윤되어 활성화 된 대식세포는 TNF-α, IL-6 등의 염증성 사이토카인과 케모카인을 분비하여, 비대해진 지방세포에서 과량의 아디포사이토카인이 분비되도록 하는데, 아디포사이토카인으로 인해 대식세포의 침윤이 더욱 가속화되어 지방조직 내에서 염증을 증폭시키는 악순환이 일어난다12. 또한 지방조직내 대식세포(adipose tissue macrophage, ATM)는 지방세포가 세포내로 당을 유입하는 능력을 감소시켜 인슐린 저항성을 유발하며, 제 2형 당뇨병의 발생을 촉진 한다13. 따라서 지방조직내 대식세포에 의한 염증반응을 억제하는 것은 비만으로 인한 대사성 질환의 예방과 치료에 중요한 전략이다.
한의학에서는 비만을 濕, 痰의 병리 상황으로 이해한다. 濕, 痰이 정체된 것은 비만 자체의 특징이며, 濕과 痰으로 인해 氣滯, 痰濁, 濕熱, 瘀血이 만들어진 것은 비만으로 인한 대사증후군과 혈관질환 등의 2차적인 합병증의 상태까지 포괄하는 개념이다. 따라서 한의학에서 비만 치료는 체중감량에만 국한되지 않고, 비만으로 인해 유발된 대사성 질환의 치료와 예방을 포함한다.
본 연구에 사용한 厚朴은 痰濕, 食積, 寒凝氣滯로 인한 병증에 널리 쓰이므로, 비만과 비만으로 유발된 대사증후군의 치료에 痰濕을 제거하고 積滯를 해소하여, 교란된 인체대사를 정상화 시킬 목적으로 사용할 수 있다. 약리적으로 厚朴의 정유에 함유되어 있는 Obovatol, Magnolol, Honokiol, 4-O-mrthylhonokiol 등은 항염작용과 진정작용을 한다고 알려져 있다14. 이전까지 厚朴을 이용한 연구에는 항우울효과에 대한 연구15, 항염작용과 관련하여 치주질환억제효과에 대한 연구16 등이 있었고, 厚朴에서 추출한 obovatol의 항염 효과와 항암 효과에 대한 연구17 등이 있었으나, 비만으로 유발된 대사성 염증과 인슐린 저항성에 미치는 영향에 대한 보고는 없었다.
실험에 사용한 ob/ob mouse는 6번 염색체의 렙틴 유전자에 열성 돌연변이가 발생하여 비만, 고인슐린혈증, 고혈당을 특징으로 하는 실험동물 모델로, 비만과 당뇨병의 연구에 활용 된다18. ob/ob mouse는 생후 2주 이내에 지방세포의 크기가 증가하기 시작하며, 생후 4주 정도가 되면 고인슐린혈증이 현저하게 나타난다19. 렙틴의 결핍은 인슐린 저항성과 면역기능의 이상, 혈관 질환의 발생에 동시에 영향을 미치기 때문에, ob/ob mouse 모델은 대사증후군의 초기단계에서 병이 진행되는 과정을 연구하기에 적합하다20.
세포막에서 당대사를 위한 신호 전달경로와 염증 반응의 신호 전달경로는 세포막 수용체와 세포내 신호전달물질을 공유한다13. 따라서 당대사가 교란되면 염증신호 또한 교란되고, 염증반응이 지속되면 당대사를 포함한 에너지대사가 영향을 받는다. 사람과 동물을 대상으로 한 여러 연구에서 만성적인 염증과 인슐린 저항성은 상호 인과관계가 있다는 증거들이 제시되었다21,22. 예를 들어, 비만으로 인해 지방조직에 침윤되는 대식세포(ATM)가 증가하면, 이와 비례하여 혈중 인슐린농도가 상승하는데, 이때 인슐린 수용체 작용제에 해당하는 약물을 투여하면 대식세포의 유전자 발현 정도가 감소한다21. 또한, 지방조직의 지방세포는 렙틴, 아디포넥틴(adiponectin), TNF-α, IL-6 등을 분비하여 지질대사와 인슐린 저항성, 염증반응에 동시에 영향을 미친다22. 이러한 연구 결과들을 바탕으로, 비만으로 유발된 대사성 질환에 대한 厚朴의 효과를 평가하기 위하여, 첫째, 인슐린 저항성과 당대사의 변화를 관찰하였고, 둘째, 지방조직에 침윤된 대식세포가 주도하는 염증반응의 변화를 관찰하였다.
먼저, 실험군에 厚朴을 6주 동안 투여한 후, 혈당의 변화와 인슐린 저항성을 측정하였다. 그 결과, 공복시 혈당, 당부하 30분 후 혈당, 당부하 90분 후 혈당, AUC, HOMA-IR에서 厚朴투여군의 값이 대조군의 값보다 유의하게 낮았다. 이 결과는 厚朴이 인슐린 저항성을 낮춰 당대사를 개선했음을 보여준다.
비만으로 유도된 염증은 급성염증 반응과는 다른 특징을 보이는데, 낮은 강도의 면역 반응이 지속적으로 유지되면서, 염증성 사이토카인에 의해 대사평형의 수위가 높아진다. 시간이 지나 이러한 상태가 만성화 되면, 고지혈증, 고혈당증으로 대사 평형이 이동한다22. 이렇게 비만으로 인한 염증반응은 대사증후군 발생의 핵심 기전이다23.
Weisberg 등12은 대식세포가 지방조직에 침윤 되는 과정이 대사성 염증의 진행 중 가장 중요한 단계라고 하였다. 대식세포는 상주하는 조직에 따라 특이적인 형태와 기능을 갖는데, ATM은 면역반응의 활성화 상태에 따라 classical activation과 alternative activation, 혹은 M1과 M2의 표현형(phenotype)으로 분화한다는 가설이 널리 받아들여지고 있다3. M1형은 T helper cell 1에서 분비하는 IFN-γ에 의해 활성화되어 세포내 감염원에 대한 면역반응을 하고, M2형은 T helper cell 2가 분비하는 IL-4로 활성화되어 세포외 감염원에 대한 면역을 담당한다24. 한편, ATM의 표현형은 한 가지로 고정되어 있지 않고, 상황에 따라 분화양상을 바꾸기 때문에, 조직 내에서 M1형과 M2형이 차지하는 비율이 변한다. M1형 대식세포는 TNF-α와 IL-6를 분비하는 등 염증반응을 활성화시키는 작용을 하는 반면, M2형 대식세포는 면역 반응을 조절하여 상처를 치유하고 조직을 재생시키는 등의 다양한 역할을 한다24.
선행된 연구를 보면, 비만한 개체의 지방조직에서는 M2형보다 M1형의 비율이 높다25. M1형 대식세포가 생산하는 TNF-α와 IL-6는 염증반응에 관여 할 뿐 아니라, 간세포, 근육세포, 지방세포에 작용하여, 인슐린 저해효과를 나타낸다26. 따라서 지방조직에서 M1형 대식세포가 증가하면 인슐린 저항성이 발생하고, 이런 상태가 만성적으로 지속되면 당대사의 평형 수위가 바뀌는 결과를 초래한다27. 그러므로, 지방조직에서 M1형 대식세포가 증가하는 단계는 비만으로부터 대사증후군이 발생하는 과정 중 핵심적인 기전이다. 따라서 본 연구에서는 ATM의 변화를 확인하기 위해, ATM의 수, phenotype의 변화, IFN-γ의 발현정도, 염증성 사이토카인인 TNF-α와 IL-6 분비량의 변화를 측정하였다.
실험동물의 지방조직에서 대식세포 표지자인 F4/80과 CD11b를 동시에 갖고 있는 세포의 수를 측정한 결과, 대조군의 ATM수는 정상군에 비해 유의하게 많았으나, 厚朴투여군은 대조군보다 유의하게 적었다. 厚朴이 대식세포가 지방조직에 침윤되는 과정을 억제하였음을 보여준다.
ATM의 phenotype이 변화하는 양상을 파악하기 위해 M1형 대식세포에서 발현되는 표면단백질인 CD11c를 가진 세포의 수를 측정한 결과, 대조군은 정상군보다 유의하게 많았고, 그 차이도 20배가 넘었으나, 厚朴투여군은 대조군보다 유의하게 적었다. 이 결과는 厚朴이 비만으로 인해 M1형 대식세포가 증가하는 phenotype switch를 억제했다는 것을 보여준다.
지방조직 내 백혈구 중 대식세포 비율을, CD45(+) 세포 중 CD11b(+), F4/80(+) 세포가 차지하는 비율로 추정한 결과, 대조군은 정상군보다 유의하게 높았으나, 厚朴투여군은 대조군보다 낮았다. 또한 대식세포 중 M1형이 차지하는 비율을 알아보기 위해 CD11b(+), F4/80(+) 세포 중 CD11c(+) 인 세포가 차지하는 비율을 측정한 결과, 대조군은 정상군보다 유의하게 높았으나, 厚朴투여군은 대조군보다 유의하게 낮았다. 따라서 厚朴이 비만으로 인한 대사성 염증에 주도적인 역할을 하는 ATM의 증가를 억제하였고, ATM의 phenotype이 M1형으로 바뀌는 과정을 억제하였음을 알 수 있다.
염증성 사이토카인의 발현정도를 알아보기 위해, TNF-α와 IFN-γ, IL-6의 발현정도를 측정하였다. 비만으로 인한 만성 염증에는 여러 종의 면역세포와 많은 종류의 염증성 사이토카인이 관여하는데, 그 중 주도적인 역할을 하는 면역세포와 초기단계에 활성화되는 사이토카인이 무엇인지 알아내기 위해 많은 연구들이 시행되어왔다. 현재까지 알려진 바에 의하면, IFN-γ는 대식세포를 M1형으로 분화시키는 등, 염증의 시작 단계에 관여 한다2. 대식세포가 M2형으로 분화하기 위해서는 IL-4와 같은 사이토카인의 자극이 있어야 하고, 동시에 M1형으로 변화시키는 IFN-γ 같은 자극 인자가 없어야 M2형을 유지할 수 있다22. 본 실험에서는 IFN-γ의 변화를 관찰하였고, 그 결과 厚朴투여군의 IFN-γ의 값이 대조군보다 낮았으나, 통계적 유의성은 없었다.
M1형 대식세포로부터 분비되는 TNF-α와 IL-6는 대식세포 뿐 아니라, B세포와 다른 종류의 T세포도 활성화시켜 광범위한 염증 반응을 일으킨다28. 본 실험에서 IL-6의 값은 대조군이 정상군보다 유의하게 높았고, 厚朴투여군에서는 대조군보다 낮았으나 통계적으로 유의하지 않았다. 반면, TNF-α의 값은 대조군에서 정상군보다 유의하게 높았으나, 厚朴투여군에서는 대조군보다 유의하게 낮았다. TNF-α는 면역반응을 활성화 시킬 뿐 아니라, 인슐린 저항성을 일으키기도 한다. 1993년에 시행된 Hotamisligil 등의 연구38에서는 비만한 쥐의 지방조직에서 TNF-α가 증가한 것을 확인한 후, TNF-α를 중화시키는 약물을 투여하자 인슐린 기전이 작동하여 포도당의 흡수가 증가했고, Ventre 등의 연구29에 의하면, 실험동물에 TNF-α의 작용을 억제하는 유전자 조작을 하였을 때 인슐린 저항성이 개선되었다. 임상에서 제2형 당뇨 환자에게 TNF-α를 억제하는 약물을 투여하였을 때 인슐린 저항성이 개선되었다 보고30가 있다. 본 연구에서는 厚朴을 투여한 실험군에서 M1형 대식세포의 TNF-α 생산이 억제되었다. 이는 厚朴이 당 부하 후 혈당 상승을 억제하고 인슐린저항성을 개선한 기전이 TNF-α의 감소와 연관되어 있음을 시사한다.
본 연구에 이용한 ob/ob mouse는 렙틴 유전자 결핍으로 인해 대사적인 특징을 여러 가지 갖는데, 렙틴은 지질대사와 면역반응에 모두 영향을 미치기 때문에, ob/ob mouse에서 일어나는 면역학적 변화를 해석하는 것은 간단하지 않다. 예를 들어 렙틴은 정상적인 상태에서는 TNF-α, IFN-γ, IL-6를 증가시키지만, 비만한 개체에서는 인슐린 저항성을 감소시킨다31. 한편, 렙틴이 분비되면 면역세포의 분화와 활성화 등에 영향을 미쳐, 대식세포가 M1형으로 분화하도록 유도하기 때문에, 렙틴유전자가 결핍된 ob/ob mouse의 지방조직에는 M2형 대식세포가 더 많이 분포한다는 연구 결과도 있다32. 따라서 厚朴이 M1형 대식세포를 감소시키고, TNF-α의 발현을 억제하여, ATM에 의한 염증반응과 인슐린저항성을 개선함으로써, 비만과 대사증후군에 대한 치료효과를 나타낸 것인지 보다 더 명확하게 평가하기 위해서, 식이로 유발된 비만 모델을 대상으로 한 추가적인 연구가 필요하다.
V. 결 론
렙틴유전자가 결핍되어 비만과 인슐린 저항성, 만성 염증의 상태를 타나내는 ob/ob mouse를 대상으로, 厚朴 추출물을 경구 투여 하였을 때 나타나는 변화를 관찰하여, 다음과 같은 결론을 얻었다.
1. 厚朴은 인슐린저항성을 유의하게 감소시켰다.
2. 厚朴은 공복시 혈당, 경구당부하 30분 후 혈당, 90분 후 혈당, AUC값을 유의하게 감소시켰다.
3. 厚朴은 지방조직에서 F4/80과 CD11b를 표지자로 나타내는 대식세포의 수와 비율을 유의하게 감소시켰다.
4. 厚朴은 지방조직에서 대식세포 중, CD11c를 표지자로 나타내는 M1형 대식세포의 수와 비율을 유의하게 감소시켰다.
5. 厚朴은 지방조직에서 대식세포와 관련된 염증성 사이토카인 중 하나인 TNF-α의 발현을 유의하게 감소시켰다.