茵蔯, 鬱金, 枳實 추출물(ACA)이 HepG2 세포에서 나타나는 이상지질혈증 관련 인자 발현 및 항산화에 미치는 영향
The Effects of Artemisiae Iwayomogii Herba, Curcumae Radix, and Aurantii Fructus Immaturus Complex Extract (ACA) on Dyslipidemia-related Factor Expression and Anti-oxidation in HepG2 Cells
Article information
Abstract
Objectives
To ianvestigate the effect of Artemisiae Iwayomogii Herba, Curcumae Radix, and Aurantii Fructus Immaturus complex extract (ACA) on dyslipidemia-related factor expression and anti-oxidation in HepG2 cells.
Method
After treatment with ACA in the HepG2 cells, DPPH, ABTS radical scavenging activity, ROS production, and glutathione (GSH) production were measured. The free fatty acid, lipid peroxidation (MDA), ACAT1, and HMG-CoA reductase mRNA expression were measured in the HepG2 cells after treatment with ACA.
Results
DPPH, ABTS radical scavenging activity increased in an ACA concentration-dependent manner.
ACA significantly decreased ROS production in comparison to the control group.
ACA significantly increased glutathione production.
ACA significantly decreased free fatty acid and lipid peroxidation (MDA) in the HepG2 cells.
ACA decreased the mRNA expression of ACAT1 and HMG-CoA reductase.
Conclusion
These results suggest that Artemisiae Iwayomogii Herba, Curcumae Radix, and Aurantii Fructus Immaturus complex extract (ACA) inhibits dyslipidemia-related factor expression and that it is effective in anti-oxidation. A future in vivo experiment with ACA is needed to investigate the effect on anti-dyslipidemia. It is expected that ACA is effective in anti-dyslipidemia and applied to cardiovascular disease, ischemic heart disease, stroke, etc.
I. 서 론
전 세계적으로 심혈관계질환으로 사망하는 인구가 연간 1,700만 명이며, 이는 전체 사망 원인의 30%에 달한다1. 이상지질혈증은 서구화된 식이와 운동부족과 같은 생활습관 등에 따라 증가하는 추세이며2 필요 이상으로 혈관 내 많은 지질성분 물질은 염증인자를 활성화시켜 만성적인 염증 상태를 유발하고 죽상동맥경화를 유발시키기 때문에 이상지질혈증의 관리 및 치료는 중요하다. 이상지질혈증의 치료는 식사요법이나 운동요법, 금연 등의 생활습관 개선이 먼저 고려되며 정도에 따라서 약물요법이 병행하기도 한다2. 그러나 치료 효과와 더불어 소화장애, 간 독성, 근육 독성의 부작용이 나타날 수 있어 이러한 단점을 보완하기 위해서 천연 한약물에서의 연구도 활발하게 이루어지고 있다3.
이상지질혈증의 치료제로 단미약으로는 茵蔯3, 鬱金4, 枳實5 등의 연구가 있었으며 처방으로는 瓜蔞枳實湯6, 枸杞子加味方7 등의 연구가 있었다. 그리고 약침을 이용한 연구8 등 다양한 치료제 개발이 활발히 이루어지고 있다.
그 중 茵蔯, 鬱金은 단미제 뿐만 아니라 茵蔯과 鬱金 복합추출물로서도 항고지혈 효능이 밝혀진 바 있으며9 茵蔯과 鬱金 복합추출물에 단미제를 추가하여 항산화 및 항고지혈 효능을 평가하려는 연구10,11가 계속되고 있다. 枳實은 단미제로서 triglyceride와 혈청 total cholesterol에 대하여 simvastatin 못지않게 고지혈증 억제 효과를 나타내었고 HDL-cholesterol 상승과 LDL-cholesterol 저하 효과가 있다고 밝혀져 있다5. 그러나 복합제로서는 아직 효증이 규명되지 않아 본 실험을 통해 茵蔯, 鬱金, 枳實 복합추출물의 효능을 규명하고자 연구를 진행하게 되었다.
본 연구에서는 항산화 효능을 평가하기 위하여 DPPH radical 소거능, ABTS radical 소거능을 측정했으며 세포 내 ROS의 생성량, glutathione의 함량을 측정했다. 이상지질혈증의 개선 효능 평가를 위하여 세포 내 free fatty acid 함량과 세포 내 lipid peroxidation, cholesterol 관련 인자인 ACAT1과 HMG-CoA reductase RNA 발현 수준을 측정하였으며 유의한 결과를 얻었기에 발표하는 바이다.
II. 재료와 방법
1. 재 료
2. 방 법
1) 시료 추출
ACA(30 g)를 80% 주정의 500 ml에 넣어 3시간동안 환류추출을 한 이후 여과액을 rotary vacuum evaporator를 통하여 감압 농축하였다. 농축된 용액을 freeze dryer를 이용하여 동결 건조를 하여 분말 4.439 g(수율 14.80%)을 얻어냈고, 얻어진 분말은 초저온 냉동고(-80 °C)에서 보관했으며 실험에 필요한 농도로 증류수에 희석하여 사용하였다.
2) 중금속 검사
준비된 검액과 표준액, 공시험액을 가지고 유도결합플라즈마-원자방출분광계(ICP-AES)를 사용하여 검량선을 작성 후 공시험액으로 보정하여 검액을 측정하였다.
3) HepG2 세포 배양
HepG2 세포는 1% antibiotic-antimycotic와 10% fetal bovine serum(FBS)으로 조성된 DMEM 배지를 사용하여 37 °C, 5% CO2 조건이 유지되는 세포배양기에서 배양하였으며, 2-3일 주기로 계대배양하여 실험을 진행하였다.
4) 항산화 효능평가
(1) DPPH radical 소거능 측정
DPPH radical 소거능 측정은 추출물 ACA의 최종 농도가 1, 10, 100, 1,00(μg/ml), 의 농도로 희석하였으며, DPPH 용액 150 μl와 추출물 ACA를 각각 100 μl을 반응 시켜 흡광도를 측정하였다. 시료액의 대조군에는 증류수를 넣었으며, DPPH 용액의 대조군으로써는 에탄올을 넣어 보정값을 얻었다. DPPH radical 소거율은 아래의 식에 따라 계산하였다.
(2) ABTS radical 소거능 측정
ABTS radical 소거능 측정은 ACA 추출물의 최종 농도가 1, 10, 100, 1,000(μg/ml), 의 농도로 될 수 있게 희석시켰으며, 희석된 ABTS+용액 150 μl와 ACA 추출물을 각각 5 μl 혼합하고, 실온에서 10분간 반응시킨 후, 732 nm에서 흡광도를 측정하였다. 항산화능은 증류수를 대조군으로 하여 대조군에 대한 ABTS radical 소거능을 백분율로 나타내었다.
(3) 세포 내 reactive oxygen species(ROS) 생성 측정
세포 내 ROS를 측정하기 위하여 2′, 7′-dichlorofluorescin diacetate(DCF-DA)를 이용하였다. ACA 추출물 1, 10, 100(μg/ml)의 농도로 처리하여 실험이 이루어졌으며 유세포 분석기를 이용하여 형광강도의 세기에 따른 변화를 분석하였다.
(4) 세포 내 glutathione(GSH) 함량 측정
세포 내 GSH 함량을 측정하기 위하여 Glutathione assay kit를 이용하여 다음과 같이 측정하였다. ACA 추출물을 각각 1, 10, 100(μg/ml)의 농도로 처리하여 실험이 이루어졌으며 NADPH(0.16 mg/ml)를 50 μl씩 넣어준 뒤 412 nm 파장에서 5분 동안 1분 간격으로 흡광도를 측정하였다. GSH 농도를 표준용액의 정량곡선을 기준으로 계산하였다.
5) 항고지혈 효능평가
(1) 세포 내 Free fatty acid 함량 측정
세포 내 free fatty acid 함량을 Free Fatty Acid Quantitation Kit를 이용하여 측정하였다. ACA 추출물을 각각 1, 10, 100(μg/ml)의 농도로 처리하여 실험이 이루어졌으며 Free fatty acid 함량은 kit에 포함된 palmitic acid 표준용액12의 정량곡선을 기준으로 계산하였다.
(2) 세포 내 Lipid peroxidation(MDA) 측정
세포 내 MDA를 측정하기 위하여 lipid peroxidation (MDA) kit를 이용하여 측정하였다. ACA 추출물을 각각 1, 10, 100(μg/ml)의 농도로 처리하여 실험이 이루어졌으며 MDA 농도를 표준용액의 정량곡선을 기준으로 계산하였다.
(3) Reverse transcription PCR
세포 내 ACAT1, HMG-CoA reductase 발현 수준을 측정하였다. ACA 추출물을 각각 1, 10, 100 (μg/ml)의 농도로 처리하여 실험이 이루어졌으며 시료가 처리된 HepG2 세포에서 total RNA를 추출한 후 cDNA를 합성하고 PCR을 수행하여 전기영동한 후 UV촬영을 통해 결과를 확인하였다.
3. 통계처리
실험 결과는 SPSS 11.0의 unpaired student’s T-test와 ANOVA를 사용하여 통계처리 하였고 p<0.05, p<0.01 및 p<0.001 수준에서 그 유의성을 검정하였다.
III. 실험 결과
1. 중금속 검사
중금속 함량을 측정한 결과, ACA는 납, 카드뮴의 경우 기준치 이하로 검출되었고 비소, 수은의 경우는 검출되지 않았다(Table 2).
2. 항산화 효능평가
1) DPPH radical 소거능 측정
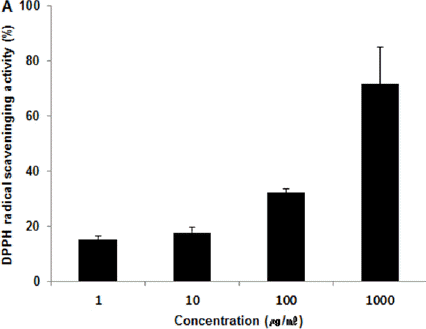
ACA 추출물의 1, 10, 100, 1,000(μg/ml) 농도에서 DPPH radical 소거능은 각각 15.20±1.30%, 17.80±1.80%, 32.20±1.30%, 71.50±13.60%로 나타나 농도 의존적으로 DPPH radical 소거능 증가가 나타났다. Ascorbic acid의 DPPH radical 소거능은 0, 1.95, 7.81, 31.25(μg/ml) 농도에서 각각 0.00±1.60%, 34.35±3.23%, 49.17±4.73%, 72.91±10.77%로 나타났다(Fig. 1).
2) ABTS radical 소거능 측정
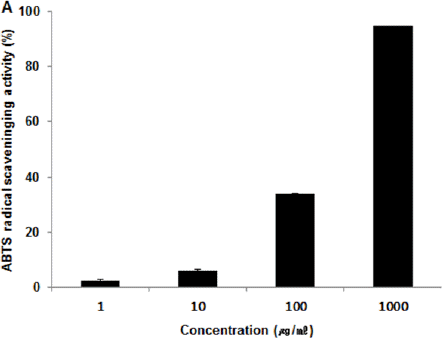
ACA 추출물의 1, 10, 100, 1,000(μg/ml) 농도에서 ABTS radical 소거능은 각각 2.20±0.80%, 5.80±0.90%, 24.60±16.10%, 94.60±0.10%로 나타나 농도 의존적으로 ABTS radical 소거능 증가가 나타났다. Ascorbic acid의 ABTS radical 소거능은 0, 1.95, 7.81, 31.25 (μg/ml) 농도에서 각각 0.00±0.23%, 5.28±0.89%, 25.83±1.52%, 93.05±0.60%로 나타났다(Fig. 2).
3) 세포 내 ROS 측정
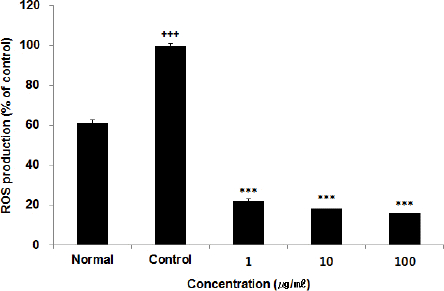
세포 내 ROS를 측정한 결과, 정상군에서 61.26 ±2.51%, 대조군에서 100.00±0.14%를 나타낸 반면, ACA 추출물 1, 10, 100(μg/ml) 농도에서 각각 22.14±1.35%, 18.36±1.06%, 16.28±0.97%로 나타나 모든 농도에서 유의성 있는(*** : p<0.001) 감소가 나타났다(Fig. 3).
4) 세포 내 GSH 함량 측정
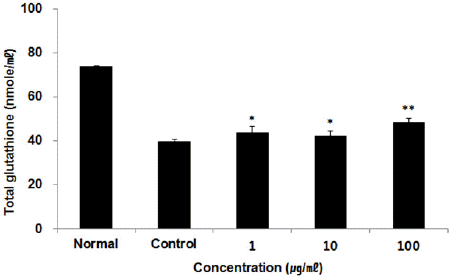
세포 내 GSH 함량을 측정한 결과, 정상군에서 73.89±0.32 nmol/ml, 대조군에서 39.70±0.85 nmol/ml를 나타낸 반면, ACA 추출물 1, 10, 100(μg/ml) 농도에서 각각 43.70±2.68 nmol/ml, 42.23±2.11 nmol/ml, 48.39±1.75 nmol/ml로 나타나 1, 10, 100(μg/ml) 농도에서 유의성 있는(*: p<0.05, **: p<0.01) 증가가 나타났다(Fig. 4).
3. 항고지혈 효능평가
1) 세포 내 free fatty acid 함량 측정
세포 내 free fatty acid 함량을 측정한 결과, 정상군에서 41.26±1.32 nmol/ml, 대조군에서 70.60± 2.36 nmol/ml를 나타낸 반면, ACA 추출물 1, 10, 100(μg/ml) 농도에서 각각 61.86±3.05 nmol/ml, 60.57±4.52 nmol/ml, 56.09±3.29 nmol/ml로 나타나 모든 농도에서 유의성 있는(* : p<0.05, ** : p<0.01, *** : p<0.001) 감소가 나타났다(Fig. 5).
2) 세포 내 MDA 측정
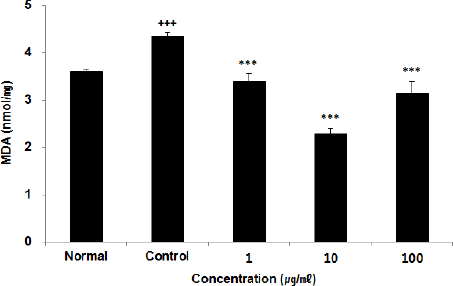
세포 내 MDA를 측정한 결과, 정상군에서 3.61 ±0.03 nmol/mg, 대조군에서 4.35±0.09 nmol/mg를 나타낸 반면, ACA 추출물 1, 10, 100(μg/ml) 농도에서 각각 3.39±0.17 nmol/mg, 2.27±0.13 nmol/mg, 3.14±0.25 nmol/mg로 나타나 모든 농도에서 유의성 있는(*** : p<0.001) 감소가 나타났다(Fig. 6).
IV. 고 찰
심혈관계 질환은 전체 사망 원인의 30% 정도로 가장 중요한 사망 원인이다. 최근 심혈관계 질환의 유발요인 중 흡연율은 감소하고 있으며 고혈압과 당뇨병의 유병률은 비교적 일정하게 유지되고 있는 반면에 이상지질혈증의 유병률은 증가하는 추세로13 이에 대한 관심 및 치료제 개발 연구가 늘어나고 있는 추세이다.
이상지질혈증이란 triglycerides(TG), HDL-cholesterol, LDL-cholesterol, 총 cholesterol 중 한 개 이상이 정상 범위를 벗어나는 것을 말한다2. 이상지질혈증은 죽상동맥경화증의 큰 위험인자로 혈중 LDL-cholesterol은 혈관의 내피세포의 기질과 쉽게 결합하여 혈관 내막에 침윤된다. 침윤된 LDL-cholesterol이나 혈액의 염증인자들은 내피세포의 기능부전을 일으키고 내피세포를 활성화 시켜 염증 유전자나 부착분자의 발현을 증가시킨다. 산화 LDL은 단핵구, 대식세포, T 세포 등을 활성화시키며 만성적인 염증 상태를 유발하여 혈관 내막으로 이주한 혈관평활근세포가 산화 변형된 지단백을 섭취하여 섬유판을 형성한다. 따라서 죽상동맥경화의 가장 중요한 위험인자는 혈중 cholesterol의 상승이며 이상지질혈증의 치료는 관상동맥질환의 발병률을 낮추는 것으로 밝혀졌다14.
이상지질혈증에 대한 치료는 체중감량이나 식사요법, 운동요법을 실시하며 생활요법 개선 후에도 조절이 잘 되지 않으면 약물요법을 병행한다. 약물요법은 Bile-acid sequestrants, Nicotinic acid, HMG-CoA reductase inhibitors, Fibrates가 있는데, HMG-CoA reductase inhibitor인 스타틴이 일차 선택약제이다. 비교적 부작용이 적고 LDL-cholesterol을 낮출 수 있기 때문이다. 그러나 가장 흔하게 소화장애, 속쓰림, 복통 등이 나타나며 간 독성과 근육 독성이 나타날 수 있다2.
이상지질혈증이란 병명은 한의학에서 직접적으로 언급된 바는 없지만 ≪靈樞⋅五癃津液別篇≫에서는 ‘五穀之津液, 和合而爲膏者, 內滲入於骨空, 補益腦髓’라 하며 膏는 곧 脂質으로 볼 수 있고 津液의 一種으로써 水穀에서 來源하여 血中에 化入하고 人體의 營養物質이 된다15라고 서술하고 있다. 이상지질혈증은 瘀血이나 痰飮으로 유발된 질환으로 볼 수 있으며 利濕化痰, 活血化瘀의 治法을 쓸 수 있다16. 그와 관련하여 단일 약재3-5와 복합제6,7,9-11, 약침을 이용한 연구8 등 다양한 치료제 개발이 활발히 이루어지고 있다.
본 연구에 활용된 茵蔯은 본초학의 분류에서 利水滲濕藥에 속하며 淸濕熱, 退黃疸의 효능이 있다17. 鬱金은 본초학상 活血祛瘀藥에 속하며 活血止痛, 行氣解鬱, 淸心凉血, 疏肝利膽하는 효능이 있다17. 鬱金은 항산화와 항고지혈증에 대하여 유효한 효과를 보이고 있다18,19. 枳實은 본초학상 理氣藥에 속하며 破氣消積, 化痰散痞하는 효능을 가지고 있는데 항고지혈증 및 항염증효능에 유효한 효과를 보인다는 연구가 있다5.
항고지혈과 관련한 연구들에서는 항산화 효능과 관련된 연구를 함께 진행하는 경우가 많다. 이는 이상지질혈증 초기에 활성산소와 산화적 스트레스가 체내 과잉되어 동맥경화를 비롯하여 암이나 노화를 유발 가능하기 때문이다. 따라서 항산화제는 산화적 스트레스를 억제하여 이상지질혈증에 의한 여러 혈관장애 유발인자를 억제하고 질병 예방 목적으로 활용될 수 있다20.
본 연구에서는 항산화 효능을 평가하기 위하여 DPPH radical 소거능, ABTS radical 소거능을 측정했고 세포 내 ROS의 생성량, glutathione의 함량을 측정했으며 이상지질혈증의 개선 효능 평가를 위하여 세포 내 free fatty acid 함량과 세포 내 lipid peroxidation을 측정했다. 그리고 지질의 전구체인 ACAT1과 cholesterol을 free cholesterol로 생합성하는 효소인 HMG-CoA reductase 발현 수준을 측정하였다.
HepG2 세포는 사람의 주요 apo단백질을 합성하는 능력을 갖고 있어 lipoprotein의 대사에 관련한 연구에 사용되어지기에 적절하며 증식률이 빠르기 때문에 본 실험에서는 HepG2 세포를 이용하여 진행하였다21.
연구에 앞서 복합추출물 ACA의 안전성 검증을 위하여 중금속 함량을 관찰한 결과 납, 카드뮴의 경우 기준치 이하로 검출되었고 비소와 수은의 경우는 검출되지 않았다(Table 2). DPPH radical 소거능, ABTS radical 소거능 측정이란 항산화능 측정에 널리 사용되는 방법으로 항산화 특성이 클수록 소거능이 증가하는 특징을 가진다22. 복합추출물 ACA를 1, 10, 100, 1,000(μg/ml) 농도로 희석시킨 후 DPPH radical 소거능과 ABTS radical 소거능을 측정하였는데 측정한 DPPH radical소거능과 ABTS radical 소거능은 농도 의존적으로 증가가 나타났다(Fig. 1, 2). 이 결과로 볼 때 복합추출물 ACA가 항산화 활성을 나타내는 것으로 사료된다.
활성산소(ROS)는 산소의 산화물이며 항산화물질인 glutathione(GSH)은 직접 활성산소와 결합하여 제거한다23. HepG2 세포에 복합추출물 ACA를 처리한 후 측정된 ROS의 양은 모든 농도에서 유의한(p<0.001) 감소를 보였다(Fig. 3). HepG2 세포에 복합추출물 ACA를 처리한 후 측정한 세포 내 GSH 함량은 모든 농도에서 유의성 있는 증가를 나타냈다(Fig. 4). 따라서 복합추출물 ACA는 glutathione을 합성, 촉진 효능을 나타내며 그와 관련된 항산화효소 활성 촉진 효능도 월등한 것을 볼 수 있다.
세포 내에서 이상지질혈증 개선 효능을 평가하기 위하여 HepG2 세포에 복합추출물 ACA를 처리한 후 세포 내 free fatty acid 함량과 lipid peroxidation을 측정했다. Free fatty acid는 지방조직에서 방출되어 혈액 내에 존재하는 지질이고 lipid peroxidation은 불포화지방산이 과산화한 것으로 반응성이 커서 생체막계에 상해를 주고, 세포의 기능저하나 괴사를 야기할 수 있다24. 본 연구에서는 lipid peroxidation을 측정하기 위하여 MDA 농도를 측정하는 법을 사용했다. 세포 내 free fatty acid 함량은 모든 농도에서 유의한 감소를 보였으며(Fig. 5), 세포 내 lipid peroxidation(MDA)도 모든 농도에서 유의한 감소를 나타내어(Fig. 6) 복합추출물 ACA가 혈중의 지질 과산화를 억제하고, 아울러 혈중 콜레스테롤 함량 및 지질함량을 감소시키는 영향을 미칠 수 있다는 것을 밝힐 수 있다.
ACAT는 식이로 섭취한 cholesterol을 세포내로 저장하는 효소이며25 HMG-CoA reductase는 간에서 LDL 수용체에 의해 유입된 cholesterol을 free cholesterol로 생합성하는 효소이기26 때문에 ACAT와 HMG-CoA 효소의 저해는 혈중 cholesterol을 감소시킬 수 있다. HepG2 세포에 복합추출물 ACA를 처리한 후 ACAT1와 HMG-CoA reductase mRNA 발현은 모든 농도에서 발현량이 확연히 감소된 것을 확인되었다(Fig. 7). 이를 통해 복합추출물 ACA는 세포내 콜레스테롤의 축적과 생합성을 감소시킬 수 있다고 볼 수 있다.
이상의 결과들을 종합해 보면, 복합추출물 ACA는 중금속이 검출되지 않았으며 실험 내의 농도에서 세포독성을 나타내지 않았다. DPPH radical과 ABTS radical 소거능의 증가, ROS 생성량 감소, GSH를 촉진하는 결과를 나타내어 항산화 효과를 증명했다. 그리고 세포 내 free fatty acid, lipid peroxidation의 감소, cholesterol 관련 효소 발현을 억제하여 세포내 cholesterol의 축적과 생합성을 감소시킬 수 있음을 입증했다.
다만, 본 실험이 세포 연구 수준에서 이루어져 혈중 LDL-cholesterol이나 total cholesterol, TG의 측정이 이루어지지 않아 이상지질혈증의 개선 효능을 명확히 결론짓기는 어렵다. 따라서 추후 in vivo 실험을 통해 효과를 입증할 필요가 있다. 그러나 본 연구를 통하여 복합추출물 ACA는 혈관의 산화적 손상을 예방하고 억제할 수 있을 것으로 보여지며 더 나아가 이상지질혈증을 개선해 줄 수 있는 가능성을 확인할 수 있었다. 향후 복합추출물 ACA에 대한 지속적인 연구가 이루어지기를 기대한다.
V. 결 론
茵蔯, 鬱金, 枳實의 복합 추출물은 이상지질혈증 관련 인자 발현을 억제시키며 항산화 효능이 있다고 보여진다. 추후 in vivo 실험을 통해서 항고지혈 효능을 입증하는 과정이 추가적으로 필요하지만 복합추출물 ACA는 이상지질혈증 개선 가능성이 있을 것으로 보여진다. 이를 이용한 심도 있고 다양한 연구가 필요할 것으로 사료된다.