고지방식이유도 실험용 Rat에서 Statin 및 한약 2종(후박, 하수오) 투여에 따른 혈중 지질, 조직 변화 비교 연구
Dyslipidemic Effect of Pravastatin and Herbal Medicine in Rats
Article information
Abstract
Objectives
The goal of this preclinical study was to compare the dyslipidemic effect of pravastatin with that of herbal medicine in rats.
Methods
In total, 40 rats were divided into 4 groups: Normal (10 rats), Control (10 rats), Statin alone (10 rats), and the MO-PM-S group (10 rats), which was given the powder of the cortex of Magnolia officinalis Rehd. et Wils., the root of Polygonum multiflorum Thunb, and pravastatin. The Control group, the Statin alone group, and the MO-PM-S group were all given a high-fat (45%) diet that made them obese. After 2 weeks of drug administration, the dyslipidemic effect of pravastatin was compared with that of herbal medicine in rats by analyzing the lipid profiles, measuring the body weights, and taking biopsies (liver, aorta).
Results
The herbal medicine and the statin complex group got a much lower TG level and a slightly higher HDL-cholesterol level than the other groups. However, it got a higher total cholesterol and LDL-cholesterol level than the other groups. In biopsies, 30% of the Statin alone group and 10% of the MO-PM-S group showed mild histopathologic findings in the liver.
Conclusion
The cortex of the Magnolia officinalis Rehd. et Wils. and the root of Polygonum multiflorum Thunb have dyslipidemic effects from the perspective of a TG level and HDL-cholesterol. However, the herbal mixture has a raising effect on both the LDL-cholesterol and the total cholesterol levels. Therefore, we cannot conclude that the herbal mixture helps to prevent dyslipidemia. In liver biopsies, the group administered with both the herbal mixture and the statin showed less histopathologic findings than the group administered with statin alone. This means that the herbal mixture helps to prevent fatty degeneration of the liver.
I. 서 론
최근 식생활의 변화와 사회적인 원인으로 인해 고지혈증, 동맥경화증 등과 같은 순환기질환의 발병은 계속 증가되어 왔으며, 현재 한국의 3대 사망원인 중에서 2, 3위로 심장 질환과 뇌혈관 질환이 차지하고 있다1.
고지혈증은 혈청 중 total cholesterol 또는 triglyceride의 함량이 증가된 상태를 말하며, 동맥경화증을 촉진시키는 원인 중에 하나이다. 동맥경화증은 동맥벽이 두터워지고 탄력성이 떨어지는 질환들을 말하는데, 뇌졸중이나 일과성 허혈발작, 간헐성 파행과 괴저, 장간막동맥 허혈 등을 일으킬 수 있다2.
심혈관계 질환의 위험인자는 혈청 총 콜레스테롤(total cholesterol)과 low-density lipoproteins(LDL) 농도의 상승, high-density lipoproteins(HDL) 농도의 감소, 혈청 중성지방 증가, 고혈압, 음주, 운동부족, 스트레스 및 흡연 등이며, 콜레스테롤 및 중성지방을 포함한 지방의 섭취 증가가 고콜레스테롤 혈증과 밀접한 관련이 있으며 동맥경화의 직접적인 요인이 된다3-5.
동맥경화의 주요 인자인 고지혈증의 치료제인 statin 계열의 약물은 콜레스테롤 합성의 반응조절 단계효소인 3-hydroxy-3-methylglutaryl coenzyme A (HMG-CoA) reductase를 억제하므로 세포 내 콜레스테롤이 감소되며, 이로 인해 세포막의 LDL 수용체의 수 및 활성이 증가됨으로써 수용체를 통한 very low-density lipoproteins(VLDL) 잔류물(remnant) 및 LDL의 대사를 촉진시킨다6.
후박(厚朴)은 목련과 식물인 후박나무 Magnolia officinalis Rehd. et Wils.의 줄기나 뿌리껍질을 말린 것이다. 봄에 20년 이상 자란 나무의 껍질을 벗겨 그늘에서 말리거나 끓는 물에 잠깐 담갔다가 건져서 햇볕에 말린 다음 이것을 다시 증기에 쪄서 원통 모양으로 말아 햇볕에서 말린다. 맛은 맵고 쓰며 성질은 따뜻하고, 비경(脾經)⋅위경(胃經)에 작용한다. 기의 순환을 촉진하고 복부가 창만한 것을 낫게 하며 비위(脾胃)를 따뜻하게 하고 습사(濕邪)를 없애며 담(痰)을 삭인다7.
물, 알코올 또는 이들의 혼합물을 용매로 하여 추출되는 후박 추출물은 간 속의 S-아데노실-L-메치오닌(S-adenosyl-L-methionine) 및 글루타치온(Gluthathione)의 함량을 증가시켜 간 손상을 억제하고, 간 조직 내에서의 중성지방 축적 억제 효과를 나타내어 지방간 질환 예방 및 치료용 조성물로 유용하게 이용될 수 있음이 2009년에 특허 등록되었고8, 또한 후박의 성분인 Honokiol은 쥐 실험 모델에서 간 세포 지방 축적을 억제함이 밝혀져 있다9.
하수오(何首烏)는 마디풀과(Polygonaceae)에 속하는 하수오 Polygonum multiflorum Thunb.의 塊根을 기원으로 하는 한약재이다. 주로 제용(製用)으로 사용하면 보간신(補肝腎), 익정혈(益精血)하고, 생용(生用)하면 윤장통변(潤腸通便), 해창독(解瘡毒), 절학(截瘧), 거풍(祛風)하는 효능이 있다7. 보익약(補益藥)으로 활용되고 있는 하수오(何首烏)는 지질대사를 향상시키는 효능10, 고지혈증쥐에 대한 지방 축적 억제 효능11 등 혈중 지질의 함량을 저하시키는 효능도 있다고 보고된 바 있다.
본 실험은 주요한 고지질혈증 약물인 pravastatin을 단독 투여했을 때와 pravastatin을 후박-하수오와 병용하였을 때 지질을 낮추는 효과를 비교하였다.
II. 실험 재료 및 방법
1. 실험 동물 및 식이 모델
1) 동물 및 사육 조건
본 실험에 사용된 실험용 쥐는 ㈜영바이오(성남시, 한국)에서 구입한 체중 360 g 전후의 12주령 수컷 Sprague Dawley Rat이며 항온항습 및 specific pathogen free상태에서 열흘간의 적응기간을 거친 후 실험에 이용하였다.
동물실험은 경희대학교 동물윤리 규정에 따라 윤리위원회의 승인을 얻어 실험하였다. (승인번호 KHMC-IACUC 16-045)(임상시험등 교육 수료증 KHUH-2016-II-177호, KHUH-2017-II-012호)
2) 식 이
정상 식이 섭취군은 ㈜카길애그리퓨리나(전북 군산, 한국)에서 구입한 실험용 쥐 육성용 일반 사료(조단백질 20.00% 이상, 조지방 4.50% 이상, 조섬유 6.00% 이하, 조회분 7.00% 이하, 칼슘 0.50% 이상, 인 1.00% 이하)로 자유 식이하였으며 나머지군은 ㈜두열바이오텍에서 구입한 고지방사료(45% fat diet)를 자유 식이하였다.
2. 약재 및 시약
1) 약 재
본 실험에 사용된 후박은 식물명 후박나무(목련과), 영문명(Latin명) Magnoliae Cortex, 하수오는 식물명 하수오(마디풀과), 영문명(Latin명) Polygoni Multiflori Radix로 경희의료원 약제실에서 구입하여 제분하였다.
2) 시 약
(1) Pravastatin
Pravastatin을 쥐 체중 1 gm당 매 회 (1/150) mg으로 계산하여 투여하였다(인체 60 kg 기준 용량인 40 mg을 토대로 비례 계산하면 체중 1 gm당 (1/1500) mg인데 쥐 실험용으로 10배하여 (1/150) mg으로 환산하였다). CJ제약에서 메바로친(pravastatin sodium 40 mg/Tab)을 구입하여 1회당 pravastatin 3 mg을 물 4 cc에 녹여 경구 투여하였다.
(2) 후박-하수오 제제(Magnolia officinalis-Polygonum multiflorum, MO-PM)
후박과 하수오를 각각 쥐 체중 1 gm당 매 회 1 mg으로 계산하여 투여하였다(인체 60 kg 기준 용량인 6 gm을 토대로 비례 계산하면 체중 1 gm당 0.1 mg인데 쥐 실험용으로 10배하여 1 mg으로 환산하였다). 매 회 후박가루 400 mg, 하수오가루 400 mg을 섞어 물 4 cc에 녹여 경구 투여하였다.
3. 실험 방법
1) 열흘간의 적응 기간 후 체중 측정
2) 고지방식이 및 시약 투여를 2주간 병행하며 1주 간격으로 체중 측정
시약 투여 그룹의 경우 시약을 2주간 1일 1회 경구 투여하였고 고지방식이 섭취 대조군의 경우 동량의 물을 공급하였다. 실험군 분류는 다음과 같다.
(1) N(Normal) : 일반 식이를 섭취하는 그룹 (10마리)
(2) C(Control) : 고지방식이 섭취 대조군(10마리)
(3) S(Statin) : 고지방식이와 함께 pravastatin을 투여하는 그룹(10마리)
(4) MO-PM-S(후박-하수오 제제와 statin 병용. Magnolia officinalis-Polygonum multiflorum-Statin) : 고지방식이와 함께 pravastatin, 후박-하수오 제제를 투여하는 그룹(10마리)
한약의 약효가 서서히 나타나는 특성 상 후박-하수오 단독 투여 그룹은 2주 안에 효과가 나타나기 어려울 것으로 판단되어 실험에서 제외하였다.
3) 채혈 및 장기(Liver, Aorta) 적출
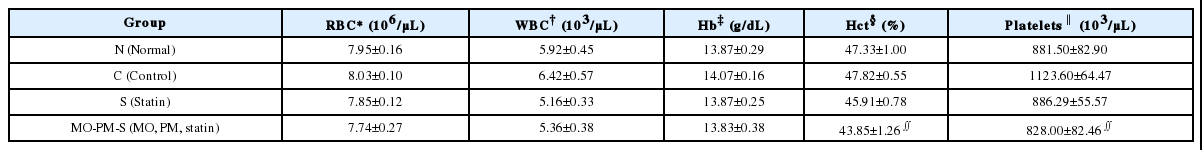
실험 종료 마지막 날 모든 동물을 ether 흡입 마취 하에 심장채혈 후, CBC 검사는 ㈜녹십자랩셀에, 생화학 검사는 ㈜옵티팜에 의뢰하였다. 혈중 지질에 미치는 영향을 알아보기 위해 혈청의 HDL-cholesterol, LDL-cholesterol, Triglyceride, Total cholesterol 함량을 분석하였으며, 간(肝) 손상에 미치는 영향을 알아보기 위해 혈청의 AST(Aspartate Transaminase), ALT(Alanine Transaminase) 함량을 분석하였고, 신(腎) 손상에 미치는 영향을 알아보기 위해 BUN (Blood Urea Nitrogen), Creatinine 함량을 분석하였다. 그 외에 영양 지표의 변화를 알아보기 위해 Total Protein, Albumin, CBC(Complete Blood Cell Count)를 분석하였다.
채혈 후 복부 절개하여 Liver와 Aorta를 적출해 formalin 시약에 넣어 고정시킨 다음 ㈜옵티팜에서 조직 절편을 만들었다.
고지방식이를 실시한 rat의 간(liver) 및 대동맥(aorta) 조직에 대한 병리 조직학적 검사를 위하여 부검 과정에서 적출한 간과 대동맥은 10% 중성 완충 포르말린 용액에 고정하였다. 고정이 완료된 조직은 단면을 검사할 수 있도록 장기별로 2부위를 삭정하였다. 삭정이 완료된 조직은 일반적인 조직처리 방법에 준하여 파라핀 포매하고 약 3~4 μm 두께로 박절하였으며, 각 조직을 구성하는 세포의 형태학적 변화 여부를 확인하기 위해 hematoxylin & eosin(H&E) 염색을 수행하였다. 제작이 완료된 슬라이드는 광학 현미경(Olympus BX53, Japan)을 이용하여 검경하였다. 고지방식이에 의한 간과 대동맥 조직의 병리조직학적 변화를 평가하기 위해 Brunt 등(1999)12, Kucera와 Cervinkova(2014)13 및 Wu 등(2010)14의 보고를 참고하여 장기별로 평가할 병변을 선정하였다. 간에서는 대수포성 지방증(macrovesicular steatosis), 간세포의 풍선 변성(hepatocellular ballooning), 염증 세포 침윤(inflammatory cell infiltration)으로 구분하여 평가하였다. 대동맥에서는 내막의 거품 세포(foam cells in the intima) 및 중막의 과다 형성(hyperplasia of the media) 여부를 평가하였다. 각 병변의 정도를 평가하기 위하여 개체 별로 병변이 확인되지 않는 경우인 ‘0’을 포함하여 총 4단계(1 : 경도, 2 : 중등도, 3 : 심함)로 등급을 나누어 검경하였다.
4. 통계 처리
모든 실험 성적은 Mean±S.E.(Standard Error)로 나타내었으며, SPSS(version : 22, IBM SPSS Statistics, USA)를 사용하여 분석하였다. 실험 성적은 정규성 검정 상 정규성을 나타내었으며, One way Anova test를 시행하여 각 군을 비교하고, 분산의 동질성 검정을 거쳐 등분산일 경우 Tukey 방법을, 등분산이 아닐 경우 Dunnett의 T3 방법으로 사후검정하였다(단, Total Protein, Albumin, BUN, Creatinine은 데이터가 정규성 분포를 따르지 않아 비모수 검정으로 Kruskal-Wallis 검정을 시행). 모든 비교에서 p-value<0.05일 때 통계적으로 유의한 차이가 있는 것으로 판정하였으며, Normal군과의 비교에서 p-value<0.05이면 #로 표시하였고, Control군과의 비교에서 p-value<0.05이면 ∬로 표시하였고, Statin군과의 비교에서 p-value<0.05이면 #로 표시하였으며, 각 비교에서 p-value<0.01이면 기호를 2개로 표시하였다.
III. 실험 결과
1. 체중 변화 분석 결과
각 군의 체중을 1주마다 측정하였고 2주간의 체중 변화량 비교에서 MO-PM-S군은 Control군과 통계적으로 유의한 차이가 있으며(∬p-value<0.05), Statin군과 통계적으로 유의한 차이가 있다(##p-value<0.01) (Table 1).
2. 혈액 검사 결과
1) 혈중 지질에 미치는 영향
(1) 혈청 중 HDL-cholesterol의 함량에 미치는 영향
MO-PM-S군은 Control군과 통계적으로 유의한 차이가 있으며(∬p-value<0.05), Statin군과 통계적으로 유의한 차이가 있다(#p-value<0.05)(Table 2).
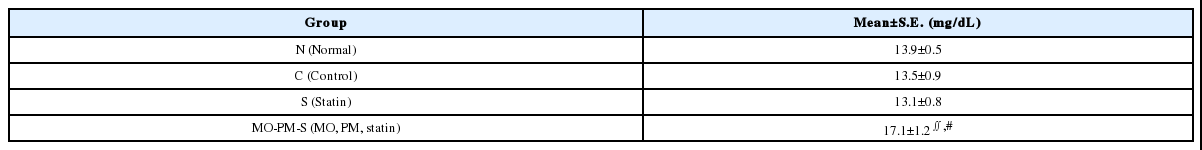
(2) 혈청 중 LDL-cholesterol의 함량에 미치는 영향
MO-PM-S군은 Control군과 통계적으로 유의한 차이가 있으며(∬p-value<0.05), Statin군과 통계적으로 유의한 차이가 있다(#p-value<0.05)(Table 3).
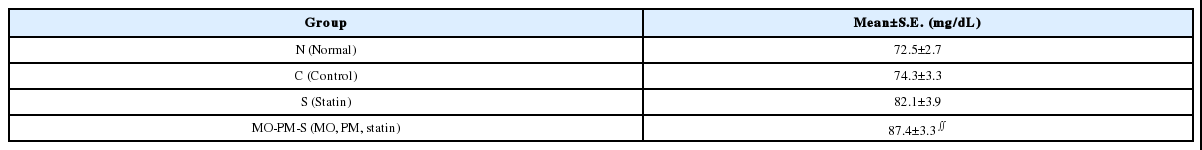
(3) 혈청 중 Total cholesterol의 함량에 미치는 영향
MO-PM-S군은 Control군과 통계적으로 유의한 차이가 있다(∬p-value<0.05)(Table 4).
(4) 혈청 중 Triglyceride 함량에 미치는 영향
Statin군은 Control군에 비해 Triglyceride가 증가하였으며(∬∬p-value<0.01), MO-PM-S군은 Statin군에 비해 Triglyceride 수치가 낮은데 이는 통계적으로 유의하다(##p-value<0.01)(Table 5).
2) 간 손상에 미치는 영향
(1) 혈청 중 AST(aspartate transaminase)의 함량에 미치는 영향
AST를 ln변환했을 때 MO-PM-S군은 Normal군과 통계적으로 유의한 차이가 있다(#p-value<0.05) (Table 6).
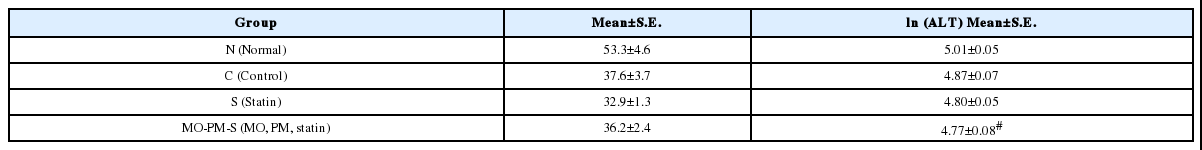
(2) 혈청 중 ALT(alanine transaminase)의 함량에 미치는 영향
ALT를 ln변환했을 때 MO-PM-S군은 Normal군과 통계적으로 유의한 차이가 있다(#p-value<0.05) (Table 7).
3) Total Protein, Albumin, BUN, Creatinine
Total Protein, Albumin, BUN, Creatinine은 데이터가 정규성 분포를 따르지 않아 비모수 검정으로 Kruskal-Wallis 검정을 시행했으며 군 간 차이가 유의함이 확인되지 않았다. BUN과 Creatinine이 군 간 유의한 차이가 없음을 통해 고지방식이와 pravastatin, 그리고 후박-하수오가 신장 기능 손상을 일으키지 않았음을 알 수 있다(Table 8).
3. 조직학적 검사 결과
간에서는 일부 개체에서만 대수포성 지방증이 관찰되었다(Fig. 1). 그 외 고지방식이와 관련된 간세포의 풍선 변성 및 염증세포 침윤은 확인되지 않았다. 대수포성 지방증은 S시험군에서 3개체 및 MO-PM-S시험군에서 1개체가 관찰되었고 병변의 정도는 미약하였다.

Histopathologic findings in the liver.
Few intracytoplasmic fat droplets were observed in the hepatocytes (arrows). No. 1, 3, 7 in Group S and No. 8 in Group MO-PM-S have fat droplets.
Control 군에서 간의 지방축적 병변이 관찰되지 않은 것은 고지방식이 투여 기간(2주)이 너무 짧았던 원인으로 판단되며, Statin 단독 투여군(S group)과 한약, statin 병용 투여군(MO-PM-S group)을 상대 비교했을 때 간의 fatty degeneration, vacuole formation 빈도가 S group 30%, MO-PM-S group 10%로 한약, statin 병용 투여군에서 긍정적 결과가 나왔다.
대동맥에서는 내막과 중막을 중심으로 변화를 살펴보았으나, 전형적으로 고지방식이에 의한 혈관 변화로 판단할만한 병변은 모든 동물에서 관찰되지 않았다. 또한 시험군 별로 뚜렷한 차이가 있는 소견도 확인되지 않았다.
IV. 고 찰
식생활의 서구화와 사회적인 원인으로 인해 고지혈증, 동맥경화증 등과 같은 순환기질환의 발병이 계속 증가되어 현재 한국의 3대 사망원인에 심장 질환과 뇌혈관 질환이 차지하고 있는 만큼 고지혈증의 치료가 중요한 시점이다1. 현대 약물과 병용 투여하였을 때 고지혈증 치료 효과를 상승시킬 수 있는 한약재를 찾고자 본 실험을 시행하였으며, 주요한 고지질혈증 약물인 pravastatin을 단독 투여했을 때와 pravastatin을 후박-하수오와 병용하였을 때 지질을 낮추는 효과를 비교하였다.
고지방식이 및 시약 경구 투여를 2주간 병행한 후 측정한 체중 증가량(g)은 후박-하수오, pravastatin 병용군(32.5±3.1)이 Control군(47.0±4.8)이나 Statin군(51.4±2.6)에 비하여 통계적으로 유의하게 낮았다. 이를 통해 후박-하수오가 실험용 Rat의 체중 증가를 억제한다고 볼 수 있다.
혈액 검사 결과 HDL-cholesterol(mg/dL)은 후박-하수오, statin 병용군(52.2±2.0)이 Control군(44.8±2.2)이나 Statin군(44.4±1.9)에 비하여 유의하게 높았으며, 이는 후박-하수오의 HDL-cholesterol 증가에 대한 긍정적 효과를 시사한다.
그러나 LDL-cholesterol(mg/dL)은 후박-하수오, statin 병용군(17.1±1.2)이 Control군(13.5±0.9)이나 Statin군(13.1±0.8)에 비하여 유의하게 높았으며, 특히 pravastatin 단독 투여 시보다 후박-하수오 병용 투여 시에 LDL-cholesterol이 유의하게 높아졌다는 점은 후박-하수오의 부정적 효과를 시사한다.
또한 Total cholesterol(mg/dL)은 후박-하수오, statin 병용군(87.4±3.3)이 대조군(74.3±3.3)에 비해 유의하게 높았으며 이는 후박-하수오와 statin의 병용투여가 total cholesterol을 증가시켰을 가능성을 보여준다. 한편, 하수오가 장기적인 알코올 투여로 유발된 흰쥐의 고지혈증의 예방에 미치는 영향을 살펴본 장 등15의 보고에서 total cholesterol은 하수오 투여군에서 대조군에 비해 유의성 있게 감소한 바 있다.
Triglyceride는 다른 세 군에 비해 Statin군에서 두드러지게 높은 수치(393.6±38.7)를 나타냈는데, 후박-하수오, statin 병용군(141.5±15.7)에서 Statin군에 비해 통계적으로 유의하게 수치가 감소하였다. 이를 통해 후박-하수오가 statin과 병용될 때 Triglyceride 상승을 억제하는 효과가 있음을 추론해볼 수 있다.
한편, AST와 ALT는 후박-하수오, statin 병용군에서 오히려 정상군보다 수치가 유의하게 감소하여 시약 투여가 간(肝) 손상에 영향이 없음을 나타냈다. 또한, BUN과 Creatinine은 군 간 유의한 차이가 없어 시약 투여가 신장(腎臟) 손상에 영향이 없음을 나타냈다. 영양 지표의 변화를 알아보기 위해 분석한 Total Protein, Albumin, CBC에서는 후박-하수오 pravastatin 병용군의 Hct(Hematocrit)과 Platelet이 Control군보다 유의하게 높았으며, 시약 투여가 영양에 미치는 악영향이 없다고 사료된다.
그리고 조직학적 검사 결과 간에서는 일부 개체에서만 대수포성 지방증이 관찰되었는데, Statin 투여군 10마리 중 3마리에서, 후박-하수오, statin 병용 투여 군 10마리 중 1마리에서 관찰되었고, 나머지 그룹(Normal군, Control군)에서는 관찰되지 않았다. Statin 단독투여군보다 후박-하수오, statin 병용 투여 군에서 대수포성 지방증의 빈도가 적으므로 후박-하수오 병용 투여가 지방간 발생을 감소시킨다고 볼 수 있다. 대동맥에서는 내막과 중막을 중심으로 변화를 살펴보았으나, 전형적으로 고지방식이에 의한 혈관 변화로 판단할만한 병변은 모든 동물에서 관찰되지 않았다. 또한 시험군 별로 뚜렷한 차이가 있는 소견도 확인되지 않았다.
V. 결 론
후박과 하수오의 항고지혈증 효과를 알아보기 위해 각 군 10마리 SD male rat 4군으로 2주간 약제 투여 후 체중 변화 분석, 혈액 검사, 조직 검사를 하여 다음과 같은 결론을 얻을 수 있었다.
고지방식이 투여 기간(2주)이 너무 짧아 Normal군과 Control군의 실험 전후 체중이 거의 비슷하지만, 후박-하수오, statin 병용 투여군의 결과를 통해, 후박-하수오가 실험용 Rat의 체중 증가를 억제한다고 볼 수 있다.
후박-하수오는 HDL-cholesterol 증가에 긍정적 효과가 있지만, LDL-cholesterol과 Total cholesterol을 증가시킨다. 한편 후박-하수오가 statin과 병용될 때에는 Triglyceride 상승을 억제하는 효과가 있다.
후박-하수오, statin의 2주간 투여는 간(肝) 및 신장(腎臟) 손상을 유발하지 않았으며, 영양에 미치는 악영향 또한 없었다.
Normal군과 Control군에서 간의 지방축적 병변이 관찰되지 않았지만, Statin 단독 투여군과 후박-하수오, statin 병용 투여군을 상대 비교했을 때 후박-하수오 제제 병용 투여가 지방간 발생 감소에 도움을 준다고 볼 수 있다.
이상 결론은 실험용 rat을 이용한 in vivo 실험으로 한약의 약효가 서서히 나타나는 특성 상 후박-하수오 단독 투여 그룹은 2주 안에 효과가 나타나기 어려울 것으로 판단되어 실험에서 제외하였기 때문에 한약에 독립적인 의미를 부여하기는 어렵다. 또한 고지방식이 투여 기간이 짧아 Normal군과 Control군의 차이가 뚜렷하게 나타나지 않아 정확한 비교가 어려웠다. 향후 후박-하수오를 단독 투여하는 그룹을 추가하고 고지방식이 투여 기간을 늘린 연구가 추가적으로 필요할 것이다.