增味二陳湯 투여가 역류성 식도염 유발 생쥐에 미치는 영향
The Administration of Jeungmiyijin-tang to Rats with Induced Gastro Reflux Esophagitis
Article information
Abstract
Objectives
This study investigated the administration of Jeungmiyijin-tang (JYT) to rats with reflux esophagitis (RE) induced by pylorus and forestomach ligation operations.
Methods
Twenty laboratory rats were divided into three groups with 5~7 rats in each group. The control group consisted of rats with no inflammation (CON). The RE group had rats with gastroesophageal reflux elicited by pylorus and forestomach ligation operations. The JYT group had rats that were orally administered Jeungmiyijin-tang (1.5 ml/day/300 g) once a day for 14 days before reflux esophagitis was induced by the pylorus and forestomach ligation operations. Six hours after the operations, the rats were sacrificed, morphological changes were observed, and histological examinations were done in the stomach and esophagus lesion areas. If apoptosis was observed, the apoptotic cells in the esophagus lesion areas were counted.
Results
The morphological and histochemical changes consisted of various injuries from hemorrhagic erosion in the RE group, while there were significantly fewer in the JYT group.
The RE group marked increases of gastric mucosa erosion and infiltration of inflammatory cells in the submucosa, as well as cell division in the epithelial layer, the proliferation and degranulation of mast cells, and increases in the IL-1β, TNF-α, and MMP-9 expressions in the esophagus of the rats. The JYT group was inhibited above expression compared with the RE group. Apoptosis was statistically significantly decreased in the JYT group compared with the RE group.
Conclusions
According to the above results, it appears that Jeungmiyijin-tang inhibits the expression of pro-inflammatory cytokines (TNF-a, IL-1β, and MMP-9) and apoptosis in the esophagus mucosa, thereby preventing esophageal mucosal damage from esophageal reflux.
I. 서 론
위식도역류질환(gastroesophageal refiux disease)은 위 내용물이 식도로 역류하여 불편한 증상을 유발하거나 이로 인하여 합병증을 유발하는 상태로 내시경으로 관찰되는 점막 손상의 유무에 따라 미란성 식도염(erosive esophagitis)과 비미란성 역류질환(non-erosive reflux disease)로 나누어진다1. 역류성 식도염은 식습관 변화 및 고령 인구의 증가로 우리나라에서도 증가추세에 있고, 역류성 식도염의 원인은 하부식도 괄약근의 일과성 결함에 의한 산역류성 식도점막 상해가 주된 병태으로 알려져 있으며2, 연구에 의하면 산 역류의 정도와 역류성 식도염에 의한 점막의 손상 정도와는 비례가 없으나 병인에 연관되어 점막에서 유리되거나 관련이 있는 다른 여러 가지 매개 요인들이 관여 한 것으로 보고된다3.
역류성 식도염은 한의학적으로 “呑酸”, “吐酸”, “胸痺”, “噎膈” 등의 病證에서 그 유사성을 찾을 수 있으며4, 增味二陳湯은 明代 ≪醫方集略≫에 최초로 소개된 처방으로 白茯苓, 陳皮, 半夏, 甘草로 구성된 二陳湯에 梔子, 黃連, 香附子, 枳實, 川芎, 蒼朮, 白芍藥 神麴을 加한 처방으로 ≪東醫寶鑑≫ <雜病篇 內傷門-呑酸 吐酸>에서는 治呑酸 등 呑酸, 嘈雜 처방으로 기록되어있다4.
역류성 식도염 대한 국내 실험연구로 二陳湯加味方5-7,11, 半夏瀉心湯8, 金銀花물 추출물9 吳茱萸추출물10 등이 있으며, 중국에서는 二陳湯加味方12 左金丸 加減, 旋覆代赭湯 加減, 半夏瀉心湯 加減, 四逆湯 加減, 降逆湯 加減 등 임상효과 보고가 있고12, 또한 일본에서는 육군자탕에 대한 임상연구가 활발히 이루어지고 있다13,14.
이에 저자는 增味二陳湯이 역류성 식도염 유발이 된 생쥐의 위와 식도 조직에 대한 영향을 살펴보기 위해 생쥐를 아무처지도 받지 않은 대조군(CON)과 외과적 수술 결찰로 역류성 식도염을 유발한 군(RE), 역류성 식도염 유발전 增味二陳湯 추출액을 투여한군(JYT)군으로 나누어 위식도점막의 형태학적변화, 식도점막의 TNF-α와 IL-1β, MMP-9, apoptotic cell 변화를 관찰하여 유의성있는 결과를 얻었기에 보고하는 바이다.
II. 실 험
1. 실험재료
1) 실험동물
실험에 사용된 동물은 SD계 수컷 흰쥐(6 주령)를 오리엔트바이오로부터 구입하여, 일주일 동안 온도 22±1 °C, 습도 55±3%인 실험실 환경에서 12시간 밤낮 주기로 적응시킨 후 실험군 당 5-7마리씩 나누어 사용하였다.
2) 약 재
약재는 增味二陳湯 2첩(79 g)을 물 1500 ml을 넣어 90 °C에서 3시간 달인 후 100 ml로 감압 농축한 후, 농축된 JYT(수율, yield=4.06%)를 실험쥐에게 1일 1회 1.5 ml씩(1.5 ml/day/300 g) 구강 투여하였다. 단 세포처리를 위하여 동결건조하여 사용하였다.
본 실험에 사용한 약재의 반하, 적복령, 황련, 감초((주)지오허브), 진피, 치자, 향부자, 천궁, 백작약(선일제약), 지실(진영제약), 신곡(남영제약), 창출(옴니허브)에서 1첩당 용량은 다음과 같다.
3) 실험동물군
실험동물군으로는 역류성 식도염 유발군(RE), 增味二陳湯 투여군(JYT)으로 하였으며, 정상적인 실험동물(무처치군)을 대조군(CON)으로 하였다.
2. 실험 방법
1) 역류성 식도염 유발
역류성 식도염은 Nakamura 등1의 방법으로 유발하였다. 수술은 24시간 전부터 절식시킨 실험쥐를 sodium pentobarbital로 마취시킨 후 복강을 열어 위의 위저부와 유문부쪽을 실크실로 결찰시켰다. 봉합 6시간 후 실험동물을 희생시켜 식도와 위부위를 절취하여 실험에 이용하였다.
2) 증미이진탕 투여
실험쥐에게(JYT) 위수술하기 전 14일 동안 1일 1회 1.5 ml씩 구강투여(1.5 ml/day/300 g)하여, 수술 1시간 전에 마지막 약물을 투여하였다.
3) 조직표본제작
동물을 sodium pentobarbital(0.3 ml/100 g)로 마취시킨 후 복부를 절개하여 식도와 위를 절취하여 얻어진 조직을 10% 포르말린에 12시간 고정시킨 후 흐르는 물에 수세하였으며, 탈수화과정을 거친 다음 파라핀에 포매시켜 6 μm로 연속 절편하여 조직화학 및 면역조직화학적 염색 그리고 Tunel 염색에 이용하였다.
4) 조직 화학적 염색
절편된 조직 표본을 xylene을 이용하여 탈파라핀한 후 가수화(rehydration)하여 조직화학적 염색으로는, 일반적으로 시행하는 H&E 염색과 중성점액다당류를 청색으로 염색시키는 PAS, 비만세포(mast cell) 관찰을 위해 Luna 염색을 행하였다.
5) 면역 조직화학적 염색
면역조직화학적 염색으로는 탈파라핀한 후 가수화시킨 표본을 proteinase K(20 μg/ml)에 5분 동안 proteolysis 과정을 거친 후 3% H2O2로 5분간 처리하여 조직내의 내인성 과산화효소를 제거하고, 1차 항체(Table 2)를 처리하여 4 °C humidified chamber에서 24시간 동안 반응시켰다. 그 후 0.02 M phophate buffered saline(PBS)에 충분히 수세한 후 2차 항체를 실온에서 1시간 처리하였다. PBS로 수세한 후 ABC 용액(ABC kit, Vector Laboratories, Inc., Burlingama, CA. USA)에 30분간 반응시킨 후 0.05% 3,3´-diaminobenzidine tetrahydrochloride(DAB, Sigma)로 발색 반응을 확인하였으며, Hematoxylin으로 대조 염색하여 광학현미경(Olympus BX50, Japan) 하에서 비교 관찰한 후 디지털 카메라(Nikon E995, Japan)로 촬영하였다.
6) Apoptosis
Apoptosis 확인을 위해 in situ apoptosis detection kit(Apoptag, Intergen, USA)를 이용한 Tunel(terminal deoxynucleotid trasferase-mediated dUTP-biotin nick-end labeling) 염색을 실시하였다. 절편된 조직을 탈파라핀한 후 proteinase K에 5분간 proteolysis 시킨 다음 equilibration buffer에서 20초간 처리하였다. Strength TdT enzyme을 37 °C에서 1시간 동안 반응시킨 후 strength stop/wash buffer에서 10분, anti-digoxigenin-peroxidase에서 1시간 처리한 후 DAB로 발색 반응을 확인하고 eosin으로 대조 염색하여 광학현미경 하에서 관찰한 후 통계처리에 이용하였다.
7) 영상분석과 통계처리
Tunel 염색한 각 조직 표본 중 5곳을 100배율에서 관찰하였다. 세포자멸사(apoptosis)가 유도된 세포를 개수하여 통계 처리하였으며, 그래프는 means±S.E값으로 하였다. 실험군 간의 유의성 검증을 위해 SPSS(ver. 20.0) program을 이용하였으며, one-way ANOVA로 분석하고 DUNCAN으로 사후 검증하였다. 유의수준은 p<0.05에서 판별하였다.
III. 결 과
1. 형태적변화
역류성 식도염을 관찰하기 위해 먼저 위액의 분비로 인한 위조직의 형태적 변화를 확인하고자 H&E염색을 시행하였다. 대조군은 전형적인 위샘의 구조를 관찰할 수 있었다(Fig. 1A). 그러나 유발군은 위샘의 구조가 명확한 형태를 나타내지 못하며 짓무름(erosion) 현상으로 매우 손상되었으며, 또한 점막내근육층이 소실된 부분이 나타났으며 점막밑층에는 염증세포들의 침투, 증식이 두드러지게 관찰되었다(Fig. 1B). 약물 처리군에서는 유발군에 비해 위샘의 손상 정도가 감소되었으며, 점막밑층에서 관찰되는 염증세포도 유발군에 비해 현저히 감소하였다(Fig. 1C).

H-E stain (A, B, C) and PAS stain (D, E, F) in stomach of rat.
A, D : control group. Epithelial surface was coated with mucose (D). B, E : RE group. The change of gastric gland and infiltreation of inflammatory cells in submucosa (B). C, F : JYT treatment group, Bar=100 μm
PAS 염색을 통한 위조직의 변화를 관찰한 결과 대조군에서는 표면상피세포에서 분비된 점액이 적색으로 염색되어 위오목과 위샘의 표면을 덮고 있었으며, 이는 산성의 환경으로부터 보호되고 있음을 알 수 있다(Fig. 1D). 반면, 유발군은 위샘조직 손상으로 인해 점액을 분비할 수 있는 세포가 소실되어 대조군에 비해 현저히 감소되었으나(Fig. 1E), 처리군에서는 유발군에 비해 현저히 증가되었다(Fig. 1F).
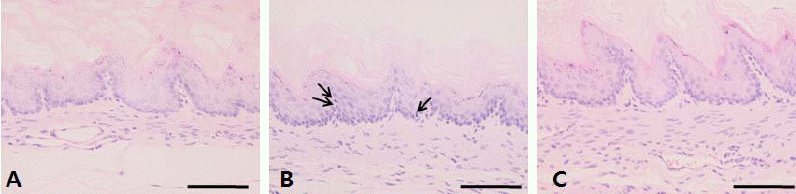
식도의 H&E 염색 결과, 대조군과 약물처리군은 형태적인 변화의 차이를 비교할 수 없었으나(Fig. 2A, 2C), 유발군은 식도 상피조직의 바닥층에서 세포분열이 일어나고 있는 세포가 대조군에 비해 많이 관찰되었다(Fig. 2B).
2.비만세포의 증식과 탈과립 현상
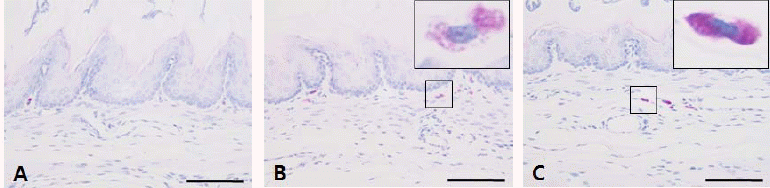
Luna 염색을 통해 비만세포를 관찰한 결과 대조군에서는 점막과 점막밑층에서 비만세포가 드물게 관찰되었다(Fig. 3A). 역류성 식도염이 유발된 군에서는 비만세포의 수가 현저히 증가되었으며 대부분의 비만세포는 탈과립 현상을 보였다(Fig. 3B). 반면, 약물 처리군에서는 대조군에 비해 비만세포의 수가 증가되었으나, 탈과립 현상을 나타내는 비만세포는 유발군에 비해 감소되는 경향을 나타내었다(Fig. 3C).
3. IL-1β 발현
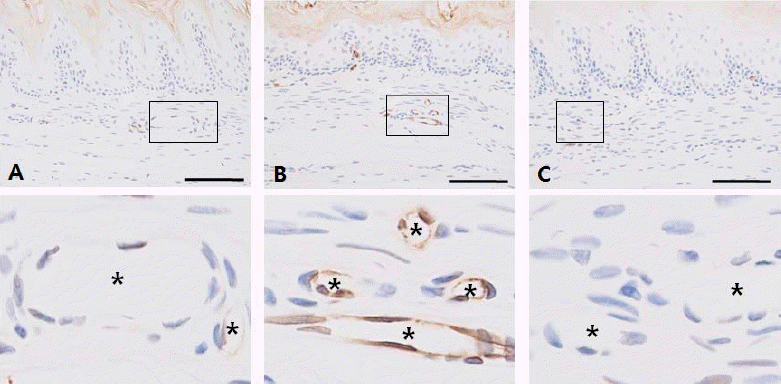
식도에서 IL-1β 발현은 대조군에서 혈관의 내피세포에 매우 약한 반응을 나타내거나 반응이 거의 없었으며, 관찰되는 비만세포에서 양성 반응을 나타내었다(Fig. 4A). 유발군에서는 비만세포 뿐만 아니라 혈관의 내피세포에서 매우 강한 양성 반응을 나타내어(Fig. 4B), 역류성 식도염으로 인해 혈관의 내피세포에서 IL-1β 발현의 증가됨을 알 수 있었다. 반면, 처리군에서는 비만세포에서의 양성반응은 관찰되었으나, 혈관의 내피세포에서는 IL-1β의 발현이 유발군에 비해 현저히 감소되거나 반응이 거의 나타나지 않았다(Fig. 4C).
4. TNF-α 발현
TNF-α의 발현을 확인한 결과, 대조군에서는 점막층 중 고유판(lamina propria)과 점막밑층에서 약한 양성 반응을 나타내었다(Fig. 5A). 그러나 유발군에서는 점막고유판에서 매우 강한 양성 반응을 나타내었으며(Fig. 5B upper), 점막고유판과 점막밑층의 세포에서 부종 현상이 관찰되는 곳이 있었다(Fig. 5B lower). 처리군에서는 TNF-α에 대한 양성 반응이 대조군에 비해 강하게 나타나는 부분이 있었으나 유발군에 비해 현저히 감소되었으며 부종 현상도 거의 관찰되지 않았다(Fig. 5C).
5. MMP-9 발현
MMP-9 발현을 관찰한 결과, 대조군에서는 비만세포에서 매우 약한 양성 반응을 나타내었으나(Fig. 6A), 유발군에서 비만세포에서 매우 강한 양성반응을 나타내었고 탈과립의 형태를 뚜렷이 확인할 수 있었다(Fig. 6B). 처리군에서도 MMP-9에 대한 양성 반응이 관찰되었으나 유발군에 비해 약하거나, 강한 반응을 나타내는 세포들이라도 탈과립 현상은 현저히 낮게 관찰되었다(Fig. 6C).
6. Apoptosis
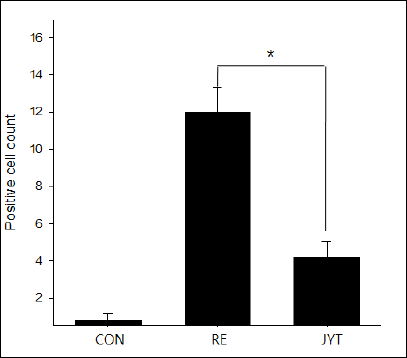
Tunel 염색을 통해 세포자멸사를 유도하는 것을 확인한 결과, 대조군에 비해 유발군은 평균 12.0±0.4개인 반면, 처리군은 평균 4.6±0.5개로 개수되었다. 유의성 검증에서 처리군과 유발군은 유의적인 차이를 나타내어 증미이진탕이 세포자멸사에 매우 효과적인 억제제로 작용함을 나타내었다(Fig. 7).
IV. 고 찰
근래 들어 식습관 변화와 및 고령 인구의 증과와 함께 우리나라에서도 증가추세에 있으며 적절히 관리되지 못할 경우에는 증상 지속에 따라 삶의 질이 현저의 저하되는 만성질환으로 환자의 신체적, 정신적 기능저하에 따른 사회경제적 손실이 적지 않다1.
역류성 식도염의 원인으로는 하부식도 괄약근의 일과성 이완 및 결함에 의한 산 역류성 식도점막 상해가 주된 병인으로 알려져 있으며3 위식도역류 증상을 개선하기 위해서 생활습관의 개선, 위산억제치료, 히스타민수용체 길항제 또는 제산제, 위장관 운동촉진제, 점막보호제, 하부식도조임근작용제 등이 표준치료방식으로 권고되며 그 중 프로톤펌프억제제가(proton pump inhibitor, PPI)가 위식도역류증상을 호전시키고 식도염을 치유하는데 가장 효과적이어서 일차 치료제로 권고된다2.
역류성 식도염의 치료에 있어 많이 사용되어 지고 있는 histamine type 2receptor antagonist 및 PPI 제제는 모두 산 분비를 억제하는 약물로, 위 점막의 벽 세포에서의 산 분비량을 줄여 위산 역류시 발생되는 증상을 완화시키며, 손상된 식도 점막을 치유케 하고 합병증을 막아주는 역할을 한다. 그러나 최대 40-60%에 이르는 환자에서 충분한 기간의 산분비 억제제의 투여에도 불구하고 오히려 협착이나 암 등의 합병증이 발생하기도하며 치료후 재발의 방지를 위해 약물을 중단하지 못하는 문제점이 있다14.
최근 연구에 따르면 산역류의 정도와 역류성 식도염에 의한 점막의 손상 정도 외는 비례관계가 없는 것으로 알려져 있어15, 병인에 연관되어 점막에서 유리되거나 관련이 있는 다른 여러 가지 매개 요인들이 관여할 것으로 생각된다.
역류성 식도염은 한의학적으로 “呑酸”, “吐酸”, “胸痺”, “噎膈” 등의 病證에서 그 유사성을 찾을 수 있다. 呑酸, 吐酸에 대하여 ≪內經素門至眞要大論≫에서 처음으로 ‘諸嘔吐酸暴注下迫 皆 屬於熱’이라 하여 原因을 熱이라 하였다16. 이에 대한 辨證은 크게 肝胃不和, 痰濕鬱阻, 胃氣虛逆로 대별하여 각각 舒肝和胃降逆, 淸化濕痰 和胃降逆, 健脾胃 降逆氣의 治法을 통해 四逆散 合 小半夏湯加減, 溫膽湯加味, 香砂六君子湯 合 旋覆代赭湯加減 등을 사용한다4.
본 실험에 사용된 增味二陳湯은 明代 ≪醫方集略≫에 최초로 소개된 처방으로 茯苓, 陳皮, 半夏, 甘草 로 구성된 二陳湯에 梔子, 黃連, 香附子, 枳實, 川芎, 蒼朮, 白芍藥 神麴을 加한 처방으로 ≪東醫寶鑑≫ <雜病篇 內傷門 -呑酸 吐酸>에서는 <治呑酸>이라고 하여 呑酸, 嘈雜 등의 증상에 사용된다.
역류성 식도염에 대한 국내 실험연구를 보면 최 등12은 이진탕가미방이 유문 및 전위결찰로 유발된 rat 역류성 식도염에 대해 대표적인 PPI제제인 omeprazole과 비교하여 효과적임을 입증하였고 박7은 이진탕가미방이 알콜로 유발된 역류성 식도염 모델 rat의 위점막 손상부위 증가억제, 산분비억제 효과, 펩신분비 억제효과 대하여 입증하였다. 이9와 김10은 각각 유문 및 전위결찰로 유발된 rat 역류성 식도염에 대해 금은화 물 추출물과 항산화 항염증 효과가 있음을 보고하였고, 장 등6은 반하사심탕이 하부식도조임근 수축과 위산분비 조절로 인하 역류성 식도염 유발을 억제함을 연구하였다.
일본에서는 육군자탕이 식도의 청소능과 운동능, 그리고 위산이나 담즙산에 대한 과민성을 개선시켜 위식도 역류질환치료에 유용하다고 밝히며21 표준용량의 양성자펌프 억제제와 육군자탕의 병용요법이 표준용량 두 배의 양성자 펌프 억제제와 유사한 임상적 효과를 보였다고 발표한바 있으며24,중국에서는 역류성 식도염에 대해 임상연구에서 左金丸 加減, 旋覆代赭湯 加減, 半夏瀉心湯 加減, 四逆湯 加減, 降逆湯 加減12, 加減梔連二陳湯, 加味二陳湯, 蔞貝二陳湯 등의 효과를 발표하였다11.
이에 저자는 增味二陳湯 이 역류성 식도염 유발이 된 생쥐의 위와 식도 조직에 대한 영향을 살펴보기 위해 생쥐를 아무처지도 받지 않은 대조군(CON)과 외과적 수술로 결찰로 역류성 식도염을 유발한 군(RE), 역류성 식도염 유발전 증미이진탕추출액을 투여한 군(JYT)으로 나누어 위식도 연결부 점막의 형태학적 변화, TNF-α와 IL-1β, MMP-9, apoptotic cell 변화를 관찰하였다.
역류성 식도염의 조직병리학적 소견은 국소궤양, 염증성 세포침유, 출혈, 점막의 국소적 탈락과 함께 점막하 조직층의 부종성변화가 주 특징이며, 이러한 변화 역시 역류성 식도염에 대한 약효 평가시 유용한 것으로 알려져 있다28.
본 실험에서도 역류성 식도염을 유발하는 위 결찰을 행한 6시간 후 위와 식도 조직을 관찰하였을 때 RE군의 위 조직은 많은 손상이 일어났으나 식도 부위에는 형태학적 변화가 뚜렷이 관찰되지 않았다. 대신 RE군의 식도의 상피조직의 바닥층에서 세포분열 중인 세포가 많이 관찰되었는데, 이것은 역류성 식도염에서 기저부과다증식(basal zone hyperplasia)을 관찰 할 수 있는 병리적 근거24,25로, 본 연구의 역류성 식도염 유발에 응용하였다.
또한 유발군(RE)에서 비만세포(mast cell)의 증식과 탈과립 현상이 대조군에 비해 현저히 증가되었으나 JYT군의 경우 RE에 비해 감소되어, 비만세포의 증식과 탈과립 현상이 초기 역류성 식도염에 중요한 영향을 미치고 있음을 알 수 있다.
비만세포는 히스타민, 트립타제, 키마제, 헤파린, 인터루킨, Tumor necrosis factor-α(TNF-α), Transforming growth factor-β(TGF-β), basic fibroblast growth factor (bFGF) 등 여러 종류의 염증 매개물질들을 함유하고 있다26-28. Iba 등29에 의하면, 12-O-tetradecanoylphorbolacetate (TPA)로 유도된 급성염증에서 MMP-9의 조절에 있어서 비만세포의 관여를 관찰하였을 때, 염증 초기 6시간째 비만세포의 수가 현저히 증가되었으나 24시간, 48시간째 측정에서는 급격히 감소되어, 시간이 경과함에 따라 나타난 비만세포의 완전한 탈과립 현상이고, 초기에 proMMP-9의 발현이 증가되면서 24시간째에는 proMMP-9 뿐만 아니라 MMP-9의 활성종인 74, 83kDa MMP-9의 증가됨을 설명한 부분이다. 이는 비만세포에서 MMP-9의 유전자 발현 조절이 탈과립 현상과 밀접한 영향이 있으며, 또한 활성 MMP-9의 유도가 TNF-α에 의한 것임을 알 수 있다. 본 실험에서도 TNF-α의 증가와 MMP-9의 발현 증가가 확인되었으며, 특히 MMP-9은 비만세포에서 관찰되었는데 유발군(RE)에서 매우 강한 과립형태의 발현이 확인되었으나 JYT군 에서는 비만세포에서 MMP-9의 발현이 현저히 감소되었다. 이것은 增味二陳湯이 비만세포의 탈과립 현상을 억제함으로 염증 진행을 억제하고 있음을 확인할 수 있는 부분이다.
또한, pro-inflammatory cytokines에 의해 systemic inflammatory response가 시작되는데, IL-1, TNF-α, IL-6가 가장 많이 연구되어 지고 있으며30-32, 이들 사이토카인은 다양한 세포들에 영향을 준다. 여러 종류의 염증매개물질 분비, multiple inflammatory cascasdes 유도 그리고 상호작용의 복합 networks을 만들어 낸다33-35. IL-1과 TNF-α는 혈관벽 조성, 특히 내피세포에 영향을 미치고 혈관 폐색과 회복을 포함하는 메커니즘에도 영향을 미친다36,37. TNF-α는 거대분자와 저분자에 대해 내피세포의 투과성을 증가시키며, 이러한 혈관 투과성에 관한 TNF-α의 영향은 세포골격 변화와 intercellular gap formation을 유도한다. 혈관 투과성의 증가에 따른 조직학적 변화는 부종으로 나타나는데, 이는 TNF-α 발현 증가에 부종이 원인이다. IL-1β도 투과성의 증가에 따른 염증 발달을 설명하며, 특히 손상에 의한 혈관 반응은 IL-1 family를 포함하는 사이토카인에 의해 조절되는 중요한 염증매개물질이다. 역류성 식도염 유발에서 TNF-α와 IL-1β 발현 증가 또한 보고되고 있다. 김 등10에 의하면 흰쥐 위의 위저부와 유분부쪽을 6시간 동안 결찰한 후 혈청내 사이토카인을 측정한 결과 TNF-α와 IL-1β의 증가되었음을 보고하였으며, Izumi 등38은 위의 위저부와 유분부 결찰로 유도되는 역류성 식도염에서 점막층 TNF-α와 IL-1β의 발현 증가가 있음을 보고하였다. 본 실험에 있어서 TNF-α의 양성 반응은 유발군(RE)의 점막고유판과 점막밑층에서 강하게 나타났으며 부종이 관찰됨으로 인해 TNF-α에 의한 염증진행임을 알 수 있다. 그러나 IL-1β의 경우는 혈관의 내피세포에서 강한 양성반응이 나타났으므로 혈관의 내피세포에 영향을 미쳐 투과성을 증가시킬 것으로 예상되며, TNF-α에 비해 반응의 범위가 극히 제한되어 나타나는 것은 IL-1β의 발현이 TNF-α에 의해 유도되기 때문에39 초기에는 TNF-α에 비해 발현 범위와 발현 양은 낮으나, 혈관의 내피세포에 가장 큰 영향을 미치는 것을 알 수 있었다.
IL-6는 발열과 급성기 반응의 가장 중요한 매개체중 하나로 이는 세포와 대식세포에의 면역반응에 의해 분비되는데 염증 유발시나 외상후 분비되며 뼈나 다른 조직을 염증으로 유도한다. IL-6는 전염증성 사이토카인이면서 함영증성 사이토카인이 된다.
Apoptosis는 세포가 정상적인 상태 또는 병리학적 요인에 노출된 후에 죽음에 이르게 되는 생리학적 과정을 말하며 apoptotic bodies는 주변 세포에 염증 손상 없이 가까이 있는 식세포의 인지로 제거된다. Apoptosis는 Bcl-2 family protein과 cysteine acid proteases인 caspase들이 중요한 조절인자로 작용하는 것으로 알려지고 있다40. 본 실험에서 apoptosis에 의한 염증 손상이 유도되는지 알아보고자 tunel 염색으로 확인한 결과, 유발군(RE)에서 apoptosis 증가된 것을 확인하였으며 약물을 투여한 결과 식도부분에서 apoptosis가 억제됨으로 인해 增味二陳湯이 apoptosis 유도를 억제하는 효과도 있는 것을 확인하였다.
그러므로 增味二陳湯이 위 결찰로 유도되는 역류성 식도염에 있어서, pro-inflammatory cytokine인 TNF-α를 억제함으로서 비만세포로부터 유도되는 활성 MMP-9에 의한 탈과립 현상의 억제와 조직의 염증 진행을 억제한다는 것을 알 수 있다. 또한 apoptosis의 억제에 실험적 효과가 있었다.
본 실험을 통하여 증미이진탕은 실험적으로 유발된 위식도점막에서 식도점막의 염증을 억제하는 효과가 있고, 기전은 식도점막에서 염증 초기 발현인자인 TNF-α와 IL-1β MMP-9 발현 억제와 apotosis 억제로 이루어지는 것으로 판단된다.
V. 결 론
CON, RE, JYT군의 위조직과 식도 조직을 관찰한 결과 다음과 같은 결론을 얻었다.
RE군에서 위조직의 염증과 궤양이 유발되나 식도 점막 손상에는 뚜렷한 변화가 관찰되지 않았다.
RE군의 식도점막에서는 apoptotic cell의 증가 및 비만세포의 증식이 확인되어 초기 염증 반응에 비만세포가 관여하고 있음을 알 수 있었다.
JYT군은 RE군에 비해 proinflammatory cytokines 인 TNF-α와 IL-1β의 발현 억제로 인해,혈관의 투과성이 억제되어 조직의 부종 및 비만세포의 침투가 억제됨을 확인할 수 있었다.
JYT군은 RE군에 비해 TNF-α로 유도되는 MMP-9의 발현 억제로 인해 비만세포의 탈과립 현상이 억제됨을 확인하였다.
JYT군은 RE 군에 비해 apoptotic cell 증가가 억제되었다
이상의 결과로 증미이진탕은 염증초기발현인자의 발현 억제와, apotosis 억제로 식도점막의 염증 진행을 억제시키는 항염증 효과가 있는 것으로 사료된다.