항암제 유발 말초신경병증 변증평가도구의 신뢰도 및 타당도 평가
Reliability and Validity Analysis of an Instrument for Pattern Identification and Evaluation in Chemotherapy-Induced Peripheral Neuropathy
Article information
Abstract
Objectives:
The purpose of this study was to evaluate the reliability and validity of an instrument for pattern identification and evaluation in chemotherapy-induced peripheral neuropathy (CIPN).
Methods:
The study consisted of 66 patients with CIPN (visual analog scale ≥30 mm, Eastern Cooperative Oncology Group ≤2). The test-retest reliability of the instrument for pattern identification and evaluation in CIPN was tested twice with the same patients in one week.
Results:
Pearson’s coefficient test-retest reliability of the instrument was 0.601-0.777. The internal reliability of each part was 0.619-0.811. To confirm the validity of the instrument for pattern identification and evaluation for CIPN, the correlation between the score for each identification pattern and that of other CIPN instruments was analyzed. The results revealed a positive correlation between the Functional Assessment of Cancer Therapy-General and CIPN-20.
Conclusion:
The reliability of the instrument for pattern identification and evaluation in CIPN was moderate, and the validity analysis revealed a positive correlation.
I. 서 론
현대의학에서 암 치료로 가장 많이 시행되는 항암화학요법은 암 환자의 생존율을 높이고 있지만 대부분 부작용을 유발하며 이로 인해 암 환자들은 신체적인 고통뿐만 아니라 정신적으로 불안, 우울 등의 정서적 고통을 받고 있다1. 항암화학요법의 부작용은 위장관계 장애, 호흡기계 장애, 심혈관계 장애, 신경계 장애 등 다양하게 나타난다. 그 중 신경계 장애는 혈액학적 독성에 이어 두 번째로 많은 부작용이다2. 항암화학요법으로 유발된 신경계 독성장애는 그 부위에 따라 뇌신경독성, 자율신경독성, 말초신경독성 등 다양한 종류가 있다. 항암제 유발 말초신경병증(chemotherapy-induced peripheral neuropathy, CIPN)은 항암화학요법 투여 후 말초신경에 손상, 염증, 퇴화로 인해 말초신경병증을 나타내는 경우를 말한다3.
CIPN은 이상 감각, 통증, 근력약화 등 다양한 증상이 나타나며 항암화학요법이 종료된 후 사라지기도 하지만 다수가 오랫동안 지속되기도 한다. CIPN을 호소하는 환자는 많지만, 외형적으로 차이가 없고 환자 본인이 느끼는 자각증상이 대부분이기 때문에 의료진도 간과하기 쉽다. 임상에서는 CIPN이 발생하면 증상 완화를 위해 마약성 진통제, 항 경련제, 삼환계 항 우울제와 같은 약물요법 등이 있지만 감소 효과가 미미한 경우를 경험하게 된다4. 그래서 CIPN이 발생할 경우 말초신경병증을 일으키는 항암제의 용량을 줄이거나 심지어 치료를 중단하는 경우도 있다. 항암화학요법을 중단하는 것은 암 치료에 있어 부정적인 결과를 가져올 수 있기 때문에 대부분 부작용으로 인한 고통을 감수하고 항암화학요법을 지속하며 결과적으로 환자는 일상생활에 어려움을 느끼고 삶의 질에 부정적인 영향을 미친다5.
현재까지 암환자에게 발생하는 말초신경병증 검사를 위한 표준화된 지침이 없는 상황이다. CIPN을 평가하기 위한 여러 가지 사정도구들이 사용되고 있으며 가장 폭넓게 제안되는 방법은 임상적 평가, 객관적 평가, 환자설문지, 생물학적 지표를 고려한 다각적 접근이다6. 먼저 임상적 평가에서는 national cancer institute common terminology criteria for adverse events (NCI-CTCAE), Eastern cooperative oncology group (ECOG), total neuropathy score (TNS), world health organization chemotherapy- induced peripheral neuropathy grade (WHO CIPN grade) 등이 가장 일반적으로 사용되고 있다7-10. 객관적 평가로는 electromyography (EMG), nerve conduction studies (NCS), quantitative sensory test (QST) 등이 있다. 이러한 검사방법은 침습적 검사라는 문제점 때문에 환자들의 순응도가 낮을 뿐 아니라 설문조사 결과와 상이한 결과를 보여 결과해석의 어려움이 있다11-14. 주관적평가로 환자 자가 설문지로는 chemotherapy-induced peripheral neuropathy-20 (CIPN-20), peripheral neuropathy scale (PNS), patient neurotoxicity questionnaire (PNQ), chemotherapy- induced peripheral assessment tool (CIPNAT) 등이 있다15-17. 이렇듯 환자가 호소하는 CIPN의 양상이 다양하고 광범위하여 여러 사정도구가 존재한다.
하지만 CIPN과 관련된 한의학적 진단 평가 도구가 부재하여 임상에서 항암제 유발 말초신경병증을 호소하는 환자들을 한의학적으로 진단하고 치료하는 과정에서 객관성이 부족하다는 문제가 있다. 이에 본 연구진은 항암제 유발 말초신경병증에 한의학적 진단 및 평가를 위하여 문헌고찰과 전문가 자문을 통한 변증평가도구를 개발하였다18.
이에 개발된 <항암제 유발 말초신경병증 변증평가도구>를 기반으로 신뢰도와 타당도 검증이 필요하기에 본 연구팀은 대전대학교 둔산한방병원에서 66명의 피험자를 대상으로 <항암제 유발 말초신경병증 변증평가도구>를 이용한 변증진단을 실시하고 신뢰도와 타당도를 검정하여 유의한 결과를 도출하였기에 보고하는 바이다.
II. 본 론
1. 연구기관과 대상인원
본 연구는 2015년 11월부터 2016년 5월까지 대전대학교 둔산한방병원에서 임상시험 모집에 참여한 피험자 66명을 대상으로 하였다.
목표한 대상자의 수는 요인분석에서 사용되는 이론을 적용하였다. 요인분석에서는 일반적으로 50에서 100개의 표본크기를 요구하는데 통상적으로 추천되는 규칙은 변수의 수와 관찰수의 비를 1:10의 사용이다. 본 연구의 평가도구는 4개 유형에서 각각 5내지 6개의 증상으로 측정되고 있고 각 유형에 대하여 일치도를 보는 것이므로 표본 크기는 60명이면 적절하다고 볼 수 있다는 통계적 판단을 하였다19,20. 따라서 순응도 80%를 고려하면 크기가 72명인 표본을 구축하면 될 것으로 판단하였다. 임상시험 중 66명이 모집되었을 때 Drop-Out 0% 이어서 임상시험의 유효성 통계분석에 적절한 인원이 모집되었다고 판단되어 66명으로 모집을 종료하였다. 최종적으로 institutional review board 승인일인 2015년 11월 13일로부터 연구종료일인 2016년 5월 31일까지 약 7개월간 66명을 모집하였다.
2. 연구방법
1) 임상시험심사위원회 임상연구 승인
본 연구는 연구시작 전에 대전대학교 부속한방병원 임상시험심사위원회에 임상시험계획서 등 서류를 제출하고 임상연구 승인을 받았다(DJDSKH-15-BM-12).
2) 피험자 모집
피험자는 병원 홈페이지, 포스터를 이용하여 모집하였다. 직접 임상연구센터에 내원하거나 전화를 통하여 내원일시를 예약한 다음 시험에 참가하도록 하였다.
3) 피험자 동의와 적합성 평가
임상시험에 참여를 신청한 지원자에게 임상시험의 목적, 방법, 발생 가능한 위험이나 불편, 비밀보장, 보상, 중도 포기의 권리 등의 설명을 하고 자유의사에 의해 피험자 동의서에 서면 동의를 하게 한 후 시험에 참여 하도록 하였다.
동의서에 서명한 지원자를 대상으로 인구학적 조사, 과거병력 및 과거력 조사, 문진 및 항암제 유발 말초신경병증 진단을 위한 구조적 면담도구 검사 등을 통하여 피험자 선정 및 제외기준에 따라 피험자로 적합한지 평가하였다.
4) 연구대상자 선정기준과 제외기준
동의서에 서명한 연구대상자 중 다음의 선정기준을 만족하고, 제외기준에 해당하지 않는 피험자를 대상으로 하였다.
(1) 선정기준
① 만 19세 이상으로 암을 진단받은 환자
② CIPN의 VAS 점수가 30점 이상인 경우(상지 또는 하지 중 높은 점수를 기준)
③ 삶의 질 평가수행도(ECOG)≤2인 경우
④ 보조치료(항암제, 방사선, 표적치료 등) 종료 후 1개월 이상 경과한 경우
⑤ CIPN과 관련된 약물을 복용하지 않거나 또는 2주 이상 복용하여도 최근 1개월 동안 증상이 VAS를 기준으로 변화가 없는 경우
⑥ 시험대상자 또는 시험대상자의 대리인이 자발적으로 동의서에 서명한 경우
(2) 제외기준
① 암의 치료와 관련하여 경구용 항암제를 복용하는 경우(호르몬 차단제(타목시펜, 레트로졸 등)는 제외)
② 망상, 환각 등의 정신증이 있거나 과거력이 있는 경우
③ 당뇨병성 말초신경병증이 있거나 과거력이 있는 경우
④ 뇌질환으로 인한 중추성 신경병증이 있거나 과거력이 있는 경우
⑤ 척추질환으로 인한 신경병증이 있거나 과거력이 있는 경우
⑥ 문자를 읽고 이해하고 쓰는 능력이 현저하게 떨어져 자가 설문에 어려움이 있다고 판단되는 경우
⑦ 다른 개입치료가 있는 임상시험에 참여중이거나 최근 3개월 이내 참여한 경험이 있는 경우
⑧ 기타 임상시험을 수행하기 어렵다고 판단되는 경우
5) 변증평가도구의 초안
<항암제 유발 말초신경병증 변증평가도구>18는 말초신경병증에 대한 한의학 문헌 고찰을 통해 정리한 변증유형과 임상증상을 전문가 자문을 통해 풍비, 한비, 습비, 허비 총 4개의 변증과 각 변증의 증상의 가중치를 확정하고 한글화작업을 실시하여 자가 설문식 변증평가도구이다. 허비는 기혈허비, 음허비, 양허비 3가지 변증으로 나누어진다. 이 도구는 30개 항목의 질문으로 구성되어 있고 각 질문에 5점 척도를 기입하도록 되어 있으며 결과는 각 변증당 확률점수로 제시되고 가장 높은 확률점수의 변증유형을 최종 변증으로 확정하게 된다. 또한 본 도구는 변증과 더불어 평가도구로서도 활용하게 만들었다. 처음 설문을 통해 결정된 변증문항에 대하여 치료 후 변증에 해당되는 항목에 대한 점수의 변화로 평가할 수 있다.
6) 임상 연구 실시
2명의 연구한의사(A, B)를 대상으로 기존에 개발된 <항암제 유발 말초신경병증 변증평가도구> 사용에 대한 사전교육을 실시하였다. 본 임상시험 진단기준에 부합한 66명을 대상으로 <항암제 유발 말초신경병증 변증평가도구>를 사용하여 변증을 실시하였다. 피험자는 1차 방문이후 7±2일에 연구센터에 2차 방문하여 총 2회의 변증진단을 받았다.
2명의 연구한의사(A, B)는 피험자의 방문 1, 방문 2 모두 각각 직관적 변증을 시행하고 한의사 A와 한의사 B의 직관적 변증은 서로 공개하지 않고 실시하였으며 그 후 피험자가 자가 설문지를 작성하였다(Fig. 1).
7) 통계 분석
<항암제 유발 말초신경병증 변증평가도구>의 신뢰도에 대한 평가 중 내적일치도는 각 변증별로 크론바흐 알파계수(Cronbach’s α Reliability Coefficient)를 사용하여 평가하였다. 변증점수 사이의 검사-재검사법(test-retest method) 신뢰도 평가는 각 변증별 평균점수의 피어슨 상관계수(Pearson correlation coefficient)를 통하여 평가하였다.
변증평가도구의 타당도는 각 변증평가점수와 CIPN 검사 점수들 간의 상관관계를 통하여 평가하였으며, 또한 방문1에서 변증도구로 변증군을 판별하여 변증군의 해당 변증점수와 CIPN 검사 점수들 간의 상관관계도 분석하였다.
통계분석은 SPSS(IBM® SPSS® statistics version 22.0)를 사용하였으며 통계적 유의성은 유의수준 5%에서 판단하였다.
III. 결 과
2. 항암제 유발 말초신경병증 변증평가도구의 신뢰도 분석
1) 변증평가도구 문항의 내적일치도 평가
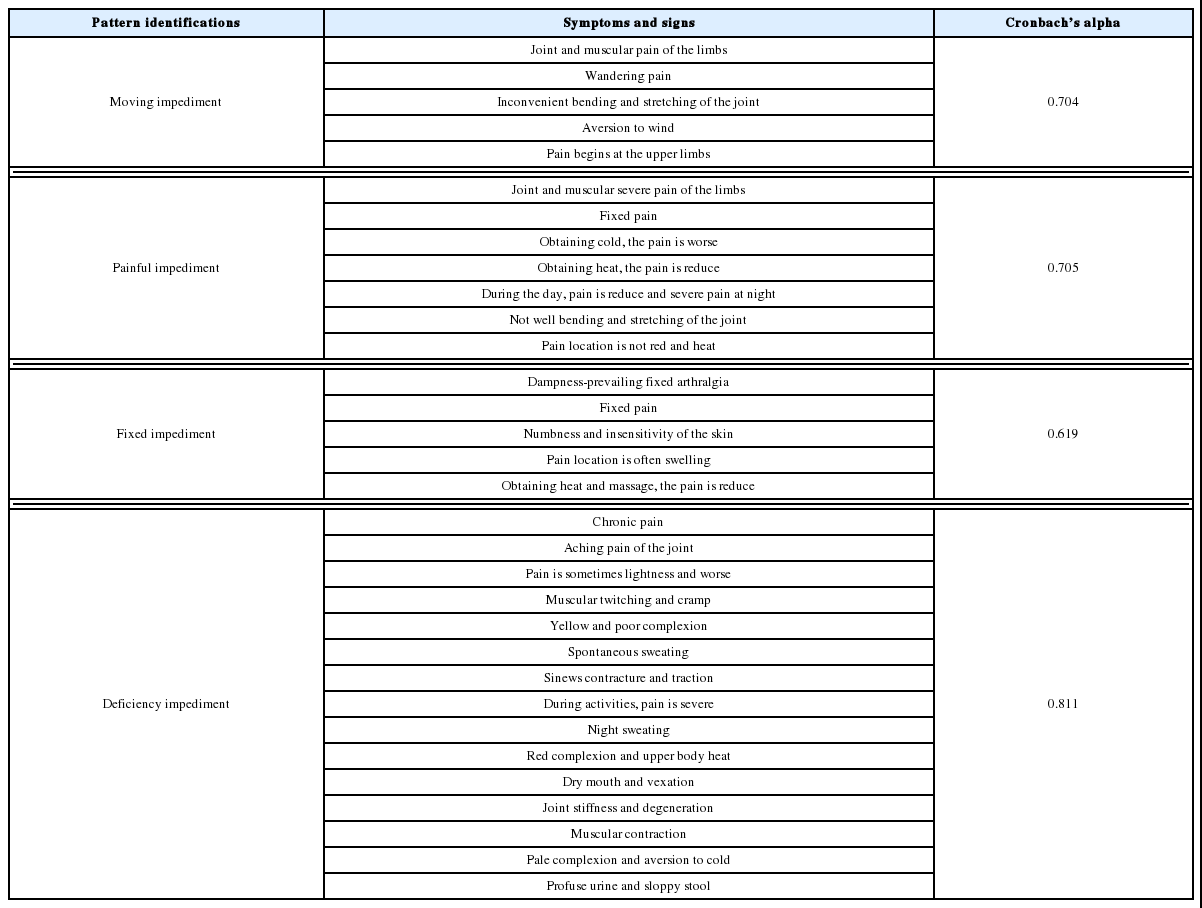
변증평가도구의 변증별 평가점수에 대한 크론바흐 알파(Cronbach’s α)값은 풍비의 경우 0.704, 한비 0.705, 습비 0.619, 허비 0.811로 나타났다(Table 2).
2) 검사-재검사 일치도 평가
피험자들의 1차와 2차의 두 방문시점 간의 변증점수 사이의 관계를 피어슨 상관계수를 구하여 살펴보았다. 여기서 변증점수는 변증도구를 시행하여 얻어진 각 변증군별 평균점수를 의미한다. 각 변증점수의 피어슨 상관계수는 0.601~0.777 사이의 값으로 모두 양의 상관관계를 보이는 것으로 나타났으며 이는 모두 통계적으로 유의하였다(Table 3).
3. 항암제 유발 말초신경병증 변증평가도구의 타당도 분석
1) 각 변증점수와 CIPN 관련 검사 점수들 간의 상관분석
각 방문시점별로 변증평가점수와 CIPN 관련 검사인 FACT-G, CIPN-20, PNQ 점수들과의 상관관계를 통하여 변증도구의 타당도를 살펴보았다. FACT-G는 PWB (physical well-being), SWB (social/family well-being), EWB (emotional well-being), FWB (functional well-being)의 세부항목으로 구성되어 있으므로 각 세부항목의 점수들도 함께 확인하였다.
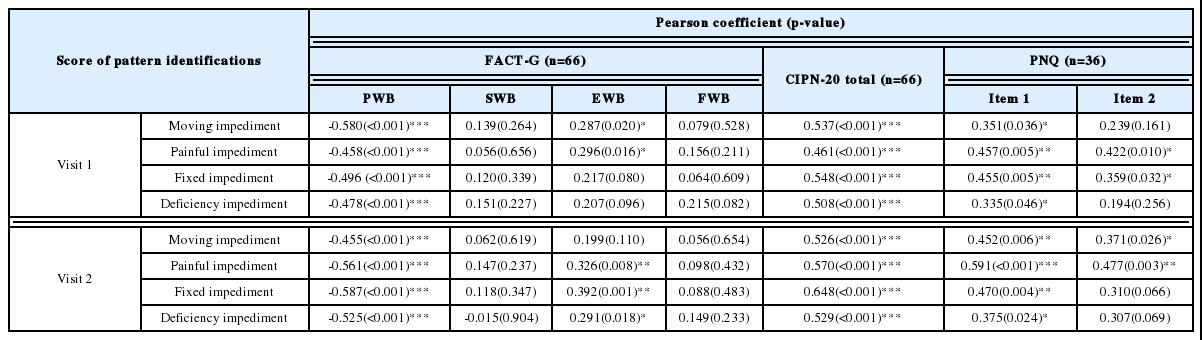
FACT-G의 PWB의 경우 두 방문의 변증점수 모두에서 음의 상관관계를 보이는 것으로 나타났고 유의수준 0.05에서 통계적으로 유의한 상관관계를 보이는 것으로 나타났다. CIPN-20의 경우 두 방문시점 모두에서 양의 상관관계를 보이는 것으로 나타나며 이는 유의수준 0.05에서 통계적으로 유의한 상관관계를 보이는 것으로 나타났다. PNQ 관련 문항 중 항목 1의 경우는 방문 1, 2의 변증점수 모두와 유의한 상관관계를 보였고 항목 2의 경우 방문 1에서 한비와 습비의 점수와 유의한 상관관계를 보였고 방문 2에서는 풍비와 한비에서 유의한 상관관계를 보였다(Table 4).
2) 변증유형(Visit 1)과 CIPN 관련 검사 점수들 간의 상관분석
변증군은 방문 1의 각 변증점수 중 가장 높은 점수를 가지는 변증을 의미하는데 이를 통하여 피험자들을 총 4개의 변증군으로 나누었다. 변증군별로 해당 변증점수와 CIPN 관련 검사인 FACT-G, CIPN-20, PNQ 점수들과의 상관관계를 살펴보았다.
FACT-G의 경우 모든 변증군에서 PWB는 음의 상관관계를 보이는 것으로 나타났으나 풍비와 허비의 경우만 통계적으로 유의하였다. 변증점수와 CIPN-20은 허비에서 통계적으로 유의한 양의 상관관계를 보이는 것으로 나타났다. 습비의 경우 PNQ가 같은 값을 가지므로 상관계수는 구해지지 않았다(Table 5).
IV. 고찰 및 결론
의료 기술의 발달에도 불구하고 암으로 인한 사망률은 매년 증가하는 추세를 보인다. 통계청 자료에 의하면 2013년 암으로 사망한 사람은 총 75,334명으로 전체 사망자의 28.3%였고 2014년 암으로 사망한 사람은 총 76,611명으로 전체 사망자의 28.6%로 증가 추세를 보였다21. 또한 세계 표준인구로 보정한 우리나라의 연령표준화발생률은 인구 10만 명당 285.7명으로, 미국(318.0명), 호주(323.0명) 보다는 낮았으나 OECD 평균(270.3명) 보다는 높았다22.
항암화학요법은 암 치료의 주된 치료방법이다. 말초신경증을 유발시키는 신경독성 항암제는 탁산계(Taxane)항암제, 플래티늄계(platinum compounds)항암제, 빈카 알칼로이드계(vinca alkaloids)항암제, 벨케이드계(bortezomib)항암제, 탈리도마이드계(thalidomide)항암제 등이 있다23. 이와 같은 신경독성 항암제를 투여 받는 환자의 30%에서 말초신경병증이 발생하며24 말초신경병증 증상은 급성적으로 발생하고 항암화학요법이 종료된 후 없어지기도 하지만 오랜 시간 지속되는 경우도 있으며 비가역적인 상태로 남을 수도 있다. 관련된 요인은 항암제의 축적 용량, 다른 신경독성 항암제 동시투여, 연령, 당뇨의 유무 등이 있다25.
항암화학요법 유발 말초신경병증에 단미제 효과로 동물연구가 진행된 석창포, 감국, 패모가 증상 개선 효과를 보였다26-28. 한약치료로는 계지가출부탕, 우차신기환, 시호가용골모려탕, 보양환오탕 등의 임상효과가 보고되었으며29-32항암화학요법 유발 말초신경병증에 대한 침 치료 및 치험례가 있으며 그 효과에 대한 평가 방법이 기존의 평가도구로 활용되었지만 다양한 말초신경병증을 평가하기에는 불충분하며 한의학적인 평가도구는 없었다33-36. 또한 실제 임상에서 항암화학요법으로 인한 말초신경병증의 복합치료로 침, 뜸, 한약치료를 병행하여 치료하지만 복합치료로 진행된 한방 치험례는 단 한건에 불과했다37.
이런 항암화학요법 유발 말초신경병증에 대한 침, 한약, 뜸 등의 개별 치료 및 한방복합치료 논문은 향후 평가방법의 객관적 지표를 마련하는데 반드시 필요한 작업이다.
한의학에서는 말초신경병증을 痺證의 범주에 둔다. 痺證은 기혈이 잘 통하지 않아 팔다리의 관절, 근육 및 피부의 통증이나 감각변화 및 저림 등을 말하는 것이다38. 이는 항암화학요법 유발 말초신경병증과 비슷한 양상의 증상을 나타내지만 항암화학요법 후 나타는 다양한 양상의 저림을 모두 표현하기 어렵다. 따라서 항암화학요법이라는 특수성과 증상의 양상에 따른 변증이 가능한 <항암제 유발 말초신경병증 변증평가도구> 디자인을 생각하게 되었다.
한의학에서는 변증을 통해 병리의 본질을 명확히 규정하여 진단 및 치료방법을 결정한다. 그러나 진료의 개인의 지식과 경험을 통하여 주관적으로 변증이 이루어지는 경우가 많기 때문에 객관적으로 변증을 결정하고 치료 전후에 대한 평가를 할 수 있는 한의학적 변증평가도구 개발연구가 진행되었다. 그러나 <항암제 유발 말초신경병증 변증평가도구>의 타당도와 신뢰도가 확인되지 않았기 때문에 실제 임상에서 활용하는데 무리가 있다. 이에 본 연구에서는 66명의 피험자를 대상으로 기존에 개발되었던 <항암제 유발 말초신경병증 변증평가도구>를 활용하여 변증유형, 증상항목의 신뢰도와 타당도를 평가하는 연구를 수행하였다. 신뢰도란 변증도구의 설문문항들의 일관성을 의미하며 이는 측정도구를 반복 시행하였을 때 동일한 결과 값이 나오는 것을 의미한다. 타당도란 사용하는 변증도구가 측정하고자 하는 것을 얼마나 대표하고 측정하고 있는가를 의미한다39.
본 연구는 66명의 피험자를 대상으로 수행되었으며, 신뢰도 분석은 변증 분류 문항의 내적일치도 평가로서 각 변증별 크론바흐 알파 계수(Cronbach’s alpha reliability coefficient)를 평가하였고 변증평가도구 점수 사이의 검사-재검사법을 이용한 신뢰도 분석의 경우에는 피어슨 상관계수(Pearson correlation coefficient analysis)를 이용하여 평가하였다.
변증평가도구의 변증별 평가점수에 대한 크론바흐 알파(Cronbach’s α)값은 풍비의 경우 0.704, 한비 0.705, 습비 0.619, 허비 0.811로 나타났다. 크론바흐의 알파(Cronbach’s alpha)값은 0.6을 받아들일만한(acceptable) 최소 기준으로 보는 성향이 있으므로 크론바흐의 알파계수 값은 0.6~0.8로 만족할 만한 수준(≥0.6)이였다.
검사-재검사 일치도 평가에서는 피험자들의 1차와 2차의 두 방문시점 간의 변증점수 사이의 관계를 피어슨 상관계수(Pearson correlation coefficient)를 구하여 살펴보았다. 여기서 변증점수는 변증도구를 시행하여 얻어진 각 변증군별 평균점수를 의미한다. 각 변증점수의 피어슨 상관계수는 풍비 0.774, 한비 0.601, 습비 0.663, 허비 0.777로 모두 양의 상관관계를 보이는 것으로 나타났으며 이는 통계적으로도 유의하였다.
타당도 분석은 <항암제 유발 말초신경병증 변증평가도구>와 CIPN-20, FACT-G, PNQ, WHO CIPN Grade와의 상관관계를 분석하여 알아보았다.
첫 번째로 각 방문시점별로 변증평가점수와 CIPN 관련 검사인 FACT-G, CIPN-20, PNQ, WHO CIPN Grade점수들과의 상관관계를 통하여 변증도구의 타당도를 살펴보았다. FACT-G는 PWB, SWB, EWB, FWB의 세부항목으로 구성되어 있으므로 각 세부항목의 점수들도 함께 확인하였다. FACT-G의 PWB의 경우 두 방문의 변증점수 모두에서 음의 상관관계를 보이는 것으로 나타났고 유의수준 0.05에서 통계적으로 유의한 상관관계를 보이는 것으로 나타났다. CIPN-20의 경우 두 방문시점 모두에서 양의 상관관계를 보이는 것으로 나타나며 이는 유의수준 0.05에서 통계적으로 유의한 상관관계를 보이는 것으로 나타났다. PNQ관련 문항 중 항목 1의 경우는 방문 1, 2의 변증점수 모두와 유의한 상관관계를 보였고 항목2의 경우 방문 1에서 한비와 습비의 점수와 유의한 상관관계를 보였고 방문 2에서는 풍비와 한비에서 유의한 상관관계를 보였다. 또한 WHO CIPN Grade는 66명 모든 환자가 Grade 1로 동일하게 체크되어 통계적으로 상관관계를 볼 수 없었다.
두 번째로 첫 번째 방문의 각 변증점수를 기준으로 변증을 구분하여 그룹을 나누고 해당 변증점수와 CIPN 관련 검사인 FACT-G, CIPN-20, PNQ 간에 관련이 있는지를 살펴본 결과, FACT-G의 PWB는 모든 변증군에서 해당 변증점수와 음의 상관관계를 보이는 것으로 나타났으며 이 중 풍비와 허비 그룹의 변증점수는 유의수준 0.05에서 통계적으로 유의하였다. 하지만 SWB, EWB, FWB의 경우 유의수준 0.05에서 통계적 유의성이 나타나지는 않았다. CIPN-20의 경우는 모든 변증군에서 해당 변증점수와 양의 상관관계를 보이는 것으로 나타났고 허비의 경우 유의수준 0.05에서 통계적으로 유의하였다. PNQ의 경우 통계적으로 유의하지 않게 나타났다.
FACT-G의 경우 삶의 질 척도로서 신체적상태, 사회/가족상태, 정서상태, 기능상태로 이루어져 있다. PWB는 신체상태는 나타내는 것으로서 손과 발이 저린 CIPN의 증상을 반영하는 변증평가도구와 더욱 관련이 밀접하다고 볼 수 있다. 변증점수와 CIPN 관련도구와의 관계와 변증과 CIPN 관련 검사에서 모두 PWB는 음의 상관관계를 보이는 것으로 나타났는데 이는 변증점수가 높다는 것과 신체적인 웰빙이 서로 상반된 관계로 해석할 수 있으므로 변증평가도구의 타당도를 뒷받침하는 결과라고 할 수 있다. CIPN-20의 경우 4점 척도로 CIPN의 증상을 평가하는 데 다용하는 평가도구이며 점수가 높을수록 증상이 악화된다는 것을 나타내는데 변증점수와 CIPN 관련도구와의 관계에서는 통계적으로 유의한 결과를 얻었으며 변증과 CIPN 관련 검사에서는 허비에서 유의수준을 보였다. 이는 변증평가도구가 허비를 평가하는데 더욱 민감하게 작동된다고 해석할 수 있으며 타당도를 뒷받침하는 결과라고 할 수 있다.
변증점수와 CIPN 관련도구와의 관계와 변증과 CIPN 관련 검사에서 PNQ는 모두 유의성이 높지 않았는데 이는 PNQ검사는 항암제가 Oxaliplatin, Taxanes, Cisplatin 및 Carboplatin인 환자에서만 평가하기 때문에 본 임상시험에서 피험자 수가 36명밖에 되지 않아서 유의성이 높지 않았다고 사료된다.
본 연구 결과를 토대로 항암제 유발 말초신경병증을 임상에서 활용하는데 있어서 하나의 변증으로 확정하는 도구라기보다는 환자의 변증특성의 비율을 확인하는 도구로 활용할 수 있을 것이다. 하나의 변증으로 결정하는 방법은 결과의 편차가 크기 때문에 각 변증의 점수를 모두 확인하고 환자의 변증의 경향성이 각각 어느 정도인지 확인하여 한약, 침, 뜸 등에서 수증가감하는 방향으로 설정하는 것을 권고한다.
본 연구는 다음과 같은 몇 가지 제한점이 있다.
첫째, 66명의 피험자로는 변증별로 의미 있는 표본수를 확보하기 어려웠다는 것이다. 변증의 종류를 4가지로 최소화했음에도 불구하고 습비의 경우 5명에 불과했다. 적은 표본수로는 작은 변이도 전반적 신뢰도에 일정 영향을 미쳐 객관적인 통계 값을 얻기 어려웠을 것으로 판단된다. 향후 변증의 종류와 그게 맞는 큰 규모의 추가적 임상연구가 필요할 것으로 생각된다.
둘째, 각 변증별 문항 수의 차이가 신뢰도에 영향을 미친 것으로 보인다. 기존에 허비의 세부 변증으로 기혈허비, 음허비, 양허비로 나누어 진단이 가능한 도구를 만들기 위하여 허비의 문항의 수가 많아지고 이에 반해 풍비, 한비, 습비는 문항의 수가 적어져 허비의 경우 임상에서는 해당변증으로 판별하는데 중요한 증상이라도 가중치가 작아지게 되어 도구가 변증을 객관적으로 판별하는데 어려움이 있었기에 향후 변증문항의 수를 조정하는 작업이 필요할 것으로 보인다.
셋째, CIPN 관련 도구와의 상관성 분석에서 충분한 타당도를 얻지 못했다는 것이다. FACT-G의 PWB와 CIPN-20에서 통계적인 유의성을 얻었지만 FACT-G의 SWB, EWB, FWB와 PNQ에서는 통계적 유의성을 얻지 못했다. CIPN과 연관성을 보기에는 FACT-G 항목이 다양하다는 것과 PNQ로 평가할 수 있는 피험자가 적었다는 것이 결과에 영향을 미쳤을 것으로 보인다. PNQ의 경우 몇 가지 항암제에 국한되어 평가할 수 있기 때문에 PNQ 도구는 상관석 분석에서 제외하는 것이 타당하였다고 본다. 향후 CIPN을 평가하는데 있어서 좀 더 보편적이고 관련성을 잘 파악할 수 있는 도구에 대한 심도있는 논의가 필요할 것으로 보인다.
본 연구는 <항암제 유발 말초신경병증 변증평가도구>의 신뢰도와 타당도를 평가하는 임상적 연구로서 일부 한계가 있었지만 항암제 유발 말초신경병증의 한의학적 진단 및 평가의 객관화를 위한 기초가 되는 연구로서 의의가 있다고 할 수 있으며 향후 연구결과를 바탕으로 임상에서 중요한 의의를 가지고 있는 증상 항목에 대한 충분한 논의를 통해 수정 및 보완이 필요하며 더 큰 규모의 임상시험이 필요할 것으로 보인다.
감사의 글
본 연구는 2015년도 보건산업진흥원 사업(HI15C0007) 지원으로 이루어졌음.