Ⅰ. 서 론
불완전한 산소의 환원에 의해 형성된 반응성 분자인 활성산소종(reactive oxygen species, ROS)은 세포 내 신호 및 항상성 유지에 중요한 역할을 한다1,2. 그러나 대사 과정에서 과잉 생성된 ROS는 산화적 스트레스(oxidative stress)를 발생시키며, 이는 다양한 질환의 병태 생리학에 연관되어 있다3,4. 이러한 ROS 축적은 단백질, 지질, 핵산과 같은 생물학적 분자의 산화적 손상을 유발하기 때문에5,6, 이에 대응하기 위하여 우리 몸을 구성하고 있는 세포들은 산화적 스트레스로 인한 신체 기능 장애를 막기 위해 다양한 항산화효소를 생산 한다7-9.
세포 내에서 ROS 생성에 관여하는 핵심 소기관은 미토콘드리아인데, 미토콘드리아는 ROS에 가장 손상 받기 쉬운 표적기관이기도 하다. ROS에 의한 산화적 스트레스는 미토콘드리아 외막과 내막 사이에 존재하는 cytochrome c와 같은 apoptosis 유도 인자들을 세포질로 방출시켜 caspase-9의 활성에 이은 caspase-3의 활성화를 통하여 내재적 세포사멸(intrinsic apoptosis)을 유도한다. 특히, 반응성이 높은 ROS의 중간 분해 산물인 H2O2는 산화적 손상에 가장 중요한 유발인자로 간주되고 있다10,11. 따라서 H2O2는 간세포를 비롯한 다양한 세포들에서 in vitro 산화적 스트레스를 모방하는 데 자주 사용되고 있다12-16. 또한 세포 외에서 H2O2는 세포막을 통과해 세포 내 H2O2농도를 직접적으로 증가시킬 수 있고17,18, 산화적 스트레스에 의한 미토콘드리아의 기능 장애에 따른 ATP 생성량의 감소는 간세포를 포함한 다양한 세포에서 산화적 스트레스로 인하여 나타나는 초기 단계 현상임이 밝혀졌다19-21.
노근은 벼과(Gramineae)에 속한 다년생 초본인 갈대(Phargmites communis Trinius)의 根이나 根莖을 건조한 것으로 淸熱瀉火藥에 해당된다. 性은 寒하고 味는 甘하고 肺⋅胃經으로 歸經하여 淸熱生津, 除煩止嘔, 利尿하는 효능이 있으며 胃熱嘔吐, 肺熱咳嗽, 肺癰吐膿, 熱淋澁痛에 사용 한다22. 임상적으로는 感冒, 급⋅만성기관지염, 급성편도선염, 구취, 폐농양, 급⋅만성간염 및 담낭염에 응용한다23.
국내 연구에서는 노근 추출물의 항염증 효능24, 항균 효능25, 비만세포의 cytokine 분비 억제 효능이26, 중국에서는 노근 다당류의 간세포손상 및 간 섬유화에 대한 간세포 보호 작용이 보고되었으며27,28, 특히 streptozocin으로 유도된 당뇨병 모델에서 간 미토콘드리아에 대한 산화스트레스를 개선한다고 보고되었다29.
하지만 국내에서는 산화적 스트레스에 의한 세포 손상에 미치는 노근의 보호 효과에 관한 연구가 이루어진 바 없다. 따라서 본 연구에서는 Chang 간세포를 대상으로 H2O2로 유발된 산화적 스트레스에 의한 DNA손상 및 apoptosis유도에 미치는 노근의 에탄올 추출물(ethanol extract of Phragmitis Rhizoma, PR)의 보호 효능을 조사하였다.
II. 실험 재료 및 방법
1. 노근 추출물 준비
본 연구에 사용한 노근은 (주)옴니허브(대구광역시, 대한민국)에서 구입하였으며, 노근의 에탄올 추출물을 얻기 위하여 노근 100 g 당 1 L의 70% 에탄올을 첨가하여 상온에서 3일간 200 rpm으로 교반하였다. 추출물은 여과지(Whatman No. 3 filter paper, Whatman International Ltd., Maidstone, UK)로 여과한 뒤 농축하였고, 농축물은 동결 건조해 분말화 하였으며 획득 수율은 약 10.08% 정도였다. 이후 추출물을 멸균시킨 증류수에 100 mg/mL (stock solution)의 농도로 녹였고, Minisart® Syringe filter(0.2 μm, Sartorius AG, Weender Landstr., Germany)로 거른 후 사용 전까지 -20 ℃에서 보관하였으며, 적절하게 세포 배양용 배지에 희석하여 사용하였다.
2. 세포 배양
Chang 간세포(human hepatocyte-derived Chang liver cell line)는 American Type Culture Collection (Manassas, VA, USA)에서 구입하였으며, 10% fetal bovine serum(FBS, WELGENE, Daegu, Republic of Korea) 및 1% penicillin-streptomycin과 1% L-glutamine이 함유된 RPMI 1640 배지(WELGENE)를 사용하여 37 ℃, 5% CO2 조건에서 배양하였다. 세포의 적정 수 유지를 위하여 48시간마다 trypsin/ ethylene-diaminetetraacetic acid(EDTA, Sigma-Aldrich Chemical Co., St. Louis, MO, USA)로 처리하여 계대 배양을 하였다.
3. ABTS+ scavenging activity 측정
산화적 스트레스에 대한 노근 추출물의 세포독성 여부를 조사하기 위하여 Chang 세포를 다양한 농도(0~2.0 mg/ml)의 노근 추출물 또는 H2O2(0.1~2.0 mM)를 처리하거나, 적정 농도(0.2 및 0.4 mg/ml)의 노근 추출물을 1시간 전 처리한 후 1 mM의 H2O2 (Sigma-Aldrich Chemical Co.)로 처리하여 24시간 배양하였다. 배양이 끝난 뒤, 배지를 제거하고 농도 0.5 mg/ml의 3-(4,5-dimethylthiazol-2-yl)-2,5 diphenyl tetrazolium bromide(MTT, Sigma-Aldrich Chemical Co.) 시약을 넣어 37 ℃, 5% CO2 incubator내에서 2시간 동안 반응시켰다. 반응이 끝난 후, 배지를 제거하고 dimethyl sulfoxide(DMSO, Sigma-Aldrich Chemical Co.)로 생성된 formazan을 모두 녹인 후 540 nm에서 enzyme-linked immunosorbent assay (ELISA) reader(Molecular Devices, Sunnyvale, CA, USA)를 이용하여 흡광도를 측정하였다. 아래와 같이 각 세포에 대한 독성은 대조군을 기준으로 하여 백분율로 나타내었다. 그리고 노근 추출물과 H2O2를 단독 및 동시 처리한 조건에 따른 세포 형태의 변화를 위상차 현미경(Carl Zeiss, Oberkochen, Germany)을 이용해 200배의 배율로 관찰하였다.
4. Apoptosis 유도 확인을 위한 핵의 형태적 변화 관찰
H2O2 처리로 인한 Chang 세포의 apoptosis 유발과 이에 미치는 노근 추출물의 영향을 확인하기 위해 핵의 형태 변화를 관찰하였다. 이를 위하여 준비된 세포를 fixing solution [3.7% formaldehyde in phosphate buffered saline (PBS)]으로 처리하여 상온에서 10분 동안 고정하였다. 고정된 세포를 PBS로 수세한 후 4’,6-diamidino-2-phenylindole(DAPI, Sigma-Aldrich Chemical Co.) 용액(1 mg/ml)으로 염색하였으며, 이 세포들을 PBS 및 증류수로 재세척한 후 형광 현미경(Carl Zeiss)을 이용해 400배의 배율로 핵의 형태 변화를 관찰하였다.
5. Apoptosis 유도의 정량적 분석
정상 및 노근 추출물과 H2O2가 단독 또는 동시에 함유된 배지에 배양된 Chang 세포에서 apoptosis 유도에 대한 정량적 분석을 위하여, 준비된 세포를 PBS로 수세 후 1,000 rpm으로 10분 간 원심분리를 하였다. 원심분리로 모아진 세포를 PBS로 잘 부유시키고, ethanol을 이용하여 4 ℃에서 1시간 동안 고정시켰다. 고정된 세포들을 핵산에 특이적으로 결합하는 propidium iodide(PI, 50 μg/ml; Sigma-Aldrich Chemical Co.)와 10 kunit의 RNase(Sigma-Aldrich Chemical Co.) 용액을 처리해 암실, 4 ℃에서 1시간 동안 염색하였다. PBS로 두 차례 수세 후 DNA flow cytometer(Becton Dickinson, San Jose, CA, USA)를 적용하여 형광반응에 따른 histogram을 ModiFit LT(Becton Dickinson) program을 사용해서 분석하였다.
6. ROS 생성의 측정
H2O2의 자극에 의한 Chang 세포에서의 ROS 생성에 미치는 노근 추출물의 영향을 조사하기 위해 Chang 세포에 적정 농도의 노근 추출물을 6시간 동안 처리하거나, 1시간 동안 노근 추출물을 처리한 후 1 mM의 H2O2를 다시 6시간 처리하였다. 이들 세포에 10 μM의 2’,7’-di-chlorodihydrofluorescein diacetate(DCF-DA, Sigma-Aldrich Chemical Co.)를 처리하여 37 ℃에서 반응시켰다. 20분 후, non-specific staining을 제거하기 위해 PBS로 수세한 뒤 flow cytometer를 이용하여 ROS의 생성량을 비교하였다. 또한 같은 조건에서 배양된 세포를 대상으로는 형광 현미경으로 ROS 생산의 정도를 관찰하기 위하여 coverslip에 부착된 Chang 세포에 동일 조건으로 노근 추출물 및 H2O2로 처리하였다. 그리고 이 세포들을 DCF-DA로 염색하여, 4% paraformaldehyde (Sigma-Aldrich Chemical Co.)으로 20분 동안 고정시킨 후 수세하고 형광 현미경을 사용하여 200배의 배율로 관찰하였다.
7. DNA 손상 확인을 위한 comet assay
Alkaline comet 분석을 통해 DNA 손상을 평가하기 위해서 노근 추출물 및 H2O2가 단독 또는 동시 처리된 조건에서 배양된 세포를 모아 0.5% low-melting-point agarose와 혼합하였다. 이 혼합물을 37 ℃에서 normal agarose(1% in PBS)로 코팅한 슬라이드 위에 펼치고 5분 동안 얼음 팩을 사용하여 냉각시켰다. Agarose가 고형화 된 후, lysis solution [2.5 M sodium chloride (NaCl), 100 mM Na-EDTA, 10 mM Tris, 1% Triton X100 및 10% DMSO(pH 10)]을 이용해 1시간 동안 4 ℃에서 반응시켰다. 반응이 끝난 슬라이드를 300 mM sodium hydroxide 및 10 mM Na-EDTA(pH 13)를 함유한 gel 전기영동 장치에서 30분간 DNA 풀림을 허용하여 30분 동안 전기영동으로 분리하였다. 전기영동 후 슬라이드를 neutralizing buffer(0.4 M Tris, pH 7.5)로 5분간 수세한 뒤, 4 ℃에서 absolute ethanol로 탈수시킨 후 건조시켰다. 반응이 끝난 세포를 20 μg/ml PI 용액으로 염색하고 이미지를 형광현미경을 사용하여 200배의 배율로 관찰하였다.
8. 단백질의 분리 및 Western blot 분석
노근 추출물과 H2O2가 단독 또는 동시 처리된 조건에서 배양된 Chang 세포에 lysis buffer [25 mM Tris-Cl(pH 7.5), 250 mM NaCl, 5 mM EDTA, 1% Nonidet-P40, 1 mM phenymethylsulfonylfluoride, 5 mM dithiothreitol]를 첨가해 1시간 동안 4 ℃에서 반응시켰고, 14,000 rpm, 30분간 원심 분리하여 상층액에 존재하는 단백질을 분리하였다. Bio-Rad 단백질 정량시약(Bio-Rad Lab., Hercules, CA, USA)으로 단백질을 정량한 다음, 동일 양의 시료를 Laemilni sample buffer(Bio-Rad Lab.)와 혼합하여 sodium dodecyl sulphate(SDS)-polyacrylamide gel을 이용하여 전기영동 후, polyvinylidene difluoride (PVDF) membrane(Schleicher and Schuell, Keene, NH, USA)에 전이시켰다. 단백질이 전이된 membrane을 5% skim milk로 1시간 처리하여 비 특이적인 단백질을 차단시켰고, 1차 항체와 2차 항체를 각각 4 ℃에서 하룻밤 동안, 상온에서 2시간 이상 반응 시켰다. 반응이 완료된 membrane을 암실에서 enhanced chemiluminoesence(ECL) solution(Amersham Biosciences Co., Arlington Heights, IL, USA)을 적용하여 특정 단백질의 발현을 분석하였다. 각각의 단백질 발현에서 상대적인 발현을 분석하기 위해서 Image J software(National Institute of Health, Bethesda, MD, USA)를 사용하였다. 본 연구에 사용된 1차 항체와 2차 항체로 사용한 horseradish peroxidase (HRP)-conjugated anti-rabbit과 anti-goat 항체는 Santa Cruz Biotechnology, Inc.(Santa Cruz, CA, USA)에서 구입해 사용하였다.
9. 미토콘드리아 막 잠재력(mitochondrial membrane potential, MMP, Δψm) 분석
노근 추출물과 H2O2가 단독 또는 동시 처리된 Chang 세포에서의 미토콘드리아 활성을 평가하기 위한 MMP 값(Δψm) 변화를 측정하기 위해서 dual-emission fluorescent dye인 5,5’,6,6’,-tetrachloro- 1,1’,,3,3’,-tetraethylbenzimidazolylcarbocyanine lodide (JC-1, Amersham Biosciences Co.)을 이용하였다. 그리고 적절한 조건에서 배양된 세포를 모아서 PBS로 수세한 후, 10 μM의 JC-1 용액으로 처리해서 20분 간 상온에서 반응시켰다. 반응이 끝난 뒤 상층액을 제거하고 PBS를 첨가해서 세포를 부유시킨 후 flow cytometer에 적용하여 MMP의 변화를 측정하였다.
10. ATP 함량의 변화 측정
노근 추출물과 H2O2가 단독 또는 동시 처리된 Chang 세포에서 ATP 생성 양의 변화를 관찰하기 위하여 Parone30의 방법에 준하는 luciferase/luciferin-based system을 사용하였다. 즉, 분리된 30 μg의 미토콘드리아 pellet를 0.1% bovine serum albumin, 1 mM malate 및 1 mM glutamate를 함유한 buffer A (150 mM KCl, 25 mM Tris-HCl, 2 mM potassium phosphate, 0.1 mM MgCl2, pH 7.4)와 buffer B (containing 0.8 mM luciferin and 20 mg/ml luciferase in 0.5 M Tris-acetate, pH 7.75)에 재현탁 시켰다. 그리고 0.1 mM ADP를 첨가해서 반응을 개시하고 microplate reader를 사용하여 ATP의 생성량을 조사하였다.
III. 결 과
1. Chang 세포의 증식에 미치는 노근 추출물과 H2O2의 영향
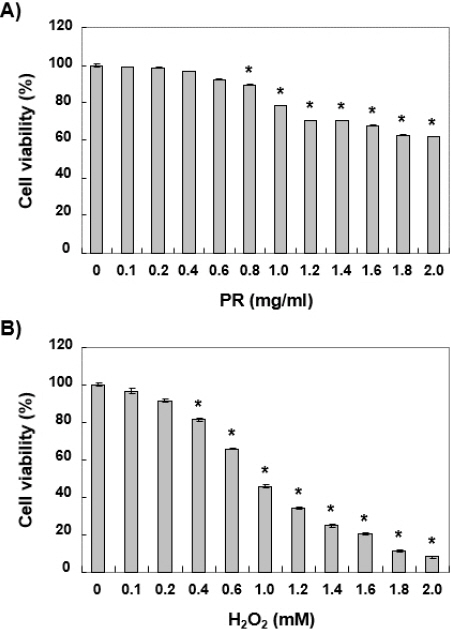
노근 추출물의 산화적 스트레스에 대한 세포 보호 효과를 조사하기 위해서 우선 노근 추출물의 독성 여부를 조사하였다. 이를 위하여 다양한 농도의 노근 추출물을 처리하여 24시간 배양 후 MTT 분석을 실시하였다. Fig. 1A에 나타낸 바와 같이 노근 추출물의 처리 농도가 0.6 mg/ml까지는 유의한 세포독성을 관찰할 수 없었으나, 0.8 mg/ml 이상 처리군부터는 처리 농도 의존적으로 세포독성이 관찰되었다. 아울러 산화적 스트레스를 유발하기 위해서 H2O2를 사용하였고, H2O2로 단독 처리한 Chang 세포의 생존력을 분석한 결과, 0.2 mM 이상의 처리군에서는 유의한 생존력 감소가 관찰되었다(Fig. 1B). 따라서 Chang 세포에게 산화적 스트레스를 유발하기 위하여 H2O2 농도를 약 40% 정도의 생존력을 보인 1 mM으로 선정하였고, 노근 추출물의 보호 효과를 조사하기 위해서는 세포독성이 나타나지 않았던 0.2 mg/ml 및 0.4 mg/ml의 처리 농도를 선정하였다.
Fig. 1
Effects of ethanol extract of Phragmitis Rhizoma (PR) and H2O2 on the cell viability in Chang liver cells.
Cells were treated with various concentrations of PR (A) and H2O2 (B) for 24 hours. Cell viability was assessed by an MTT reduction assay. The results are the mean±SD obtained from three independent experiments (*p<0.05 compared with the control group).
2. Chang 세포의 증식 억제에 미치는 노근 추출물의 영향
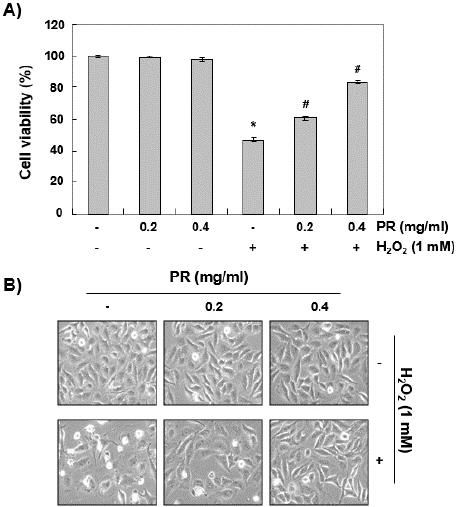
위에서 선정한 농도로 H2O2에 의한 산화적 스트레스로부터 노근 추출물의 보호 효과를 조사하기 위하여 0.2 mg/ml 및 0.4 mg/ml의 노근 추출물과 1 mM의 H2O2를 단독 및 동시 처리한 조건에서 24시간 동안 배양된 Chang 세포를 MTT 분석하였다. Fig. 2A에 나타낸 결과에서 알 수 있듯이, 노근 추출물은 H2O2에 의한 Chang 세포의 생존력 감소를 처리 농도 의존적으로 억제하였다. 동일 조건에서 관찰된 Chang 세포의 형태적 관찰에서도 H2O2로 단독 처리된 세포에서는 전체 세포 수가 감소됨과 동시에 분지를 형성하였으며, 세포질이 응축되는 현상과 공포의 형성 및 부착력 상실로 인하여 배양 배지로 부유된 세포의 수가 증가되었으나, 노근 추출물이 존재하는 조건에서는 이러한 현상이 현저히 감소되었다(Fig. 2B).
Fig. 2
Inhibition of H2O2-induced cytotoxicity by PR in Chang liver cells.
Cells were treated with the indicated concentrations of PR for 24 hours, or pretreated with or without PR for 1 hour, and then stimulated with 1 mM H2O2 for 24 hours. (A) Cell viability was assessed by an MTT reduction assay. The results are the mean±SD obtained from three independent experiments (*p<0.05 compared with the control group, #p<0.05 compared with the H2O2-treated group). (B) To investigate morphological changes of Chang cells, cells cultured under the same conditions were photographed using an inverted microscope (original magnification, ×200).
3. Chang 세포에서 H2O2에 의한 apoptosis 유도에 미치는 노근 추출물의 영향
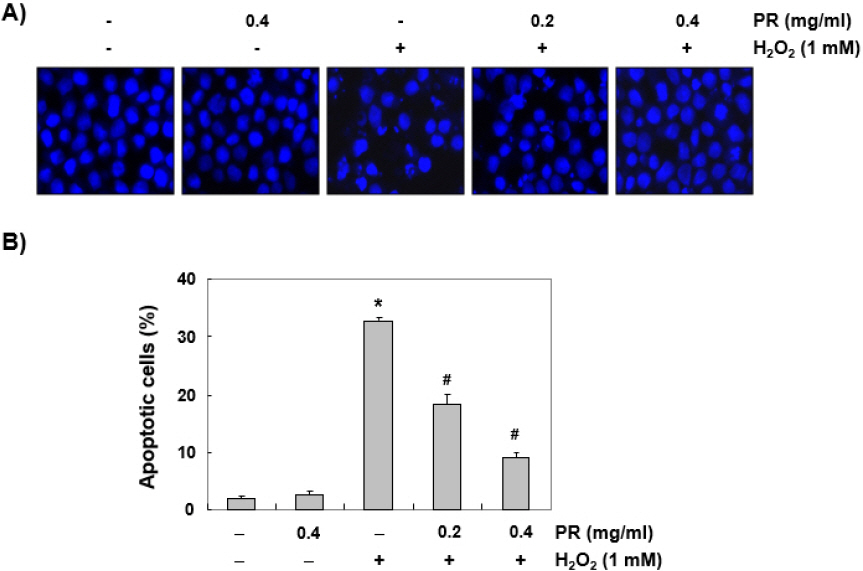
Chang 세포에서 산화적 스트레스에 대한 노근 추출물의 세포보호 효과가 apoptosis 유발 억제와 관련성이 있는지를 확인하기 위해서 핵의 형태 변화와 flow cytometry 분석을 실시하였다. Fig. 3A에 나타낸 바와 같이 H2O2 단독으로 처리된 배지에서 배양된 Chang 세포에서는 apoptosis가 유발되었음을 의미하는 염색질 응축(chromatin condensation)으로 인한 apoptotic body의 증가와 같은 전형적 핵 형태의 변화가 관찰되었지만, 노근 추출물이 존재하는 경우 현저히 감소되었다. 또한 H2O2 단독 처리군에서는 apoptosis가 유발된 세포의 비율이 대조군에 비하여 현저하게 증가하였으나 노근 추출물의 전처리군에서는 처리 농도 의존적으로 유의적인 감소를 보였다(Fig. 3B).
Fig. 3
Suppression of H2O2-induced apoptosis by PR in Chang liver cells.
Cells were treated with the indicated concentrations of PR for 1 hour, and then stimulated with or without 1 mM H2O2 for 24 hours. (A) The cells were fixed and stained with DAPI solution. The stained nuclei were observed by a fluorescence microscope (original magnification, ×400). Representative photographs are shown. (B) The cells were collected and stained with PI solution, and the percentages of apoptotic cells were then analyzed by a flow cytometer. The results are the mean±SD obtained from three independent experiments (*p<0.05 compared with the control group, #p<0.05 compared with the H2O2-treated group).
4. Chang 세포에서 H2O2에 의한 ROS의 생성에 미치는 노근 추출물의 영향
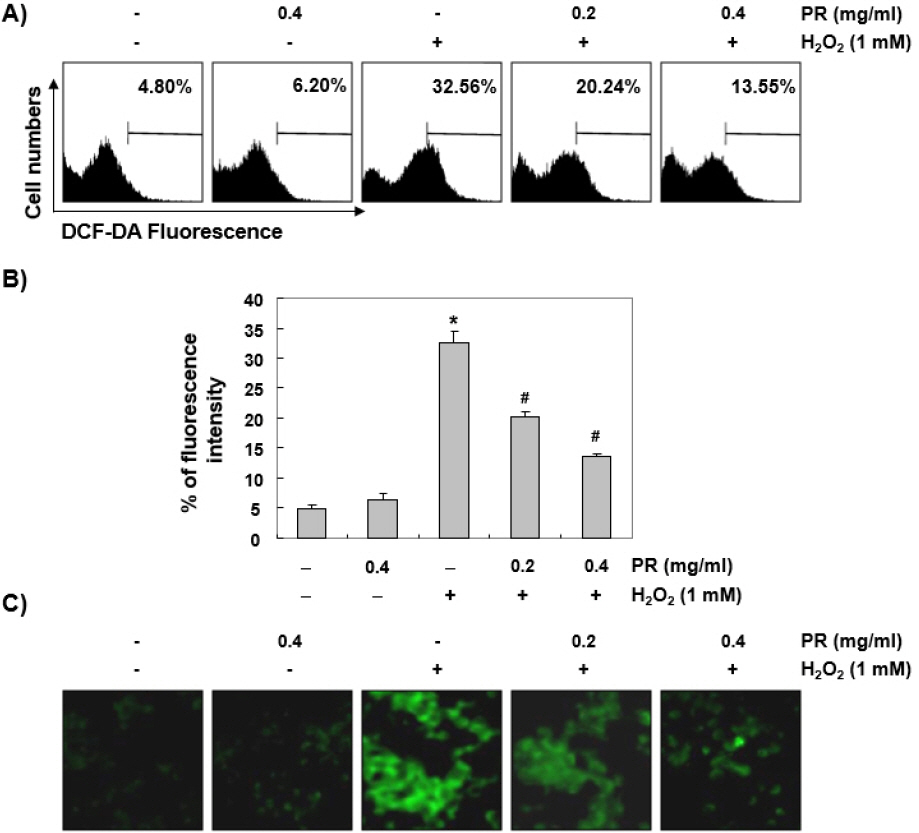
Chang 세포에서 노근 추출물의 세포 보호 및 apoptosis 억제 효과가 산화적 스트레스의 직접적인 차단에 의한 것인지를 알기 위해서 ROS의 생성에 미치는 영향을 조사하였다. Fig. 4A 및 4B에 나타낸 결과에서 알 수 있듯이, 노근 추출물 단독 처리군에서는 대조군에 비하여 유의한 변화는 관찰되지 않았다. 그러나 1 mM의 H2O2 단독 처리군에서는 대조군과 비교하여 약 7배 이상의 ROS 생성이 증가하였으며 노근 추출물은 H2O2에 의하여 유도된 ROS의 생성을 처리 농도 의존적으로 차단하였다. 그리고 형광 현미경을 사용한 관찰에서는 ROS의 생성을 뜻하는 초록 형광의 강도가 아주 강하게 나타났지만 노근 추출물이 존재하는 조건에서는 배양된 Chang 세포의 형광 강도가 현저히 감소되었다(Fig. 4C).
Fig. 4
Attenuation of H2O2-induced ROS generation by PR in Chang liver cells.
Cells were pretreated with the indicated concentration of PR for 1 hour, and then stimulated with or without 1 mM H2O2 for 1 hour. (A and B) The cells were incubated with DCF-DA, and DCF fluorescence was measured by a flow cytometer. The values represent the mean±SD obtained from three independent experiments (*p<0.05 compared with the control group, #p<0.05 compared with the H2O2-treated group). (C) After staining with DCF-DA, images were obtained by a fluorescence microscope (original magnification,×200). These images are representative of at least three independent experiments.
5. Chang 세포에서 H2O2에 의한 DNA 손상에 미치는 노근 추출물의 영향
이상에서 관찰된 노근 추출물의 산화적 스트레스로 인한 ROS의 생성 억제 효과와 이것과 관련된 생존력 회복이 DNA 손상의 차단과 연관 있는지 조사하였다. 이를 위해서 DNA 이중 나선 손상 지표로 사용되는 γH2AX 단백질의 인산화(p-γH2AX, serine 139) 발현 변화 및 comet assay를 실시하였다. Fig. 5A와 B의 immunoblotting 결과에 따르면 H2O2로 처리된 Chang 세포에서는 대조군에 비해서 γH2AX 단백질의 전체적 발현에는 큰 변화 없이 인산화가 상당히 증가하였으나, 노근 추출물로 전처리 한 세포에서는 이와 같은 현상이 농도 의존적으로 감소하였다. 또한 Comet assay에서 DNA 손상 정도를 관찰한 결과, H2O2로 단독 처리된 Chang 세포에서는 DNA 손상으로 comet tail의 뚜렷한 증가가 관찰되었고, 이러한 현상은 노근 추출물 처리에 의하여 대조군 수준으로 차단되었다(Fig. 5C).
Fig. 5
Protection of H2O2-induced DNA damage by PR in Chang liver cells.
Cells were pretreated with the indicated concentrations of PR for 1 hour, and then stimulated with or without 1 mM H2O2 for 24 hours. (A) Equal amounts of cell lysates were separated on SDS-polyacrylamidegels, and transferred to PVDF membranes. The membranes were probed with specific antibodies against γH2AX and p-γH2AX, and the proteins were visualized using an ECL detection system. Actin was used as an internal control. (B) Bands were quantified using ImageJ and normalized to actin, and the ratio was determined. Data are expressed as mean±SD. All experiments were repeated three times (*p<0.05 compared with the control group, #p<0.05 compared with the H2O2-treated group). (C) To detect cellular DNA damage, the comet assay was performed, and representative photographs of the comets were taken by a fluorescence microscope (original magnification, ×200). These images are representative of at least three independent experiments.

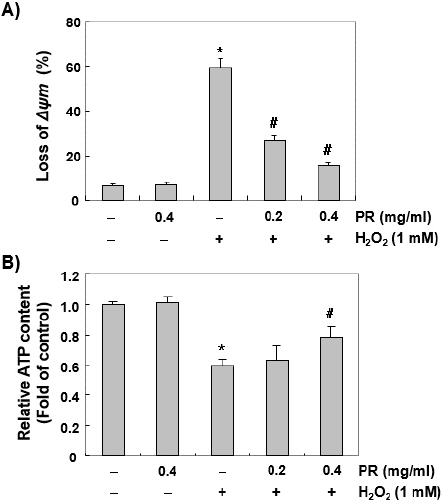
6. Chang 세포에서 H2O2에 의한 미토콘드리아 기능 손상에 미치는 노근 추출물의 영향
미토콘드리아의 기능을 평가하는 대표적인 방법은 MMP 값의 변화를 조사하는 것으로, MMP 값의 소실은 미토콘드리아의 기능의 손상을 의미하는 지표로 사용된다. 따라서 산화적 스트레스에 의한 Chang 세포의 DNA 손상 및 apoptosis 유도와 미토콘드리아 기능 손상이 연관되어 있는지, 노근 추출물이 이것을 차단 가능한지를 조사하였다. Fig. 6A의 결과에서 대조군과 노근 추출물이 단독 처리된 경우는 두 군 간(6~7%)의 유의한 변화가 없었지만, H2O2가 함유된 배지에서 배양된 Chang 세포에서의 MMP의 소실 정도가 약 60% 수준으로 증가되었고, 노근 추출물 전처리 조건에서는 농도 의존적 미토콘드리아의 기능 손상에 대하여 차단 효과를 나타냈다. 아울러 세포의 항산화 기능을 초과한 ROS의 축적과 관련된 MMP의 소실은 전자 수송 체인의 손상을 유발하여 ATP 생산을 감소시킬 수 있다. Fig. 6B의 결과에서는 H2O2에 노출된 세포에서 MMP의 소실과 더불어 세포 내의 ATP 농도는 정상적인 배지에서 배양된 세포와 비교하여 의미있게 감소하였다. 그러나 노근 추출물이 존재하는 경우는 H2O2로 인한 ATP의 감소가 유의적으로 회복되었다.
Fig. 6
Prevention of H2O2-induced mitochondrial dysfunction by PR in Chang liver cells.
Cells were pretreated with the indicated concentrations of PR for 1 hour, and then stimulated with or without 1 mM H2O2 for 24 hours. (A) The cells were collected and incubated with JC-1 solution for 20 min at 37 ℃ in the dark. The values of MMP were evaluated by a flow cytometer. (B) To monitor the ATP production using a luminometer, a commercially available kit was used. The values represent the mean± SD obtained from three independent experiments (*p<0.05 compared with the control group, #p<0.05 compared with the H2O2-treated group).
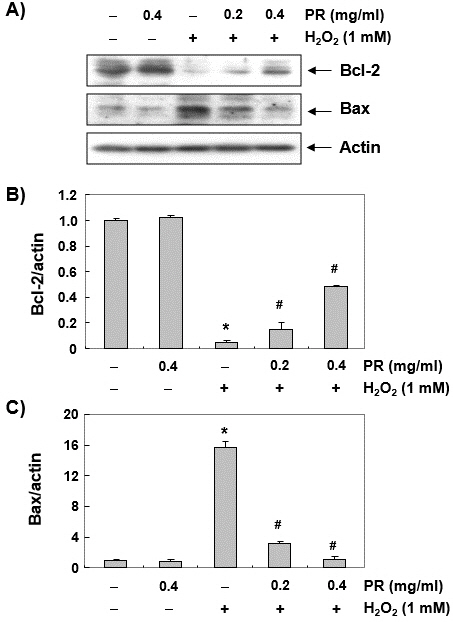
7. Chang 세포에서 H2O2에 의한 Bcl-2 및 Bax의 발현 변화에 미치는 노근 추출물의 영향
H2O2에 의해 유도된 미토콘드리아 기능 손상과 노근 추출물의 방어 효과와 관련된 apoptosis 유발의 기전을 이해하기 위하여 Bcl-2 family member에 속하는 대표적인 anti-apoptotic 및 pro-apoptotic 단백질인 Bcl-2 및 Bax의 발현 변화를 조사하였다. Fig. 7A의 immunoblotting 결과에 의하면 Bcl-2 단백질은 H2O2가 처리된 Chang 세포에서 현저히 감소된 반면, Bax 단백질은 증가되었음을 알 수 있었다. 즉 대조군 세포와 비교하여 H2O2에 노출된 세포에서 apoptosis에 대한 세포의 apoptosis 감수성을 결정하는 Bcl-2/Bax 단백질 발현의 비율이 크게 감소하였으나 노근 추출물이 존재하는 경우, H2O2가 단독 처리된 세포에 비해 이러한 현상이 유의적으로 차단되었다.
Fig. 7
Effect of PR on the expression of Bcl-2 and Bax in H2O2-treated Chang liver cells.
(A) After treatment with the indicated concentrations of PR in the presence or absence of H2O2 for 24 hours, the cellular proteins were prepared, and Bcl-2 and Bax protein levels were assayed by Western blot analysis using an ECL detection system. Actin was used as an internal control.
(B), (C) Bands were quantified using ImageJ and normalized to actin, and the ratio of Bcl-2 and Bax to actin was determined. Each point represents the mean±SD of three independent experiments (*p<0.05 compared with the control group, #p<0.05 compared with the tacrolimus- treated group).
IV. 고 찰
산화적 스트레스에 따르는 과도한 ROS의 생성은 인체의 다양한 질병 원인으로 작용하며, 간의 항산화 방어체계 손상은 만성 퇴행성 간 질환의 발병과 진행을 촉진시킨다31-33. 간세포에 대한 산화적 스트레스의 부하는 지질 과산화, 핵산 및 단백질 손상을 거쳐 간세포의 사멸을 유도하고, 이러한 과정에서 ATP 고갈로 인한 세포의 에너지 대사 방해와 같은 신진 대사의 복잡한 변화가 동반 된다34,35. 따라서 간 손상 관련 질환의 발병을 감소시키기 위한 전략으로 산화적 스트레스를 차단하는 것이 매우 중요한 역할을 할 것으로 기대된다.
노근의 根莖에는 coixol 및 단백질 5%, 지방 1%, 탄수화물 51%, asparagin 0.1%가 함유 되어 있으며 다당을 가수분해하면 d-xylose, 1-arabinose, d-glucose, d-galacton 및 2종의 uron 酸을 얻고 이 외에 다량의 비타민 B1, B2, C와 tricin이 함유되어있다22. 노근 추출물에는 p-hyroxycinnamic acid, stigmasta-3,5-dien-7-one 등 다양한 화합물이 함유되어있는데24,36, 선행 연구에 의하면 coixol(6-methoxybenzoxalzolineone)은 Microtus pinetorum의 난포자극호르몬의 분비를 자극하고 난소와 자궁의 무게를 증가시켰고37,38, 노근 수성추출물의 주요성분인 p-hydroxycinamic acid은 in vitro와 in vivo에서 docetaxel로 유도된 골수독성을 개선할 수 있었다36. 그리고 노근에서 분리한 stigmasta-3,5-dien-7-one은 RAW 264.7 대식세포에서 NF-κB 정보전달경로를 차단함으로써 LPS에 의해 유발된 염증을 억제하였다24. 한편, 노근추출물은 cyclophosphamide로 유발된 면역억제상태의 쥐에서 망상내피계의 식세포의 기능을 개선하고 NK세포의 활동을 증가시켜 비특이적 면역에 영향을 미쳤으며39, 인간의 비만세포와 폐포상피세포의 사이토카인 분비로 인한 염증을 억제 할 수 있었다26. 또한 노근 다당류는 CCl4로 유발된 간 손상에서의 간 보호 효과 및 항산화 효능과27, porine serum투여로 유발된 면역학적 간 섬유화 모델에서 간 기능 보호 작용이 있었고 이는 노근 다당류가 간세포 효소의 활성화를 감소시키는 것과 항산화작용이 관련된 것일 수 있다고 보고하였다28. 더불어 침수스트레스와 수영피로를 유발한 모델에서 산화적 손상에 대한 길항작용과 시상하부-뇌하수체-부신 축의 과활성화를 억제함으로써 항스트레스 및 항피로효과가 있었으며40, 고지혈증을 유발한 쥐에서 과산화지질과 요단백 유출량, 사구체 직경을 감소시켜 신장 보호 효과를 기대할 수 있다는 보고가 있었다41.
그러나 노근 추출물의 항산화 효능 관련 연구는 아직 미비한 편이며 특히 간세포를 대상으로 수행된 연구는 아직 부족하다. 따라서 본 연구에서는 Chang 세포에서 H2O2로 유도된 DNA 손상 및 apoptosis 유도에 대한 노근 추출물의 억제 효과 및 이와 연관된 기전을 조사하였다. 본 연구의 결과에서는 H2O2로 인한 Chang 세포의 증식 억제와 apoptosis 유도 현상이 노근 추출물에 의해 현저하게 차단되었고, 이것은 ROS 생성의 저하와 관련 있었다. 또한 노근 추출물은 DNA 손상 차단 효과와 더불어 미토콘드리아의 기능을 유지하면서 에너지 대사 항상성의 교란을 억제하였다.
많은 선행 연구들의 결과에 따르면 과도하게 생성된 ROS는 미토콘드리아의 기능 장애를 유발하며, 이로 인한 미토콘드리아 호흡 사슬에서의 부적절한 전자 전달은 세포 내의 ATP 생성을 방해한다. 게다가 부적절한 전자 전달계의 손상에 의한 ROS의 축적은 intrinsic apoptosis pathway를 활성화 시킨다42,43. 본 연구에서 MTT 분석을 통하여 노근 추출물이 H2O2에 의한 산화적 스트레스로부터 Chang 세포를 보호한다는 것을 확인하였다. 또한 comet assay와 immunoblotting 분석을 통해 노근 추출물이 H2O2로 처리된 세포에서 발견되는 DNA 손상 표지자인 DNA tail의 형성44과 γH2AX 인산화45를 억제하였음을 확인하여 산화적 스트레스에 의한 DNA 손상을 차단할 수 있음을 입증하였다. 그리고 DNA 손상을 차단하는 것은 ROS의 생성 감소와 관련이 있으며, 이것은 노근 추출물이 과도한 ROS 생성을 억제하여 H2O2에 의해 유발된 DNA 손상을 감소시킨다는 것을 의미한다.
한편 미토콘드리아 내부 막의 산화적 인산화는 ADP에서 ATP로의 전환을 위한 에너지 대사에 필수적이다46,47. 따라서 MMP의 소실과 연관된 미토콘드리아 호흡효소의 활성감소는 에너지 대사에 손상을 입혀 에너지 고갈을 야기한다. 그래서 세포 내의 에너지 고갈 신호는 ATP를 소모하는 과정을 방지하면서 이화 경로를 활성화하고 에너지 대사를 조절하여 ATP 생산 단계를 개선한다42,48. 본 연구에서는 H2O2가 단독 또는 노근 추출물과 동시에 처리된 Chang 세포에서 ATP 수준을 측정하여 노근 추출물에 의한 미토콘드리아 손상의 회복 효과를 평가하였고, H2O2에 의한 세포 내 ATP 함량의 감소는 노근 추출물이 존재하는 조건에서는 전처리에 의해 현저히 억제되었다.
미토콘드리아는 ROS 생산의 세포 내 주요 소기관이면서 ROS에 의하여 손상 받는 감수성이 가장 높은 기관이다. ROS의 증가는 내재적 세포사멸 경로에서 첫 신호인 MMP의 감소로 이어진다47,49. 감소된 MMP는 미토콘드리아에서부터 세포질로 cytochrome c 같은 apoptosis 촉진 인자들의 방출을 유도하며 다양한 세포 내 기질 단백질을 파괴하기 위하여 미토콘드리아가 매개하는 내재적 세포사멸 경로의 강한 자극제인 caspase-9와 caspase-3을 차례대로 활성화 시킨다50,51. 이 과정에서 Bcl-2 family에 속하는 Bax와 같이 세포사멸을 촉진하는 단백질은 미토콘드리아 투과성 변화 통로(mitochondrial permeability transition pores, MPTPs)를 열어 cytochrome c의 방출을 유도하고, Bcl-2와 같은 세포사멸을 억제하는 단백질은 이와 반대의 과정을 수행한다52,53. 따라서 anti-apoptotic Bcl-2 단백질에 대한 pro-apoptotic Bax 단백질의 균형은 intrinsic apoptosis 경로를 활성화 또는 억제하기 위한 결정 인자 역할을 한다. 이러한 관점에서 본 연구에서 관찰된 H2O2가 처리된 Chang 세포에서의 MMP 소실과 함께 Bcl-2/Bax 비율의 감소는 ROS 의존적 미토콘드리아 매개 진입 경로가 apoptosis 유도에 결정적인 역할을 한다는 것을 시사한다. 따라서 노근 추출물이 존재하는 조건에서 이러한 발현의 변화가 유의적으로 차단되었다는 것은 ROS 생성 의존적 intrinsic apoptosis 유도 경로를 차단하였음을 의미한다.
비록 apoptosis 조절 관련 유전자들의 변화에 미치는 추가적인 연구와 노근 추출물의 생리활성 성분에 대한 탐색이 수행되어야겠지만, 본 연구의 결과는 노근 추출물이 Chang 세포에서 산화적 스트레스에 의해 발생한 ROS를 제거하면서 미토콘드리아 기능을 보존하여 에너지 신진 대사를 유지하고 apoptosis를 억제할 수 있음을 나타낸다.
V. 결 론
Chang 간세포에서 H2O2로 유발한 산화적 스트레스에 대한 노근 추출물의 보호효과를 연구하여 아래와 같은 결과를 얻었다.
1. 노근 추출물은 0.6 mg/ml까지는 유의한 세포독성을 관찰 할 수 없었으며, H2O2는 0.2 mM 이상의 처리군부터 유의한 생존력 감소가 관찰되었다.
2. 노근 추출물은 H2O2에 의한 Chang세포의 생존력 감소를 처리 농도 의존적으로 억제하였다.
3. 노근 추출물은 H2O2에 의한 apoptopic body의 증가와 전형적인 핵 형태의 변화를 현저히 감소시켰으며, apoptosis가 유발된 세포의 비율을 유의적으로 감소시켰다.
4. 노근 추출물은 H2O2에 의하여 유도된 ROS의 생성을 처리 농도 의존적으로 차단하였다.
5. 노근 추출물은 DNA 손상 지표로 사용되는 γH2AX 단백질의 인산화와 DNA 손상에 따른 comet tail 생성을 현저하게 억제하였다.
6. 노근 추출물은 H2O2에 노출 된 세포에서 MMP의 소실을 억제하였으며 세포 내 ATP농도의 감소를 회복시켰다.
7. 노근 추출물은 H2O2가 처리된 Chang세포에서 Bcl-2단백질의 감소와 Bax 단백질의 증가를 억제하였다.
이러한 결과는 노근 추출물이 산화적 스트레스에 의한 과도한 ROS 생성을 억제하고, DNA손상을 보호하면서 미토콘드리아의 기능을 유지하여 에너지 대사 항상성의 교란을 억제한다는 것으로 이는 미토콘드리아가 매개된 intrinsic apoptosis 경로를 차단함으로써 Chang 간세포를 보호할 수 있을 것이라 추정된다. 따라서 노근 추출물의 Chang 간세포에 대한 항산화 작용은 간질환에 대한 예방 및 개선 효과가 있을 것으로 예상되며, 이후 추가적인 연구를 통해 다양한 질환에 대한 노근의 효능 및 효과에 대한 근거를 확립해 나가길 기대한다.











