I. 서 론
아스트라제네카 코로나19 백신(ChAdOx1 nCoV-19/ AZD1222)은 SARS-CoV-2 스파이크 단백질의 DNA가 삽입된 복제 불능 침팬지 유도 아데노바이러스를 바이러스 벡터로 사용하는 백신이다1. The World Health Organization(WHO)는 2번의 접종을 8~12주 간격으로 투여할 것을 권장했는데2, 임상 3상 무작위 다국적 무작위 연구에서 중간 결과를 보고한 바에 따르면, 두 번째 투여 14일부터 증상이 있는 코로나바이러스감염증-19(COVID-19)에 대해 70.4%(95% CI 54.8-80.6)의 효능이 있었다3. 또한 추가 분석에 따르면, 1회 접종의 효능은 접종 이후 21일부터 90일까지 76.0%(95% CI 59.3-85.9)로 나타났다4.
아스트라제네카 코로나19 백신은 이상반응을 흔하게 동반하는 것으로 보고되고 있다. 1/2상 임상 시험에서는 피로와 두통이 가장 흔한 전신반응으로 보고되었고, 근육통, 불쾌감, 오한, 열감, 발열이 발생하였으며, 전신반응과 국소반응은 백신 접종 하루 후 가장 심했고, 예방적 Acetaminophen 사용이 통증, 열감, 오한, 근육통, 두통, 불쾌감을 유의하게 경감하였다고 보고되었다5. 흔한 이상반응 외에 3상 시험에서는 2건의 횡단성 척수염 사례가 있었는데, 1건은 백신과 관련이 있는 것으로 생각되었다3. 또한 국내에서도 논란이 있었던 혈소판 감소와 관련된 혈전증과 관련하여서는, 비록 WHO에서 인과 관계가 확인되지 않으며, 이환 위험 대비 발생률이 매우 낮다고 하였으나6, 덴마크, 노르웨이, 아이슬란드는 혈전증에 대한 우려로 아스트라제네카 코로나19 백신 사용을 중단하였다7. 2021년 7월 26일에는 WHO 글로벌백신안전자문위원회에서 아데노바이러스 벡터 백신 접종 후 길랑-바레 증후군의 사례가 드물게 보고되었다고 성명을 발표하기도 하였다8.
한방 치료 현장에서도 아스트라제네카 코로나19 백신의 이상반응에 대한 우려와 더불어 한방 치료가 이상반응에 영향을 미치는 지에 대한 불안감을 제기하는 환자들이 증가하고 있다. 기존에 중국과 한국에서 COVID-19에 대해 변증에 따라 한약을 사용하기 위한 지침이 출판되었으나9, 아스트라제네카 코로나19 백신 접종자에 대한 한방 치료 시행의 안전성에 대해서는 기존에 연구된 바가 없다. 이에 저자는 본 연구를 통해 아스트라제네카 코로나19 백신을 접종한 환자에서 한방 치료를 시행하였을 때 이상반응의 종류와 중증도, 빈도와 함께 백신과 한방 치료와의 인과성을 조사하였다.
II. 연구대상 및 방법
1. 연구 설계 및 참가자
경희대학교 부속한방병원에 입원한 환자 중 한방 치료를 받으면서 2021년 6월 1일부터 2021년 6월 30일까지 아스트라제네카 코로나19 백신을 접종한 환자를 대상으로 의무기록을 조사하였다.
2. 중 재
백신 접종 후 7일 동안 투여한 한약 및 양약, 한방 치료를 조사하였다. 한약은 의무기록에 기록된 처방명을 기준으로 조사하였으며, 기존 처방에서 증상에 따라 약재 구성과 용량이 변화되는 경우에는 동일한 처방으로 간주하였다. 백신 접종 후 이상반응에 대하여 추가로 사용된 한약 혹은 양약은 추가약물(additional medicine)로 정의하였다.
3. 데이터 수집 및 결과 측정
연령, 성별, 체질량지수(body mass index, BMI), 동반 질환과 같은 기본 특성이 고려되었다. 1차 결과는 백신 접종 후 7일 동안 발생한 이상반응, 2차 결과는 백신 접종 전후 혈액검사에서 간수치 - AST(aspartate aminotransferase), ALT(alanine aminotransferase), 신수치 - BUN(blood urea nitrogen), Creatinine이었다. 백신 접종 전과 후의 혈액검사는 기한에 제한을 두지 않고 백신 접종 시점과 가장 가까운 혈액검사를 조사하였다.
5. 이상반응의 중증도와 인과성 평가
백신 접종 후 7일 동안 나타난 이상반응을 모두 조사하였다. 이상반응의 중증도는 한국 질병관리청의 코로나19 예방접종 후 이상반응 관리지침10의 기준으로 평가하였고, 상기 지침에 기술되지 않은 이상반응의 경우 한국 식품의약품안전처의 백신 임상시험 이상반응 중증도 평가 가이드라인11과 미국 식품의약국의 독성 등급 척도12를 기반으로 평가하여 경증(1단계), 중등증(2단계), 중증(3단계), 잠재적 생명위험(4단계)으로 분류하였다. 백신과 이상반응의 인과성 평가를 위하여 한국 질병관리청의 코로나19 예방접종 후 이상반응 관리지침10 인과성평가 알고리즘에 따라 인과관계를 결정하여 인과성이 명백한 경우(definite), 인과성에 개연성이 있는 경우(probable), 인과성에 가능성이 있는 경우(possible), 인과성이 인정되기 어려운 경우(unlikely), 명확히 인과성이 있는 경우(definitely not related)로 인과관계를 분류하였다(Suppl. 1, 2). 또한 한방 치료와 이상반응의 인과성 평가를 위해 The World Health Organization-Uppsala Monitoring Centre(WHO-UMC) causality assessment system을 사용하여 Certain, Probable / Likely, Possible, Unlikely, Conditional / Unclassified, Unassessable / Unclassifiable로 분류하였다(Suppl. 3)13. 이상반응의 중증도와 인과성은 독립적인 조사자가 결정하였으며, 추가 정보가 필요할 때 담당 의사에게 정보를 얻었다.
III. 연구 결과
1. 증례보고
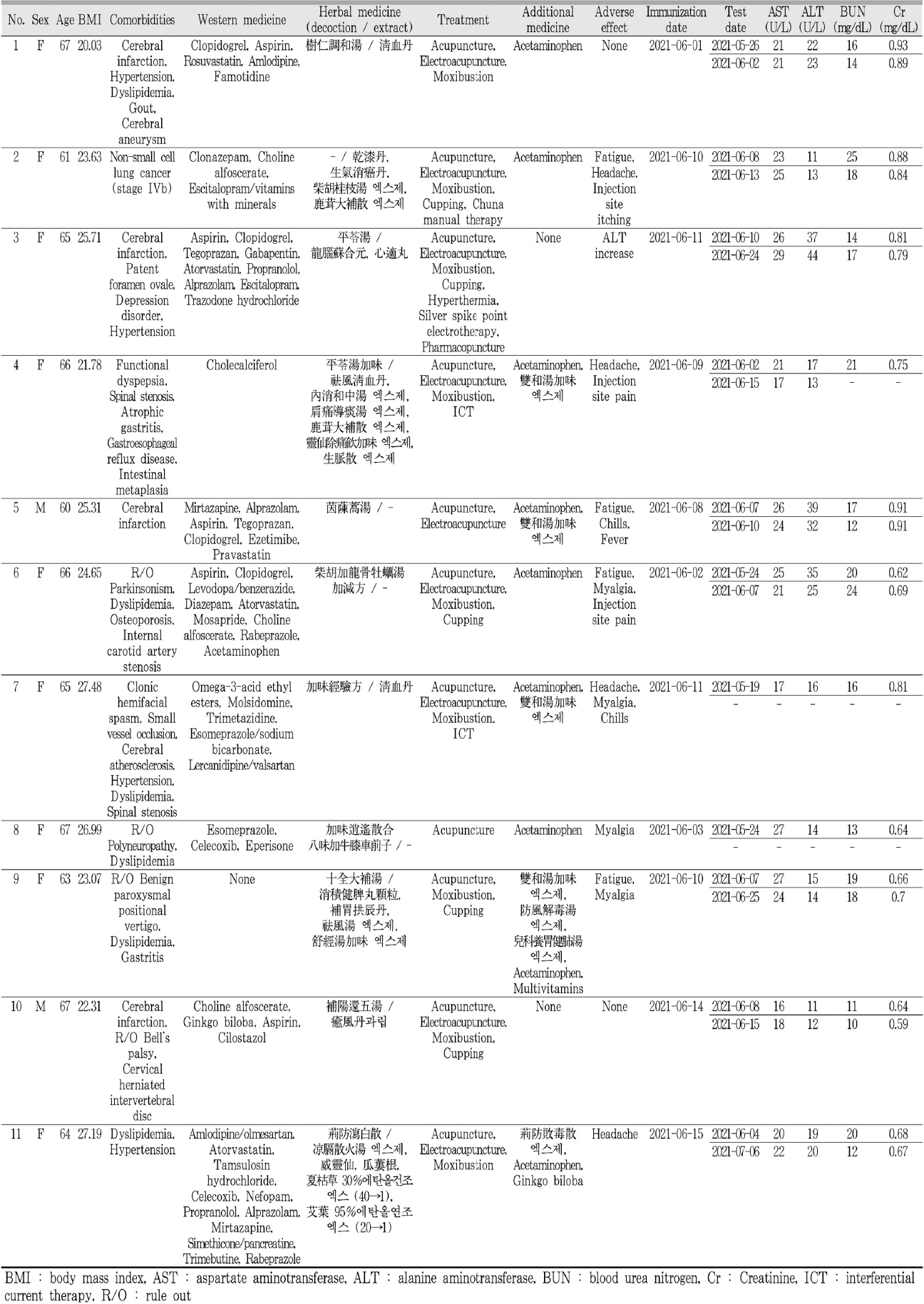
2021년 6월 1일부터 6월 30일까지 11명의 환자가 경희대학교 부속한방병원 입원 중 아스트라제네카 코로나19 백신을 접종하였다. 모든 환자는 1차 접종이었으며, 한방 치료를 받고 있었다. 총 11명의 환자는 남자 2명, 여자 9명, 평균 나이 64.64±2.42세로 분포하였다. 환자의 동반질환은 고지혈증 6명(54.5%)이 가장 많았고, 고혈압 4명(36.4%), 뇌경색 4명(36.4%)이 그 다음으로 빈도가 높았다(Table 1). 환자의 기본 특성과 함께 복용한 양약과 한약, 백신 접종 후 7일 동안 발생한 이상반응과 추가 약물, 백신 접종 전후 혈액검사를 Table 2에 요약하였다.
Table 1
Patient Characteristics
1) 증례 1
67세 여성, 고혈압, 고지혈증, 통풍 병력 있으며, 좌측 중대뇌동맥 3 mm 비파열 뇌동맥류 있는 자로 2020년 12월 25일 우측 시상 경색, 소뇌 경색 과거력 있으며, 2021년 5월 1일 조음곤란 증상 발생하여 2021년 5월 3일 ⃝⃝병원 방문하여 뇌 확산강조영상에서 우측 뇌량 뇌경색 진단받고 2021년 5월 10일 오전 좌반신소력 악화되어 2021년 5월 11일-2021년 5월 20일 ⃝⃝병원 신경과 입원하여 급성기 처치 및 뇌졸중 원인 검사 시행 후 2021년 5월 22일 본원 순환신경내과로 우측 뇌량 뇌경색 진단 하에 입원하였다. 입원 기간 중 2021년 6월 1일 아스트라제네카 코로나19 백신 1차 접종하였다. 기존 복용 한약은 樹仁調和湯(白朮 4 g, 白芍藥 12 g, 川芎 8 g, 大棗 4 g, 當歸 8 g, 甘草 4 g, 枸杞子 4 g, 桂枝 8 g, 黃芪 8 g, 生薑 4 g, 熟地黃 8 g, 杜沖 4 g 1일 3회 아침, 점심, 저녁 2첩 3포 100 mL), 淸血丹(1일 1회 아침 2개)이었으며, 양약은 Clopidogrel, Aspirin, Rosuvastatin, AmLodipine, Famotidine이었다. 예방 접종 후 7일 동안 상기 약물은 동일하게 복용하였으며, 치료는 침, 전침, 간접구 치료를 지속적으로 시행하였다. 이상반응은 발생하지 않았다.
2) 증례 2
61세 여성, 2016년 7월 비소세포폐암(IVb기) 진단 받고 항암화학요법 및 감마나이프 수술 수차례 받은 병력 있는 자로, 2021년 6월 8일 본원 폐장호흡내과로 비소세포폐암을 진단 하에 입원하였다. 2021년 6월 10일 아스트라제네카 코로나19 백신1차 접종하였다. 기존 복용 한약은 乾漆丹, 生氣消癌丹, 柴胡桂枝湯 엑스제(1일 2회 아침, 저녁), 鹿茸大補散 엑스제(1일 1회 점심)이었으며, 양약은 Clonazepam, Choline alfoscerate, Escitalopram/vitamins with minerals이었다. 예방 접종 후 7일 동안 상기 약물은 동일하게 복용하였으며, 치료는 침, 전침, 간접구, 부항, 호흡재활추나를 지속적으로 시행하였다. 2021년 6월 11일 환자가 새벽 수면 중 머리 약간 불편한 느낌 있어 Acetaminophen 650 mg 1정을 경구 복용 후 호전되었으며, 이후로 불편감은 없고 기운이 없고 쳐지는 느낌을 호소하였다. 2021년 6월 12일부터는 불편감 호소하지 않았으나 2021년 6월 14일 접종 부위 약간의 소양감이 남아 있다고 표현하였다.
3) 증례 3
65세 여성, 고혈압 병력 있는 자로 2021년 5월 26일 증상 발생하여 2021년 5월 27일 본원 응급실 방문하여 뇌 자기공명영상에서 급성 뇌졸중(우측 중뇌) 진단받고 2021년 5월 27일부터 2021년 6월 4일까지 본원 신경과 입원하였으며, 뇌졸중 정밀검사 시행하여 난원공 개존증(Grade 3) 확인되었으며, 2021년 6월 4일 본원 침구과로 뇌경색 진단 하에 입원하였다. 2021년 6월 11일 아스트라제네카 코로나19 백신 1차 접종하였다. 기존 복용 한약은 平苓湯(蒼朮 8 g, 甘草 2 g, 厚朴 4 g, 陳皮 5 g, 白茯苓 6 g, 白朮 3 g, 甘草(炙) 2 g, 桂枝 4 g 1일 3회 아침, 점심, 저녁 2첩 3포 80 mL), 龍腦蘇合元(1일 1회 저녁)이었으며, 양약은 Aspirin, Clopidogrel, Tegoprazan, Gabapentin, Atorvastatin, Propranolol, Alprazolam, Escitalopram, Trazodone hydrochloride이었다. 예방 접종 이후 7일 동안 한약은 2021년 6월 18일 주소증에 대한 치료를 위해 기존 탕약에서 약재 구성을 변경하였으며, 龍腦蘇合元 대신 心適丸(1일 2회 아침, 저녁)으로 변경하였다. 예방 접종 이후 7일 동안 양약 변경은 없었다. 예방 접종 이후 7일 동안 치료는 침, 전침, 간접구, 부항, 고주파 온열 치료, Silver spike point 전자 침술 치료, 약침 치료를 받았다. 예방 접종 이후 7일 동안 환자가 호소하는 주관적인 증상은 없었으나, 2021년 6월 24일 시행한 혈액검사에서 AST가 44 U/L 측정되었다.
4) 증례 4
66세 여성, 척추관 협착증, 위축성 위염, 위-식도 역류 질환, 장상피 화생 병력 있는 자로, 소화불량에 대해 한방 치료 원하여 2021년 6월 2일 본원 위장소화내과로 기능성 소화불량 진단 하에 입원하였다. 2021년 6월 9일 16시 아스트라제네카 코로나19 백신 1차 접종하였다. 기존 복용 한약은 平苓湯加味(蒼朮 8 g, 甘草 2 g, 厚朴 8 g, 陳皮 5 g, 白茯苓 6 g, 白朮3 g, 甘草(炙) 2 g, 牡蠣 4 g, 龍眼肉4 g, 丹蔘 4 g, 黨蔘 3 g, 葛根 4 g, 藁本 4 g, 甘菊 2 g, 半夏 4 g, 生薑 4 g, 旋覆花 6 g, 枳實 4 g, 枳殼 4 g 1일 3회 아침, 점심, 저녁 2첩 3포 70 mL), 祛風淸血丹, 內消和中湯, 肩痛導痰湯, 鹿茸大補散, 靈仙除痛飮加味 엑스제(1일 3회 아침, 점심, 저녁), 生脈散 엑스제(1일 3회 아침, 점심, 저녁 2포)이었으며, 양약은 Cholecalciferol이었다. 예방 접종 후 7일 동안 상기 약물은 동일하게 복용하였으며, 雙和湯加味 엑스제 8포를 환자가 필요 시 복용할 수 있도록 투여하였다. 예방 접종 이후 7일 동안 치료는 침, 전침, 간접구, 경근간섭저주파요법(interferential current therapy, ICT)을 지속적으로 받았다. 2021년 6월 9일 19시에 증상 없었으나 이상반응에 대한 예방 위해 Acetaminophen 650 mg 1정을 복용하였다. 2021년 6월 10일 2시 두통으로 잠에서 깨어나Acetaminophen 650 mg 1정을 복용하고 취침하였으며, 8시 기상 후 두통 여전했으며 몸살 기운 있어 Acetaminophen 650 mg 1정을 추가로 복용했다. 열감은 있으나 체온은 정상이었다. 접종 부위 약한 통증은 2021년 6월 15일까지 남아 있었다.
5) 증례 5
60세 남성, 특이 병력 없는 자로, 2021년 5월 4일 우상하지 소력감 발생하여 2021년 5월 5일 본원 응급실 방문, 뇌 자기공명영상에서 뇌경색 진단받고 2021년 5월 5일-2021년 5월 14일 본원 신경과 입원하여 뇌졸중 원인 검사 후 2021년 5월 14일 본원 순환신경내과로 뇌경색 진단 하에 입원하였다. 2021년 6월 8일 아스트라제네카 코로나19 백신 1차 접종하였다. 기존 복용 한약은 茵蔯蒿湯(茵蔯蒿 6 g, 梔子 3 g, 大黃 3 g 1일 3회 아침, 점심, 저녁 3첩 3포 100 mL)이었으며, 양약은 Mirtazapine, Alprazolam, Aspirin, Tegoprazan, Clopidogrel, Ezetimibe, Pravastatin이었다. 예방 접종 이후 7일 동안 상기 약물은 동일하게 복용하였다. 예방 접종 이후 7일 동안 치료는 침, 전침 치료를 지속적으로 받았다. 2021년 6월 9일 2:00 오한 있으며 춥다고 말하였으며 체온 38.2 ℃ 측정되어 acetaminophen 650 mg 1정 복용하였으며, 3:27 37.1 ℃ 측정되며 오한 관찰되지 않았고 식은 땀 관찰되나 그 외 특이 불편감 호소하지 않았다. 15:14 다시 오한 호소하며 체온 38.1 ℃ 측정되었으며 근육통은 호소하지 않아 Acetaminophen 650 mg 1정 복용하였다. 2021년 6월 10일 2:18 오한 있었으며 체온 38.7 ℃ 측정되어 Acetaminophen 650 mg 1정 복용하였다. 2021년 6월 11일 13:10 오한 호소하였으나 체온은 정상이었으며, 20:30 기력 저하 및 오한 호소하였으나 체온은 정상이었으며 雙和湯加味 엑스제 1포 투약하였다. 2021년 6월 12일 오한, 무기력 지속되었으며 통증, 발열은 없어 雙和湯加味 엑스제 1포 점심에 투약하였다. 2021년 6월 13일-2021년 6월 14일 雙和湯加味 엑스제 1포를 1일 1회 아침에 투약하였으며, 2021년 6월 13일 주관적인 증상 호전되었다고 하였으며 2021년 6월 14일부터 이상반응은 나타나지 않았다.
6) 증례 6
66세 여성, 고지혈증, 골다공증 병력 있는 자로, 2021년 4월 본원 신경과 입원하여 시행한 뇌자기공명영상에서 우측 내경 동맥 근위부 중증 협착 확인하였으며, 파킨슨병 진단 받고 약물 치료하며 증상 개선하던 중 2021년 4월 21일 본원 순환신경내과로 파킨슨병 의증 진단 하에 입원하였다. 2021년 6월 2일 오전 아스트라제네카 코로나19 백신 1차 접종하였다. 기존 복용 한약은 柴胡加龍骨牡蠣湯加減方(柴胡 5 g, 半夏 4 g, 大棗 3 g, 黃芩 2 g, 龍骨 2 g, 牡蠣 2 g, 桂枝 2 g, 白茯苓 2 g, 生薑 2 g, 人蔘 2 g, 大黃 2 g 1일 3회 아침, 점심, 저녁 3첩 3포 100 mL)이었으며, 양약은 Aspirin, Clopidogrel, Levodopa/ benzerazide, Diazepam, Atorvastatin, Mosapride, Choline alfoscerate, Rabeprazole, Acetaminophen이었다. 예방 접종 이후 7일 동안 한약 변경은 없었다. 예방 접종 이후 7일 동안 치료는 침, 전침, 간접구, 부항 치료를 지속적으로 받았다. 2021년 6월 2일 16시 접종 부위 근육통 호소하여 Acetaminophen 650 mg 1정 복용하였으며, 2021년 6월 3일 근육통 및 전신적인 불편감 완화되어 지낼 만하다고 말하였다.
7) 증례 7
65세 여성, 고혈압, 고지혈증, 척추관 협착증 병력 있는 자로 2012년 4월 안검하수 수술 후 안면연축 발생하였으며, 2013년 우반신소력, 두통, 현훈으로 뇌 컴퓨터 단층 촬영, 뇌 자기공명영상에서 소혈관질환 진단받았으며, 2015년 2월 두통 및 현훈 악화되어 ⃝⃝병원 응급실 방문하여 대뇌죽상경화증 진단받았으며, 본원 입원과 퇴원 반복하고 있는 자로 2021년 5월 18일 본원 간장조혈내과로 간대성 반쪽안면연축 의증 진단 하에 입원하였다. 2021년 6월 11일 16시 아스트라제네카 코로나19 백신 1차 접종하였다. 기존 복용 한약은 加味經驗方(酸棗仁(炒) 12 g, 生薑 10 g, 柏子仁 6 g, 熟地黃 6 g, 防己4 g, 白芷 4 g, 蒼朮 4 g, 川芎 4 g, 當歸 4 g, 羌活 4 g, 黃柏 4 g, 天南星 4 g, 肉桂 4 g, 葳靈仙 4 g, 赤芍藥 4 g, 麻黃 4 g, 遠志 4 g, 石菖蒲 4 g, 黃精 4 g, 紅花 2 g, 獨活 2 g, 甘草 2 g, 葛根 2 g, 桔梗 2 g, 黃芩(酒炒) 2 g, 荊芥 2 g, 枳實 2 g, 升麻 2 g, 防風 2 g 1일 3회 아침, 점심, 저녁 2첩 3포 100 mL), 淸血丹(1일 3회 아침, 점심, 저녁 2개)이었으며, 양약은 Omega-3-acid ethyl esters, Molsidomine, Trimetazidine, Esomeprazole/sodium bicarbonate, Lercanidipine/ valsartan이었다. 예방 접종 후 7일 동안 상기 약물은 동일하게 복용하였다. 예방 접종 후 7일 동안 치료는 침, 전침, 간접구, 경근간섭저주파요법(ICT)을 지속적으로 받았다. 2021년 6월 11일 취침 전까지 Numeric Rating Scale(NRS) 5 정도의 전신 근육통이 지속되었으며, 새벽에 오한 발생하여 Acetaminophen 650 mg을 복용하였으며, 2021년 6월 12일 아침에는 오한은 없고 근육통은 있으나 약 추가로 먹을 정도는 아니라고 하였으나, 이후 전신 근육통 NRS 7-8로 있어 雙和湯加味 엑스제 1일 3회 아침, 점심, 저녁, Acetaminophen 650 mg 2정 복용하였다. 17:33에는 오한 있다고 호소하였으며 열은 없었으나 컨디션 좋지 않다고 하여 Acetaminophen 650 mg 2정 추가로 복용하였다. 2021년 6월 13일 두통 호전되었다고 하였으며, 雙和湯加味 엑스제를 1일 3회 아침, 점심, 저녁으로 2021년 6월 14일까지 투여하였다.
8) 증례 8
67세 여성, 고지혈증 병력 있는 자로, 2020년 10월부터 우하지소력 있었으며 2021년 1월 척추관 협착증 진단받은 자로 2021년 5월 24일 본원 순환신경내과로 다발성 신경병증 의증 진단 하에 입원하였다. 2021년 6월 3일 아스트라제네카 코로나19 백신 1차 접종하였다. 기존 복용 한약은 加味逍遙散合八味加牛膝車前子(當歸 3 g, 白芍藥 3 g, 白朮 3 g, 柴胡 3 g, 甘草 2 g, 附子(炮) 2 g, 肉桂 2 g, 白茯苓 6 g, 牡丹皮 6 g, 熟地黃 16 g, 山茱萸 8 g, 山藥 8 g, 澤瀉 6 g, 牛膝 4 g, 車前子 4 g 1일 3회 아침, 점심, 저녁 3첩 3포 90 mL)이었으며, 양약은 Esomeprazole, Celecoxib, Eperisone이었다. 예방 접종 후 7일 동안 상기 약물은 동일하게 복용하였다. 예방 접종 후 7일 동안 치료는 침 치료를 지속적으로 받았다. 2021년 6월 4일 1:30 몸이 아프지는 않은데 감기 올 것 같다고 하여 Acetaminophen 650 mg 1정 경구 복용하였으며, 10:45 경도의 전신 근육통 발생하여 Acetaminophen 원하여 Acetaminophen 650 mg 1정 추가로 경구 복용하였다. 이후 2021년 6월 5일부터 특이할 만한 증상 호소하지 않았다.
9) 증례 9
63세 여성, 위염, 고지혈증 병력 있는 자로, 2021년 5월 이충만감 및 어지럼증 자각하여 2021년 6월 7일 본원 한방안이비인후피부과로 양성돌발성두위현훈 의증 진단 하에 입원하였다. 2021년 6월 10일 10시 아스트라제네카 코로나19 백신 1차 접종하였다. 기존 복용 한약은 十全大補湯(白茯苓 5 g, 白朮5 g, 白芍藥 5 g, 川芎 5 g, 大棗 6 g, 當歸 5 g, 甘草 5 g, 黃芪 6 g, 生薑 6 g, 熟地黃 5 g, 肉桂 6 g, 人蔘 5 g 1일 3회 아침, 점심, 저녁 2첩 3포 100 mL), 消積健脾丸과립, 補胃拱辰丹(1일 3회 아침, 점심, 저녁)이었으며, 양약은 없었다. 예방 접종 후 7일 동안 한약은 주소증에 따라 변경되었다. 2021년 6월 11일 十全大補湯, 消積健脾丸과립, 補胃拱辰丹을 아침까지 복용 후 점심부터 雙和湯加味, 防風解毒湯, 兒科養胃健肺湯 엑스제를 1일 2회 점심, 저녁에 복용하였으며, 2021년 6월 12일 雙和湯加味, 防風解毒湯, 兒科養胃健肺湯 엑스제를 1일 3회 아침, 점심, 저녁 복용하였다. 2021년 6월 13일-2021년 6월 14일 補胃拱辰丹을 1일 3회 아침, 점심, 저녁에 복용하였다. 2021년 6월 15일 補胃拱辰丹을 아침까지 1일 1회 복용하였으며, 消積健脾丸과립을 1일 2회 점심, 저녁, 祛風湯 엑스제를 1일 1회 저녁 복용하였다. 2021년 6월 16일 消積健脾丸과립과 祛風湯 엑스제를 1일 3회 아침, 점심, 저녁 복용하였으며, 舒經湯加味 엑스제를 1일 1회 저녁에 복용하였다. 2021년 6월 17일 消積健脾丸과립을 1일 3회 아침, 점심, 저녁 복용하였다. 예방 접종 후 7일 동안 치료는 침, 간접구, 부항 치료를 지속적으로 받았다. 2021년 6월 10일 발열 및 두통 호소는 없었으나 Acetaminophen 650 mg 2정을 점심 식후 30분에 복용하였으며, 18:34 열감 및 근육통 심하지 않은 상태라고 표현하여 Acetaminophen 650 mg 2정 추가 투약하였다. 2021년 6월 11일 13:30 전일 백신 접종 이후 미열 느껴진다고 표현하여 생리식염 주사액 500 mL 및 multivitamins 1 vial을 혼합하여 40 mL/hr 속도로 주입하였다. 15:54 약간의 몸살 기운 있다고 하였고 18:38 열감, 기력저하 남아있으나 호전 양상이라고 하였다. 2021년 6월 12일 10:35 열감 미약하게 남아있다고 표현하였으나 추가 처치 및 약제 요구 없었으며, 이후 이상반응은 발생하지 않았다. 활력 징후에서 이상은 보이지 않았다.
10) 증례 10
67세 남성, 경추 추간판 탈출증 병력 있던 자로, 2020년 10월 1일 만성 열공경색(좌측 기저핵) 진단받은 병력 있으며 2021년 2월 10일 조음곤란 발생하여 뇌 자기공명영상에서 급성 뇌경색(우측 기저핵) 진단받고 2021년 2월 15일 좌안면마비 발생하여 뇌자기공명영상에서 병변 부위 확대되었다는 소견 듣고 2021년 2월 17일 본원 침구과로 급성 뇌경색(우측 기저핵), 만성 열공 경색(좌측 기저핵), 벨마비(좌측) 의증 진단 하에 입원하였다. 2021년 6월 14일 아스트라제네카 코로나19 백신 1차 접종하였다. 기존 복용 한약은 補陽還五湯(黃芪 8 g, 當歸 5 g, 赤芍藥 5 g, 地龍 3 g, 川芎 3 g, 桃仁 3 g, 紅花 3 g 1일 3회 아침, 점심, 저녁 2첩 3포 70 mL), 癒風丹과립(1일 1회 저녁)이었으며, 양약은 Choline alfoscerate, Ginkgo biloba, Aspirin, Cilostazol이었다. 예방 접종 후 7일 동안 상기 약물은 동일하게 복용하였다. 예방 접종 후 7일 동안 치료는 침, 전침, 간접구, 부항 치료를 지속적으로 받았다. 이상반응은 발생하지 않았다.
11) 증례 11
64세 여성, 고지혈증, 고혈압 병력 있으며, 2020년 7월 자궁경부암 및 장협착 수술한 과거력 있는 자로 2021년 6월 4일 본원 사상체질과에 두통 진단하에 입원하였다. 2021년 6월 15일 11시 아스트라제네카 코로나19 백신 1차 접종하였다. 기존 복용 한약은 荊防瀉白散(生地黃 12 g, 白茯苓 8 g, 澤瀉 8 g, 石膏 4 g, 知母 4 g, 羌活 4 g, 獨活 4 g, 荊芥 4 g, 防風 4 g 1일 3회 아침, 점심, 저녁 2첩 3포 120 mL), 凉膈散火湯 엑스제(1일 1회 취침 전), 威靈仙, 瓜蔞根, 夏枯草 30%에탄올건조엑스(40→1)(1일 2회 아침, 저녁), 艾葉 95%에탄올연조엑스(20→1)(1일 2회 아침, 저녁)이었으며, 양약은 AmLodipine/olmesartan, Atorvastatin, Tamsulosin hydrochloride, Celecoxib, Nefopam, Propranolol, Alprazolam, Mirtazapine, Simethicone/pancreatine, Trimebutine, Rabeprazole이었다. 예방 접종 후 7일 동안 凉膈散火湯은 동일하게 복용하였다. 2021년 6월 16일 荊防瀉白散 탕약 대신 荊防敗毒散 엑스제를 1일 3회 아침, 점심, 저녁 복용하였으며, 2021년 6월 17일부터 다시 기존 복용하던 荊防瀉白散 탕약을 지속적으로 복용하였다. 2021년 6월 21일 기존에 존재하던 어지럼증 및 이명과 관련하여 이비인후과 협진 하에 Ginkgo biloba를 추가 복용하였다. 예방 접종 후 7일 동안 치료는 침, 전침, 간접구 치료를 받았다. 2021년 6월 16일 1:55 머리가 아프고 열이 나는 것 같고 잠도 못 잤다고 하여 Acetaminophen 650 mg 1정 복용하였으며, 6:30에 추가로 1정 복용하였다. 오후에는 몸살 난 듯한 증상은 좋아졌다고 표현하였다.
2. 이상반응과 안전성 평가
총 19건의 이상반응이 보고되었으며, 전신 이상반응이 15건, 국소 이상반응이 3건, 검사결과 이상(ALT 상승)이 1건이었다. 11명의 환자에서 가장 흔하게 보고된 전신 이상반응은 피로감(4건, 36.4%), 두통(4건, 36.4%), 근육통(4건, 36.4%)이었으며, 모든 이상반응은 중증도가 중등증(2단계) 이하로 평가되었다. 백신과 이상반응 사이의 인과관계를 평가한 결과 검사결과 이상 1건을 제외하고 모두 인과성이 명백한 경우(definite)로 판단하였으며, 검사결과 이상 1건은 인과성이 인정되기 어려운 경우(unlikely)로 판단하였다. WHO-UMC 인과 관계 평가 시스템에 따라 한방 치료와 이상반응 사이의 인과관계를 평가한 결과 모두 unlikely로 평가되었다. 이외에 백신 접종 후 신수치를 확인할 수 있었던 환자 8명에서 BUN과 Creatinine은 모두 참고 범위 내로 측정되었다(Table 3).
Table 3
A Data Analysis on Adverse Events Following Immunization
IV. 고 찰
본 연구는 한방병원 입원 환자 중 아스트라제네카 코로나19 백신 접종을 시행한 환자를 대상으로 예방접종 후 이상반응을 후향적으로 조사하였다. 그 결과 아스트라제네카 코로나19 백신 접종 후 한방 치료를 시행하였을 때 백신 단독 접종 후에 비해 이상반응의 중증도와 빈도가 증가하지 않았으며, 백신이나 한방 치료와 인과성이 높은 새로운 이상반응이 나타나지 않았다는 것을 확인할 수 있었다.
아스트라제네카 코로나19 백신 접종 후 이상반응에 대해 해외에서 이루어진 4가지 연구를 종합한 결과에 따르면, 가장 흔한 이상반응은 주사 부위 압통(63.7%), 주사 부위 통증(54.2%), 두통(52.6%), 피로(53.1%), 근육통(44.0%), 권태감(44.2%), 열이 있음(체온 상승 33.6%, 38도 초과 발열 7.9%), 오한(31.9%), 관절통(26.4%), 오심(21.9%) 순이었고, 백신 접종 하루 후에 국소 및 전신 증상 발생률이 가장 높았으며, 7일차에 각각 4%와 13%로 감소했다. 두 번째 접종 시에는 비슷한 증상이 나타났으나, 증상의 정도가 가볍고 낮은 빈도로 나타났다14. 또한 WHO에서 발표한 바에 따르면, 10% 이상의 대상자에서 두통, 오심, 근육통, 관절통, 주사 부위 압통, 주사 부위 통증, 주사 부위 온기, 주사 부위 소양감, 피로, 권태감, 발열, 오한이 나타났다15.
국내 보고에서도 이상반응에 대해 연구가 이루어졌다. 아스트라제네카 코로나19 백신 접종 후3일 내의 이상반응에 대하여 한국에서 보고한 바에 따르면 5589명의 의료 관련 종사자 중 전체 이상반응 비율은 93%였으며, 국소적으로는 통증(81.2%), 소양감(22.2%)에서 보고되었고, 전신반응으로는 근육통(79.9%), 피로(76.5%), 두통(69.5%), 오한(65.8%), 발열(51.3%), 관절 통증(48.6%), 현기증(46.8%), 소화 불량(30.9%), 두근거림(28.3%) 등이 나타났다. 해열제는 82.3%에서 사용했다. 또한 3.5%는 39도를 초과한 고열, 21%는 38.0도에서 39.0도 사이의 중등도 열을 보고하였다16.
본 연구에서도 기저 질환이 있는 입원 환자에 백신 접종 후 한약 투여 및 한방 치료를 지속하며 관찰한 결과 전신반응으로 피로감, 근육통과 두통, 오한, 발열, 국소반응으로 주사 부위의 통증, 소양감이 나타나 종류에 있어 대체로 기존 보고와 일관된 경향을 보였다. 이에 이상반응이 발생한 시기와 기존 보고를 기초로 인과성평가를 한 결과 전신 이상반응 15건과 국소 이상반응 3건은 예방 접종과 인과성이 명백한 경우(definite)로 평가할 수 있었다. 또한 모든 이상반응의 중증도가 중등증(Grade 2) 이하로 평가되었으며, 발생 빈도에 있어 기존 연구에 비해 낮게 발생하여 한방 치료가 부정적인 영향을 끼치지 않은 것으로 추정할 수 있었다.
특히 이상반응에 있어 추가 약물을 처방한 환자 9명 중 5명은 이상반응의 조절을 위해 한약을 사용하였으며, 5명 중 4명은 이상반응 조절을 위해 雙和湯加味를 사용하였다. 雙和湯은 정신과 육체가 피로하고 氣血이 모두 손상되었을 때 피로가 심하거나 大病 후 虛勞한 경우 사용하는 약으로, 항염증, 항피로, 간기능 개선, 면역활성화 등에 효과가 있음이 보고되었다17. 따라서 雙和湯을 백신의 이상반응으로 인한 불편감을 경감시키는 데 활용할 가능성이 있어 보인다. 향후 雙和湯과 같은 한약이 백신 접종 후 접종자의 불편감을 경감한다는 근거를 마련한다면 백신 접종자에 적극적으로 한약을 권유할 근거가 될 것이다.
기존 연구에서 보고되지 않은 이상반응으로는 증례 3에서의 검사결과 이상으로 ALT 상승이 있었다. 해당 환자의 수치를 살펴보면 증례 3에서의 ALT 상승은 백신 접종 13일 후인 2021년 6월 24일 44 U/L(reference range < 35 U/L)로 경도의 상승이 관찰되어 백신 접종 전 2021년 6월 10일 검사에서의 경도 상승 수치인 37 U/L 보다 상승이 관찰되었다. 당시 ALP(alkaline phosphatase) 수치는 60 U/L(reference range 30~120 U/L)로 측정되었다. 2019년 EASL(European Association for the Study of the Liver) 약인성 간손상 임상 진료 지침에 의하면18, 증례 3에서의 ALT 상승은 급성 약인성 간손상의 사례 정의인 i) ALT 정상 상한치의 5배 이상 상승 ii) ALP에서 정상 상한치 2배 이상 상승, iii) ALT 정상 상한치 3배 이상 상승 및 총빌리루빈 농도의 정상 상한치 2배 초과 동시 상승을 만족하지 못하였다. 또한 백신 접종 이전이며 한방 치료를 시행하지 않았던 한방병원 입원 1주일 전 응급실에서 시행한 2021년 5월 27일 검사상 57 U/L으로 측정된 것으로 볼 때 백신 또는 한방 치료와 관련된 수치 상승의 가능성보다는 기저 질환에 의한 수치 상승으로 보는 것이 타당해 보인다. 결론적으로 ALT 상승의 경우에는 본 연구에서 혈액검사와 관련한 이상반응의 수집 및 중증도 평가가 건강한 청소년과 성인이 참가하는 임상시험을 위한 가이드라인인 한국 식품의약품안전처의 백신 임상시험 이상반응 중증도 평가 가이드라인11과 미국 식품의약국의 독성 등급 척도12를 기반으로 이루어지면서 기저에 수치 상승이 있는 환자에 건강인의 기준이 적용되며 이상반응이 과대추정된 것으로 보는 것이 타당할 것이다. 따라서 ALT 상승이 백신과 이상반응에 대한 자료가 충분하지 않고 기저 질환의 가능성이 높아 인과성이 인정되기 어려운 경우(unlikely)로 분류되었고, 마찬가지로 한방 치료와의 인과관계도 기저 질환의 가능성이 높아 unlikely로 평가되었으며, 상승 정도 또한 낮아 의미 있는 이상반응이 아닌 것으로 사료된다.
따라서 본 연구는 아스트라제네카 코로나19 백신 접종 환자에서 한방 치료가 이상반응에 있어 부정적인 영향을 끼치지 않음을 관찰한 것에 의의가 있다. 기존 연구에 따르면 한약재는 대식세포와 T/B 림프구의 신호 경로를 활성화하고 자연 살해 세포의 신호 경로를 조절하고 보체 체계를 활성화하는 등 백신의 면역 효과를 향상시키며19, 바이러스 침입, 복제를 억제하고 면역 반응을 조절할 뿐 아니라 백신의 효율성을 높이는 백신의 보조제 및 예방적 약물로 사용될 가능성이 있다고 보고되었고9,20, 또한 十全大補湯과 補中益氣湯은 mouse 실험에서 체액성 면역과 세포성 면역을 증진시킴으로서 백신의 효과적인 보조제로 사용될 수 있다는 가능성이 제기된 바 있다21. 따라서 추후에는 백신 접종자에 대해 한방 치료를 시행하였을 때 백신의 효과 지표인 면역원성, 유효성 변화를 심층적으로 평가하여, 한방 치료를 백신에 대한 보조 치료로 활용할 근거를 마련하는 연구가 진행되길 기대한다.
한편, 본 연구의 한계점은 본 연구가 사례군 연구로서 혈액검사 시점, 복용 중인 약물, 사용한 한약, 동반질환 등 변수 통제가 어려워 환자마다 편차가 컸고, 예방접종 후 이상반응이 축소 보고되었을 가능성이 존재했다는 점을 들 수 있다. 다만 실제 임상에서는 다양한 기저 질환 환자에 대해서 다양한 한방 치료가 예방접종 후 시행될 가능성이 높으므로, 본 연구를 이에 대한 정보 제공 및 향후 질 높은 연구에 대한 기초 연구로서 활용할 수 있겠다. 또한 기존에 아스트라제네카 코로나19 백신과 다른 약물 사이의 약물 상호작용 연구가 이루어지지 않음에 따라22, 한방 치료와의 상호작용에 대한 연구 또한 이루어지지 않아 백신과 한방 치료 사이의 상호작용을 평가하는 데 한계가 있었다. 추후 정확한 이상반응과의 인과성 평가 및 백신과 한방 치료 사이의 상호작용 여부 파악을 위하여 추가적인 사례 보고 수집 및 약물역학연구와 잘 설계된 무작위배정 임상시험을 통하여 심층적인 연구가 필요하다.
마지막으로 아스트라제네카 코로나19 백신의 2차 접종을 시행한 환자의 증례가 없으며, 관찰 기간이 짧아 추적 조사가 이루어지지 못하여, 아스트라제네카 코로나19 백신의 1차 접종에 국한된 관찰 연구라는 한계점이 있었다. 그러나 기존 보고에 따르면 아스트라제네카 코로나19 백신 접종의 부작용이 1차보다 2차 접종 후 덜 빈번하고 가볍게 나타났다14,16고 알려진 만큼 2차 접종에서 한방 치료를 병행하여도 추가적인 이상반응 발생이 나타날 가능성은 낮을 것으로 보인다. 입원 환자 중 다른 백신을 접종한 환자가 없어 아스트라제네카 코로나19 백신에 대한 관찰로 한정된 것도 아쉬운 점인데, 이외에 COVID-19 예방을 위해 국내 허가된 다른 백신인 화이자 코로나19 백신(BNT162b2), 얀센 코로나19 백신(Ad26.COV2.S), 모더나 코로나19 백신(mRNA-1273)에 대하여도 한방 치료와의 안전성을 파악하기 위한 연구가 필요할 것으로 사료된다.
V. 결 론
아스트라제네카 코로나19 백신을 접종한 환자 11명에서 한방 치료를 시행하였을 때 전신, 국소 이상반응 18건의 경우 백신과 인과성이 명백한 경우로 기존 연구에 비해 중증도나 빈도가 증가하지 않았으며, 백신과의 인과성이 인정되기 어려운 경우인 검사결과 이상(ALT 상승) 1건의 경우 한방 치료와의 인과성 또한 낮으므로, 기저 질환이 있는 아스트라제네카 코로나19 백신을 접종한 환자에게 한약과 침, 전침, 뜸, 부항, 추나 치료, ICT, 고주파 온열 치료, Silver spike point 전자 침술 치료, 약침 치료 등 한방 치료를 지속적으로 시행하는 것이 백신 접종에 있어 새로운 이상반응을 나타내거나 이상반응을 악화시키지 않았음을 관찰하였다.