Ⅰ. 서 론
감초(Glycyrrhiza foetida, Glycyrrhiza glabra, Glycyrrhiza uralensis 등)는 한⋅중⋅일을 중심으로 동아시아에서 한의학적 처방이나 식용의 목적으로 널리 사용되고 있을 뿐만 아니라 핀란드, 아이슬란드 등의 북유럽을 중심으로 한 서구권 각 국가에서도 사탕(licorice candy) 및 감미료 등으로 널리 사용되고 있으며 네덜란드에서는 연간 1인당 평균 2kg의 감초를 섭취한다는 통계가 있다1. 최근에는 감초의 항당뇨효과에 관한 연구결과들이 발표되었으며 약리적으로는 감초의 내분비계에 대한 작용과 관련하여 glycyrrhetinic acid, isoglycyrrhigenin, glycyrrhizin 등의 혈당강하 효과가 보고되었다2-9. 하지만 감초의 지표성분인 glycyrrhizin이 triterpene glycoside로서 甘味를 나타내므로10,11 적극적으로 당뇨치료에 이용된 경우는 많지 않다.
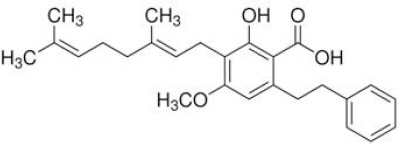
최근 기존에 잘 알려진 감초의 성분 외에 amorfrutin이라는 성분(Fig. 1)의 효과에 대한 보고가 있었는데 이에 따르면 amorfrutin이 혈장 내 glucose와 지방산 감소에 효과를 나타냈다12. Amorfrutin은 2형 당뇨 치료 기전에서 glucose와 lipid 항상성 유지에 중요한 역할을 하는 수용체인 Peroxisome Proliferator-Activated Receptor Gamma(PPARγ)³에 직접 결합하였다13. 이를 통해 amorfrutin은 혈중 포도당과 지방산을 감소시키는 여러 유전자를 활성화시키는 기전을 나타냈으며 성인 당뇨병 주원인인 인슐린 저항성 발달을 막아 2형 당뇨 치료에 효과를 나타낸 것으로 보고되었다.
기존의 당뇨병 약들 중 PPARγ 수용체에 작용하는 기전을 가지는 약들이 있지만 체중증가, 심혈관장애 등의 부작용이 보고되었다12. 이에 비해 amorfrutin은 연구결과에서 큰 부작용을 나타내지 않았기에 보다 안전한 당뇨병 치료 물질로서의 가능성을 전망해 볼 수 있다. 저자들은 당뇨에 대한 감초의 amorfrutin성분의 효과에 관한 연구에 대한 문헌 고찰을 진행하였으며 유효한 효과가 있음을 확인하였기에 이를 보고하고자 한다.
Ⅱ. 연구방법
1. 정보원 및 문헌검색 전략
당뇨에 대한 amorfrutin성분에 관한 문헌을 조사하기 위해 영어 문헌은 PubMed(https://www.ncbi. nlm.nih.gov/pubmed), 중국어 문헌은 CNKI(http:// www.cnki.net)와 Wanfang data(http://www.wanfangdata. com.cn/index.html), 한국어 문헌은 OASIS(http:// oasis.kiom.re.kr)와 NDSL(https://www.ndsl.kr), 일본어 문헌은 J-STAGE(https://www.jstage.jst.go.jp)와 CiNii(https://ci.nii.ac.jp)를 이용하여 검색하였다. 검색은 2020년 9월 10일부터 9월 20일까지 시행되었다. 국내 검색엔진 키워드는 “amorfrutin”과 “당뇨” 등을 이용하였고, 중국어 검색엔진 키워드는 “amorfrutin”, “糖尿病” 등이었고 간체와 번체를 같이 검색하였다. 영미권 검색 엔진에서는 “(amorfrutin) AND {(glucose) OR (hyperglycemia) OR (“diabetes mellitus”[MeSH Terms])}”, “[(Licorice) OR (Glycyrrhiza)] AND (Amorfrutin)”의 검색어를 사용하였고, 일본 검색엔진 키워드는 “アモルフルチン”, “amorfrutin”를 사용하였다. 각 국가별 검색엔진의 특성에 따라 검색 키워드를 조합하여 검색을 진행하였다.
2. 선정 기준 및 제외 기준
문헌 선정기준은 insulin, glucose등 당뇨와 관련된 지표에 대한 amorfrutin의 효과를 다룬 문헌, amorfrutin을 단독으로 또는 포도당과 결합하여 투여한 in vivo 문헌이었으며 문헌 제외기준은 review문헌 등 in vivo실험을 포함하지 않는 문헌과 당뇨와의 관련성이 없는 문헌이었다.
Ⅲ. 결 과
1. 문헌 검색 및 분석결과
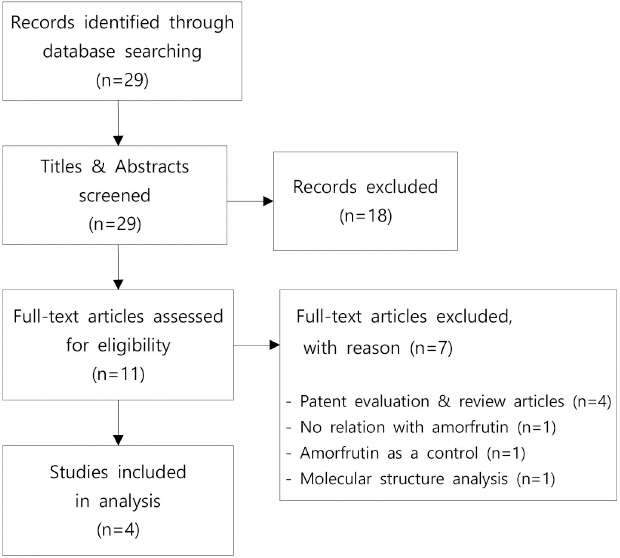
2020년 9월 10일부터 20일까지 국내외 검색기관에서 검색된 논문은 중복 논문을 제외하고 총 29편이었다. 일차적으로 선정 및 제외기준에 따라 제목과 초록을 검토한 결과 당뇨와 관련성이 없는 논문 18편을 제외하였다. 다음으로 11편의 논문을 대상으로 전문 검토를 진행하여 당뇨에 효과 있는 천연물질들을 다루었으나 amorfrutin을 대상으로 하지 않은 연구 1편, 새로운 화합물의 당뇨에 대한 효과에 관한 실험에 amorfrutin을 대조군으로서 투여한 연구 1편, 실험을 진행하지 않고 분자구조 분석을 통해 amorfrutin의 당뇨에 관한 효과를 예측한 연구 1편, amorfrutin의 특허권 심사에 관한 문헌 1편 및 review형식의 문헌 3편 등 총 7편을 추가적으로 배제하였다. 최종적으로 amorfrutin의 당뇨에 관한 3편의 동물실험연구와 amorfrutin과 당뇨치료에 관여하는 수용체간의 결합정도를 실험한 연구 1편이 분석대상으로 선정되었다.
2. 자료 추출 및 분석
1) 연구 개요
최종 선정된 4편의 연구는 in vivo연구 3편(Table 1, 2)과 in silico연구 1편(Table 3)이었으며 당뇨에 대한 순수amorfrutin 또는 PEGylated amorfrutin의 효과를 확인하기 위해 설계된 논문들이었다.
Table 1
Characteristics of Included in vivo Studies (DIO)
Table 2
Characteristic of Included in vivo Study (Genetically Modified Animal)
Table 3
Characteristic of Included in silico Study
2) 연구 대상
In vivo연구 3편12,14,15에서 총 5건의 실험연구가 진행되었으며 그 중 1건12에서 9주 연령의 leptin receptor-deficient db/db mouse(렙틴 수용체 결핍 당뇨모델 쥐)가 사용되었으며 성별은 언급되지 않았다. 2건12,14의 실험연구에서는 고지방식이(high fat diet; HFD/60 kcal% fat)를 12주 동안 먹여 당뇨를 유발한 6주 연령의 male C57BL/6 mouse가 사용되었으며, 고지방식이(HFD/60 kcal% fat)를 15주 동안 먹인 9주 연령의 male C57BL/6 mouse가 1건12에서 사용되었다. 또한 표준식이를 먹여 22.5±3 g의 몸무게에 도달하도록 한 mouse가 1건15에서 사용되었는데 먹이를 먹인 기간과 연령 및 성별은 언급되지 않았다.
In silico문헌 1편16에서는 인체 glucagon receptor (GCGR)의 3D crystal structure와 이에 결합시킬 amorfrutin을 포함한 83종의 천연화합물의 3D 구조물들을 사용하였다.
3) In vivo문헌의 실험군 설계
Weidner의 연구12에서는 amorfrutin 1(100 mg/kg/day)을 HFD와 함께 투여하거나 standard diet와 함께 투여하여 각각 별개의 연구를 진행하였고 투여기간은 모두 3주 이상(Oral Glucose Tolerance Test (OGTT)는 투여 17일 이후, Intraperitoneal Insulin Sensitivity Test(IPIST)는 투여 23일 이후 시행)이었다. 또한 Low-dose amorfrutin 1(37 mg/kg/day)을 HFD와 함께 10주 이상 투여한 뒤 OGTT를 시행하였다. Weidner14에서는 amorfrutin B(100 mg/kg/day)를 HFD와 함께 4주 이상 투여하였다. Samad15의 연구에서는 PEGylated amorfrutin B를 12시간의 공복 이후 glucose(2.5 g/10 mL/kg body weight)와 함께 투여하였다.
4) In vivo문헌의 무처치 대조군(vehicle)과 대조군(positive control) 설계
Weidner의 연구12에서는 무처치군에게는 표준 식이만을, positive control군은 표준식이군과 rosiglitazone (4 mg/kg/day)을 함께 3주 이상 투여하는 연구를 독립적으로 진행하였다. 또한 무처치군에게 HFD 또는 저지방식이(low fat diet, LFD)만을, Positive Control군은 rosiglitazone(4 mg/kg/day)을 HFD와 함께 투여하여 또 다른 연구를 진행하였다. Weidner14에서는 무처치군에게 HFD만을, Positive Control군은 rosiglitazone(4 mg/kg/day)를 HFD와 함께 4주 이상 투여하였다. Samad의 연구15에서는 무처치군에게 포도당 용액(glucose solution)과 동일한 양의 증류수만을, Positive Control군은 각각 amorfrutin B(100 mg/kg/dose)와 rosiglitazone을 12시간의 공복 이후 glucose(2.5 g/10 mL/kg body weight)와 함께 투여하였다.
5) 평가변수 및 방법
선정된 in vivo문헌 3편12,14,15에서는 당뇨에 대한 효과의 평가변수로서 insulin resistance(or sensitivity), glucose tolerance, plasma(blood) insulin과 plasma (blood) glucose의 concentration 및 pancreatic insulin level의 변화정도를 관찰하였다. 또한 선정된 in silico문헌 1편16에서는 제2형 당뇨의 치료 타깃이 되는 glucagon receptor(GCGR)과 당뇨에 효과가 있다고 알려진 amorfrutin을 포함한 천연 화합물들 간의 분자적 결합정도를 실험한 후 점수화하였다.
선정 문헌에서 사용한 평가 방법은 Homeostatic Model Assessment for Insulin Resistance(HOMA-IR), OGTT, IPIST, 정상혈당으로 돌아오는데 걸리는 시간 및 GOLD fitness score, X-score 등이었다.
Homeostasis model assessment(HOMA)는 임상연구를 비롯한 실제에서는 인슐린 저항성의 대리 지표로 사용되는 간단한 공식으로 ‘HOMA-IR=[공복 혈중인슐린(uU/mL)]×[공복 혈당(mmol/L)] /22.5’라는 식으로 얻을 수 있으며 인슐린 저항성과 β세포 기능 사이의 가능한 광범위한 조합에 대한 공복 시 평형 상태의 glucose와 insulin 농도를 예측하는 데 이용될 수 있다. 경구 내당능 검사(Oral Glucose Tolerance Test, OGTT)는 임상에서 내당능 평가와 제2형 당뇨병의 진단에 가장 널리 쓰이고 있는 검사법으로 밤새 금식 후, 표준 경구 glucose 또는 표준 식사 섭취 후, 0, 30, 60, 120분 후 채혈하여 glucose와 insulin 농도를 측정한다17.
Genetic Optimization for Ligand Docking(GOLD)는 GCGR과 천연화합물들 간의 반데르발스(van der Waals)힘과 수소결합을 평가하기 위해 각각에서 5.0과 2.5로 설정되어 사용되었다. GOLD score평가 이후 분자들 간의 결합 에너지를 측정하는 χ-score (Kcal/mol)를 이용해 다시 점수를 매겨 결합의 정도를 보다 정확하게 측정하였다.
6) 연구 결과
Weidner12에서 고지방식이로 비만이 유도된 C57BL/6 mouse에 amorfrutin을 투여한 실험군과 무처치군(vehicle) 사이에 실험 후 모든 평가 지표에서 통계적으로 유의한 차이가 있었다(p≤0.05). amorfrutin 1 투여군은 기존에 당뇨치료제로 널리 사용되고 있는 thiazolidinedione계열(TZDs)의 경구용 혈당강하제인 rosiglitazone을 투여한 대조군과 동등하게 DIO mouse에서 insulin resistance을 감소시켰으며(p≤0.05) DIO mouse의 내장 백색지방조직(viscerale white adipose tissue)에서 PPARγ의 인산화반응을 억제하여 insulin sensitivity를 증가시켰다(p≤0.05). Amorfrutin 1 투여군은 무처치군에 대비하여 glucose는 area under the curve(AUC)에서 19% 감소, insulin AUC는 42% 감소하여 glucose tolerance를 유의미하게 증가시켰으며 glucose AUCi는 14% 증가하여 insulin sensitivity를 유의미하게 증가시켰다(p≤0.05). 또한 amorfrutin 1 투여군에서 plasma insulin과 glucose이 rosiglitazone 투여군과 비슷한 수준으로 감소하였다(p≤0.05). Pancreatic insulin level은 무처치군에 비해 증가하였다(p≤0.05).
동일 문헌12에서는 또한 당뇨에 대한 amorfrutin의 long-term, low-dose연구를 15주간 진행하였다. 결과적으로 투여 10주 후 실시한 OGTT에서 insulin AUC가 22% 감소하여 glucose tolerance가 상승하였으며 투여 13주 후 실시한 IPIST에서 glucose AUCi가 21% 상승하여 insulin sensitivity를 상승시키는 결과를 얻었다(p≤0.05).
또한 동일 문헌12에서 severe diabetes의 유전적 모델인 leptin receptor-deficient db/db mouse를 대상으로 한 연구에서는 투여 24일 후 plasma insulin과 glucose를 무처치군에 비해 유의하게 감소시켰으며(p≤0.05) pancreatic insulin level을 무처치군에 비해 유의하게 상승시켰다(p≤0.05).
Weidner14의 연구 결과 Amorfrutin B를 투여한 mouse는 무처치군에 비해 insulin resistance 감소를 나타내었는데 그 정도가 rosiglitazone투여군과 유사했다(p≤0.001). Glucose tolerance와 관련한 OGTT에서는 blood glucose가 감소하였으며(p≤0.001) plasma insulin이 감소하였다(p≤0.01). 또한 concentrations of fasting plasma insulin과 fasting blood glucose가 무처치군에 비해 감소하였고(각각 p≤0.001, p≤0.01) 그 정도는 rosiglitazone투여군과 유사하거나 그 이상이었다.
Samad15의 경우 당뇨 mouse 모델에서 PEGylated amorfrutin B의 효과를 연구하였다. 페길화(PEGylation)는 이전의 동물 모델 실험들에서 약물 분자의 위장관 흡수율을 향상시키는 것으로 밝혀져있다. PEGylated amorfrutin B는 1당량의 amorfrutin B가 5당량의 2-(2-(2-Aminoethoxy)ethoxy) acetic acid와 120 ℃에 24h 동안 반응하여 생성되었으며 이후 95% 이상으로 purified 되었는지 평가한 후 사용되었다. PEGAmB은 AmB군과 무처치군에 비하여 rosiglitazone와 거의 동일한 수준으로 insulin surge를 효과적으로 조절하였다(p≤0.05). PEGAmB는 AmB군과 무처치군에 비하여 T3T-L1 adipocytes에서의 glucose uptake를 두드러지게 촉진하였다 (p≤0.05). 또한 PEGAmB는 무처치군에 비하여 경구 투여이후 나타난 glucose spike를 억제하는데 훨씬 효율적이었고(p≤0.05), 20분 이내에 glucose level를 정상혈당치로 회복시켜 120분이 걸린 AmB군에 비해 더 큰 성과를 나타냈다(p≤0.05).
Baig16에서 amorfrutin 1은 GCGR과의 결합능력을 나타내는 평가 점수인 GOLD fitness score에서 42.18점을, χ-score에서 -8.37점을 나타내어 83종의 천연 화합물 중 curcumin에 이어 두 번째로 높은 점수를 나타내었다. 실험 결과 두 점수평가는 긍정적인 상관관계를 나타냈다.
Ⅳ. 고찰 및 결론
본 연구는 당뇨에 대한 amorfrutin의 효과를 파악하기 위하여 실험 연구를 중심으로 문헌고찰을 하였다. 국내 및 외국의 검색엔진 기관에 정해진 키워드를 검색하여 총 29편의 문헌을 대상으로 하였다. 이후 당뇨에 대한 amorfrutin의 효과를 확인하기 위하여 제목과 초록 및 전문분석을 통한 선별과정을 거쳐 실험군의 중재(intervention)로 amorfrutin류를 투여한 총 3건의 동물실험 연구와 1건의 in silico 연구를 선정하였다.
Amorfrutin류를 투여한 당뇨 모델 mouse에서 혈중 glucose와 insulin농도가 감소하였으며 insulin resistance을 감소시키고 glucose tolerance를 향상시키는 결과를 나타내었다. 이 과정에서 amorfrutin은 2형 당뇨에서 인슐린 저항성을 치료하는 기전에 관여하는 PPARγ 수용체에 결합하여 활성화시키는 것으로 나타났다. 또한 PPARγ외에도 amorfrutin은 제2형 당뇨치료의 주 타깃으로 알려진 GCGR(glucagon receptor)과도 높은 분자적 결합력을 나타내었으며 GCGR을 억제하여 2형 당뇨 발생기전을 억제하는 결과를 나타내었다.
de Groot18에서는 amorfrutin이 PPARγ agonist로서 기능하는 것에 대한 분자 구조적 근거를 제시하였다. 이 연구에서는 amorfrutin과 PPARγ간의 결합 구조를 분석하여 amorfrutin이 agonist로서 PPARγ를 활성화시키는 정도와 PPARγ과 결합하는 정도를 측정하였다. Amorfrutin은 PPARα, PPARβ, PPARδ와 달리 Arg288를 포함하고 있는 PPARγ에만 agonist로서 작용하였다. 이는 PPARγ에 agonist로서 작용하여 기존의 2형 당뇨 치료제로 사용되는 rosiglitazone과 같은 기전을 나타낸다. Amorfrutin이 PPARγ를 활성화시키는 정도는 rosiglitazone이 PPARγ를 활성화시키는 정도의 20-39%에 달하는 것으로 보고되었다. Rosiglitazone은 생체분자와 유사한 수준으로 수용체를 활성화시키는 full agonist에 해당한다. 이에 비해 amorfrutin은 비교적 낮은 활성도를 가지는 partial agonist로서 작용하였다. 하지만 PPARγ에 대한 결합력은 rosiglitazone 이상인 것으로 나타났다.
또한 amorfrutin은 여러 연구에서 기존 당뇨치료제와 달리 부작용을 나타내지 않는 것으로 보고되었다. 기존에 당뇨치료제로 널리 사용되고 있는 rosiglitazone과 같은 thiazolidinedione계열(TZDs)경구용 혈당강하제는 체액저류, 심혈관계합병증, 방광암, 골 흡수 및 체중 증가 등의 부작용을 동반할 수 있는 것으로 알려져 있다12. 이에 비해 당뇨 모델 쥐를 이용한 2건의 실험에서 실험군에는 amorfrutin을, 대조군에는 rosiglitazone을 투여하여 그 결과를 각각 무처치군(vehicle)과 비교한 결과, 실험군에서는 지방과다증(adiposity)14 및 유의미한 체중증가가 관찰되지 않았다12. 또한 조골세포(osteoblast)의 발현이나 골세포(bone cell)의 무기화작용(mineralisation)을 저해하지 않는 것으로 나타나 골 흡수의 위험도가 낮을 것으로 생각된다14. 간 독성 및 유전독성(genotoxicity)등의 부작용 역시 나타나지 않았으며12 Tumor Necrosis Factor(TNF), EGF-like module-containing mucin-like hormone receptor-like 1(EMR1), C-C Motif Chemokine Ligand 3(CCL3) 등의 염증지표 발현이 유의미하게 감소하는 결과가 나타났다14.
또한 그 외에도 amorfrutin이 우수한 α-glucosidase 억제제로서 작용한다는 연구결과가 보고되었다19. 당분해 효소인 α-Glucosidase를 억제하면 소장에서 단당류의 흡수가 줄어들어 식후의 혈당상승을 억제할 수 있다20. 따라서 α-glucosidase 억제제는 근육이나 지방세포에서의 당 소모를 돕는 TZD계와는 다른 기전으로 당뇨치료효과를 나타낸다.
이렇듯 amorfrutin은 여러 기전을 통해 당뇨치료효과를 나타낼 수 있으며 기존의 당뇨치료제들과는 달리 부작용을 나타내지 않았다. 따라서 비교적 안전한 당뇨치료제로서 amorfrutin의 활용가능성을 전망해 볼 수 있을 것으로 사료된다. 당화혈색소가 7.5% 이상인 2형 당뇨군에서는 적극적인 생활습관 개선뿐만 아니라 동시에 경구혈당강하제를 투여하도록 되어있으며 환자의 상태를 고려하여 적절한 치료제를 선택하도록 권고하고 있다21. 특히 이 중 기존의 경구혈당강하제 투여 시 부작용이 나타나거나 또는 금기대상에 해당하는 당뇨환자군은 치료약 선택 시 각별한 주의가 필요하다. 향후 충분한 임상실험을 거친다면 이러한 환자군을 대상으로 amorfrutin을 포함하는 감초를 유용하게 활용할 수 있을 것으로 생각된다.
Amorfrutin외에도 감초의 효과를 다룬 기존의 여러 연구들에서 동물 실험을 통해 혈당상승억제22 및 혈당강하효과에 관한 결과가 보고되었다2-9,23. 또한 감초의 glabridin성분은 혈당 내성의 증가, 공복 혈당의 감소를 나타내었다23,24. 감초의 isoliquiritigenin성분 역시 aldose reductase를 억제함으로써 적혈구에서의 sorbitol축적을 억제하는 결과를 나타낸 바 있다25. 최근에는 앞서 언급된 glabridin과 isoliquiritigenin 외에도 감초에서 추출된 liquiritigenin, liquiritin, licochalcone E와 3가지 triterpenoid가 당뇨치료효과를 나타낸다는 결과가 보고되기도 했다26. 따라서 추후 이러한 amorfrutin 성분을 비롯한 감초의 당뇨 치료효과를 뒷받침 할 수 있는 동물 및 임상실험 등의 연구가 진행된다면 향후 당뇨 치료의 발전에 도움이 될 것으로 사료된다.
Weidner의 연구12에 따르면 감초(Glycyrrhiza foetida) 뿌리에서 organic extraction과 유기물 함량(organic fraction) HPLC 분석을 시행한 결과 plant material 1 kg당 대략 3.5 g의 amorfrutin이 추출되었다고 보고되었다. 비록 감초의 amorfrutin함량이 비교적 적지만 효율적인 추출법 개발을 기대해 볼 수 있을 것으로 사료된다. 기존의 연구에서 추출용매의 종류27와 추출 시간 및 온도에 따른 감초의 활성도 차이28가 보고되었으며 다양한 약물과의 배합에 따른 성분 추출률 변화에 관한 연구29,30가 진행되었다. 이는 한의학에서 다양한 炮製法에 따라 本草의 성질이 달라지는 것과 다양한 약재들의 조합을 통해 처방(方劑)의 효능이 나타나는 원리와 비슷한 것으로 사료된다. 따라서 추후 이러한 한의학적 원리를 응용한 amorfrutin의 추출량 및 활성도를 증가시킬 수 있는 연구 또한 추가적으로 필요할 것으로 생각된다.
Amorfrutin의 당뇨 치료 효과를 다룬 문헌들 중 실질적인 실험연구(in vivo)는 3편으로 그 수가 많지 않았다. 이는 amorfrutin에 대한 연구결과가 비교적 최근에 발표되었기 때문에 관련 연구가 충분히 진행되지 못했기 때문으로 생각된다. 하지만 실험연구에 당뇨 모델로서 유전자 결핍 mouse와 비만 mouse를 모두 포함하고 있으며12 당뇨 치료효과를 다양한 항목에서 실험하였고 실험 결과의 유의성 역시 높아 양질의 연구문헌으로 사료된다.
문헌검색을 통해 amorfrutin은 당뇨기전에 관여하는 수용체들과 모두 높은 결합력을 나타내며 또한 insulin resistance 감소, glucose tolerance 증가, plasma insulin 및 glucose감소 등의 효과를 나타내어 2형 당뇨치료에 도움이 되는 것을 확인하였다.