Ⅰ.서 론
기침은 폭발적이며 갑작스러운 호기운동을 통해 기도 내에 있는 이물질이나 과하게 만들어진 분비물을 제거하는 작용이며 호흡기의 정상적인 방어기전이다[1]. 그렇지만 과도한 기침은 사회생활, 작업활동, 여가시간, 취침 등 전반적인 활동에 지장을 끼치고, 피로감과 같은 신체적 증상과 암과 같은 중대한 질환에 대한 정신적 불안감을 가져온다. 또한 흉통, 두통, 요실금, 늑골 골절, 실신 등의 합병증을 일으킬 수 있다[2]. 객담은 호흡기도에서 정상적으로 분비되는 점액성 물질이다. 작용으로는 기도상피를 보호하고 외부로부터 들어오는 흡인물질을 제거하는 방어기전의 역할을 한다. 하지만, 객담 생산의 증가, 점도의 변화 혹은 객담처리능력이 떨어지게 되는 상황에서는 객담이 기도 내에 머무르게 되어 기침, 호흡곤란 등 증상을 유발하고 만성호흡기 질환의 예후를 악화시키는 주요한 요인이 된다[3].
기침에 대한 기존 진해제는 말초조직의 기침수용체 작용을 방해하거나, 중추신경의 기침중추를 억제하는 약제들로 구성된다[4]. 중추작용 진해제는 비특이적 기침치료의 대표적인 약제로서 효과도 상당하지만, 일정하게 효과가 용량에 따라 나타나지 않아 환자 개체 특이성에 따라 필요한 투여량이 달라질 수 있고, 고용량 투여에 의한 중추성 부작용의 증가를 주의해야 한다[5]. 말초작용 진해제는 주로 호흡기도의 감각신경-펩타이드 레벨을 조절하여 진해작용을 나타내어 건기침과 폐암에 의한 기침에 효과적이라는 보고가 있으나[6,7], 오심, 구토, 설사 등 위장관계 부작용과 어지러움, 두통 등의 중추신경계 부작용이 있을 수 있다[4]. 실제 임상 상황에서는 거담제는 대부분 점액용해제로, 급만성 호흡기질환에서 증상완화를 위하여 사용한다. 하지만 효과가 일정하지 않아 가능한 짧은 기간 동안 사용하도록 권장하고 있다[8]. 따라서 호흡기질환에서 가장 많이 나타나는 증후인 기침과 가래에 대하여 안전하고 효과적이면서 장기적으로 사용할 수 있는 제제 개발과 연구에 대한 필요성이 끊임없이 요구되고 있다.
절패모(浙貝母, Fritillariae Thunbergii Bulbus, FTB)는 백합과에 속한 다년생 초본인 절패모(Fritillaria thunbergii Miquel)의 비늘줄기를 건조한 것으로 폐경(肺經)과 심경(心經)에 귀경하여 청열화담(淸熱化痰), 개울산결(開鬱散結)하는 효능이 있어 담열(痰熱)로 인한 해수를 비롯하여 다양한 호흡기질환에 다용되는 약재이다[9,10]. 절패모의 주요 성분은 알카로이드계에 속하는 peiminine, peimine, fritillarin, verticine, fritilline 등이 있다고 알려져 있다[11]. 또한 현재까지 절패모의 연구로는 항균, 항혈전 및 항산화 효과[12], 항암 효과[13], 알레르기 염증 완화 효과[14], 미백효과[15]에 대한 것들이 있다.
본 연구에서는 절패모의 항염 및 진해거담 효과를 평가하기 위해서 RAW264.7 세포를 사용한 in vitro 실험과 ICR 마우스를 사용한 동물실험을 진행하였다. 세포실험에서는 MTT assay를 통하여 세포독성과 Enzyme-Linked Immunosorbent Assay를 이용하여 항염증 효과를 관찰하였다. 동물모델에서는 phenol red 분비량 측정을 통한 거담효과, ammonia 용액으로 유발한 기침에 대한 진해효과, 급성기도염증 모델에서 백혈구 증가 억제효과를 평가하였다. 본 실험결과 절패모가 염증과 관련된 세포 및 cytokine의 발현을 억제시키고 기도 분비량을 증가시키며 기침을 억제하는 효과를 나타내는 것을 확인하였기에 보고하는 바이다.
Ⅱ. 재료 및 방법
1. 재 료
2) 시약 및 기기
본 실험에는 LPS(Sigma, MA, USA), mouse TNF-α, mouse IL-6는 R&D systems사(MN, USA), Dulbecco's phosphate buffered saline(D-PBS), formaldehyde, Dulbecco’s Modified Eagle Medium(DMEM)(Sigma, MA, USA), Fetal Bovine Serum(FBS)(Serum Source, NC, USA) 제품을 활용하였고, 그 외 일반 시약은 특급을 사용하였다. 열탕추출기(Daewoong, Korea), CO2 incubator(Forma Scientific, USA), rotary vacuum evaporator(Büchi, Switzerland), micro-pipet(Gilson, France), freeze dryer(EYELA, Japan), autoclave(Sanyo, Japan), chemical balance(Cas, Korea), water bath (Vision scientific, Korea), clean bench(Vision Scientific, Korea), spectrophotometer(Shimazue, Japan), thermocycler system(MWG Biotech, Germany), vortex mixer(Vision scientific, Korea), deep-freezer(Sanyo, Japan), centrifuge (Sigma, USA), Biosystem XA(Buxco Research System, USA), plate shaker(Lab-Line, USA), ice-maker(Vision scientific, Korea), homogenizer(OMNI, USA), ELISA reader(Molecular Devices, USA), chemical balance (Cas, Korea) 등의 제품을 실험에 사용하였다.
2. 방 법
1) 절패모의 세포독성 및 항염작용 실험
(1) 세포 배양
In vitro 실험에 사용한 RAW 264.7 cell은 한국세포주 은행(Seoul, Korea)으로부터 분양받았고, 배양에는 10% FBS이 포함된 DMEM배지를 사용하였다. 세포는 CO2 공급 5%, 온도 37 ℃, 조건에서 배양하였다.
(2) 세포 독성
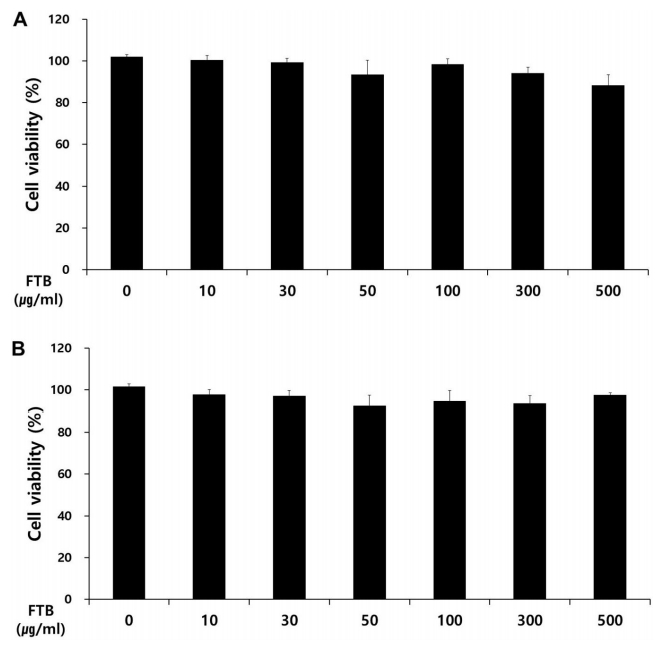
절패모 추출물을 RAW 264.7 cell 독성 측정은 MTT[3-(4,5-dimethylthiazol-2-yl)-2,5-diphenyl tetrazolium bromide, MA, Sigma, USA]의 측정으로 분석하였다. 5×104 cells/well로 RAW 264.7 세포를 분주하여, 추출물을 농도별(10, 30, 50, 100, 300 및 500 μg/ml) 24시간, 48시간 동안 처리하였다. 각각의 well 당 50 μl의 MTT용액을 가하고 온도 37 ℃, CO2 5% 조건의 배양기에서 4시간 동안 반응을 유도한 뒤, 570 nm의 파장에서 흡광도를 측정하여, 배지만을 배양한 대조군에 대한 백분율로 세포생존율을 표시하였다.
① Nitric Oxide(NO) 측정
Nitric oxide(NO)의 발현에 미치는 영향을 측정하기 위하여 절패모 추출물(10, 30, 50, 100, 300 및 500 μg/ml)을 농도별로 3반복하여 60분 처리하였고 이어서 24시간 동안 400 ng/ml의 LPS를 처리하였다. 세포에 시료를 농도별로 처리하고 16시간 동안 배양하였다. 배양상층액에 Griess 시약(0.1% naphthylethylenediamine dihydrochloride & 1% sulfanilamide in 5% H3PO) 100 μl를 섞어 흡광도 570 nm에서 측정하였다.
② TNF-α, IL-6 측정
절패모 추출물의 lipopolysacharide 반응한 RAW 264.7 세포에서 TNF-α와 IL-6의 발현에 대한 영향을 측정하기 위해 ELISA를 수행하였다. 절패모 추출물 10, 30, 50, 100, 300 및 500 μg/ml을 1시간 동안 반응시키고, 그 후 24시간 동안 LPS 400 ng/ml을 처리하였다. Coating buffer에 혼합한 capture antibody를 각각의 well에 100 μl씩 넣고 나서, 4 ℃에서 overnight한 이후, washing buffer를 사용하여 5번의 세척을 실시하였다. 각 well에 assay diluent를 300 μl씩 넣어, 1시간 동안 실온에서 blocking을 한 후, washing buffer로 3회 세척하였다. 농도별 실험군을 coating한 wellte에 100 μl씩을 첨가하고 나서, 2시간 동안 실온에서 반응시켰다. Washing buffer를 사용하여 4회 세척한 이후, 세포배양을 시행하기 위하여 biotin-conjugate antibody reagent 처리하고, 실온에서 반응시킨 뒤 4회 세척한 후, streptavidine-HRP solution 100 μl씩 각 well에 처리하여 30분 동안 실온에서 반응시키고, 다시 washing buffer로 4회 세척하였다. 여기에 substrate solution을 100 μl씩 처리하고 나서 30분간 반응시키고, stop solution을 처리하여 반응을 종료하여 450 nm의 파장에서 흡광도를 측정하였다.
2) 객담, 기침 및 급성기도염증 실험
(1) 동 물
실험에 사용된 동물은 ICR 계열의 7주령 수컷 생쥐(오리엔트바이오, Korea)로 고형 사료와 물을 섭취하도록 하였고, 22~24 ℃의 온도와 50±10%의 습도가 유지되며, 밤낮 주기의 조절이 가능한 조명을 갖춘 실험실 환경에서 7일간 순응시킨 다음 실험에 사용하였다. 실험동물의 평균 체중 측정결과는24±4 g으로 나타났다. 본 실험은 대전대학교 동물실험윤리위원회(승인번호: DJUARB2019-021)가 정한 규정에 따라 시행되었다.
(2) Phenol red 분비 측정 객담 실험[16]
점액분비 촉진작용을 확인하기 위해 무작위로 실험동물을 정상군, 대조군, 양성대조군(Positive control: PC), 실험군(200, 400 mg/kg)으로 나누어(군당 9마리) 양성대조군은 ambroxol 250 mg/kg을, 실험군은 절패모 추출물 200 및 400 mg/kg을 1일 1회, 3일간 동일한 시간에 경구로 투여하였으며 정상군과 대조군은 생리식염수를 투여하였다. 마지막 투여일에는 약물 투여 30분 후에 5%의 phenol red를 복강 주사하고, 30분후 기도를 절개하여 1 ml의 생리식염수를 30분간 침적하여 phenol red를 추출하였고 여기에 0.1 ml의 1 M NaOH를 가하고 546 nm에서 흡광도를 측정하여 phenol red의 분비량을 정량화 하였다.
(3) Ammonia 용액 유발 기침 실험
진해 효과는 ICR 마우스에서 ammonia liquor에 의해 유도된 기침 모델[17]에 의해 평가되었다. 마우스를 500 ml 유리병에 넣고 13% ammonium hydroxide (0.2 ml)를 분무하여 첫 기침 유발까지의 시간이 1분 미만이면서 분당 3회 이상 기침을 하는 개체를 실험에 적합한 것으로 선택하였다. 24시간의 회복 후 선택한 개체들을 무작위로 대조군, 양성대조군, 실험군으로 나누어(군당 9마리) 양성대조군은 pentoxyverine citrate 50 mg/kg을, 실험군은 절패모 추출물 200 및 400 mg/kg을 1일 1회, 3일간 동일한 시간에 경구로 투여하였으며 대조군은 동량의 생리식염수를 투여하였다. 마지막 투여일에는 약물투여 1시간 후 실험동물을 ammonia liquor에 노출시킨 다음, 2분 동안 첫 기침 유발까지의 시간과 기침횟수를 측정하였다.
(4) Ammonia 용액 유발 급성기도염증 실험[18]
항염 활성은 ICR 마우스에서 ammonia liquor에 의해 유도된 급성기도 염증에 의해 평가되었다. 실험동물은 무작위로 정상군, 대조군, 양성대조군, 실험군으로 나누어 양성대조군은 predinisone acetate 10 mg/kg을, 실험군은 절패모 추출물 200 및 400 mg/kg을 1일 1회, 3일간 투여하였으며 정상군과 대조군은 동량의 생리식염수를 투여하였다. 마지막 투여일에는 약물 투여 30분 전에, 마우스를 2분 동안 ammonia liquor에 노출시켰다. 6시간 이후, 마우스를 30% 우레탄을 사용하여 마취시켜 폐를 적출한 다음 2.1 ml의 생리식염수(1회 0.7 ml, 총 3회)로 수세하여 기관지 폐포 세척액(BALF)을 얻었다. BALF 내 총 백혈구수의 세포계수를 위해서 cytospin 시행하고 나서 침전된 혈구를 분리하여 Diff-Quik staining(Romanowsky stain)을 총 3회에 걸쳐서 처리하였다. 그 후 PBS로 2회 세척하고 군당 9개의 slide를 제작하고 400배율의 광학현미경(Light microscope, Nikon, Japan)을 통해서 계수하였다.
Ⅲ. 결 과
1. 절패모의 세포독성 및 항염작용에 대한 영향
2) NO 생성에 미치는 영향
RAW 264.7 세포에서 LPS로 유도한 대조군의 NO는 38.28±0.80 μM로 정상군의 1.14±0.04 μM보다 유의하게 증가하였다. FTB를 투여한 실험군은 30, 50, 100, 300, 500 μg/ml의 농도에서 각각 30.93±1.61, 30.13±1.52, 30.08±1.42, 27.82±1.45, 22.50±1.89 μM로 나타나 대조군에 비해 유의성 있는 감소를 보였다(Fig. 2).
3) TNF-α 생성에 미치는 영향
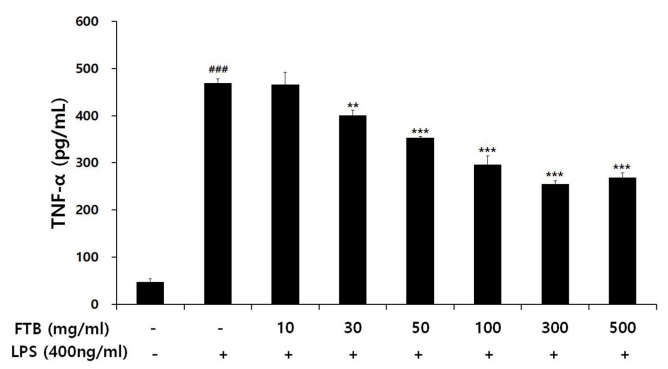
RAW 264.7 세포에서 LPS로 유도한 대조군의 TNF-α는 469.10±8.49 pg/ml로 나타나 정상군의 46.18±7.34 pg/ml보다 유의하게 증가하였다. FTB를 투여한 실험군은 30, 50, 100, 300, 500 μg/ml의 농도에서 각각 399.92±11.78, 353.02±2.48, 296.00±18.53, 254.84±6.85, 268.34±9.92 pg/ml로 나타나 대조군에 비해 30 μg/ml 이상의 농도에서 유의성 있게 감소하였다(Fig. 3).
4) IL-6 생성에 미치는 영향
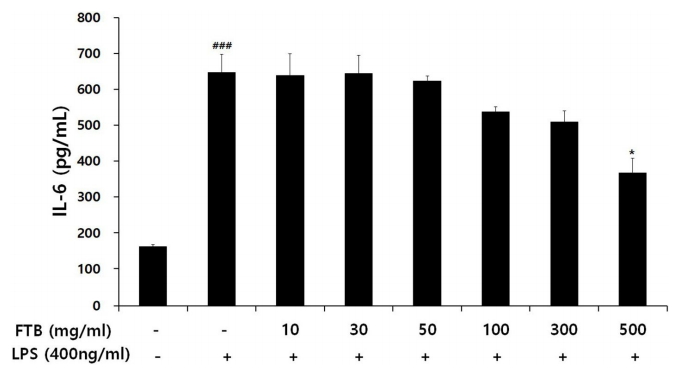
RAW 264.7 세포에서 LPS로 유도한 대조군의 IL-6는 647.05±51.59 pg/ml로 나타나 정상군의 161.22±6.76 pg/ml보다 유의하게 증가하였다. FTB를 투여한 실험군 중 500 μg/ml의 농도에서 367.40±41.11 pg/ml로 나타났다. 따라서 대조군에 비해 FTB를 투여한 실험군 중 500 μg/ml 농도에서 유의성 있게 감소하였다(Fig. 4).
2. 절패모의 객담, 기침 및 급성기도염증에 대한 영향
1) 객담 동물모델에 대한 영향
점액분비 촉진작용 확인을 위해 측정한 phenol red의 분비에서 ambroxol을 투여한 양성대조군은 78.45±5.65%로 나타나 대조군의 33.46±5.35%보다 유의하게 증가하였으며, FTB를 각각 200 및 400 mg/kg 투여한 실험군에서는 46.15±5.85%와 70.36±7.65%로 나타나 400 mg/kg 투여군에서 유의성 있는 증가를 보였다(Fig. 5).
2) 기침 동물모델에 대한 영향
Ammonia 용액을 투여하여 기침을 유발한 대조군의 기침 횟수는 40.63±2.86회로 나타났고, pentoxyverine citrate을 투여한 양성대조군은 24.29±1.93회로 유의하게 감소하였다. FTB를 각각 200 및 400 mg/kg 투여한 실험군의 기침 횟수는 22.11±1.67회와 18.00±1.82회로 나타나 두 농도 모두에서 유의성 있는 감소를 보였다(Fig. 6A). 기침 유발 후 첫 번째 기침이 시작할 때까지의 시간은 대조군에서 10.89±1.71초로 나타났고, pentoxyverine citrate을 투여한 양성대조군에서는 69.89±5.49초로 나타나 유의하게 증가하였으며, FTB를 각각 200 및 400 mg/kg 투여한 실험군에서는 36.89±3.09초와 37.44±6.60초로 나타나 두 농도 모두에서 유의성 있는 증가를 보였다(Fig. 6B).
3) 급성기도염증 동물모델에 대한 영향
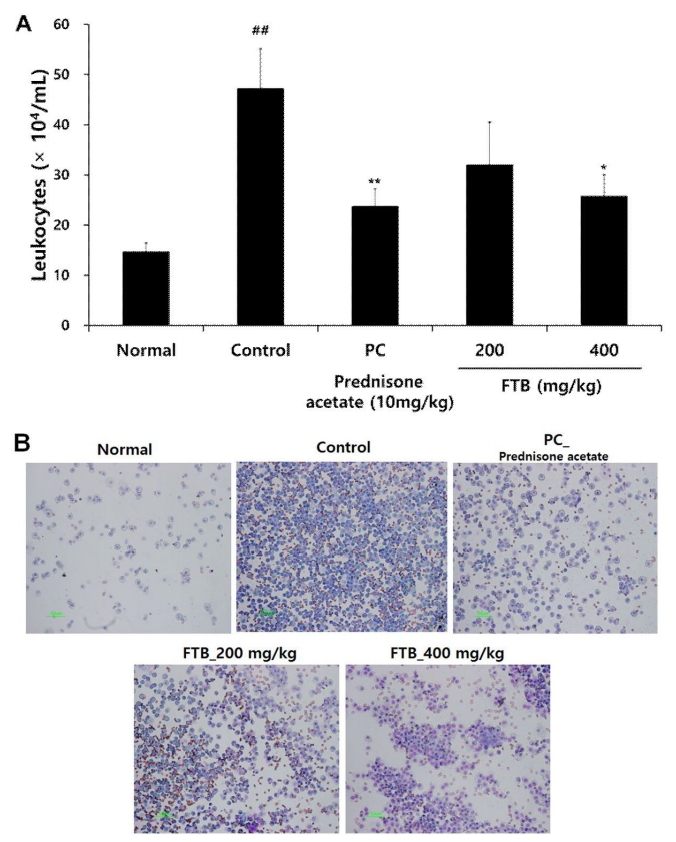
대조군의 백혈구 수는 47.22±8.48(×104/ml)로 나타났고, prednisone acetate을 10mg/kg으로 투여한 양성대조군은 23.71±3.55(×104/ml)로 유의한 감소를 보였다. FTB를 각각 200 및 400 mg/kg 투여한 실험군은 31.98±8.54(×104/ml)와 25.73±4.33(×104/ml)로 나타나 400 mg/kg 투여한 실험군에서 통계학적으로 유의성 있는 감소를 보였다(Fig. 7).
Ⅳ. 고 찰
기침은 지속기간에 따라 8주 이상은 만성기침, 3~8주는 아급성기침, 3주 미만의 경우 급성기침으로 분류하고, 객담의 동반 유무에 따라서는 젖은 기침(productive cough)과 마른 기침(non-productive cough)으로 나눈다[2]. 기간에 따른 분류는 기침의 원인을 감별하는데 도움이 되고, 객담에 따른 분류의 경우 병의 중증도 및 치료를 결정하는데 유용하다[19]. 급성기침은 상기도 바이러스 감염이 주요한 원인으로 자연 호전이 대부분이고, 아급성기침은 기도 감염 후 기관지과민성이 지속되어 발생하는 감염후기침(postinfectious cough)이 가장 흔한 원인이며 일부에서는 천식, 부비동염 등이 관련되어 있다[20]. 이와 달리 8주 이상 지속되는 만성기침은 자연 호전이 드물어 이의 해결을 위해서는 관련된 질환을 찾아서 적절히 치료하는 것이 중요하다고 강조되고 있으나 병력청취, 신체검사, 가슴 X선검사, 폐기능 검사에서 특이 소견이 관찰되지 않는 비특이적 만성기침(nonspecific chronic cough)의 비율이 상당하다[21]. 특히 만성기침의 주요원인들에 대해서 진단적 검사, 경험적 치료에도 원인을 정확히 밝히지 못하고 지속되는 원인미상 만성기침(unexplained chronic cough)이 성인 만성기침 환자의 5~10%를 차지하는 것으로 추정되고 있어 추가적 검사뿐만 아니라 기침 자체에 대한 경험적 치료의 중요성도 높아지고 있다[22]. 따라서 부작용의 위험이 적고 장기적으로 안전하게 사용할 수 있는 진해거담제의 개발을 위해 한의학에서 급만성 호흡기질환에 다용하고 있는 약재를 대상으로 기침과 가래에 대한 효과를 실험적으로 확인하고자하는 노력이 시도되고 있다[23].
절패모는 성미(性味)가 고한(苦寒)하며 청폐화담(淸肺化痰)시켜 지해(止咳)하므로 담열(痰熱)로 인한 해수(咳嗽)를 치료한다[9]. 동의보감 중 패모가 주약(主藥)으로 배오(配伍)된 방제 48처방을 분석한 결과에 따르면, 해수문(咳嗽門)에 19개 처방(39.6%)이 분포하여 높은 비중을 차지하는 것으로 나타나 호흡기질환에 다용되는 약물임을 보이고 있다[10]. 패모의 진해거담 효과에 대한 기존의 연구는 주로 천패모(川貝母, Fritillariae Cirrhosae Bulbus) 위주로 이루어졌고[17,24] 절패모를 대상으로 하는 연구는 찾기 어려웠다.
절패모의 항염효과를 평가하기 위해서 RAW 264.7 세포를 사용하여 NO 생성과 염증 사이토카인에 대한 ELISA 분석한 결과, 대조군에서 NO, TNF-α 및 IL-6가 정상군에 비하여 유의한 증가를 보였다. 절패모는 30, 50, 100, 300, 500 μg/ml의 농도에서 NO와 TNF-α 발현을 대조군에 비해 유의성 있게 감소시켰고, 500 μg/ml의 농도에서 IL-6 발현을 대조군에 비해서 유의성 있게 감소시켰다. 산화 스트레스는 COPD를 포함한 만성폐질환의 기도손상 유발에 있어서 중추적인 역할을 하는 것으로 알려져 있고, TNF-α와 IL-6는 염증 cytokine으로 기도와 폐의 염증반응을 증가시킬 뿐만 아니라[25], 건강 대조군에 비하여 COPD 환자군에서 증가가 관찰되며 이는 COPD의 중증도와도 연관되는 것으로 알려져 있다[26]. 따라서 절패모 투여가 NO 생성과 TNF-α 및 IL-6의 발현을 억제하는 결과를 보임으로써 산화물질의 억제와 염증 cytokine의 억제효과를 통해서 전반적인 염증 조절작용을 해낼 것으로 기대된다.
절패모의 진해 효과를 평가하기 위하여 생쥐에 ammonia 용액을 분무 흡입시켜 기침을 유발하였다. 일반적으로 진해 효과를 연구하기 위한 실험에는 기니피그에 capsaicin, citric acid, 증류수 등을 흡입시켜 유발한 기침모델이 주로 사용되고 있다[27]. 본 실험에서 사용한 생쥐에 ammonia 용액을 흡입시켜 유발하는 기침모델은 기도표면에 기침수용체가 부족한 단점에도 불구하고 모델 제작의 용이성 측면에서 장점이 있다[17]. 기침 반사 및 과민성은 말초신경계의 미주신경과 중추신경계 회로의 상호작용에 의해 결정되며[28], 미주신경 분지는 기도 점막하에 주로 분포하여 다양한 외부 자극 물질이 외부로부터 들어올 경우 기침 반사가 즉각적으로 일어나도록 신호를 전달한다[29]. 절패모는 200 및 400 mg/kg 투여 농도에서 기침 횟수를 대조군에 비하여 통계학적으로 유의하게 감소시켰고, 200 및 400 mg/kg 투여 농도 모두에서 기침 지연 시간을 대조군에 비하여 유의하게 증가시켰다. 이는 절패모의 항염, 항산화 효과가 국소 조직 염증 자극을 감소시켜 기침 반사작동을 억제하는 것으로 추측되며 관련된 추가 연구가 필요할 것으로 생각된다.
점액분비가 촉진되는 정도의 경우 분비되는 양을 측정하는 것이 정확하다. Phenol red의 분비는 객담의 분비량을 측정하기 위한 중요한 지표로 활용되고 있다[16]. 절패모는 400 mg/kg 투여 농도에서 phenol red 분비량을 대조군에 비하여 유의하게 증가시켰다. 정상 생리적 조건에서 기도 내부의 점액은 상피세포층을 덮어 점액섬모 청소(mucociliary clearance) 기능을 통해 미세분진, 병원 미생물, 비산 화학물질 등의 유해인자를 포집, 배출하는 기능을 담당하지만[3], 만성 염증성 호흡기 질환에서는 끈끈한 점액의 과다생성이 병리적 요소로 작용하여 기관내강 폐쇄, 공기유입 저해 등을 통해 질환의 악화를 유발할 수 있다[30]. 절패모 투여는 기도내 분비량을 증가시킴으로써 점도가 높은 객담의 배출을 용이하게 하는 거담효과를 통해 가래로 인한 호흡기 증상의 감소를 나타낼 것으로 생각된다.
절패모의 급성기도염증에 대한 효과를 평가하기 위하여 생쥐에 ammonia 용액을 분무 흡입시켜 급성염증을 유발하였다. 절패모 투여가 400 mg/kg 투여 농도에서 백혈구수를 대조군에 비하여 유의하게 감소시켰다. 알레르기를 포함한 기도염증의 병리기전에서 백혈구의 침윤은 핵심적인 과정으로 알려져 있다[31]. 따라서 절패모가 BALF 내 백혈구수를 유의하게 억제함으로써 기도의 급성염증을 감소시키는 작용을 하는 것으로 생각된다.
결과를 종합하면 절패모는 염증 cytokine을 억제하고 염증세포를 감소시킴으로써 호흡기질환의 주요 증상인 기침과 가래에 대한 치료 효과를 나타낼 것으로 사료된다.
Ⅴ. 결 론
절패모(浙貝母)의 항염 및 진해거담 효과를 평가하기 위해 RAW 264.7 세포에서의 항염증 효과와 동물모델에서 항염 및 진해거담 효과를 평가한 결과 다음과 같은 결론을 얻었다.
1. 세포독성 및 항염작용 실험
1) 절패모는 10~500 μg/ml 농도의 실험군에서 세포독성을 보이지 않았다.
2) 절패모는 30, 50, 100, 300, 500 μg/ml 농도에서 NO의 증가를 유의성 있게 억제하였다.
3) 절패모는 30, 50, 100, 300, 500 μg/ml 농도에서 TNF-α의 증가를 유의성 있게 억제하였다.
4) 절패모는 500 μg/ml 농도에서 IL-6의 증가를 유의성 있게 억제하였다.
2. 객담, 기침 및 급성기도염증 동물모델
1) 절패모는 400 mg/kg 투여군에서 phenol red 분비량을 유의성 있게 증가시켰다.
2) 절패모는 200 및 400 mg/kg 투여군 모두에서 기침 횟수를 유의성 있게 감소시켰고, 기침 지연 시간을 유의성 있게 증가시켰다.
3) 절패모는 400 mg/kg 투여군에서 BALF 내 백혈구수를 감소시켰다.
이상의 결과로 절패모는 세포 실험에서 염증 cytokine을 억제하고, 객담, 기침 및 급성기도염증 모델에서 객담 분비를 증가시키고, 기침을 억제하며 염증세포를 감소시키는 것으로 관찰되어 진해거담 치료에 활용할 수 있을 것으로 사료된다.