I. 서 론
궤양성 대장염은 대장점막을 침범하는 원인미상의 만성 염증성 장 질환으로, 혈변과 설사가 주 증상과 함께 점액변, 이급후중, 변실금, 복통 등이 나타나기도 하며 피로감, 식욕부진, 체중감소 등 전신증상이 동반되는 만성적 경과가 특징인 질환이다1.
우리나라에서도 육류 섭취가 증가 하면서 증가 추세에 있는데, 서울시에서 시행된 다기관 공동연구에 따르면 궤양성 대장염의 연간 발병률은 1986-1988년 사이에 인구 10만 명 당 0.20명에 불과하던 것이 1995-1997년 사이에 1.23명으로 증가하는 추세를 보였고, 1997년 말 현재 유병율도 인구 10만 명 당 7.57명에 이른 것으로 보고되었다2. 치료는 식사요법, 약물요법, 백혈구 제거요법, 외과치료 등이 있으나 일반적으로 환자의 영양상태 개선과 함께 염증 매개 억제와 숙주의 방어기전을 증가 시키는 악물 치료가 유지 된다3.
한의학에서는 泄瀉, 痢疾, 便血, 腸澼의 범주에 해당 되고, 임상에서 虛實證으로 구분하여 脾虛阻滯, 脾腎陽虛, 陰血虧損, 肝鬱脾虛, 濕熱內蘊, 氣滯血瘀 등의 변증에 치료 효과가 있다4. 임상연구로는 芍藥湯加味方, 平胃地楡湯加味方의 궤양성대장염환자 치료효과에 대한 연구 등이 있고5,6, 四味軟堅湯, 地楡湯, 槐花散 등의 동물실험연구가 있다7-9.
桂枝加龍骨牡蠣湯은 張仲景의 ≪金櫃要略≫에 기록되어 있으며 桂枝湯에 龍骨, 牡蠣를 가미한 처방이 驚悸, 精志不安에 사용하였다10. 桂枝湯을 구성하는 桂枝, 芍藥, 大棗, 生薑, 甘草의 항염 효과에 대한 다수의 연구가 보고11-15되고 있으며, 개개 구성약이 궤양성대장염 치료를 위한 항염효과에 대한 연구16-19가 있다. 龍骨과 牡蠣는 收斂固脫 작용이 있어, 久寫久利 便血을 치료하고, 生肌斂瘡의 효능에 대한 기록이 있다20.
이에 저자는 桂枝加龍骨牡蠣湯 구성 약물의 항염효과 보고에 참고하여, Dextran sulfate sodium (DSS)으로 생쥐에게 유발한 궤양성 대장염에 桂枝加龍骨牡蠣湯 투여 후 대장 점막의 형태적 변화, 상피세포 보호 효과, 염증성 발현인자 억제효과, 세포자연사 억제 효과에서 조직 면역학적 유의성 있는 결과를 얻었기에 보고 한다.
II. 재료 및 방법
1. 실험재료
1) 배양세포
실험에 사용한 세포주는 마우스의 RAW264.7 세포를 KCLB(Korean Cell Line Bank)에서 구입하였다. 세포는 37 °C, 5% CO2 incubator에서 10% Fetal Bovine Serum(FBS; Sigma, USA)이 함유된 Dulbecco’s modified Eagle’s medium(DMEM; Welgin, Korea)에 배양하고, 오염방지를 위해 항생제 100 unit/ml penicillin(Sigma, USA)와 100 μg/ml streptomycin (Gibco/BRL, USA)을 첨가하여 사용하였다.
2) 동 물
실험에 사용된 동물은 오리엔트바이오로부터 구입한 ICR계 평균 체중 30 g의 6주령 수컷 생쥐이며, 일주일 동안 온도 22±1 °C, 습도 55±3%인 실험실 환경에서 12시간 밤낮 주기로 적응시킨 후 실험군당 5-7마리씩 나누어 사용하였다.
3) 약 재
桂枝加龍骨牡蠣湯의 구성약물은 ≪金櫃要略≫에 준하여 ◯◯대학교 부속한방병원 약제실에서 공급받아 사용하였다. 첩 당 처방의 내용과 용량은 다음과 같다(Table 1).
Table 1
The Amount and Composition of Gyejigayonggolmoryeo-tang (GYT)
2. 실험방법
1) Dextran Sulfate Sodium(DSS)에 의한 대장 염증 유발
대장염 유발을 위해 5% DSS(dextran sodium sulfate, MW 5,000, Wako, Japan)를 5일간 음용시켰다. DSS는 물에 타서 생쥐들이 음용할 수 있도록 하였으며, 약물은 존대를 이용하여 구강투여 하였다. 치료 효과를 확인은 5% DSS를 5일 동안 음용시킨 뒤 3일 동안 약물 투여한 군 Sample group(S), 그리고 5% DSS를 5일 동안 음용시킨 뒤 3일 동안 생수를 투여한 군Control group(C)으로 나누었으며, 무처치군을 Normal group(N)으로 하였다.
2) Cell viability assay
RAW264.7 세포 5×104 cell/ml을 96 well에 분주하여 24시간 동안 배양한 후 각기 다른 농도(0.125, 0.25, 0.5, 1.0, 1.5, 2.0 mg/ml)의 계지가용골모려탕 추출물(Gyejigayonggolmoryeo-tang, GYT)에 24시간 동안 담가 두었다. Cell viability assay는 EZ-Cytox Cell Viability Assay Kit를 이용하였으며 450 nm 흡광도에서 측정하였다.
3) NO 생성 측정
배양액 내의 nitrite 농도를 Griess Reagent System을 이용하여 측정하였다. RAW264.7 세포에 추출물을 0.125, 0.25, 0.5, 1.0 mg/ml의 농도로 전처리하고 1시간 후 1 mg/ml LPS를 처리하여 18시간 배양한 후 배양액 50 μl와 동량의 Griess Reagent를 넣어주고 10분간 상온에서 반응시킨 후 ELISA reader로 540 nm에서 흡광도를 측정하였다.
4) 염증효소 유전자 발현 측정
역전사중합효소연쇄반응법(Reverse Transcriptase -Polymerase Chain Reaction, RT-PCR)을 실시하였다. RAW264.7 세포 1×105/ml을 6 well에 plating하고 12시간 후 1 μl/ml LPS(lipopolysaccharide)를 처리하고 2시간 뒤 추출물을 농도별(0.125, 0.25, 0.5, 1.0 mg/ml)로 처리하였다. 추출물 처리 24시간 후 Trizol reagent(Sigma, USA)를 이용하여 RNA를 추출하고 Nano Drop(ND-1000, USA)을 이용해 RNA를 정량을 시행하였다. RT-PCR kit(Promega, USA)를 이용하여 cDNA를 합성한 후 iNOS와 Cox-2의 primer(Table 2)로 반응시켰으며 internal standard로 β-actin을 동시에 실시한 후 증폭된 mRNA를 1% agarose gel에 전기영동하여 얻어진 밴드로 평가하였다.
Table 2
The Primer of iNOS, COX-2 and β-actin mRNA
5) 조직표본 준비
동물을 sodium pentobarbital(0.3 ml/100 g)로 마취시킨 후 복부를 절개하여 대장을 절취하여 얻어진 조직을 10% 포르말린에 12시간 고정시킨 후 흐르는 물에 수세하였으며, 탈수화 과정을 거친 다음 파라핀에 포매시켜 6 μm 두께로 연속 절편하여 조직화학 및 면역조직화학적 염색 그리고 tunnel 염색에 이용하였다.
6) 조직화학 및 면역조직화학적 염색
절편된 조직 표본을 xylene을 이용하여 탈파라핀한 후 가수화(rehydration)하여 조직화학적 염색으로는, 일반적으로 시행하는 H&E 염색과 산성점액다당류를 청색으로 염색시키는 alcian blue, 혈구염색법으로 Wright를 시행하였다. 또한 면역조직화학적 염색으로는 탈파라핀한 후 가수화시킨 표본을 proteinase K(20 μg/ml)에 5분 동안 proteolysis 과정을 거친 후 3% H2O2로 5분간 처리하여 조직 내의 내인성 과산화효소를 제거하고, 1차 항체 (Table 3)를 처리하여 4 °C humidified chamber에서 24시간 동안 반응시켰다. PBS로 충분히 수세한 후 2차 항체를 처리하여 실온에서 1시간 동안 반응시켰다. ABC 용액(ABC kit, Vector Laboratories, Inc., Burlingama, CA. USA)에 실온에서 30분간 반응시킨 후 0.05% 3,3´-diaminobenzidine tetrahydrochloride(DAB, Sigma)로 발색 반응을 확인하였으며, Hematoxylin으로 대조 염색하여 광학현미경(Olympus BX50, Japan) 하에서 비교 관찰한 후 디지털 카메라(Nikon E995, Japan)로 촬영하였다.
7) 세포자연사
세포자연사(apoptosis) 확인을 위해 in situ apoptosis detection kit(Apoptag, Intergen, USA)를 이용한 TUNEL(terminal deoxynucleotid trasferase-mediated dUTP-biotin nick-end labeling) 염색을 실시하였다. 절편된 조직을 탈파라핀한 후 proteinase K에 5분간 proteolysis 시킨 다음 equilibration buffer에서 20초간 처리하였다. Strength TdT enzyme을 37 °C에서 1시간 동안 반응시킨 후 strength stop/wash buffer에서 10분, anti-digoxigenin-peroxidase에서 1시간 처리한 후 DAB로 발색 반응을 확인하고 eosin으로 대조 염색하여 광학현미경 하에서 관찰하였다.
III. 결 과
1. RAW264.7 세포를 이용한 염증억제 효과
1) GYT가 RAW264.7 세포 생존률에 미치는 영향
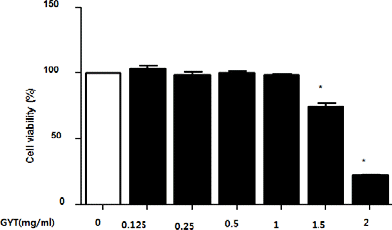
GYT가 RAW264.7 세포에 미치는 독성 범위를 확인하고자 XTT assay를 하였다. 그 결과 GYT 농도 1.0 mg/ml의 농도까지 세포에 독성을 나타내지 않았으며, 1.5 mg/ml의 농도부터 유의적인 세포독성이 확인 되었으므로 GYT는 1.0 mg/ml의 농도까지 안전한 것으로 판명되었다(Fig. 1).
2) RAW264.7 세포에서의 NO 생성억제 효과
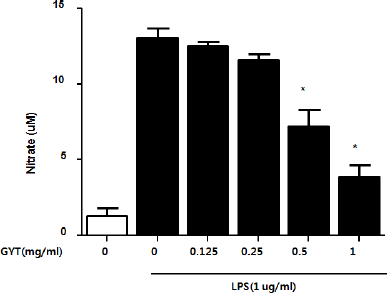
염증유발물질로 주로 사용되는 Lipopolysaccharides를 RAW264.7 세포에 처리하면서 GYT를 농도별 (0, 0.125, 0.25, 0.5, 1.0 mg/ml)로 같이 처리한 결과 LPS만 처리한 것을 NO 생성 100% 기준으로 했을 때, LPS만 처리된 것에는 NO 생성이 매우 높은 증가량을 나타내었으나 0.5와 1.0 mg/ml 농도의 GYT를 처리했을 때 유의하게 감소하였다(Fig. 2).
3) RAW264.7 세포에서의 염증효소 유전자 발현억제 효과
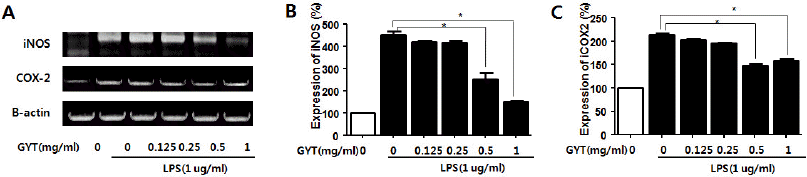
RAW264.7 세포에 LPS를 처리한 후 GYT의 염증효소 유전자 중 iNOS와 COX-2 mRNA 발현억제 효과를 확인한 결과, iNOS mRNA는 0.5 mg/ml의 농도에서부터 현저한 발현억제 효과를 보였으며 농도 비례적인 억제 효과가 나타났다. COX-2 mRNA 역시 0.5 mg/ml의 농도에서부터 발현 억제 효과가 나타났다(Fig. 3).
2. 궤양성 대장염 유발 흰쥐 치료효과
1) 형태적 변화
H&E 염색을 통한 대장의 형태적 변화에서 Normal group은 전형적인 대장의 조직을 나타내고 있으나(Fig. 4A), Control group은 mucosa 부분이 짓무름(erosion) 현상으로 매우 손상되었고 crypt가 소실되었으며 점막층과 점막밑층의 경계를 이루는 근육판의 소실이 증가되었다(Fig. 4B). 또한 점막 층과 점막밑층에서 많은 염증 세포들의 증가와 조직으로의 침투 현상이 관찰되어(Fig. 4E), DSS 음용 이후 생수를 투여한 3일 동안 염증진행이 더욱 증가되었음을 알 수 있었다. Sample group에서는 Control group에 비해 crypt의 손상이 적었으나(Fig. 4C), 조직으로 침투하는 염증세포는 Control group과 유사하게 많이 증가되었다(Fig. 4F).
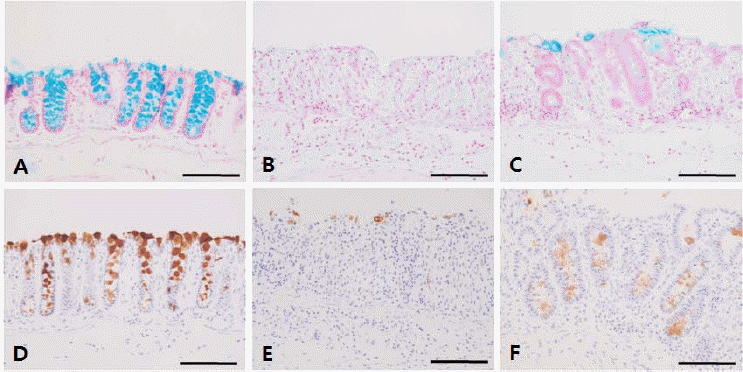
Fig. 4
The histological changes of mucosa and submucosa.
Light micrographical findings by H&E stain (A, B and C) and Wright stain (D, E and F). A, D : Normal group without DSS; B, E : Control group, DSS-induced colitis, B showed the erosion and increased the infiltration of inflammatory cells (E); C and F : GYT extract treatment for 3 days after DSS-induced colitis. Sample group showed the decrease of damage compared to the Control group (C). However, Sample group did not show the decrease of inflammatory cells compared to the Control group (F). bar=100 μm

2) 상피세포 보호 효과
상피세포 보호효과를 확인하기 위해 술잔세포(goblet cell)의 산성점액다당류를 청색으로 나타내는 alcian blue 염색에서 분비되는 mucin 중 mucin2 (Muc2) 발현을 확인한 결과, Normal group에서는 상피세포 대부분에서 alcian blue에 청색으로 염색되고(Fig. 5A), Muc2 또한 많은 발현을 확인할 수 있었으며, 특히 Muc2가 상피의 표면에 코팅되어 있어 내강으로부터 보호되고 있음을 알 수 있었다(Fig. 5D). Control group에서는 crypt의 붕괴로 인한 술잔세포의 소실로 인해 alcian blue에 대한 염색성은 현저히 감소되거나 조직 손상이 심한 곳에서는 염색성이 거의 나타나지 않는 곳이 많이 관찰되었다(Fig. 5B). Muc2 발현 또한 Normal group에 비해 현저히 감소되었는데 매우 약한 양성 반응을 나타내거나 발현이 거의 나타나지 않았다(Fig. 5E). 그러나 Sample group에서는 Control group에 비해 발현이 증가되었음을 확인할 수 있었다(Fig. 5C). Muc2의 발현 또한 Control group에 비해 약한 양성 반응을 나타냈다(Fig. 5F).
Fig. 5
Alcian blue-positive goblet cells (A, B and C) and expression of Mucin2 (D, E and F).
A and D : Normal group without DSS; B and E : Control group, DSS-induced colitis; C, F : Sample group, GYT extract treatment for 3 days after DSS-induced colitis. Sample group showed the increase of Muc2 expression compared to the Control group (F). bar=100 μm
3) 염증성 발현인자 억제효과
염증성 발현인자 억제효과를 확인하기 위해 예방 효과에서 확인한 것처럼 NF-κB p65, COX-2 그리고 iNOS 항체의 발현을 조직에서 확인하였다. (1) NF-κB p65
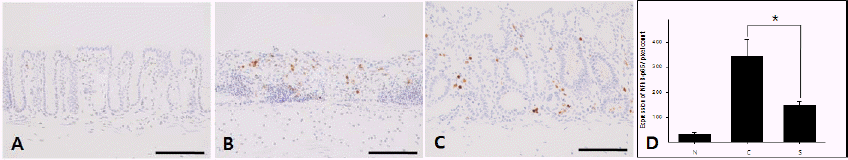
NF-κB p65 발현은 Normal group에서는 매우 약한 발현 현상을 나타낸 반면 Control group에서는 증가된 발현 양상이 확인되었다. 점막 층에서 매우 강한 발현을 나타내었으나 Sample group에서는 Control group에 비해 현저히 감소되었다(Fig. 6A, Fig. 6B and C). 영상분석을 통해 확인한 결과 Control group과 Sample group이 각각 341.8±70.04와 148.2± 14.14로 그 값이 유의하게 감소한 것을 알 수 있었다(Fig. 6D).
Fig. 6
The expression of NF-κB p65 in colon.
A : Normal group without DSS; B : Control group, DSS-induced colitis; C : Sample group, GYT extract treatment for 3 days after DSS-induced colitis; D : image analysis of NF-κB p65 *p<0.01, bar=100 μm
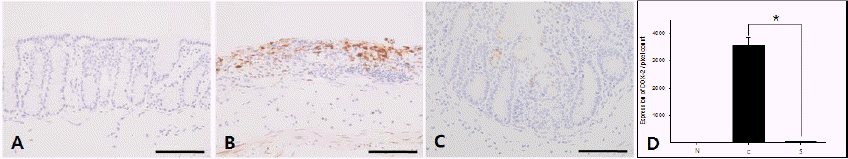
(2) COX-2
COX-2와 iNOS 발현을 확인한 결과, COX-2의 발현 양상은 NF-κB p65 발현에 영향을 받았음을 알 수 있었다. Normal group에서는 거의 없거나 매우 약한 발현(Fig. 7A)이 관찰된 반면 Control group은 점막 층에서 COX-2의 발현이 매우 증가되었으며, 특히 점막 층의 손상이 매우 심한 곳뿐만 아니라 점막밑층에서도 COX-2의 발현이 관찰되어(Fig. 7B) COX-2 발현으로 조직 손상에 영향을 미치고 있었으며 DSS 음용 이후 진행되어지는 염증의 범위가 증가되고 있음을 나타낸다. Sample group은 COX-2의 발현이 Control group에 비해 현저히 감소되었다(Fig. 7C). 영상 분석결과 Control group은 3579.2±272.35의 값으로 측정되었고 Control group은 62.0±17.19의 값으로 측정되어 유의한 감소를 확인하였다(Fig. 7D).
Fig. 7
The expression of COX-2 in colon.
A : Normal group without DSS; B : Control group, DSS-induced colitis; C : Sample group, GYT extract treatment for 3 day after DSS-induced colitis; D : image analysis of COX-2 *p<0.001, bar=100 μm
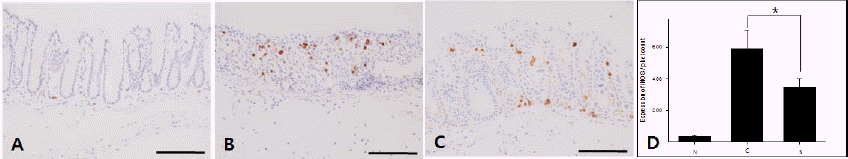
(3) iNOS
iNOS 발현을 관찰한 결과, Normal group에서는 가장 낮게 나타내었으나(Fig. 8A), Control group의 점막 층에서는 iNOS의 발현이 많이 증가되었다(Fig. 8B). Sample group은 Control group에 비해 감소된 경향을 보였다(Fig. 8C). 영상 분석결과 Control group과 Sample group에서 각각 590.8±118.07과 351.2±52.17의 값으로 측정되었으며 두 그룹 간에 유의한 감소 현상을 확인할 수 있었다(Fig. 8D).
Fig. 8
The expression iNOS in colon.
A : Normal group without DSS; B : Control group, DSS-induced colitis (CI); C : Sample group, GYT extract treatment for 3 days after DSS-induced colitis; D : image analysis of iNOS *p<0.01, bar=100 μm
4) 세포자연사 억제효과
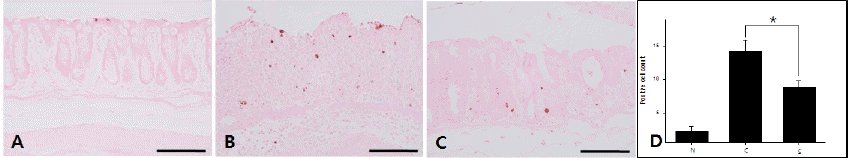
세포자연사를 확인하기 위해 TUNEL 염색을 한 결과, Normal group, Control group 그리고 Sample group에서 각각 1.6±0.40, 14.2±1.69 및 8.8±1.02로 측정되었다. Normal group에 비해 모두 증가되었으나, 약물을 처리를 했을 경우 세포자연사를 나타내는 세포가 유의성 있게 감소하였다(Fig. 9). 염증이 진행되면서 세포자멸사도 증가하는 결과는 얻지 못하였으나 GYT의 세포자연사를 억제하는 효과는 나타났다.
IV. 고 찰
궤양성 대장염은 병변이 대장에 국한되어 나타나며, 복통, 설사, 출혈, 체중감소가 주된 증상으로 반복적인 회복과 악화를 거듭 한다. 원인은 현재까지 명확하게 밝혀지지 않았으나 유전적으로 취약한 환자에게서 외부요인(감염체, 정상 상재균)과 숙주요인(장 상피세포 방어기능, 혈류공급, 신경활성도)이 흡연 등의 환경 요인과 함께 작용하여 만성적인 점막 면역반응의 이상을 초래하는 것으로 설명되고 있다21. 면역학적 요인은 선천성, cytokine의 생성, CD4+ T cell의 활성화 등이 있으며, 최근에는 cytokine의 염증 및 면역반응 조절기능에 관한 연구가 활발히 진행되고 있다22.
궤양성 대장염의 치료는 근원적인 치료법이 없어 관해에 치료의 초점이 맞추어 영양상태의 개선 수액 및 전해질의 공급, 수혈 또는 항생제 투여 등의 대증요법, 정신적 요법 및 sulfasalazine, Azathioprin, Steroid, ACTH, 5-aminosalicylicacid(5-ASA) 등의 항염증성 및 항면역제를 사용하며 국소적 corticosteroid 관장이 이용되고 있다21. 그러나 지속적인 치료의 어려움으로 인한 임상적 한계와22,23 부작용 및 대장출혈, 장천공 및 감염 등의 치명적인 합병증이 나타나고 대장암으로 진행되기도 한다21. 그러므로 궤양성 대장염은 부작용이 적으며 안정적인 치료법의 개발이 시급하다고 할 수 있다.
궤양성 대장염은 한의학적으로 泄瀉, 痢疾, 便血, 腸澼의 범주이다. 朱24는 “瀉痢之病 水穀或化 或不化幷無 努責惟覺 困倦 若滯 下則不然 或膿或血 或膿血相雜 或無糟粕 或 糟粕相混 雖有痛不痛 大痛之異 然皆裏急後重 逼迫 惱人”이라 하였고, 赤痢는 濕熱이 腸迫하여 糞色如血, 身熱, 腹痛, 裏急後重하고, 膿血痢는 大腸에 積熱蘊結하여 血化爲膿하고 粘稠膿血을 泄하고 裏急後重한다 하였다. 腸風은 “自外感得, 隨感隨見所以 色鮮, 自大腸氣分來也”라 하여 外感의 鮮明하게 붉은색으로 大便 前에 나오는 것이라 하였다. ≪仲景全書≫에서는 “下血 先便後血 此遠血也 下血先血後便 次近血也”라 하여 변혈을 先後에 따라 遠血과 近血로 구분하였다10. 이러한 증상들이 궤양성 대장염의 지속적 혹은 반복적인 혈액과 점액이 섞인 설사, 복통, 후중감 등의 증상과 유사하다.
桂枝加龍骨牡蠣湯은 張仲景의 ≪金櫃要略≫에 근거한 처방으로, 桂枝湯에 龍骨, 牡蠣를 가미한 처방으로 임상적 활용에는 煩驚, 腹痛, 하복부 긴장, 유정, 몽정 등의 증상에 활용할 수 있다10. 구성약 중 계지는 iNOS 및 COX-2의 활성을 감소시키고 NO와 PGE2 생성을 억제하는 항염증 효과에 대한 연구가 보고되었고11 계지의 성분중 cinnamicaldehyde가 복강 투여 세포 실험에서 lipopolysaccharide(LPS)에 의한 항염 효능이 보고되었다19. 芍藥은 脘中止痛 斂陰收汗하는 효능이 있어 瀉痢腹痛과 崩漏 등의 질환에 치료에 응용되고 있고20 芍藥의 NO 생성억제와 T-증식억제 등에 의한 항염효과에 대한 여러 연구들이 보고와 작약의 성분 중 aeoniflorin이 항염효과와 면역조절작용을 한다는 연구 보고가 있다13,14. 大棗는 補脾和胃의 효능으로 胃虛食少 脾弱便溏에 효과가 있고20 NO, PGE2, 염증성 cytokine 생성 및 COX-2발현을 억제하여 항염증 효과가 있으며 DSS로 유발된 궤양성 대장염에 효과가 있다는 연구들이 보고되었다15. 生薑은 溫中止嘔의 효능으로 脹滿 泄瀉를 치료 하고20 DSS(Dextran Sulfate Sodium)로 유도된 마우스의 장염 억제 효과 있다는 실험적 연구가 보고가 있다15. 甘草는 解毒 調和諸藥하여 脾胃虛弱 食少 腹痛便溏 消化性潰瘍 癰疽瘡瘍의 효증 보고20와 DSS로 유발된 궤양성 대장염에 미치는 영향에 대한 실험적 연구 보고가 있고17-19, 龍骨은 止血澀腸 生肌斂瘡의 효능으로 吐衄便血 瀉痢脫肛을 치료하고 止痢, 止血의 작용을 하며 牡蠣는 平肝潛陽 軟堅散結 收斂固澀하는 효능이 있어 癥瘕痞塊 胃痛泛酸을 치료하고 항위궤양이 효과가 보고되었다20. 상기 선행 연구를 고찰하여 桂枝加龍骨牡蠣湯이 대장의 염증 회복에 효과를 가정하여, 본 연구에서 DSS로 궤양성 대장염이 유발된 생쥐에 桂枝加龍骨牡蠣湯 추출물을 투여하여 NO 생성 억제 효과, 염증효소 유전자 발현 억제 효과와 조직화학적 변화, 면역조직화학적 변화, 세포자연사를 살펴보았다.
조직학적으로는 대장에 존재하는 술잔세포가 대장내의 점액을 생산하는 주된 세포로서, 생산된 점액은 점막을 보호하는 중요한 역할을 한다. DSS로 대장염이 유도된 Control group에서는 창자샘의 많은 부분이 침식되어 없어지면서 그 벽을 이루던 술잔세포를 비롯한 여러 세포가 없어졌으며, 상피 탈락현상 그리고 염증세포의 침윤 등 심하게 손상된 모습을 나타내었다. 술잔세포의 점액분비로 인한 상피보호에 미치는 영향을 alcian blue 염색과 Muc2 발현을 통해 관찰하였다. 장에서 상피세포와 점막층(mucus layer)은 장 내강과 하부 조직에 존재하는 잠재적 독소와 유해 물질 사이에 물리적 장벽을 형성한다. 사람, 흰쥐, 생쥐의 대장 상피는 분비하는 mucin 중 많은 양의 Muc2를 발현하고 있으며, 이것은 술잔세포의 bulky apical granule로 저장되고 술잔세포 형태를 확정하는 가장 중요한 요인으로 작용한다26. 또한 Muc2는 상피보호에 중요한 역할을 하고 있음이 Muc2 knockout mice에서 본태성 대장염과 장 종양의 발달 연구에서 증명되었다24. 桂枝加龍骨牡蠣湯 추출물을 투여했을 경우, alcian blue 염색성과 Muc2 발현이 Control group에 비해 증가되어 Sample group에서 GYT에 의한 상피 보호 효과가 있다고 볼 수 있다.
이와 같은 조직학적 변화를 유도하는 염증인자 발현을 확인하는 연구를 하였는데, 동물실험을 수행하기에 앞서 桂枝加龍骨牡蠣湯이 염증억제 효과가 있는지 확인하고자 먼저 세포실험을 하였다. RAW264.7 세포를 이용한 iNOS와 COX-2 발현에 있어서, 약물 처리군이 효과가 있음을 증명하였다. 대장에 있어서도 COX-2와 iNOS의 단백질 상향조절은 대장 손상의 중요한 요인으로 여겨지고 있으며, 특히 IBD(Inflammatory bowel disease)에서 면역 조절장애에 중요한 역할을 한다27. Nitric oxide (NO)는 단핵구(monocyte)와 큰포식세포(macrophage) 등의 면역세포를 비롯한 다양한 세포로부터 L-arginine의 guanidine group으로 합성되며 NO 합성효소(nitric oxide synthase, NOS)는 endothelial NOS(eNOS), neuronal NOS(nNOS), inducible NOS(iNOS)가 있다. 그 중 염증이 있는 경우 내피세포와 다양한 염증세포로부터 iNOS가 합성되어 다량의 NO를 생산하게 되며, 궤양성 대장염의 NO 생산과 NOS의 활성도가 증가하게 된다28. 또한 cyclooxygenase(COX) enzyme은 COX-1, COX-2 두개의 isoenzyme이 존재하는 것이 알려져 있으며, 각기 다른 유전자로부터 발현된다. COX enzyme은 prostaglandins(PGs)의 합성을 조절하는 효소이기도 하다. 내인성 PGs (PGE2, PG12)는 위액의 분비조절, 점막의 혈류량과 점액의 알칼리 분비 촉진, 점막 연속성을 유지하는 기능을 가지고 있으며 이로 인해 위장관이 보호된다는 사실이 알려져 있다28. COX enzyme 중 대부분의 세포에 널리 분포하고 있는 COX-1은 정상적인 위장관의 PGs 생산에 관여하여 점막 보호에 중요한 역할을 하는 것으로 알려져 있는 반면, COX-2는 사이토카인, 성장인자, 종양촉진자 등의 여러 자극에 의해 유도되며, 주로 조직에서 PGs를 생성하여 염증과 통증을 유발하는 것으로 보고되고 있다30. 본 실험의 세포실험을 통해서는 iNOS와 COX-2 mRNA 발현이 GYT에 의해 현저히 감소되어 GYT가 염증억제에 효과가 있음을 확인하였다. 동물실험을 통한 iNOS와 COX-2 발현도 Sample group이 Control group에 비해 발현 감소가 확인되었다. 세포 실험에서는 iNOS가 COX-2 보다 발현 억제효과가 더욱 높았으나 동물 실험에서는 COX-2의 억제 효과가 우수함을 확인하였다.
Mitogen-activated protein kinases(MAPKs) 같은 signaling pathways는 핵 전사인자의 활성을 유도하는데 영향을 주며, 그 중 nuclear factor-κB (NF-κB)는 궤양성 대장염의 발병에 중요한 역할을 수반하는 여러 가지 proinflammatory cytokine genes의 활성을 조절하는 역할을 맡고 있고, 면역 반응이나 염증 반응에 관여하는 다양한 유전자들의 발현을 증가시키는 전사인자로서 활성화되면 핵 내로 이동하여 염증유전자 발현을 증가 시킨다30. 본 실험의 결과에서도 NF-κB p65 발현 증가에 따라 iNOS와 COX-2 발현이 증가되는 것을 알 수 있으며 GYT 투여 시 NF-κB p65 발현이 억제됨으로 인해 iNOS와 COX-2의 염증인자 발현이 감소되었다. 따라서 GYT에 의해 NF-κB p65 발현 억제효과가 있으며 이로 인해 염증진행이 억제되었다고 할 수 있다. 또한 Control group과 Sample group을 비교했을 때 NF-κB p65 발현 억제효과 보다 COX-2 발현 억제효과가 우수하였다.
DSS로 유도된 대장염에서 apoptosis 유도 및 그 영향에 대해 연구하였다. Apoptosis는 단백질 합성과 활성을 위해 에너지가 요구되는 과정으로 고도로 조절되며, 광학현미경으로 보이는 apoptosis 현상의 특징은 세포수축, 세포질과 염색질의 응축, 세포표면의 수포현상, 그리고 자연 살해된 세포의 파편 등이다. Apoptotic bodies는 주변세포에 염증 손상 없이 가까이 있는 식세포의 인지로 제거 된다. 또한 Apoptosis는 세포가 정상적인 상태 또는 병리학적 요인에 노출된 후에 죽음에 이르게 되는 생리학적 과정을 말하며, 세포내⋅외적인 신호에 의해 시작되어 일련의 과정을 거쳐 이루어진다31. 궤양성대장염 환자의 창자샘에서 상피 소실이 발생하는 주된 원인은 apoptosis의 증가이며, DSS로 유도된 급성염증 동안 대장의 상피세포에서 현저한 apoptosis가 나타났다고 보고하였다32.
본 연구 결과에서도 DSS로 유도된 대장염의 Control group에서 apoptosis 증가를 보였으나 GYT 투여로 인한 감소 현상을 나타내어, GYT가 apoptosis에 의한 상피 손상도 억제하고 있음을 확인하였다. 그러나 DSS 음용 5일 후 희생시킨 Control group과 DSS 음용 후 3일 동안 물을 투여한 Control group을 비교했을 때, 염증 진행은 DSS 음용 후 3일 동안 물을 투여했을 때 염증이 더욱 진행되고 있었으나 apoptosis의 증가는 비례하지 않았다. 이는 DSS로 유도된 급성 대장염 초기에 apoptosis가 유도되는 것을 보여준다.
이상 DSS로 유도된 급성궤양성대장염에서 GYT가 NF-κB p65 유전자 발현을 억제함으로써 염증인자인 iNOS와 COX-2 발현을 억제하였으며, 특히 COX-2의 발현 억제효과가 현저히 증가되어 염증 완화 효과가 있음을 보여주었고 세포의 apoptosis 길항물질조절에 긍정적으로 영향을 미쳤음을 보여주었다. 향후 궤양성 대장염, 크론씨병 등과 같은 만성 대장질환에 임상적 연구 효용성 입증을 목표로 처방을 구성하는 각 약물의 분자 생물학적 분석에 의한 발전적 연구 방향 등이 지속되어야 할 것으로 사료된다.
V. 결 론
桂枝加龍骨牡蠣湯(GYT)이 dextran sodium sulfate (DSS)로 유발된 생쥐의 궤양성 대장염에 미치는 영향을 실험적으로 규명하기 위해 GYT를 투여한 후 세포 생존력 검사, NO 생성 억제 효과, 염증효소 유전자 발현 억제 효과, 조직화학적 변화, 면역조직화학적 변화, 세포자연사를 영상분석 및 통계처리를 이용하여 측정하여 다음과 같은 결과를 얻었다.
1. 세포실험을 통한 염증효소 억제 효과에서 桂枝加龍骨牡蠣湯이 COX-2와 iNOS 발현을 모두 억제하였으며 NO생성도 억제하였고, COX-2의 발현 억제 보다 iNOS 발현 억제 효과가 뚜렷하게 나타났으며 조직 손상에 직접 미치는 영향은 COX-2의 억제 효과가 더 우수했다.
2. 생쥐에게 DSS로 유도된 궤양성 대장염에 조직의 손상과 염증인자발현, 그리고 세포자멸사에 모두 억제하는 효과를 나타냈다.