I. 서 론
II. 재료와 방법
1. 실험 재료
1) 실험동물
2) 자금정 추출물의 제조
3) 자금정 GC/MS 분석
2. 실험 방법
1) 궤양성 대장염 유발과 자금정 추출물 투여
2) 자금정 추출물과 펜티사 투여
3) 조직표본제작
4) 조직화학
5) 면역조직화학
III. 결 과
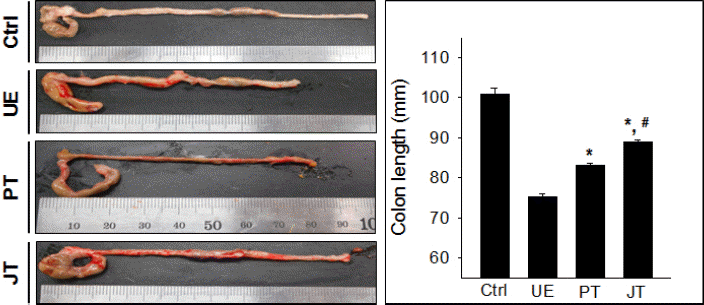
2. 대장 길이 회복
Fig. 2
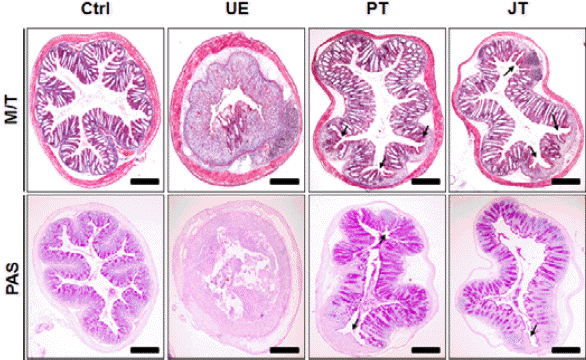
3. 점막 손상 완화
Fig. 3
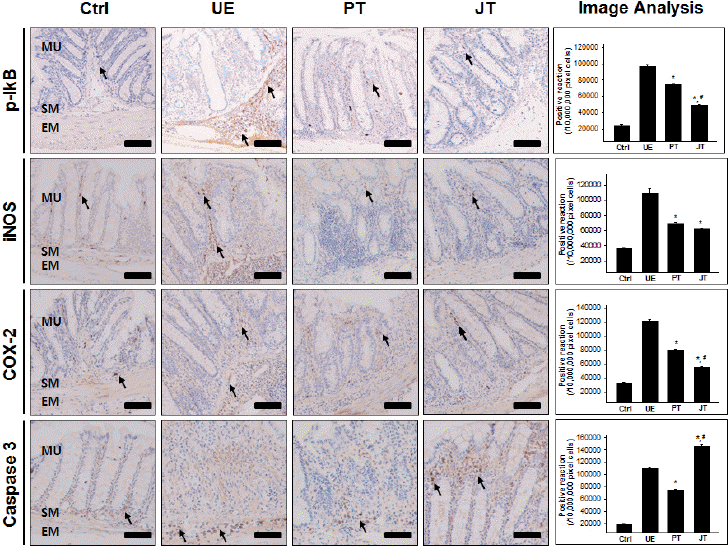
4. 항염증작용
Fig. 4
AbstractObjectivesThis study investigated the anti-inflammatory effects of Jageum-jung extract on Dextran sulfate sodium (DSS-induced) ulcerative colitis in mice.
MethodsUlcerative colitis was induced by DSS in Balb/C male mice. Ten mice were assigned to each of four groups: Ctrl (control), UE (ulcerative colitis-induced), PT (treated with pentasaccharide after induction of ulcerative colitis), and JT (treated with Jageum-jung extract after induction of ulcerative colitis). The effects of Jageum-jung extract were measured by restoration of the length of the intestine, degree of mucosal damage as seen with histochemistry, and changes of p-IkB, iNOS, COX-2, and caspase-3 determined by immunohistochemistry.
ResultsThe recovered intestinal length of the JT group was longer than that of the UE group. In the colon mucosa of JT group, hemorrhagic lesions were reduced, and the mucus barrier was recovered. This group also showed inhibited production of inflammatory enzymes (iNOS, COX-2) through regulation of proinflammatory enzyme (NF-kB, p65) activity in the colon. In addition, caspase 3 activation induced apoptosis. By GC/MS analysis, azetidine was identified.
I. 서 론궤양성 대장염(ulcerative colitis, UC)은 주로 대장 점막이나 점막하층에 염증이 있는 원인불명의 만성 염증성 장질환이다. 혈변, 설사, 대변급박감(urgency), 복통을 주증상으로 하며, 호전과 악화를 반복한다1. 유전적인 요인과 환경적 요인이 복합적으로 작용하며, 북미와 유럽에서 가장 호발하는 것으로 알려져 있다. 동양인에서는 비교적 드문 질환이었으나2, 최근 우리나라를 포함하는 아시아 국가에서 환자가 점점 더 늘어나고 있다3,4. 국내 궤양성 대장염 유병률은 인구 100,000명당 30.87명 정도로 추정되며5, 발병연령은 20-40대의 연령에서 가장 빈도가 높다6,7.
궤양성 대장염의 치료목표는 점막의 염증을 호전시키고 관해를 유도하여 환자의 삶의 질을 높이는 것이다8. 적절한 치료가 시행되지 않으면 혈변, 설사, 복통과 같은 증상이 지속되기 때문에 치료를 시행하는 것이 우선되어야 한다9. 오늘날 표준 약물치료제로 스테로이드, 면역조절약물, 5-aminosalicylic acid(5-ASA) 제제가 사용되며, 환자의 20~40%는 약물치료가 실패하거나 부작용으로 대장절제술을 받게 된다10. 이러한 이유로 최근 부작용을 줄이면서 대장염 치료에 보다 효과적인 치료약물을 개발하려는 시도가 많다11.
한의학에서 궤양성 대장염이 혈변, 복통, 설사가 지속적이기에 便血, 腸風, 腸毒, 腸澼, 腹痛, 積聚, 休息痢, 久痢, 久瀉 등의 범주에 해당한다고 볼 수 있다12. 국내에서 궤양성 대장염의 한의학적 치료에 대하여 DSS(Dextran Sulfate Sodium)로 유발된 대장염 동물모델에서의 실험논문은 발표된 바 있으나11,12, 후속연구가 부족하며 치료제 개발도 미진한 상태이다.
자금정(紫金錠)는 만병해독단(萬病解毒丹)이라고도 알려져 있으며, 해독지통(解毒止痛)하여 균, 충독(蟲毒), 산람장기(山嵐瘴氣) 등을 치료한다13. 중국에서는 약물중독과 충독에 걸린 환자들의 임상 치료에 자금정을 사용하여 항균효과를 증명하였다14.
자금정은 오배자(五倍子), 산자고(山茨菰), 대극 (大戟), 속수자(續隨子), 사향(麝香)으로 구성되며, 본 연구에서는 침향(沈香)을 추가하였다. 오배자는 P. aeruginosa, E. coli, C. albicans, S. aereus 등의 세균에 항균 효과15와 COX 억제작용으로 인한 항염 효과16가 보고되었으며, 대극과 사향도 항염 효과가 보고되었다17,18. 이러한 자금정의 항염, 항균 작용은 궤양성 대장염 치료에 유효한 효과를 보일 것으로 생각된다.
이러한 연구결과에 근거하여 자금정이 만성 복통, 설사를 주된 증상으로 하는 궤양성 대장염에 효과가 있을 것으로 생각되나, DSS로 유발된 궤양성 대장염 동물모델을 이용한 연구가 부족한 실정이다. 따라서 본 연구에서는 자금정이 궤양성 대장염 치료에 활용될 수 있는 근거를 마련하기 위해 자금정의 염증효소(iNOS, COX-2) 생성 억제 효과 및 점막 손상 완화 효과를 관찰하여 유의한 결과를 얻었기에 보고하는 바이다.
II. 재료와 방법1. 실험 재료1) 실험동물오리엔트(한국)에서 분양 받은 태령 8주된 C57BL/6 수컷 생쥐를 무균사육장치내에서 2주일 동안 적응시킨 후 체중 30 g된 생쥐를 선별하여 사용하였다. 대조군(Ctrl군), DDS로 궤양성 대장염 유발군(UE군), DDS로 궤양성 대장염 유발 후 펜타사 처리군 (PT군), DDS로 궤양성 대장염 유발 후 자금정 추출물 처리군(JT군)으로 나누었으며, 각 군에 각 10마리씩 배정하였다. 본 연구과정은 부산대학교 IACUC 승인을 받아 시행되었으며(IACUC number: PNU- 2017-1707), 실험실 동물의 관리와 사용에 대해서는 NIH 가이드라인에 따라 시행되었다.
2) 자금정 추출물의 제조자금정은 대구 청신한약방에서 만들었다. 오배자(五倍子, Rhois Galla, 대구약령제약)는 벌레집을 제거하고 깨끗하게 세척한 후 건조하여 사용하였다. 산자고(山茨菰, Cremastrae seu Pleiones Pseudobulbus, 대구약령제약)는 덩이뿌리를 깨끗하게 세척한 후 건조하여 사용하였다. 대극(大戟, Euphorbiae Pekinensis Radix, 대구약령제약)은 뿌리를 세척한 후에 뿌리의 심을 제거하고 남은 뿌리껍질을 건조하여 사용하였다. 속수자(續隨子, Euphorbiae Lathyridis Semen, 대구약령제약)는 껍질을 제거하고 광목천으로 감싼 후에 압착을 하여 기름을 제거한 후 사용하였다. 이러한 과정을 거친 오배자 120 g, 산자고 80 g, 대극 60 g, 속수자 40 g에 침향(沈香, Aquilariae Agallochae Lignum Resinatum, 대구약령제약) 40 g을 추가한 후에 막자를 이용하여 고운 분말을 만들었다. 만들어진 혼합분말에 사향(麝香, Moschus, 한국수출입산업) 12 g을 첨가한 후 발아된 현미를 사용한 반죽풀 50 g을 사용하여 반죽하였다. 최종적으로 개당 1 g 정도로 400개의 자금정을 만들었다.
자금정 20 g를 증류수 100 ml에 넣고 3시간 동안 전탕한 후 여과하였다. 그 여액을 rotary evaporator를 이용하여 감압, 농축 후 동결 건조하여 추출물 (수득률 5.4%)을 얻었다.
3) 자금정 GC/MS 분석자금정의 염증조절 성분을 분석하기 위한 GC/MS로는 6890N GC/5975i MS(Agilent, USA)를 사용하였다. GC/MS 분석을 위한 컬럼은 DB-5MS UI (30 m, 0.25 mm, 0.25 mm)을 사용하였다. 오븐 온도는 처음 80 °C에서 2분 동안 머물게 한 후 1분당 10 °C씩 올려 300 °C까지 올리고 5분 동안 머물게 하였다. 시료 2 μL를 분할(split) 주입법을 사용하여 주입하였으며, 유속은 1.0 mL/min으로 흘려주었다. 시료 주입구의 온도, 연결부분의 온도, 이온 원의 온도는 각각 280 °C, 230 °C 및 150 °C로 맞추었다. 질량분석범위 50~800 m/z를 가지는 이온들을 순차적으로 반복 검출하는 방법(scan monitoring)을 사용하여 분석하였다. 자금정의 분석은 RT(retention time)에 대하여 Wiley 7 library를 기준으로 library 검색하였다.
2. 실험 방법1) 궤양성 대장염 유발과 자금정 추출물 투여궤양성 대장염을 유발하기 위해 5일 동안 5% (wt/vol) Dextran sulfate sodium(DSS, with a molecular weight of 40,000, ICN, Aurora, OH)을 voluntary administration 시켰다.
2) 자금정 추출물과 펜티사 투여생리식염수에 희석된 펜타사(Pentasa SR Tab, 한국페링제약)는 PT군에 궤양성 대장염 유발 후 5일 동안 40 mg/kg/day량으로 100 μl 구강투여 하였다. 생리식염수에 희석된 자금정 추출물은 JT군에 궤양성 대장염 유발 후 5일 동안 20 mg/kg/day량으로 100 μl 구강투여 하였다. Ctrl과 UE군에 생리식염수 100 μl/day량으로 구강투여 하였다.
3) 조직표본제작DSS 처리 5일 후 sodium pentobarbital 용액으로 마취한 후 vascular rinse와 10% 중성 포르말린용액(neutral buffered formalin, NBF)으로 심장관류고정을 실시하였다. 맹장에서 내림주름창자까지 적출하여 길이를 측정하고 내림결장만 따로 분리한 후 실온에서 24시간 동안 10% NBF에 고정하였다. 고정된 조직은 통상적인 방법으로 paraffin에 포매한 후 5 μm 두께의 연속절편으로 제작되었다.
4) 조직화학점막손상 변화는 Masson trichrome 염색을 통해 조사되었다. 우선 50-60 °C Bouin 용액에서 1시간 동안 매염 처리한 다음 70% 에탄올에서 picric acid를 제거하였다. Weigert iron hematoxylin에서 10분 동안 반응시켜 핵 염색하고, Biebrich scalet-acid fuchsin와 phosphomolybdic-phosphotungstic acid에서 각각 15분간, aniline blue에 5분간 처리한 후 관찰하였다.
점액장벽을 형성하는 중성점액질(neutral mucin)을 분비하는 점액분비세포의 변화를 조사하기 위해서 periodic acid-schiff reaction(PAS) stain을 실시하였는데, 우선 periodic acid에서 5분간 반응시킨 후 Schiff reagent에서 15분 동안 처리하였다. 그런 다음 sulfurous rinse에서 각 2분씩 3회 세척한 후 Hematoxylin에서 1분 동안 대조염색하였다.
5) 면역조직화학내림결장 점막내 염증 변화를 조사하기 위해 결장조직을 proteinase K(20 μg/ml)에 5분 동안 proteolysis 과정을 거친 후 blocking serum인 10% normal goat serum에 4시간 동안 실온에서 반응시켰다. 1차 항체인 mouse anti-p-IkB(1:500, Santa Cruz Biotec, USA), mouse anti-iNOS(1:250, Santa Cruz Biotec), mouse anti-COX-2(1:100, Santa Cruz Biotec), mouse anti-COX-2(1:100, Santa Cruz Biotec)에 4 °C humidified chamber에서 72시간 동안 반응시켰다. 그런 다음 2차 항체인 biotinylated goat anti-mouse IgG1(1:100, Santa Cruz Biotec)에 실온에서 24시간 동안 반응 하였고, avidin biotin complex kit(Vector Lab, USA)를 이용하여 1시간 동안 실온에서 반응시켰다. 0.05% 3,3’-diaminobenzidine과 0.01% HCl이 포함된 0.05 M tris-HCl 완충용액(pH 7.4)에서 발색시킨 후, hematoxylin으로 대조염색하였다.
III. 결 과2. 대장 길이 회복Ctrl군의 맹장에서 내림주름창자까지의 길이는 101±1.4 mm였지만, UE군에서는 Ctrl군에 비해 26% 감소한 75±0.7 mm로 측정되었다. PT군은 UE군에 비해 11% 증가한 83±0.6 mm로 측정되었다. JT군에서는 UE군에 비해 19% 증가한 89±0.6 mm로 측정되었다(Fig. 2).
Fig. 2The repair effects of colonic length by Pentasa and Jageum-jung.
Left : photograph of colon, Right : graph for changes of colonic length, Ctrl : no treated mouse, UE : Ulcerative colitis elicited mouse, PT : Pentasa treated mouse after Ulcerative colitis elicitation, JT : Jageum-jung treated mouse after Ulcerative colitis elicitation, * : P<0.05 compared with UE, # : P<0.05 compared with JT

3. 점막 손상 완화Masson trichrome 염색을 통해 점막 변화를 관찰하였다. UE군의 점막의 많은 부분에서 창자세포와 창자샘이 유실된 출혈성 침식(hemorrhagic erosion)이 관찰되었는데, 많은 수의 림프구, 섬유모세포, 과립백혈구 등 염증관여세포의 침윤(infiltration)이 점막고유층에서 관찰되었다. 일부 창자에서는 창자 점막에서 일어난 출혈성 침식은 점막근층(muscularis mucosae)을 지나 점막밑층(submucosa)까지 확대된 것을 확인 할 수 있었다. 이에 비해 PT군과 JT군에서는 UE군에 비해서는 출혈성 침식이 완화된 것으로 나타났으며, 점막고유층에서도 염증관여세포의 침식 감소가 확인되었다(Fig. 3).
Fig. 3The mitigative effects of ulcerative colitis in mouse by Pentasa and Jageum-jung.
M/T : Masson trichrome stain, PAS : periodic acid-schiff reaction (PAS) stain, Bar size : 100 μm, arrow : hemorrhagic erosion

PAS 염색을 통해서 점액분비세포의 분포 변화를 관찰하였다. UE군의 표면상피 상층부(apical surface)에 위치한 PAS 양성반응의 창자세포는 거의 손상된 형태로 나타났고, 솔모양 가장자리는 관찰되지 않았다. PT군과 JT군의 일부 표면상피 상층부를 제외하고는 정상적인 창자세포의 배열을 확인 할 수 있었으며, 솔모양 가장자리도 관찰되었다(Fig. 3).
4. 항염증작용전염증효소인 NF-kB의 활성에 관여하는 p-IkB 양성반응을 점막고유층(lamina propria)내 변화를 조사하기 위해 mouse anti-p-IKB를 이용한 면역조직화학적 염색을 실시하였다. UE군에서는 p-IkB 양성반응은 점막 고유층에 증가하였으며, 양성반응세포의 핵막 가장자리에서 강하게 양성반응을 보였다. UE군은 대조군에 비해 양성반응이 298% 증가하였다. 이에 반해 PT군에서는 UE군에 비해 양성반응이 23%, JT군에서는 UE군에 비해 양성반응이 49% 감소하였다(Fig. 4).
Fig. 4The anti-inflammation effect of ulcerative colitis in mouse by Pentasa and Jageum-jung.
p-IkB : phospho-IkB, iNOS : inducible nitric oxide synthase, COX-2 : cycloygenase-2, Bar size : 100 μm, arrow : positive reaction, MU : colonic mucosa, SM : submucosa, EM : muscularis externa

점막내 염증효소인 iNOS 생성 변화를 조사하기 위해 mouse anti-iNOS를 이용한 면역조직화학적 염색을 실시하였다. UE군에서는 iNOS 양성반응은 점막 고유층에 증가하였으며, 양성반응세포의 세포질에서 강하게 양성반응을 보였다. UE군은 대조군에 비해 양성반응이 204% 증가하였다. 이에 반해 PT군에서는 UE군에 비해 양성반응이 37%, JT군에서는 UE군에 비해 양성반응이 43% 감소하였다(Fig. 4).
점막내 염증효소인 COX-2 생성 변화를 조사하기 위해 mouse anti-COX-2를 이용한 면역조직화학적 염색을 실시하였다. UE군에서는 COX-2 양성반응은 점막 고유층에 증가하였으며, 양성반응세포의 세포질에서 강하게 양성반응을 보였다. UE군은 대조군에 비해 양성반응이 273% 증가하였다. 이에 반해 PT군에서는 UE군에 비해 양성반응이 34%, JT군에서는 UE군에 비해 양성반응이 55% 감소하였다(Fig. 4).
염증세포의 apoptosis에 관여하는 Caspase-3 변화를 조사하기 위해 mouse anti-caspase 3를 이용한 면역조직화학적 염색을 실시하였다. UE군에서는 Caspase-3 양성반응은 점막 고유층에 증가하였으며, 양성반응세포의 핵막 주변세포질에서 강하게 양성반응을 보였다. UE군은 대조군에 비해 양성반응이 499% 증가하였다. PT군에서는 UE군에 비해 양성반응이 32% 감소하였고, JT군에서는 UE군에 비해 양성반응이 34% 증가하였다(Fig. 4).
IV. 고 찰한국인의 식생활 습관이 서구화 되면서 궤양성 대장염(ulcerative colitis, UC)이나 크론병(Crohn’s disease, CD)과 같은 염증성 장질환(inflammatory bowel disease, IBD)이 증가하고 있다. 이러한 IBD와 관련하여 다양한 연구가 진행중이며, 최근 염증반응을 조절하여 치료에 활용하는 다양한 방법들이 시도되고 있다19-21.
궤양성 대장염의 주증상은 염증 및 궤양, 직장길이 감소이며, 조직학적으로는 환부에 염증세포의 침윤이 나타난다. 장기간 약물치료를 받을 경우 구역, 구토, 식욕부진, 소화불량, 두통과 같은 부작용이 발생하기도 하며, 내성이 초래되기도 한다22. 이러한 이유로 인해 유효성과 안전성이 높은 궤양성 대장염 치료제 개발이 필요한 실정이다23.
자금정은 ≪의학입문(醫學入門)≫에 기재되어 있으며, 옥추단(玉樞丹), 태을자금단(太乙紫金丹)이라고도 한다. 처방내용 및 용량에는 문헌에 따라 차이가 있으며, ≪동의보감(東醫寶鑑)≫에서는 옥추단(玉樞丹)을 태을자금단(太乙紫金丹)에 석웅황(石雄黃)과 주사(朱砂)를 가한 것이라고 말하고 있다. 자금정의 효능은 해제독료제창(解諸毒療諸瘡), 지통(止痛), 이관규(利關竅)하여 악균(惡菌), 서분(鼠奔), 충독(蟲毒), 호리(狐狸), 하돈(河豚), 산람장기(山嵐瘴氣), 사우마육독(死牛馬肉毒) 및 백충(百蟲), 초목(草木), 금석(金石) 등을 해독(解毒)하며, 특히 내복하면 벽예통규(辟穢通竅)하고 외용하면 해독소종(解毒消腫), 연견산결(軟堅散結)한다13.
자금정의 GC/MS 검사결과 염증억제능이 있는 Azetidine(RT 5.974/Area 10%)을 확인하였다. Azetidine는 대사 및 염증질환에 효과가 있는 것으로 알려져 있다24. 자금정에 Azetidine이 함유되어 있다는 검사 결과는 자금정이 실제로 궤양성 대장염에서 염증을 억제시킬 수 있는 가능성을 제시하여 준다.
본 연구에서는 궤양성 대장염 유발을 위해 5% DSS를 사용하였는데, DSS는 장막(intestinal flora)에 변화를 주어 점막내 염증반응을 유도하고25, 궤양성 대장염 초기에는 혈변이나 체중감소, 대장 길이의 감소, 점막 궤양을 유발한다. 만성으로 진행되면 점막에 다양한 면역물질이 증가하면서 장내 염증을 일으킨다26-28. DDS 처리로 궤양성 대장염이 유도된 UE군에서는 Ctrl군에 비해 맹장에서 내림주름창자까지의 길이가 감소하였으나, PT군은 UE군에 비해 11%, JT군에서는 19% 증가하였다. 이는 자금정이 창자 길이를 회복하는데 효과가 있음을 의미한다.
소화기 점막상피는 일종의 방어체계이며, DSS 처리는 이러한 체계의 연결 단백질 중 하나인 zonula occludin(ZO)-1 분포를 감소시킨다. 이러한 감소는 점액상피세포사이에 있는 폐쇄띠(zonula occludens)가 손상됨으로서 발생하게 된다. 폐쇄띠가 손상되면 intestinal permeability가 증가하여 장내 염증이 발생하고 궤양성 대장염을 일으킨다29. 또한 표피 주위에 점액조직의 비대, 과립백혈구의 침윤, 궤양 형성, 조직벽의 심각한 부종이 나타난다30.
본 연구에서도 창자 점막의 일반적인 형태 변화를 확인한 결과 UE군의 점막의 많은 부분에서 창자세포와 창자샘이 유실된 출혈성 침식(hemorrhagic erosion)이 관찰되었으며, 많은 수의 림프구, 섬유모세포, 과립백혈구 등 염증관여세포의 침윤(infiltration)이 점막고유층에서 관찰되었다. 일부 창자에서는 창자 점막에서 일어난 출혈성 침식은 점막근층(muscularis mucosae)을 지나 점막밑층(submucosa)까지 확대된 것을 확인 할 수 있었다. 이에 비해 PT군과 JT군에서는 UE군에 비해 출혈성 침식이 심하지 하였으며, 점막고유층에서도 염증관여세포의 침식 감소가 확인되었다.
또한 PAS 염색을 통해서 점액분비세포의 분포 변화를 관찰하였다. UE군의 표면상피 상층부(apical surface)에 위치한 PAS 양성반응의 창자세포는 거의 손상된 형태로 나타났고, 솔모양가장자리는 관찰되지 않았다. PT군과 JT군의 일부 표면상피 상층부를 제외하고는 정상적인 창자세포의 배열을 확인 할 수 있었으며, 솔모양가장자리도 관찰되었다.
이러한 결과를 볼 때, 자금정이 폐쇄띠 손상을 줄이고 장내 투과성을 감소시켜 출혈성 침식 및 염증관여세포의 침윤을 완화시키는 것으로 생각된다.
iNOS와 COX-2는 전염증 효소로서, nuclear factor interleukin-6, fos/jun(AP-1), CCAAT/enhancer-binding protein(C/EBP), nuclear factor-kappa B(NF-κB) 같은 전사인자에 의해 조절 된다31. 궤양성 대장염에서는 NF-kB 활성으로 인하여 iNOS와 COX-2의 생성이 증가하고 이로 인해 심각한 염증을 유발한다. 섬유모세포와 대식세포 등에서 발현되는 COX-2는 성장인자와 mitogen에 유도되어 류마티스성 관절염, Crohn’s disease, 궤양성 대장염과 같은 다양한 만성 염증성 질환을 유발한다32,33. 또한 NF-κB는 IBD에서 산화적 스트레스에 의한 염증과 유전자의 발현을 조절한다34,35.
본 연구에서는 전염증효소인 NF-kB의 활성에 관여하는 p-IkB 양성반응을 조사하기 위해 mouse anti-p-IKB를 이용한 면역조직화학적 염색을 실시하였다. UE군에서는 p-IkB 양성반응이 점막 고유층에서 증가하였으며, 양성반응세포의 핵막 가장자리에서 강한 양성반응을 보였다. UE군은 대조군에 비해 양성반응이 298% 증가하였으며, PT군에서는 UE군에 비해 양성반응이 23%, JT군에서는 UE군에 비해 양성반응이 49% 감소하였다. 또한 mouse anti-iNOS를 이용한 면역조직화학적 염색에서 UE군에서는 iNOS 양성반응이 점막 고유층에서 증가하였으며, 대조군에 비해 204% 증가하였다. 반면에 PT군에서는 UE군에 비해 양성반응이 37%, JT군에서는 43% 감소하였다. 점막내 염증효소인 COX-2 생성 변화에서는 UE군에서는 COX-2 양성반응이 대조군에 비해 273% 증가하였다. PT군에서는 UE군에 비해 양성반응이 34%, JT군에서는 55% 감소하였다. 이러한 결과들은 자금정이 대식세포의 iNOS와 COX-2 같은 전염증 효소의 생산을 억제하고 NF-κB과 같은 전사인자를 조절하여 염증 유발을 억제함으로써 염증 억제 효과에 대한 가능성을 제시한다.
또한 본 연구에서는 염증세포의 apoptosis에 관여하는 Caspase-3 변화를 조사하기 위해 항caspase 3 항체를 이용한 면역조직화학적 염색을 실시하였다. Caspases는 apoptosis의 중재자 역할을 하며, 그 중에서도 caspase-3는 가장 마지막에 활성화되는 caspase로서, 많은 주요 세포 단백질의 특이적인 절단을 촉매하여 사멸시키는 단백질이다36. 따라서, caspase-3는 세포 apoptosis 과정에 필수적이다. UE군에서는 Caspase 3 양성반응은 점막 고유층에 증가하였으며, 양성반응세포의 핵막 주변세포질에서 강하게 양성반응을 보였다. UE군은 대조군에 비해 양성반응이 499% 증가한 반면에, PT군에서는 UE군에 비해 양성반응이 32% 감소하였고, JT군에서는 양성반응이 34% 증가하였다. JT군에서 양성반응이 증가하였다는 결과는 자금정의 항염증 효과가 apoptosis를 증가를 통하여 나타나는 것으로 해석될 수 있다. 그러한 기전에 근거한다면, 자금정은 궤양성 대장염의 초기 혹은 급성기에 효과적일 것으로 생각되며, 이외에도 약물중독이나 독성물질의 자극에 응급약으로 활용될 수 있는 가능성이 있다. 과거 화상의 외용약이나 열성 종창의 해독약 등으로 사용한 것37도 이러한 효과 때문이 아니었을까 생각된다.
이상의 결과로 볼 때, 자금정은 항염증 효과 및 창자 점막 보호 효과를 가지며, 기존의 궤양성 대장염 치료제인 펜타사에 비해 그 효과가 더 우수한 것으로 나타났다. 이러한 결과는 자금정의 궤양성 대장염 치료제로서의 가능성을 보여준다. 본 연구는 향후 궤양성 대장염 치료의 근거를 제공할 수 있을 것으로 생각된다.
V. 결 론자금정의 궤양성 대장염에 대한 치료 효과를 조사하기 위해 행해진 본 연구는 자금정 추출물이 DSS 처리를 통해 인위적으로 궤양성 대장염이 유발된 생쥐에서 창자점막 손상과 염증 변화를 관찰하였다. 염증조절 효능을 가지고 있는 자금정을 투여한 생쥐 결장에서는 전염증효소(NF-kB p65) 활성 조절을 통한 염증효소(iNOS, COX-2)의 생성을 억제하였고, caspase-3 활성을 통한 apoptosis를 유도하였다. 그 결과 낮은 점막의 출혈성 찰과와 궤양 유발을 보였다. 또한 대조약물인 펜타사보다 나은 치료효과를 보였다. 이상의 결과로 자금정은 과도한 염증작용을 조절함으로서 궤양성 대장염으로 기인된 점막 손상을 완화시키는 것으로 생각된다. 이러한 결과는 자금정이 궤양성 대장염의 치료제로서의 가능성을 제시한다. 향후 궤양성 대장염 환자를 대상으로 한 임상연구가 필요할 것으로 생각된다.
참고문헌1. Kornbluth A, Sachar DB; Practice Parameters Committee of the American College of Gastroenterology. Ulcerative colitis practice guidelines in adults (update):American College of Gastroenterology, Practice Parameters Committee. Am J Gastroenterol 2004:99(7):1371–85.
2. Su C, Lichtenstein GR. Ulcerative colitis. In : Feldman M, Friedman LS, Brandt LJ, editors. Sleisenger and Fordtran's gastrointestinal and liver disease:pathophysiology, diagnosis, management 2:8th ed. Philadelphia: Saunders: 2006. p. 2499–548.
3. Yang SK, Loftus EV Jr, Sandborn WJ. Epidemiology of inflammatory bowel disease in Asia. Inflamm Bowel Dis 2001:7(3):260–70.
4. Lakatos PL. Recent trends in the epidemiology of inflammatory bowel diseases:up or down? World J Gastroenterol 2006:12(38):6102–8.
5. Yang SK, Yun SC, Kim JH, Park JY, Kim HY, Kim YH, et al. Epidemiology of inflammatory bowel disease in the Songpa-Kangdong district, Seoul, Korea 1986-2005:a KASID study. Inflamm Bowel Dis 2008:14(4):542–9.
6. Lee CR, Suh JH, Hahn CH, Chung HW, Lee HW, Lee JH, et al. Characteristics of ulcerative colitis according to the age of onset. Korean J Gastroenterol 2001:37(3):196–202.
7. Park JB, Yang SK, Byeon JS. Familial occurrence of inflammatory bowel disease in Korea. Inflamm Bowel Dis 2006:12(2):1146–51.
8. Su C, Lewis JD, Goldberg B, Brensinger C, Lichtenstein GR. A meta-analysis of the placebo rates of remission and response in clinical trials of active ulcerative colitis. Gastroenterology 2007:132(2):516–26.
9. Choi CH, Kim YH, Kim YS, Ye BD, Lee KM, Lee BI, et al. Guidelines for the Management of Ulcerative Colitis. Korean J Gastroenterol 2012:59(2):118–40.
10. Jeen YT, Kim JH. Advances in ulcerative colitis therapy. Korean Journal of Medicine 2009:76(6):654–60.
11. Kim SY, Park JW, Ryu BH. Effects of Auklandia Lappa on Dextran Sulfate Sodium-Induced Murine Colitis. Korean J Orient Int Med 2013:34(2):134–46.
12. Cha HY, Jeong AR, Cheon JH, Ahn SH, Park SY, Kim KB. The Anti-oxidative and Anti-inflammatory Effect of Lonicera Japonica on Ulcerative Colitis Induced by Dextran Sulfate Sodium in Mice. J Pediatr Korean Med 2015:29(3):54–64.
13. Park ID, Son CG, Cho CK. A literal study of anti-tumor effects of Jakeumjung. J Daejeon University Korean Oriental Medical Research Institute 2002:10(2):73–81.
14. Wi SB, Lim LY. A study on the antibacterial effect of external application Jakeumjung. J Chinese Medicinal Materials 2004:27(10):761–2.
15. Cho HS, Kang SW, Kim JH, Choi MJ, Yu HW, Park ET, et al. Antioxidant and Antimicrobial Activities of Combined Extracts of Galla rhois, Achyranthes japonica Nakai, Terminalia chebula Retz and Glycyrrhiza uralensis. Korean Society for Biotechnology and Bioengineering Journal 2014:29(1):29–35.
16. Yoo JG, Ckoi KH, Kim YK, Kang SK, Jung SY, Jung JH, et al. The study on the anti-inflammatory effects of Phellodendri Cortex, Indigo Naturalis, Alumen, and Chinensis Galla, most frequently used for the external theraphy of Gu-Chang. J Korean Medicine Ophthalmology & Otolaryngology & Dermatology 2005:18(1):183–98.
17. Ha HJ, Kim YJ, Kweon KT, Kim JJ. Review of the domestic research trends in the study of Korean herbal medicine with anti-inflammation effects. The Korea Journal of Herbology 2011:26(4):15–22.
18. Taneja V, Siddiqui HH, Arora RB. Studies on the antiinflammatory activity of Moschus moschiferus (musk) and its possible mode of action. Indian J Physiol Pharmacol 1973:17(3):241–7.
19. Itzkowitz SH, Yio X; Inflammation and cancer IV. Colorectal cancer in inflammatory bowel disease: the role of inflammation. Am J Physiol Gastrointest Liver Physiol 2004:287(1):G7–17.
21. Surh YJ, Chun KS, Cha HH, Han SS, Keum YS, Park KK, et al. Molecular mechanisms underlying chemopreventive activities of anti-inflammatory phytochemicals:down-regulation of COX-2 and iNOS through suppression of NF-kappa B activation. Mutat Res 2001:480-481:243–68.
22. Ishiguro K, Ando T, Maeda O, Hasegawa M, Kadomatsu K, Ohmiya N, et al. Paeonol attenuates TNBS-induced colitis by inhibiting NF-B and STAT1 transactivation. Toxicol Appl Pharmacol 2006:217(1):35–42.
23. Myung NY. The inhibitory effect of Orostachys japonicus on dextran sulfate sodium-induced colitis in mice. Kor J Herbology 2014:29(4):29–34.
24. Srivastava SK, Srivastava S, Srivastava SD. Synthesis of new carbazolyl-thiadiazol-2-oxo- azetidines :Antimicrobial, anticonvulsant and anti-inflammatory agents. Indian J Chem 1999:38(2):183–7.
25. Kim HS, Berstad A. Experimental colitis in animal models. Scand J Gastroenterol 1992:27(7):529–37.
26. Frank K, Helmut M, Marianne A, Volker G, Tina B, Jürgen S, et al. Clinical and histopathological features of dextran sulfate sodium induced acute and chronic colitis associated with dysplasia in rats. Int J Colorectal Dis 2001:16(4):238–46.
27. Ishioka T, Kuwabara N, Oohashi Y, Wakabayashi K. Induction of colorectal tumors in rats by sulfated polysaccharides. Crit Rev Toxicol 1987:17(3):215–44.
28. Okayasu I, Hatakeyama S, Yamada M, Ohkusa T, Inagaki Y, Nakaya RA. Novel method in the induction of reliable experimental acute and chronic ulcerative colitis in mice. Gastroenterology 1990:98(3):694–702.
29. Gassler N, Rohr C, Schneider A, Kartenbeck J, Bach A, Obermüller N, et al. Inflammatory bowel disease is associated with changes of enterocytic junctions. Am J Physiol Gastrointest Liver Physiol 2001:281(1):G216–28.
30. Melgar S, Engströom K, Jäagervall A, Martinez V. Psychological stress reactivates dextran sulfate sodium-induced chronic colitis in mice. Stress 2008:11(5):348–62.
31. Xie QW, Kashiwabara Y, Nathan C. Role of transcription factor NF-kappa B/Rel in induction of nitric oxide synthase. J Biol Chem 1994:269(7):4705–8.
33. RothkÖtter HJ, Pabst P, Bailey M. Lymphocyte migration in the intestinal mucosa :entry, transit and emigration of lymphoid cells and the influence of antigen. Vetrinary Immuno immunopath 1999:72(1-2):157–65.
34. Barnes PJ, Karin MN. Nuclear factor-kappaB:a pivotal transcription factor in chronic inflammatory diseases. Engl J Med 1997:336(15):1066–71.
35. Baeuerle PA. IκB-NF-κB structure:at the interface of inflammation control. Cell 1998:95(6):729–31.
36. Porter AG, Jänicke RU. Emerging roles of caspase-3 in apoptosis. Cell Death & Differentiation 1999:6(2):99–104.
37. Kim JE, Choi DY, Jeong HS, Shin HJ, Shin SW, Ha KT. Study on Jong-jun Lee's Medical Records in Sinsuntaeeuljagumdan. Korean J Oriental Physiology & Pathology 2011:25(2):155–62.
|
|
||||||||||||||||||||||||||||||||||||||||||