生附子 및 蔘附湯의 aconitine 함량 분석 및 삼부탕 단회투여 독성시험
Abstract
Objectives:
This study investigated the aconitine contents analysis of Buja extracts (raw material of Buja, hot water extract of Buja, and hot water extract of Sambu-tang) and the single oral dose toxicity of Sambu-tang-R in six-week-old Sprague-Dawley rats in order to compare the toxicity of Buja extracts.
Methods:
A conitine content analysis is that Buja extracts were hold purity test. To detect single oral dose toxicity, six-week-old Sprague-Dawley rats were divided into two groups, a normal control group and a sambutang-R (2,000 mg/kg) group. For 14 days of treatment, clinical signs, body weight, clinical chemistry, necropsy, and histopathology were examined.
Results:
The aconitine contents of the Buja extracts were Buja-RH (0.1738%), Buja-RD (0.1746%), and Sambu-tang-R (0.0961%). There were no cases of death in either the control group or the experimental group. Nor was there any disorder to the clinical signs or any significant change in body weight in either group. There was no significant change of clinical chemistry or disorder of necropsy findings in either the control or the experimental group. And there was no difference in histopathological findings in comparing the control group with the experimental group.
Conclusions:
These results suggest that the aconitine content of the hot water extract of Buja was similar to the raw material of Buja, but the hot water extract of Sambu-tang had greatly decreased aconitine content. These results also suggest that a single oral lethal dose of Sambu-tang-R for Sprague-Dawley rats exceeds 2,000 mg/kg for both female and male rats.
Keywords: aconitine, Buja-RH (raw-material of Buja), Buja-RD (hot-water extract of Buja), Sambu-tang-R (hot-water extract of Sambu-tang), single-oral-dose-toxicity
I. 서 론
최근 몇 년 동안 전 세계적으로 전통의학 및 보완대체의학에 대한 관심이 높아지면서 한의학에 대한 사회적인 관심과 기대가 높아지고 있다 1. 다른 한편으로는 한약의 안전성에 대하여 한약 자체의 독성에 의한 간장손상이나 신장손상 등이 주로 제기되고 있다 2. 한약에 대한 독성과 부작용에 대한 연구가 진행되고 있으나, 보고되고 있는 대부분의 자료들은 한의사의 처방 없이 무분별한 한약의 오용이나 검증되지 않는 민간약물의 오용, 건강기능식품의 남용 등으로 발생한 임상보고가 주류를 이루고 있어 한약이 부정적으로 인식되고 있다 3. 따라서 한약에 대한 올바른 인식과 한의학의 위상을 지키기 위해서는 한약재의 독성에 대한 다양한 접근들이 필요하다. 附子는 독성이 있다고 알려진 대표적인 한약재이다. 附子는 미나리아재비과(毛茛科, Ranunculaceae)에 속한 多年生草本인 烏頭(Aconitum carmichaeli Debx.)의 子根을 가공한 것으로, 6월 하순부터 8월 상순에 母根과 鬚根을 제거하고 가공한 것이며, 그 방법에 따라 鹽附子, 黑順片 및 白附片으로 나눈다. 附子의 性味는 辛甘, 熱有毒하고, 그 歸經은 心, 脾, 腎經이다. 回陽補火, 散寒除濕 等의 효능이 있어 陰盛格陽, 大汗亡陽, 吐痢厥逆, 心腹冷痛, 脾泄冷痢, 脚氣水腫, 小兒慢驚, 風寒濕痺, 踒躄拘攣, 陰疽瘡漏, 一切沈寒痼冷 등의 치료에 使用된다. 附子는 alkaloid 成分으로 hypaconitine, aconitine, mesaconitine, talatisamine 등이 있고, aconitine類의 alkaloid가 독성을 일으키는 주요 물질로 알려져 있다 4-8. 부자의 중독증상은 신경계통과 순환계통이 주가 되고, 그 다음으로는 소화계통 증상이다. 중독증상으로는 입술과 사지의 마비감, 牙關緊閉, 頭痛, 眩暈, 혈압하강, 심실성기외수축, 심실세동, 惡心 및 嘔吐 등이 있다 9-11. 이렇게 부자는 독성이 있어 중독증상이 나타남에도 불구하고, 그 사용빈도는 높은 편으로 ≪東醫寶鑑≫에서 附子가 主藥으로 配伍된 처방은 70方에 달하고, 寒門에서만 12方에 달한다 12. ≪方藥合編≫의 처방 중 부자를 사용한 경우는 전체의 7.1%인 33方에 달한다 13. 특히 조선말 石谷 李圭晙(1855~1923)은 淸上通中溫下하는 扶陽論의 관점에서 附子를 매우 많이 응용하였고, 그의 처방들을 병증별로 분류하여 편집한 ≪新方新編≫에 수재된 부자를 사용한 처방은 전체의 82%인 542方에 달한다 14. 임상에서 약물 처방을 할 때에 單味보다는 2개 이상의 한약재로 조성된 복합처방을 응용하는 경우가 많다. 附子도 마찬가지로 單味로 사용하기 보다는 人蔘과 配伍하여 蔘附湯의 형태로 임상에서 많이 활용되고 있다.
蔘附湯은 ≪濟生續方≫에 처음 수재된 처방으로 人蔘과 附子로 조성되어 있고, 益氣⋅回陽⋅固脫의 작용이 있으며, 手足逆冷⋅頭暈喘促⋅面色蒼白⋅冷汗淋漓⋅脈微欲絶의 元氣大虧⋅陽氣暴脫證을 치료한다 15. 장 등 16, 송 등 17, 한 등 18, 이 등 19, 안 등 20에 의한 연구에 의하면 임상적으로는 附子가 肝機能과 腎機能 및 心臟에 별다른 유해 작용을 나타내지 않았으며, 도리어 이들의 생리적인 기능을 개선시킨다고 보고하였다. 부자의 aconitine 함량을 열수추출 전후, 부자와 인삼으로 조성된 삼부탕에 대해 aconitine 함량을 비교분석하여 중독량과의 상관성을 알아보고, 人蔘과 부자를 配伍 시 附子의 aconitine content 변화 혹은 감소에 대한 연구는 아직 보고되지 않았다. 본 논문에서는 생부자 원약재, 생부자 열수 추출물 및 삼부탕 열수 추출물의 aconitine 함량을 분석하고, 암수 Sprague-Dawley 랫드를 이용하여 삼부탕 열수추출물의 단회투여독성 시험에 대한 유의한 결과를 얻었기에 보고하는 바이다.
II. 실험재료 및 연구방법
1. 실험재료
1) 실험동물
(주)오리엔트바이오(ORIENTBIO Inc., Korea)의 SPF 환경에서 사육하고 공급한 5주령의 Sprague- Dawley 랫드(Crl : CD(SD))의 암수 각 12마리를 구입하여 1주 간 실험실 환경에 적응하도록 한 후 실험에 사용하였다.
실험 기간 동안 스테인레스 철망사육상자(260 W×350 D×210 Hmm) 당 수용동물 수는 검역순화기간에는 3마리, 관찰기간에는 1마리로 하였고, 온도(실측치 : 21.1~22.8 °C, 허용범위 : 19.0~25.0 °C), 습도(실측치 : 45.9~53.7%, 허용범위 : 30.0~70.0%), 환기 횟수 10∼15회/hour, 조도 150∼300 lux, 그리고 12시간의 명암(점등 : 07:00, 소등 : 19:00) 주기가 있는 실험실 환경에서 고형사료(Harlan, USA)와 청주시 수돗물을 필터유수살균기로 여과 후 자외선을 조사한 물을 자유롭게 공급 받았다.
사육상자 및 급이기는 1회/2주 빈도로 교환하였다. 사육기재는 자동세척기를 이용하여 세척하였고, 고압증기멸균기를 이용하여 멸균하였다.
반입 시 동물의 외관 검사를 실시하였고, 전자저울(CP3202S, Sartorius, Germany)로 체중을 측정하였다. 6일간의 순화기간 중에 매일 1회 일반증상을 관찰하였다. 단, 동물입수 시 검역실에서 약 3일간 일반증상을 관찰한 후 동물실로 이동하였다. 순화기간 종료일에 체중을 측정하였고, 일반증상 및 체중변화 Table 1을 확인하여 모든 동물에 이상이 없음을 확인하였다.
Table 1
Individual Body Weights during an Acclimation Period (g)
|
Male |
Female |
|
|
Animal ID |
Temporary animal ID |
Receipt |
Group assignment |
Animal ID |
Temporary animal ID |
Receipt |
Group assignment |
|
1101 |
1003 |
121.3 |
181.1 |
2101 |
2010 |
116.9 |
149.1 |
|
1102 |
1010 |
131.3 |
182.0 |
2102 |
2005 |
121.0 |
145.9 |
|
1103 |
1012 |
124.9 |
177.5 |
2103 |
2003 |
116.1 |
143.7 |
|
1104 |
1009 |
126.7 |
177.0 |
2104 |
2012 |
117.0 |
139.5 |
|
1105 |
1001 |
124.7 |
172.2 |
2105 |
2006 |
113.2 |
132.9 |
|
1201 |
1011 |
124.3 |
179.4 |
2201 |
2009 |
119.1 |
138.8 |
|
1202 |
1006 |
129.2 |
179.9 |
2202 |
2008 |
121.0 |
146.5 |
|
1203 |
1002 |
124.0 |
171.8 |
2203 |
2011 |
111.9 |
136.9 |
|
1204 |
1005 |
129.7 |
182.6 |
2204 |
2004 |
115.7 |
140.8 |
|
1205 |
1008 |
123.3 |
175.5 |
2205 |
2007 |
118.4 |
147.0 |
|
1004 |
132.5 |
187.6 |
|
2001 |
106.0 |
132.4 |
|
1007 |
126.1 |
171.3 |
|
2002 |
120.6 |
155.2 |
|
Mean |
126.5 |
178.2 |
|
Mean |
116.4 |
142.4 |
|
S.D. |
3.5 |
4.9 |
|
S.D. |
4.4 |
6.8 |
|
N |
12 |
12 |
|
N |
12 |
12 |
입수 시 성별, 동물수, 주령 및 체중범위는 수컷 12마리 5주령 121.3~132.5 g, 암컷 12마리 5주령 106.0~121.0 g이고, 투여 시 성별, 동물수, 주령 및 체중범위는 수컷 10마리 6주령 151.9~166.1 g, 암컷 10마리 6주령 118.4~132.4 g이었다.
본 실험은 동물보호법(제정 1991년 5월 31일 법률 제 4379호, 일부개정 2015년 1월 20일 법률 제 13023호)에 근거한 (주)바이오톡스텍(Cheongju, Korea)의 동물실험윤리위원회에 의해 승인되었다(승인번호 : 150497).
2) 실험물질
실험에 사용된 물질은 生附子(Buja-RH) 원약재, 生附子 열수추출물(Buja-RD), 生附子 함유 蔘附湯 열수추출물(Sambu-tang-R)을 사용하였다.
生附子(Aconiti Lateralis Radix Preparata)는 중국 四川省에서 생산된 附子로 Bozhou Sunglim Traditional Chinese Medicine Co. Ltd.(Anhui, China)를 통하여 구입하였고 이를 사용하였다. 蔘附湯의 조성약물인 人蔘(Ginseng Radix Alba)은 한국 충남 금산군에서 생산된 백삼 4년근으로 광명생약 (Busan, Korea)에서 구입하였고 이를 사용하였다.
생부자 원약재(Buja-RH)는 생부자 20 g을 그대로 사용하여 aconitine의 함량을 측정하였고, 생부자 열수추출물(Buja-RD)는 생부자 120 g에 정수물 3000 cc를 약탕항아리(Geum-gwang, Hamyang, Korea)에 넣고 100 °C 에서 2시간 전탕하였다. 이 전탕액을 농축기용 워터베이스(SB-1100, Eyela, Japan)에서 70 °C 로 맞추고, 원심농축기(N-1100, Eyela, Japan)로 가열 농축한 후 동결건조시스템 (FDU-2100, Eyela, Japan)에서 동결건조하여 16.1 g을 얻었다. 蔘附湯 열수 추출물( Sambu-tang-R)은 생부자 200 g과 인삼 200 g에 정수물 4000 cc를 약탕항아리(Geum-gwang, Hamyang, Korea)에 넣고 100 °C 로 2시간 전탕하였다. 이 전탕액을 농축기용 워터베이스(SB-1100, Eyela, Japan)에서 70 °C 로 맞추고, 원심농축기(N-1100, Eyela, Japan)로 열수 농축한 후 동결건조시스템(FDU-2100, Eyela, Japan)에서 동결건조하여 66.7 g을 얻을 수 있었다( Table 2).
Table 2
The Composition of Extracts
|
Extracts |
韓藥名 |
Ingredient (%) |
Yield (%) |
|
Buja-RH*
|
生附子 |
Aconiti Lateralis Radix
|
100 |
100 |
|
|
Buja-RD**
|
生附子 |
Aconiti Lateralis Radix
|
100 |
13.42 |
|
|
Sambu-tang-R***
|
生附子 |
Aconiti Lateralis Radix
|
50 |
100 |
16.68 |
|
人 蔘 |
Ginseng Radix Alba
|
50 |
3) 실험군 및 투여방법
군 분리는 모든 동물에 대하여 순화종료일에 실시하였다. 군 분리일의 평균체중에 가까운 암수 각 10마리를 선발하였다. 선발한 동물을 각 군 평균체중이 균등하도록 무작위로 암수 각 2군, 군당 5마리로 군 분리하였다.
단회투여 독성시험에 사용한 蔘附湯(Sambu-tang-R)은 전자저울(CP323S, Sartorius, Germany)로 칭량하여 유리 조제병에 넣고, 부형제를 일부 넣어 교반기로 현탁시키고 부형제를 가하여 규정농도(200 mg/mL)로 조제하였다. 조제물은 투여당일 조제하였다. 蔘附湯은 결정성 고체 형태로 냉장(실측치 : 4.5~5.7 °C, 허용범위 : 2~8 °C), 제습하여 고온 노출을 피하여 보관하였고, 부형제는 (주)중외제약 (Choongwae Pharma Corp., Republic of Korea)에서 공급한 주사용수(DBA500)를 실온으로 보관하여 사용하였다.
투여액량은 10 mL/kg으로 하였고, 개체별 투여액량은 절식 후 투여당일의 체중을 기준으로 산출하였다. 경구 투여용 존데를 부착한 일회용 주사기 (3 mL)를 이용하여 위내에 단회 강제 투여하였다. 모든 동물은 투여 전에 약 16시간 이상 음수는 자유섭취 시키면서 절식시키고, 투여 후 약 4시간에 사료를 급여하였다.
시험물질의 임상적용 예정 용량은 0.8 g/human/day (성인 60 kg 기준시 약 13.3 mg/kg)이다. 본 시험의 예비시험(Biotoxtech Study No. : B15567P1)으로 2,000 mg/10 mL/kg을 암수 랫드 각 1마리에 단회 경구 투여한 결과 사망례가 관찰되지 않았다. 따라서, 본 시험의 투여용량은 2,000 mg/kg의 단일 시험물질 투여군을 설정하였다. 대조군에는 시험물질 투여군과 동일한 액량의 부형제를 투여하였다( Table 3).
Table 3
Summary of Experimental Design
|
Group |
Dose (mg/kg) |
Liquid (mL/kg) |
No. of animals |
|
|
Male |
Female |
|
G1 |
Control group |
0 |
10 |
5 |
5 |
|
G2 |
Sambu-tang-R group |
2,000 |
10 |
5 |
5 |
2. 연구방법
1) Aconitine 함량분석
(주)동의한약분석센터(Busan, Korea)에서 aconitine의 함량을 분석하였다. 그 분석법은 다음과 같다.
준비한 시료 약 5 g을 삼각플라스크에 넣고 메탄올 50 mL를 넣은 다음 교반기를 사용하여 30분간 교반추출하고 탈지면을 써서 여과하고 소량의 메탄올로 씻고 여액과 씻은 액을 합한다. 잔류물에 대하여 같은 방법으로 메탄올 50 mL씩으로 6~7번 반복 추출한 다음 각 추출액을 합한다(최종 추출액이 드라겐돌프시액에 의하여 알칼로이드의 정색반응이 나타나지 않을 때까지). 전 추출액을 수욕에서 증발건고한 다음 10% 염산 5 mL를 넣고 입자가 고르게 퍼지도록 흔들어 섞은 다음 압착한 탈지면으로 여과하고 탈지면은 물로 여러 번 씻는다. 여액과 씻은 액을 합하고 암모니아수를 넣어 알칼리성으로 한 다음 분액깔때기에 넣고 클로로포름 20 mL씩으로 6~7회 반복하여 흔들어 섞은 다음 클로로포름층을 합하고 무수황산나트륨 5 g을 넣어 흔들어 섞은 다음 여과한다. 무수황산나트륨을 클로로포름 소량으로 씻고 여액과 씻은 액을 합한 다음 수욕에서 증발건고하여 전량이 0.5 mL가 되게 하여 검액으로 한다. 따로 아코니틴표준품 10.0 mg을 클로로포름에 녹여 표준액으로 한다. 이들 액을 가지고 박층크로마토그래프법에 따라 시험한다. 검액 및 표준액 100 μL(확인용은 별도로 50 μL)씩을 박층크로마토그래프용 실리카겔을 써서 만든 박층판에 점적한다. 다음에 클로로포름⋅아세톤혼합액(3:2)을 전개용매로 하여 약 10 cm 전개한 다음 박층판을 바람에 말린다. 여기에 분무용 드라겐돌프시액을 고르게 뿌릴 때 검액에서 얻은 반점중 표준액에서 얻은 반점과 색상 및 Rf 값이 같은 부위를 각각 박리하여 각각 에탄올 8 mL를 넣고 55~60 °C 수욕에서 5분간 가온한 다음 에탄올을 넣어 정확히 10 mL가 되게 하고 측정용 검액 및 표준액으로 한다. 이들 측정용 검액 및 표준액을 에탄올을 대조로 하여 파장 231 nm에서 흡광도 As 및 Ar를 측정한다. 아코니틴 함량의 수식은 다음과 같다.
아코니틴(C34H47NO11 : 645.75)의 양(mg)= 표준품의 양(mg)×Ar÷(As×검체채취량(mg))
2) 단회투여 독성시험
본 시험은 다음의 Good Laboratory Practice Regulation을 준수하였고[“비임상시험관리기준” 식품의약품안전처 고시 제 2014-67호(2014년 2월 12일)], 다음의 시험기준에 근거하여 실시하였다[“의약품등의 독성시험기준” 식품의약품안전처 고시 제 2014-136호(2014년 7월 30일)]. 독성시험방법은 다음과 같다.
(1) 일반증상 관찰
투여당일에는 투여 후 30분, 1, 2, 4 및 6시간째에 일반상태(독성징후의 종류, 발현시기, 회복시기 등) 및 사망유무를 관찰하였다. 투여 후 1일부터 14일까지는 매일 1회 일반증상을 관찰하였다.
(2) 체중 측정
체중은 투여당일(투여 전), 투여 후 1, 3, 7 및 13일에 측정하였다.
(3) 혈액생화학적 검사
모든 동물에 대하여 부검 전 약 18시간 이상 절식시킨 후, 부검일에 isoflurane으로 마취하여 배대동맥으로부터 혈액을 채취하여 3,000 rpm으로 10분간 원심분리 후 혈청을 취하여 이용하였다. 락테이트 탈수소효소의 측정은 헤파린 함유 tube에 혈액을 넣고 3,000 rpm으로 10분간 원심분리 후 혈장을 취하여 이용하였다. 혈액생화학 분석기(7180, HITACHI, Japan)로 다음 항목들을 측정하였다. 알라닌 아미노기전이효소(alanine aminotransferase, ALT)와 아스파테이트 아미노기전이효소(aspartate aminotransferase, AST)는 JSCC법, 알칼라인 포스파타제(alkaline phosphatase, ALP)는 4-Nitrophenyl-phosphate 2Na법, 락테이트 탈수소효소(lactate dehydrogenase, LDH)는 UV-Kinetic법, 감마 글루타밀트란스펩티다제(gamma glutamyl transpeptidase, GGT)는 IFCC법으로 측정하였고, 단위는 모두 U/L로 하였다.
(4) 동물 부검
모든 동물에 대해서 투여 후 14일에 isoflurane 마취하에 배대동맥에서 방혈하여 안락사시키고 부검하였다. 부검을 실시한 모든 동물에 대해서 전신의 장기 및 조직에 대하여 상세한 육안검사를 실시하였다.
(5) 조직병리학적 검사
부검 시 대조군 및 시험물질 투여군의 간(liver)을 적출하여 10% 중성완충 포르말린용액(neutral buffered formalin)에 고정하였다. 고정된 검체는 삭정, 탈수 및 파라핀 포매 등의 일반적인 조직처리과정을 거쳐 조직절편을 제작하여 박절한 후, Hematoxylin & Eosin(H&E) 염색을 실시하였다. 잔여 장기 및 조직은 10% 중성완충포르말린용액에 보존하였다.
조직병리학적 검사는 대조군 및 시험물질 투여군(G1 및 G2)의 간의 장기 및 조직에 대하여 검경하였다.
3. 통계분석
실험에서 얻어진 체중 및 혈액생화학적 검사 결과는 SAS(version 9.3, SAS Institute Inc., USA)를 사용하여 검정하였다. Folded-F 검정법을 사용하여 등분산성을 검정한 결과(유의수준 : 0.05), 등분산인 경우 Student t-test를, 등분산이 기각되면 Aspin-Welch t-test를 실시하여 유의성을 확인하였다(유의수준 : 양측 0.05 및 0.01).
III. 실험 결과
1. Aconitine 함량분석
Buja-RH, Buja-RD 및 Sambu-tang-R의 aconitine 함량은 다음과 같다( Table 4).
Table 4
Aconitine Contents of Buja-extracts
|
Buja-extracts |
Content (%) |
|
Buja-RH*
|
0.1738 |
|
Buja-RD**
|
0.1746 |
|
Sambu-tang-R***
|
0.0961 |
2. 사망유무
관찰기간 동안, 암수 대조군 및 2,000 mg/kg 투여군에서 사망례는 없었다( Table 5).
Table 5
|
Sex |
Group /Dose (mg/kg) |
No. of animals |
Days after dosing |
Mortality |
|
|
0 |
1 |
2 |
3 |
4 |
5 |
6 |
7 |
8 |
9 |
10 |
11 |
12 |
13 |
14 |
|
Male |
G1 0 |
5 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
0/5 |
|
G2 2,000 |
5 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
0/5 |
|
|
Female |
G1 0 |
5 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
0/5 |
|
G2 2,000 |
5 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
0/5 |
3. 일반증상
관찰기간 동안, 암수 대조군 및 2,000 mg/kg 투여군에서 일반증상의 이상은 관찰되지 않았다( Table 6).
Table 6
Summary of Clinical Signs
|
Sex |
Group /Dose (mg/kg) |
No. of animals |
Clinical sign |
Hours (Day 0) after dosing |
|
|
0.5 |
1 |
2 |
4 |
6 |
|
Male |
G1 0 |
5 |
NOA |
5 |
5 |
5 |
5 |
5 |
|
G2 2,000 |
5 |
NOA |
5 |
5 |
5 |
5 |
5 |
|
|
Female |
G1 0 |
5 |
NOA |
5 |
5 |
5 |
5 |
5 |
|
G2 2,000 |
5 |
NOA |
5 |
5 |
5 |
5 |
5 |
|
|
Sex
|
Group /Dose (mg/kg)
|
No. of animals
|
Clinical sign
|
Days after dosing
|
|
|
1
|
2
|
3
|
4
|
5
|
6
|
7
|
8
|
9
|
10
|
11
|
12
|
13
|
14
|
|
|
Male |
G1 0 |
5 |
NOA |
5 |
5 |
5 |
5 |
5 |
5 |
5 |
5 |
5 |
5 |
5 |
5 |
5 |
5 |
|
G2 2,000 |
5 |
NOA |
5 |
5 |
5 |
5 |
5 |
5 |
5 |
5 |
5 |
5 |
5 |
5 |
5 |
5 |
|
|
Female |
G1 0 |
5 |
NOA |
5 |
5 |
5 |
5 |
5 |
5 |
5 |
5 |
5 |
5 |
5 |
5 |
5 |
5 |
|
G2 2,000 |
5 |
NOA |
5 |
5 |
5 |
5 |
5 |
5 |
5 |
5 |
5 |
5 |
5 |
5 |
5 |
5 |
4. 체중변화
관찰기간 동안, 암컷 2,000 mg/kg 투여군에서 대조군과 비교 시 유의성 있는 체중변화는 인정되지 않았다.
수컷 2,000 mg/kg 투여군에서 투여 후 13일에 대조군과 비교 시 유의성 있는 체중감소가 관찰되었지만, 전례에서 순조로운 체중증가가 관찰되었고, 일반증상의 이상이 관찰되지 않았으므로, 시험물질의 투여에 의한 영향은 아닌 것으로 판단된다 ( Fig. 1, 2, Table 7).
Fig. 1
Body weights in male SD rats. 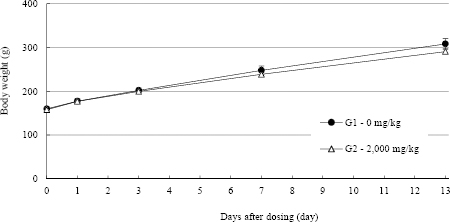
Fig. 2
Body weights in female SD rats. 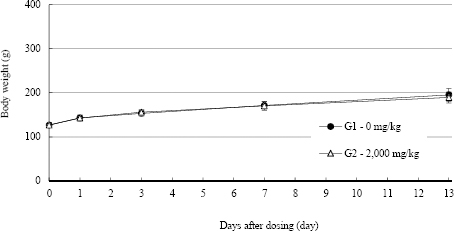
Table 7
Summary of Body Weights (g)
|
Sex |
Group/Dose (mg/kg) |
|
Days after dosing |
Gain |
|
|
0 |
1 |
3 |
7 |
13 |
0~13 |
|
Male |
G1 0 |
Mean |
159.5 |
177.3 |
201.9 |
247.8 |
308.2 |
148.6 |
|
S.D. |
5.4 |
5.9 |
5.6 |
10.1 |
12.0 |
6.8 |
|
N |
5 |
5 |
5 |
5 |
5 |
5 |
|
|
G2 2,000 |
Mean |
157.6 |
176.9 |
199.6 |
238.6 |
290.8*
|
133.2 |
|
S.D. |
4.1 |
3.6 |
3.2 |
4.4 |
6.6 |
7.7 |
|
N |
5 |
5 |
5 |
5 |
5 |
5 |
|
|
Female |
G1 0 |
Mean |
126.9 |
143.0 |
153.5 |
171.5 |
195.5 |
68.6 |
|
S.D. |
5.4 |
5.6 |
6.3 |
8.4 |
14.4 |
10.9 |
|
N |
5 |
5 |
5 |
5 |
5 |
5 |
|
|
G2 2,000 |
Mean |
126.9 |
142.9 |
156.2 |
170.6 |
189.6 |
62.7 |
|
S.D. |
4.6 |
7.0 |
6.0 |
9.8 |
12.2 |
11.7 |
|
N |
5 |
5 |
5 |
5 |
5 |
5 |
5. 혈액생화학적 검사
혈액생화학적 검사결과, 암수 2,000 mg/kg 투여군에서 대조군과 비교시 유의성 있는 변화는 인정되지 않았다( Table 8).
Table 8
|
Sex |
Group/Dose (mg/kg) |
|
ALT (U/L) |
AST (U/L) |
ALP (U/L) |
GGT (U/L) |
LDH (U/L) |
|
Male |
G1 0 |
Mean |
27.5 |
85.9 |
736.1 |
0.50 |
127 |
|
S.D. |
3.6 |
17.9 |
165.5 |
0.17 |
16 |
|
N |
5 |
5 |
5 |
5 |
5 |
|
|
G2 2,000 |
Mean |
29.4 |
99.5 |
869.7 |
0.50 |
168 |
|
S.D. |
3.2 |
10.6 |
260.8 |
0.11 |
76 |
|
N |
5 |
5 |
5 |
5 |
5 |
|
|
Female |
G1 0 |
Mean |
25.2 |
87.5 |
389.1 |
0.71 |
167 |
|
S.D. |
3.0 |
17.3 |
61.3 |
0.21 |
61 |
|
N |
5 |
5 |
5 |
5 |
5 |
|
|
G2 2,000 |
Mean |
27.6 |
80.6 |
452.0 |
0.78 |
170 |
|
S.D. |
6.4 |
19.5 |
52.1 |
0.19 |
62 |
|
N |
5 |
5 |
5 |
5 |
5 |
6. 육안적 부검소견
부검시, 암수 대조군 및 2,000 mg/kg 투여군에서 육안적 이상 소견은 관찰되지 않았다( Table 9).
Table 9
Summary of Necropsy Findings
|
Study |
The type of necropsy |
Sex |
Organ |
Group*
|
1 |
2 |
|
|
No. of animal |
5 |
5 |
|
B15567 |
Scheduled |
Male |
External surface and organs |
No. of examined |
5 |
5 |
|
Not remarkable |
5 |
5 |
|
|
Female |
External surface and organs |
No. of examined |
5 |
5 |
|
Not remarkable |
5 |
5 |
7. 조직병리학적 검사
2,000 mg/kg 투여군의 간에서 시험물질의 영향은 관찰되지 않았다. 2,000 mg/kg 투여군의 간에서 관찰된 모든 소견은 자연발생적으로 나타날 수 있는 소견이며, 대조군과 비교하여 빈도 또는 정도에서 변화가 없다고 판단되므로, 독성학적 의미는 없었다( Table 10, Fig. 3, 4).
Table 10
Summary of Histopathological Findings
|
Study |
The type of necropsy |
Sex |
Organ |
Group*
|
1 |
2 |
|
|
No. of animal |
5 |
5 |
|
B15567 |
Scheduled |
Male |
Liver |
No. of examined |
5 |
5 |
|
|
- Cell infiltration, mononuclear, focal/multifocal |
Grade 1**
|
1 |
1 |
|
Total number of affected |
1 |
1 |
|
|
- Cell infiltration, mononuclear, perivascular |
Grade 1 |
0 |
1 |
|
Total number of affected |
0 |
1 |
|
|
- Periportal vacuolation |
Grade 1 |
1 |
0 |
|
Total number of affected |
1 |
0 |
|
|
Female |
Liver |
No. of examined |
5 |
5 |
|
|
- Cell infiltration, mononuclear, focal/multifocal |
Grade 1 |
2 |
3 |
|
Total number of affected |
2 |
3 |
|
|
- Periportal vacuolation |
Grade 1 |
2 |
1 |
|
Total number of affected |
2 |
1 |
Fig. 3
Histological analysis of liver in male SD rats.
(A) Group1 (0 mg/kg) in male SD rats.
1101, 1102, 1105 : There were no remarkable findings in the liver.
1103 : Cell infiltration, mononuclear, focal/multifocal, Grade 1 (minimal)
1104 : Periportal vacuolation, Grade 1 (minimal)
(B) Group 2 (2,000 mg/kg) in male SD rats
1201, 1203, 1205 : There were no remarkable findings in the liver.
1202 : Cell infiltration, mononuclear, perivascular, Grade 1 (minimal)
1204 : Cell infiltration, mononuclear, focal/multifocal, Grade 1 (minimal)
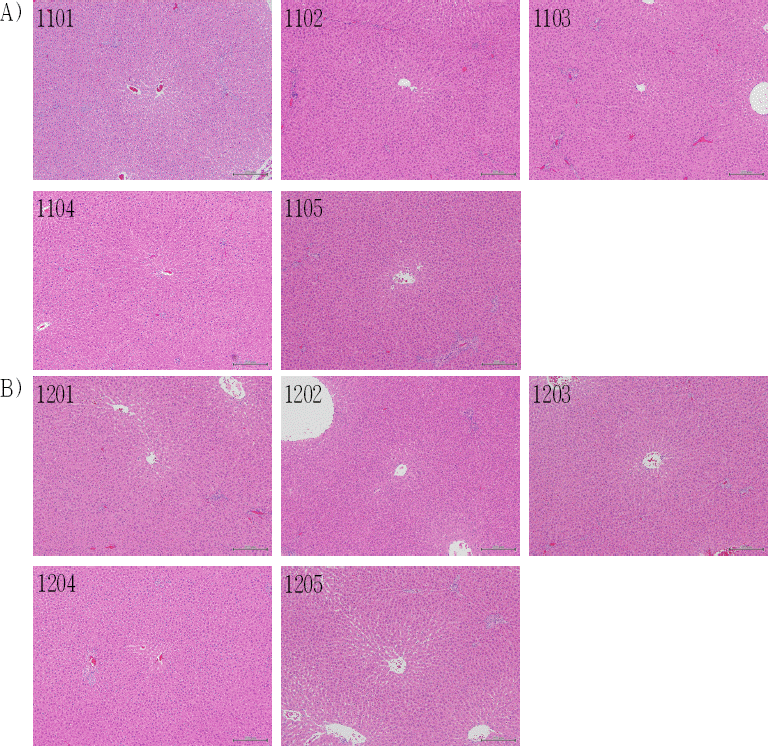
Fig. 4
Histological analysis of liver in female SD rats.
(A) Group1 (0 mg/kg) in female SD rats
2101, 2103 : There were no remarkable findings in the liver.
2102 : Cell infiltration, mononuclear, focal/multifocal, Grade 1 (minimal)
2104 : Cell infiltration, mononuclear, focal/multifocal, Grade 1 (minimal) Periportal vacuolation, Grade 1 (minimal)
2105 : Periportal vacuolation, Grade 1 (minimal)
(B) Group 2 (2,000 mg/kg) in female SD rats
2201, 2203 : There were no remarkable findings in the liver.
2202 : Cell infiltration, mononuclear, focal/multifocal, Grade 1 (minimal)
2204 : Cell infiltration, mononuclear, focal/multifocal, Grade 1 (minimal)
2205 : Cell infiltration, mononuclear, focal/multifocal, Grade 1 (minimal) Periportal vacuolation, Grade 1 (minimal)
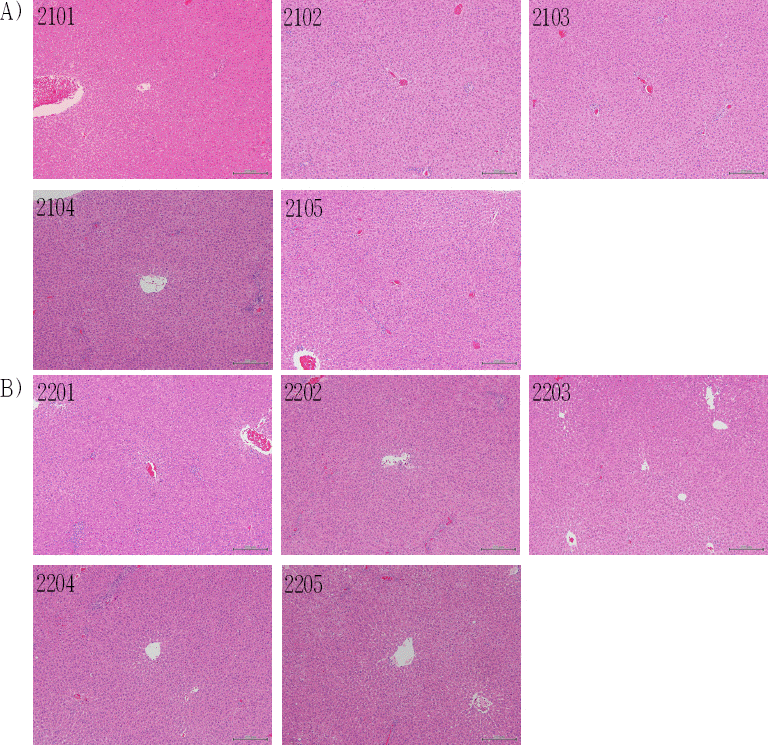
IV. 고 찰
Aconitum속 식물의 성분과 함량은 기원식물, 산지, 채집시기 및 가공방법에 따라 차이가 있다. Aconitum속 식물에는 독성이 강한 aconitine계 alkaloids인 aconitine, hypaconitine, jesaconitine 및 mesaconitine 등과 독성이 적은 atisine계 alkaloids인 atisine, apelline, songorine, ignavine, kousin, hetisine, heigenamine 및 lucidusculine 등이 함유되어 있다. 이러한 성분들은 修治나 炮製, 製劑化의 방법과 정도에 따라 독성이 감소하는데, 특히 열과 알칼리에 의하여 deacetylation, debenzoylation 및 oxidation 등의 반응이 일어나 독성이 낮은 benzoylaconine계, aconine계 및 pyroaconine계 등으로 변화되어 독성이 90%이상 저하된다 5,21-24. 생부자의 원약재, 생부자 열수추출물과 생부자로 조성된 삼부탕 열수추출물에 함유된 aconitine 함량을 분석한 결과 각각 0.1738%, 0.1746% 및 0.0961%로 나타났다.
본 실험에서는 생부자 열수추출시 생부자 원약재에 비하여 aconitine 함량은 큰 차이가 없었고, 생부자에 인삼을 配伍하여 열수추출시 생부자 열수추출물에 비하여 aconitine 함량이 29% 감소하였다. 염부자에 물을 가하여 100 °C 로 2시간 가열시 aconitine이 가수분해되어 aconitine계 알칼로이드 함량이 줄어들어 독성도 감소된다 25,26는 연구결과가 있으나 본 연구에서는 생부자 열수추출시 별다른 차이가 없었다. 따라서 본 실험에서는 연구방법의 차이로 열수추출시 aconitine이 가수분해되어 aconitine계 알칼로이드 함량이 줄어드는 것은 증명하지 못하였고, 인삼이 부자의 aconitine계 알칼로이드 함량을 감소시키는 것으로 생각할 수 있으나 더 자세한 기전은 추가 연구가 필요하다.
임상에서 많이 응용되고 있는 附子와 人蔘으로 조성된 蔘附湯은 안전성을 확보하고 있는지 확인하기 위하여, 암수 Sprague-Dawley 랫드를 이용하여 蔘附湯의 단회 경구투여 독성시험을 실시하였다.
일반증상 관찰의 경우, 투여당일에는 투여 후 30분, 1, 2, 4 및 6시간째에 독성징후의 종류, 발현시기 및 회복시기 등 일반상태와 사망유무를 관찰하였다. 투여 후 1일부터 14일까지는 매일 1회 일반증상을 관찰하였다. 관찰기간 동안, 암수 대조군 및 2,000 mg/kg 투여군에서 사망례는 없었으며, 일반증상의 이상도 관찰되지 않았다.
체중변화의 경우, 투여당일(투여 전), 투여 후 1, 3, 7 및 13일에 체중을 측정하였고, 수컷 2,000 mg/kg 투여군에서 투여 후 13일에 대조군과 비교시 투여군은 308.2±12.0 g, 대조군은 290.8g±6.6 g으로 유의성 있는 체중감소가 관찰되었지만(p<0.05), 전례에서 순조로운 체중증가가 관찰되었고, 일반증상의 이상이 관찰되지 않았으므로, 시험물질의 투여에 의한 영향은 아닌 것으로 판단된다. 관찰기간 동안, 암컷 2,000 mg/kg 투여군에서 대조군과 비교시 유의성 있는 체중변화는 없는 것으로 관찰되었다.
삼부탕의 간독성 여부를 알아보기 위하여 혈액생화학적 검사, 조직검사 및 부검을 시행하였다. 혈액생화학적 검사에서, ALT의 경우 수컷 대조군은 27.5±3.6 U/L, 수컷 2,000 mg/kg 삼부탕 투여군은 29.4±3.2 U/L, 암컷 대조군은 25.2±3.0 U/L, 암컷 2,000 mg/kg 삼부탕 투여군은 27.6±6.4 U/L로 암수 모두 삼부탕 투여군의 혈중 ALT 농도가 상승하였으나, 유의성 있는 변화는 아니었다.
AST의 경우 수컷 대조군은 85.9±17.9 U/L, 수컷 2,000 mg/kg 삼부탕 투여군은 99.5±10.6 U/L, 암컷 대조군은 87.5±3.0 U/L, 암컷 2,000 mg/kg 삼부탕 투여군은 80.6±19.5 U/L로 수컷은 삼부탕 투여군의 혈중 AST 농도가 상승하였으나 유의성 있는 변화는 아니었으며, 암컷은 도리어 대조군의 혈중 AST 농도가 상승하여 유의한 결과를 얻어내지 못하였다.
ALP의 경우, 수컷 대조군은 736.1±165.5 U/L, 수컷 2,000 mg/kg 삼부탕 투여군은 869.7±260.8 U/L, 암컷 대조군은 389.1±61.3 U/L, 암컷 2,000 mg/kg 삼부탕 투여군은 452.0±52.1 U/L로 암수 모두 삼부탕 투여군의 혈중 ALP 농도가 상승하였으나, 유의성 있는 변화는 아니었다.
GGT의 경우, 수컷 대조군은 0.50±0.17 U/L, 수컷 2,000 mg/kg 삼부탕 투여군은 0.5±0.11 U/L, 암컷 대조군은 0.71±0.21 U/L, 암컷 2,000 mg/kg 삼부탕 투여군은 0.78±0.19 U/L로 암수 모두 삼부탕 투여군과 대조군의 혈중 GGT 농도가 유사하여 유의성 있는 변화는 아니었다.
LDH의 경우, 수컷 대조군은 127±16 U/L, 수컷 2,000 mg/kg 삼부탕 투여군은 168±76 U/L, 암컷 대조군은 167±61 U/L, 암컷 2,000 mg/kg 삼부탕 투여군은 170±62 U/L로 암수 모두 삼부탕 투여군의 혈중 LDH 농도가 상승하였으나, 유의성 있는 변화는 아니었다.
부검을 실시한 모든 동물에 대해서 전신의 장기 및 조직에 대하여 상세한 육안검사를 실시하였다. 부검시, 암수 대조군 및 2,000 mg/kg 삼부탕 투여군에서 육안적 이상 소견은 관찰되지 않았다.
간에 대한 조직병리학적 검사를 한 결과, 암수 2,000 mg/kg 삼부탕 투여군의 간에서 삼부탕의 영향은 관찰되지 않았다. 암수 2,000 mg/kg 삼부탕 투여군의 간에서 관찰된 모든 소견은 자연발생적으로 나타날 수 있는 소견이며, 대조군과 비교하여 빈도 또는 정도에서 변화가 없다고 판단되므로, 독성학적 의미는 없었다.
이상의 연구결과를 종합해 보면, 생부자 단독으로 열수추출 하였을 때의 aconitine 함량은 큰 차이가 없었고, 人蔘과 配伍한 삼부탕을 열수추출 하였을 때의 aconitine 함량은 생부자 단독으로 열수추출 하였을 때의 aconitine 함량보다 29% 감소하여 인삼이 부자의 독성을 줄일 수 있는 것으로 생각된다. 삼부탕을 암수 6주령 랫드에 단회 경구 투여하여 삼부탕 투여군과 대조군을 비교 시 사망례가 없었으며, 일반증상 및 체중에 대하여도 유의한 변화가 없었고, 혈액생화학적 검사, 육안적 부검소견 및 조직병리학적 검사에 대해서도 유의성 있는 이상 결과가 없는 것으로 나타났다. 이는 부자 단미를 사용하기 보다는 부자에 인삼을 배오한 삼부탕의 안전성이 더 우수하다는 실험적 근거로써 의미 있는 연구라고 판단된다.
본 연구는 현재 유통되고 있는 생부자에 국한한 점과 동물실험 개체수가 작고, 간에 대해서만 조직검사를 한 것에 대한 제한점이 있다.
향후 국내에 유통되고 있는 炮製한 부자와 비교 분석하고, 인삼 이외의 여러 다른 한약재와 配伍 시 부자의 aconitine계 알칼로이드 함량변화 및 독성시험 관련하여 추가적인 연구가 필요할 것으로 생각된다.
V. 결 론
순도시험을 통한 aconitine의 함량 분석과 蔘附湯의 Sprague-Dawley계 암수 6주령 랫드에 단회 경구투여 시 사망유무, 일반증상, 체중변화, 혈액생화학적 검사, 육안적 부검소견 및 조직병리학적 검사를 조사하여 다음과 같은 결론을 얻었다.
Aconitine 함량은 생부자는 0.1738%, 생부자 열수추출물은 0.1746%, 삼부탕 열수추출물은 0.0961%로 측정되었다. 암수 대조군 및 2,000 mg/kg 삼부탕 투여군에서 사망례는 없었으며, 일반증상의 이상도 없는 것으로 나타났다. 암수 2,000 mg/kg 삼부탕 투여군에서 대조군과 비교시 유의성 있는 체중변화는 없는 것으로 나타났다. 혈중 ALT, AST, ALP, GGT 및 LDH의 농도는 암수 2,000 mg/kg 삼부탕 투여군에서 대조군과 비교하여 유의성 있는 변화는 없는 것으로 나타났다. 부검 시, 암수 대조군 및 2,000 mg/kg 삼부탕 투여군에서 장기 및 조직의 육안적 이상 소견은 없는 것으로 나타났다. 간조직 검사에서 암수 2,000 mg/kg 삼부탕 투여군은 대조군과 비교하여 이상이 없는 것으로 나타났다. 삼부탕의 단회 경구 투여를 한 결과, 치사량은 암수 모두 2,000 mg/kg을 상회하는 것으로 판단된다.
결론적으로 생부자의 aconitine 함량과 단회 경구 투여 독성시험 결과에서 보듯이 한의학적 진단에 따라 적절하게 사용된다면 부자의 독성을 극복할 수 있을 것으로 생각된다.
참고문헌
1. Park HM, Jang IS, Lee SD. Hepatotoxic Events Associated with Herbal Medicinal Products, Folk Remedies and Food Supplements in Korea. J Korean Oriental Med 2005:26(2):152–65.
2. Jang IS, Yang CS, Lee SD, Han CH. A Review of Herbal Medicinal Products Associated with Toxic Events in Korea. J Korean Oriental Med 2007:28(1):1–10.
3. Lee E, Park BW, Hea GJ, Ko H. A Study on The Side Effects and Toxicity of Herbal Medicine. Korean J Orient Int Med 2002:23(2):222–7.
4. Kang BS, Kim IR, Kim HC, Guk YB, Park YG, Seo BI, et al. Bonchohak Seoul: Yeonglimsa: 2007. p. 372–4. 572-5.
5. Shin MK. Imsang-bonchohak Seoul: Yeonglimsa: 2000. p. 188–91. 298-304.
6. Shin GG. Shinci-bonchohak(各論) Seoul: Gomunsa: 1988. p. 1–8. 23-9.
7. Kang BS, Kim YP. Imsangbaehap-bonchohak Seoul: Yeonglimsa: 1996. p. 108–12. 193-6.
8. Ahn SY, Kim SI. Bonchojeongeui Seoul: Cheonghong: 2009. p. 45–65. 540-53.
9. Shim YG. Jungyak-pharmacology Beijing: Inminwiseng: 2000. p. 490–6.
10. Seo BI, Jeong GY. Easily learning bonchohak Gyeongsan: Daeguhani-university publishing department: 2007. p. 209–12.
11. Joe CH. Jungchoyakjungdokgeupgu. Seongdo-jeongigongjeong hakwon 1989:68–9.
12. Lee JS, Yun YG. A Study on the Applications of Radix Aconiti Lateralis Prepararta Mainly Blended Prescription in Dongeuibogam. Master’s thesis of Wonkwang University Graduate School 2010:1–38.
13. Song IS, Oh MS, Song TW. The study of Acontii Tuber in Bang-Yak-Hap-Pyun. Daejeon University Institute of Oriental Medicine 2001:10(1):323–36.
14. Lee HH, Ryu SJ. The investigation about the Seokgok’s use of Rehmanniae Radix and Aconiti Iateralis Preparata Radix. J Somun Oriental Medical Society 2007:10(1):75–82.
15. Lee B. Bangjaehak(Sangchec) Beijing: Inminwiseng: 2011. p. 676.
16. Jang JW, Kim JY, Min SS, Song SJ, Kim KT, Hwang WD. The Consequences of Long-period Dosages of Herbal Medicine Including Boo-ja and Cheon-o on Liver Injury. Korean J Orient Int Med 2005:26(4):828–35.
17. Song SJ, Jang JW, Hwang WD. The Consequences of Long-period Dosages of Herbal Medicine Including Boo-ja and Cheon-o on Liver Injury (II). Korean J Orient Int Med 2006:27(2):407–15.
18. Han HY, Hwang WD. The Study of Dosages of Herbal Medicine Including Aconiti Lateralis Preparata Radix and Aconiti Tuber on Aspartate Aminotransferase, Alanine Aminotransferase. Kor J Herbology 2009:24(4):87–93.
19. Lee YJ, Kim KG, Hwang WD, Lee JW, Jeong HJ, Bae SH. The Study of Safety of Herbal Medicine Including Fuzi(Buja) on High Range of LFT, RFT Patients. The Korean Journal of Oriental Medical Prescription 2011:19(2):179–89.  20. Ahn SY, Hwang WD. The Consequences of Dosage of Herbal Medicine Including Buja and Cheono on Electrocardiography. Master’s thesis of Dongeui University Graduate School 2015:1–28.
21. Kang BS, Seo BI, Choi HY. Herbal medicine processing and clinical application Seoul: Yeonglimsa: 2003.
22. Kim YK, Lee JH, Song KY, Park SK, Kim CS. Studies on the Liver Toxicities with different Dosage of Wild Aconiti Tuber Decoction. The Korean Journal of Oriental Medical Prescription 2005:13(1):123–43.
23. Lim TH, Park KY. A case of aconitine poisoning with transient tetraplegia and hypocalcemia. Korean Journal of Medicine 1998:55(6):1093–6.
24. Lee JH. Effects on Gene Expressions in the Liver and Transition Ratio of Cytotoxic Alkaloid Components in Herbal Prescriptions Containing Aconitum Species. Doctor’s thesis of Wonkwang University Graduate School 2006:1–76.
25. Hikino H, Yamada C, Nakamura K, Sato H, Ohizumi Y, Endo K. Change of Alkaloid Composition and Acute toxicity of Aconitum Roots during Processing. Yakugaku Zasshi 1977:97(4):359–66.  26. Park HS, Kim SH, Kim PY, Chang IM. Toxicological Studies on Raw and Processed Aconiti Tubers;Acute, Subacute Toxicity Studies and Assay of Aconitine Alkaloids. Korean J Toxicol 1990:6(1):41–9.
|
|















