과루인 및 과루인청혈플러스가 인간 탯줄 정맥 내피 세포(Human umbilicl vein endothelial cells, HUVECs)에서 염증인자 발현 억제에 미치는 영향
The Effect of Trichosanthes Kirilowii Maximowicz Extract and Trichosanthes Kirilowii Maximowicz Cheonghyeol Plus on Anti-Inflammatory Factor Expression in Human Umbilical Vein Endothelial Cells (HUVECs)
Article information
Abstract
Objective:
To examine the effects of Trichosanthes kirilowii Maximowicz extract (TE) and Trichosanthes kirilowii Maxi mowicz Cheonghyeol Plus Phellinus linteus Cheonghyeol plus (TCP) on anti-inflammatory factor expression in human umbilical vein endothelial cells (HUVECs).
Methods:
HUVECs were activated with TNF-α and then treated with TE and TCP. The expression levels were then measured for intracellular genes (KLF2, eNOS, MCP-1, ICAM-1, and VCAM-1), proteins (KLF2, eNOS, MCP-1, ICAM-1, VCAM-1, ERK, and JNK, p38), and extracellular biomarkers (ICAM-1, VCAM-1, and MCP-1).
Results:
1. TCP at concentrations of 100 μg/mL or greater significantly increased the expression of KLF2 and eNOS intracellular genes and significantly decreased the expression of ICAM-1, VCAM-1, and MCP-1 genes compared to the control group.
2. TCP at concentrations of 100 μg/mL or greater significantly increased the expression of KLF2, eNOS proteins compared to the control group, and significantly reduced the expression of VCAM-1, ICAM-1, MCP-1, ERK, and p38 proteins. However, JNK protein phosphorylation showed no significant change compared to the control group.
3. TCP at concentrations of 100 μg/mL or more significantly decreased the production of MCP-1, ICAM-1, and VCAM-1 extracellular biomarkers compared to the control group.
4. TE at a concentration of 100 μg/mL did not cause any significant change in the expression of intracellular genes or proteins, in the production of the extracellular biomarker MCP-1, or in the amount of JNK protein compared to the control group. Other intracellular genes, proteins, and extracellular biomarker expression showed the same trend as observed with TCP exposure.
Conclusion:
This study experimentally confirmed that TE and TCP could be effective in preventing or inhibiting various inflammatory vascular diseases due to their anti-inflammatory effects.
I. 서 론
죽상 경화증은 당뇨병, 고혈압, 이상지질혈증, 비만 등 다양한 대사질환의 종착역으로 인식되고 있다. 과거에 죽상 경화증은 단순 지질이 침착되는 것으로 인식되었으나 최근에는 혈관 내피세포, 면역세포, 혈관 평활근 세포들의 염증반응으로 인식되고 있다1. 이상지질혈증 등 심혈관질환 위험요인이 화학적, 면역 반응을 일으켜 혈관 내피세포에 손상을 주고, LDL-cholesterol이 손상된 내피세포에 들어가 산화 반응을 발생시킨다. 그리고 Vascular cell adhesion molecule(VCAM)-1, Intercellular adhesion molecule(ICAM)-1 등의 부착분자(adhesion molecule) 발현을 증가시켜 혈액 내 단핵구가 혈관 벽 부착하면서 내피세포 아래 공간으로 들어가 대식세포로 분화된다2. 분화된 대식세포는 Monocyte chemoattractment protein(MCP)-1 분비를 통해 또 다른 단핵구 유입을 유도하고 산화물질 분비를 통해 더욱 산화 시킨다3. 또 대식세포, 혈관평활근세포, T림프구 등이 지속적인 만성 염증반응을 일으켜 혈관 평활근 세포가 증식하여 plaque를 만든다1.
Nitric oxide(NO)는 평활근 이완으로 혈관 이완, 신경전달, 혈소판 응집 억제, 면역 조절, 세포 독성 등 역할을 한다4. Nitric oxide synthase(NOS)는 NO를 합성하는 역할을 하고 neuronal NOS(nNOS), mononuclear phagocyte inducible NOS(iNOS), endothelial NOS(eNOS) 세 종류가 있다. 내피세포에서 발현되는 NO를 합성하는 eNOS는 관상동맥 연축과 혈압을 조절한다고 알려져 있다. eNOS 7번 염색체에 위치한 exon7의 894번째 염기변이(G894T (Glu298Asp))가 관상동맥 경련, 심근경색의 주요 원인이라고 제기되고 있다5.
Mitogen-activated protein kinases(MAPKs)는 p38, c Jun N terminal kinase(JNK), extracellular signal regulated kinase(ERK)를 포함한다. 세균 세포벽 구성성분으로 염증반응을 일으키는 lipopolysaccharide (LPS)는 대식세포 표면 TLR4를 자극하여 MAPKs 신호 전달 경로를 활성화하고 prostaglandin(PG)s, pro-inflammatory cytokines, NO 등 여러 염증 매개 인자를 발현시켜 면역기능 장애를 일으킨다6.
한의학적으로 이상지질혈증과 관련된 연구는 활발히 이루어지고 있고 그 중 대전대학교 심계내과학교실에는 山楂, 茵蔯蒿, 丹蔘, 鬱金으로 구성되어 있는 청혈플러스를 개발, 처방하고 있다. 청혈플러스는 다양한 연구에서 항산화, 항염증 효능과 항고지혈증 기능이 확인된 약7,8이다. 과루인은 葫蘆科(박과; Cucuritaceae)에 속한 다년생 하늘타리의 성숙한 과실의 종자로 saponin, glycoside 등 유기물질을 가지고 있다9. 과루인은 化痰止咳平喘藥에 분류되어 性味는 寒, 微苦, 甘하고 潤肺化痰, 散結消癰, 滑腸通便 등의 효능이 있다10. 또 항염증 효과가 있어 NO, IL-6, TNF-α, IL-β 생성량 증가를 억제 시킨다11. 본 연구에서는 항염증 효과를 가졌다고 밝혀진 과루인과 이러한 과루인을 가미한 과루인청혈플러스의 항염증약 가능성을 염두에 두고 실험을 진행하였다. KLF-2, eNOS, VCAM-1, MCP-1, ICAM-1 등의 유전자 및 단백질 발현량을 측정하여 과루인과 과루인청혈플러스의 염증 관련 인자를 억제하는지 확인하였다.
II. 재료 및 방법
1. 재 료
1) 시 료
본 연구에 사용된 과루인(Trichosanthes kirilowii Maximowicz extract, TE)과 과루인청혈플러스(Trichosanthes kirilowii Maximowicz Cheonghyeol Plus, TCP)의 구성 약재는 한약재 유통업체인 (주)옴니허브에서 검수된 한약재를 구입하여 사용하였으며, 그 구성은 아래와 같다(Table 1).
2) 시 약
본 연구에는 EGM™-2 endothelial cell growth medium-2 bullet kit™(CC-3162, Lonza, U.S.A.), EZ-cytox(EZ-3000, Daeilab, Korea), tumor necrosis factor-α human(TNF-α : SRP3177-50UG, Sigma-Aldrich, U.S.A.), gelatin solution(G1393, Sigma-Aldrich, U.S.A.), trypan blue(T8154-100 mL, Sigma-Aldrich, U.S.A.), dulbecco’s phosphate buffered saline(D-PBS : LB 201-02, Welgene, Korea), trypsin-EDTA solution(LS 015-10, Welgene, Korea), human MCP-1 ELISA kit(K0331218, Komabiotech, Korea), KLF2 ELISA kit(MBS931735, Mybiosource, U.S.A.), human ICAM-1 ELISA kit(K0331281, Komabiotech, Korea), human VCAM-1 ELISA kit(K0332185, Komabiotech, Korea), eNOS ELISA kit(MBS160479, Mybiosource, U.S.A.), SYBR Green(204145, Qiagen, Germany), total RNA prep kit(17221, Intronbio, Korea), accupower cyclescript RT premix(K-2048, Bioneer, Korea), DEPC-DW (C-9030, Bioneer, Korea), RIPA lysis and extraction buffer(89900, Thermo Fisher, U.S.A.), pierce™ BCA protein assay Kit(23225, Thermo Fisher, U.S.A), bovine serum albumin(BSA : CA068-010, Gendepot, U.S.A.), protease inhibitor cocktail(P8340-5 mL, Sigma-Aldrich, U.S.A.), phosphatase inhibitor cocktail 2(P5726-5 mL, Sigma-Aldrich, U.S.A.), phosphatase inhibitor cocktail 3(P0044-5 mL, Sigma-Aldrich, U.S.A.), primary antibody(2485, Cell Signaling Technology, U.S.A., AF-410-NA, Novus Biologicals U.S.A.), secondary antibody(109-001-001, Jackson Immunoresearch, U.S.A.), miracle-star™ western blot detection system(16028, Intron Biotechnology, Korea) 등 시약을 사용하였다.
3) 기 기
본 연구에는 extraction mantle(Misung Scientific, Korea), rotary vacuum evaporator(EYELA, Japan), CO2 incubator(Sanyo, Japan), freeze dryer(ilShinbiobase, Korea), vortex mixer(Vision scientific, Korea), clean bench(Vision scientific, Korea), autoclave(Sanyo, Japan), deep-freezer(Sanyo, Japan), centrifuge(Vision scientific, Korea), plate shaker(Lab-Line, U.S.A.), ice-maker(Vision scientific, Korea), micro plate reader(Molecular Devices, U.S.A.), nanodrop(Thermo Fisher, U.S.A.), luminex(Millipore, U.S.A.), real-time PCR cycler(Rotor-Gene Q : Qiagen, Germany), PCR cycler(alpha cycler 1 PCRmax : PCRmax, U.K.), chemidoc(fusion FX : Vilber Lourmat, France)등을 사용하였다.
2. 방 법
1) 시료 추출
100 g의 과루인과 2첩 분량(100 g)의 과루인청혈플러스에 각각 1 L의 증류수를 첨가하여 100 °C 온도에서 3시간 동안 추출하였으며, 여과지를 사용하여 추출물을 여과하였다. 여과된 추출물은 rotary vacuum evaporator를 사용하여 감압농축하고 freeze dryer를 사용하여 동결건조를 진행하였다. 동결건조 완료 후, TE는 2.08 g(수득율 : 2.08%), TCP는 12.60 g(수득률 : 12.60%)의 분말을 얻었으며, -20 °C에 보관하면서 실험 당일 소분하고 증류수에 용해 시켜 사용하였다.
2) 세포 배양
인간 유래 혈관내피세포인 Human umbilical vein endothelial cells(HUVECs)은 Lonza(Switzerland)에서 분양받아 사용하였으며, EGM™-2 singlequots™과 EGM™-2 medium과 kit가 혼합된 배지를 이용하여 37 °C, 5% CO2 조건이 유지되게끔 하는 세포배양기에서 배양하였다. 세포의 계대 배양은 2-3일 주기로 진행하였으며, 실험에 사용되는 모든 plate는 0.2% gelatin solution으로 30분간 코팅한 후 PBS로 세척하여 사용하였다.
3) 세포생존율 측정
HUVECs를 48 well plate에 1×105 cells/well로 분주 처리 후 24시간 동안 배양하였으며, 24시간 후, TE는 100 ug/mL로 처리하고 TCP는 100, 200, 400, 600 ug/mL의 농도로 처리해서 다시 24시간 동안 배양하였다. 모든 배양이 종료된 뒤 배양액 100 μL당 10 μL의 EZ-Cytox 시액을 사용하여 30분간 세포배양기에서 반응시켰다. 반응 후 450 nm에서 흡광도를 측정한 후 대조군에 대한 TE, TCP 세포생존율을 백분율로 표시하였다.
4) 시료 및 약물 처리
HUVECs를 6 well plate에 1×106 cells/well로 분주한 후 24시간에 걸쳐 배양하였으며, 24시간 후, TE는 100 ug/mL로 처리하고 TCP는 100, 200, 400 ug/mL의 농도로 전처리하고 1시간 후에 TNF-α 10 ng/mL를 추가하여 다시 24시간 동안 배양하였다. 모든 배양이 종료된 후 원심분리하여 얻은 세포는 유전자 및 단백질 발현량 측정에 사용하였으며, 상등액은 바이오마커 생성량 측정에 사용하였다.
5) 유전자 발현량 측정
시료 및 약물을 처리한 세포는 total RNA prep kit를 사용하여 RNA를 추출하였으며, 추출한 RNA는 reverse transcription premix와 혼합하고 PCR cycler를 사용하여 45 °C에서 60분, 95 °C에서 5분간 반응을 통해 cDNA를 합성하였다. 합성된 cDNA로부터 특정 유전자를 증폭시켜 확인하기 위해 real-time PCR을 진행하였으며, cDNA와 특정 유전자에 맞는 primer, SYBR green premix를 혼합하여 95 °C에서 2분 동안 반응시키고 95 °C에서 5초, 62.5 °C에서 30초씩 40회를 반복하여 KLF2, eNOS, MCP-1, ICAM-1, VCAM-1 유전자를 증폭시켰다. 유전자 발현량은 대조군의 유전자 발현량을 기준으로 상대정량 하였으며, 사용된 primer들의 정보는 Table 2와 같다(Table 2).
6) 단백질 발현량 측정
시료 및 약물을 처리한 세포는 protease inhibitor cocktail I, phosphatase inhibitor II, III가 있는 RIPA buffer를 첨가하여 단백질을 추출하였다. 추출한 단백질은 BCA protein assay kit를 이용하여 정량하였으며, sample loading buffer와 섞어 95 °C에서 5분간 반응시켜 준비하였다. 준비된 단백질은 10% acrylamide gel을 사용하여 SDS-PAGE 후 크기별로 분리하였고, PVDF membrane에 이동시켰다. 단백질이 옮겨진 membrane을 3% BSA에 넣어 상온에서 2시간 반응시켰다. TBS-T buffer를 이용하여 세척 후 primary antibody를 첨가하여 4 °C에서 16시간 동안 반응시켰다. 다시 3회 세척 후 secondary antibody를 첨가하여 상온에서 1시간 동안 반응시키고, 다시 세척하고 나서 ECL solution 첨가를 통해 단백질을 발색시켰다. 이후, chemidoc fusion FX로 KLF2, eNOS, MCP-1, ICAM-1, VCAM-1, ERK, p38, JNK 단백질 발현량을 분석하였다.
7) 바이오마커 생성량 측정
시료 및 약물을 처리한 세포 상등액과 standard를 96 well plate에 각각 100 μL씩 넣어 37 °C에서 2시간 동안 반응시켰다. 반응 후, washing buffer를 사용하여 4회 세척 작업을 한 후, 100 μL의 detection antibody를 첨가하여 다시 37 °C에서 2시간 반응시키고 나서 세척 하였다. 세척 후, HRP conjugate를 100 μL씩 첨가하여 37 °C에서 30분간 반응시킨 후 세척하여 다음 substrate reagent를 100 μL씩 첨가하여 37 °C에서 15분 동안 반응시킨 후 100 μL의 stop solution을 넣어 micro plate reader를 통해 450 nm 조건에서 MCP-1, ICAM-1, VCAM-1 흡광도를 측정하였고, standard curve를 기준으로 삼아 절대값으로 표기하였다.
3. 통계처리
연구 결과는 mean±standard error of mean으로 나타내었으며, SPSS Statistics Version 21.0(IBM, U.S.A.)을 이용하였으며, 먼저 두 그룹 간의 통계적 비교는 independent sample t-test를 사용하여 수행하였고 여러 그룹 간의 통계적 비교는 analysis of variance(ANOVA)를 사용하여 수행하였다. 이 후 Tukey’s HSD test를 하여 유의수준 0.05로 설정하고 유의성을 검사하였으며, p<0.001, p<0.05, p<0.01의 3가지 유의수준으로 나누어 표기하였다.
III. 실험 결과
1. 세포생존율
TE, TCP 세포생존율을 확인 결과, TE는 100 ug/mL 농도에서 세포 독성이 나타나지 않았으며, TCP는 600 ug/mL 이상의 농도에서 80% 이하의 세포생존율이 나타났으며, 이후 연구에서 100 ug/mL부터 400 ug/mL까지 농도로 설정하여 사용하였다(Fig. 1).

Cell viability of TE or TCP in HUVEC.
HUVEC were treated by TE (100 ug/mL) or TCP (100, 200, 400, and 600 ug/mL) for 24 hours. Treated cells were reacted by EZ-Cytox for 30 minutes and absorbance was measured at 450 nm using micro plate reader. Cell viability was calculated as percentage relative to the control group. The results were presented by the mean±standard error of mean from three independent experiments (Significance of results, ** ; p<0.01 compared to the control).
2. 세포 내 유전자 발현량
1) KLF2
세포 내 KLF2 유전자 발현량 측정 결과, TE는 100 ug/mL 농도에서 대조군과 비교 시 유의적인 증가가 나타났으며, TCP는 100 ug/mL 이상의 농도에서 농도 의존적이고 대조군에 비해 유의적인 증가를 확인할 수 있었다(Fig. 2A).

Effect of TE or TCP on KLF2 (A), eNOS (B) mRNA expression level in HUVECs.
HUVECs were treated TE (100 ug/mL) or TCP (100, 200, and 400 ug/mL), with TNF-α 10 ng/mL for 12 h. The mRNA expression level was measured using a real-time PCR (qPCR). The results were presented by the mean±standard error of mean from three independent experiments (Significance of results, +++ ; p<0.001 compared to the normal group, ** ; p<0.01, *** ; p<0.001 compared to the control group).
2) eNOS
세포 내 eNOS 유전자 발현량 측정 결과, TE는 100 ug/mL 농도에서 대조군과 비교 시 유의적인 증가가 나타났으며, TCP는 100 ug/mL 이상의 농도에서 농도 의존적이고 대조군에 비해 유의적인 증가를 확인할 수 있었다(Fig. 2B).
3) MCP-1
세포 내 MCP-1의 유전자 발현량을 측정한 결과, TE는 100 ug/mL 농도에서 대조군과 비교 시 유의적인 변화가 나타나지 않았으며, TCP는 100 ug/mL 이상의 농도에서 농도 의존적이고 대조군에 비해 유의적인 감소를 확인했다(Fig. 3A).

Effect of TE or TCP on MCP-1 (A), ICAM-1 (B), VCAM-1 (C) mRNA expression level in HUVECs.
HUVECs were treated TE (100 ug/mL) or TCP (100, 200, and 400 ug/mL), with TNF-α 10 ng/mL for 12 h. The mRNA expression level was measured using a real-time PCR (qPCR). The results were presented by the mean±standard error of mean from three independent experiments (Significance of results, +++ ; p<0.001 compared to the normal group, ** ; p<0.01, *** ; p<0.001 compared to the control group).
4) ICAM-1
세포 내 ICAM-1의 유전자 발현량 측정 결과, TE는 100 ug/mL 농도에서 대조군과 비교 시 유의적 감소를 확인했고, TCP는 200 ug/mL 이상의 농도에서 농도 의존적이고 대조군에 비해 유의적인 감소를 확인했다(Fig. 3B).
5) VCAM-1
세포 내 VCAM-1의 유전자 발현량 측정 결과, TE는 100 ug/mL 농도에서 대조군과 비교 시 유의적 감소를 확인했고, TCP는 100 ug/mL 이상의 농도에서 농도 의존적이고 대조군에 비해 유의적인 감소를 확인했다(Fig. 3C).
3. 세포 내 단백질 발현량
1) KLF2
세포 내 KLF2 단백질 발현량을 측정한 결과, TE는 100 ug/mL 농도에서 대조군보다 유의적인 증가가 나타났으며, TCP는 100 ug/mL 이상의 농도에서 농도 의존적이고 대조군에 비해 유의한 증가가 나타났다(Fig. 4A).

Effect of TE or TCP on KLF2 (A), eNOS (B) protein expression level in HUVECs.
HUVECs were treated TE (100 ug/mL) or TCP (100, 200, and 400 ug/mL), with TNF-α 10 ng/mL for 12 hours. The protein expression level was measured using a western blot. The results were presented by the mean±standard error of mean from three independent experiments (Significance of results, +++ ; p<0.001 compared to the normal, *** ; p<0.001 compared to the control).
2) eNOS
세포 내 eNOS 단백질 발현량을 측정한 결과, TE는 100 ug/mL 농도에서 대조군과 비교 시 유의적인 증가가 나타났으며, TCP는 100 ug/mL 이상의 농도에서 농도 의존적이고 대조군에 비해 유의한 증가가 나타났다(Fig. 4B).
3) MCP-1
세포 내 MCP-1 단백질 발현량을 측정한 결과, TE는 100 ug/mL 농도에서 대조군과 비교 시 유의적인 변화가 나타나지 않았으며, TCP는 100 ug/mL 이상의 농도에서 농도 의존적이고 대조군에 비해 유의적 감소를 확인했다(Fig. 5A).
Effect of TE or TCP on MCP-1 (A), ICAM-1 (B), VCAM-1 (C), ERK (D), p38 (E) protein expression level in HUVECs.
HUVECs were treated TE (100 ug/mL) or TCP (100, 200, and 400 ug/mL), with TNF-α 10 ng/mL for 12 hours. The protein expression level was measured using a western blot. The results were presented by the mean±standard error of mean from three independent experiments (Significance of results, +++ ; p<0.001 compared to the normal, *** ; p<0.001 compared to the control).
4) ICAM-1
세포 내 ICAM-1 단백질 발현량을 측정한 결과, TE는 100 ug/mL 농도에서 대조군과 비교 시 유의적인 감소가 나타났으며, TCP는 100 ug/mL 이상의 농도에서 농도 의존적이고 대조군에 비해 유의성 있는 감소를 확인할 수 있었다(Fig. 5B).
5) VCAM-1
세포 내 VCAM-1 단백질 발현량을 측정한 결과, TE는 100 ug/mL 농도에서 대조군에 비해서 유의적인 감소가 확인되었고, TCP는 100 ug/mL 이상의 농도에서 농도 의존적이고 대조군에 비해 유의적 감소를 확인했다(Fig. 5C).
6) ERK
세포 내 ERK 단백질 인산화를 측정한 결과, TE는 100 ug/mL 농도에서 대조군과 비교 시 유의적인 감소를 확인할 수 있었고, TCP는 100 ug/mL 이상의 농도에서 농도 의존적이고 대조군에 비해 유의적 감소가 확인되었다(Fig. 5D).
7) p38
세포 내 p38 단백질 인산화를 측정한 결과, TE는 100 ug/mL 농도에서 대조군에 비해 유의적 감소가 확인되었으며, TCP는 100 ug/mL 이상의 농도에서 농도 의존적이고 대조군에 비해 유의적 감소가 확인되었다(Fig. 5E).
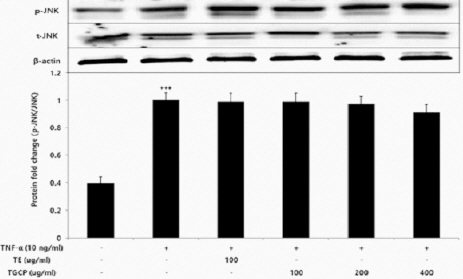
8) JNK
세포 내 JNK 단백질 인산화를 측정한 결과, TE와 TCP는 대조군에 비해 유의적인 변화가 나타나지 않았다(Fig. 6).

Effect of TE or TCP on JNK protein expression level in HUVECs.
HUVECs were treated TE (100 ug/mL) or TCP (100, 200, and 400 ug/mL), with TNF-α 10 ng/mL for 12 hours. The protein expression level was measured using a western blot. The results were presented by the mean±standard error of mean from three independent experiments (Significance of results, +++ ; p<0.001 compared to the normal, *** ; p<0.001 compared to the control).
4. 세포 외 바이오마커 생성량
1) MCP-1
세포 외 MCP-1 생성량을 측정한 결과, TE는 100 ug/mL 농도에서 대조군보다 유의적인 변화가 나타나지 않았으며, TCP는 100 ug/mL 이상의 농도에서 농도 의존적이고 대조군에 비해 유의적 감소를 확인했다(Fig. 7A).
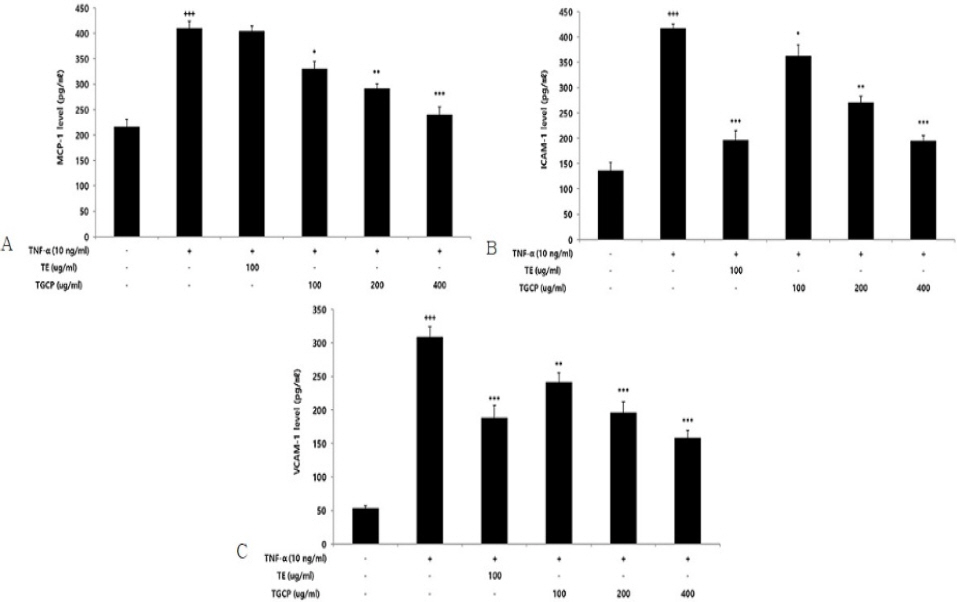
Effect of TE or TCP on MCP-1 (A), ICAM-1 (B), VCAM-1 (C) level in HUVECs.
HUVECs were treated TE (100 ug/mL) or TCP (100, 200, and 400 ug/mL), with TNF-α 10 ng/mL for 12 hours. MCP-1 level was measured using a ELISA kit. The results were presented by the mean±standard error of mean from three independent experiments (Significance of results, +++ ; p<0.001 compared to the normal, * ; p<0.05, ** ; p<0.01, *** ; p<0.001 compared to the control).
2) ICAM-1
세포 외 ICAM-1 생성량을 측정한 결과, TE는 100 ug/mL 농도에서 대조군보다 유의적인 감소가 나타났으며, TCP는 100 ug/mL 이상의 농도에서 농도 의존적이고 대조군에 비해 유의적 감소가 확인되었다(Fig. 7B).
3) VCAM-1
세포 외 VCAM-1 생성량을 측정한 결과, TE는 100 ug/mL 농도에서 대조군보다 유의적인 감소가 확인되었고, TCP는 100 ug/mL 이상의 농도에서 농도 의존적이고 대조군에 비해 유의적 감소세를 보였다(Fig. 7C).
IV. 고 찰
2020년 우리나라 통계청 사망통계에 의하면 심뇌혈관계 질환은 주요 사망원인 2위를 차지하고 있고, 심장질환으로 인한 사망률은 여자 10만 명 당 63.7명, 남자 10만 명 당 62.3명으로 확인되었며 뇌혈관 질환으로 인한 사망률은 여자 10만 명 당 43.6명, 남자 10만 명 당 41.5명으로 확인되었다12.
죽상 경화는 물리적, 화학적 자극, 생물학적 손상으로 인한 혈관 내피 손상에 의해 발생하며, 이때 발생하는 내피세포 손상은 염증반응에 중요한 요인이 된다. 산화된 LDL-cholesterol이 손상된 혈관 내피세포 안으로 단핵구를 유입시키면서 죽상 경화가 발생이 시작된다13. 혈관 내피세포는 ICAM-1, VCAM-1 등 세포 부착 인자를 발현하여 백혈구를 불러들인다. ICAM-1은 병변이 아닌 부위에서도 발현되고 VCAM-1은 병변 부위에서만 발현된다14. Cytokine의 몇몇 종류는 염증세포를 끌어들여 혈관 내로 이동시키는 물질로 염증세포와 방향성 있는 운동(Chemotaxis)을 유도하여 Chemokine이라고 일컬어지고 그 중 MCP-1이 가장 많은 연구가 이루어진 Chemokine이다. 혈관 내로 이동한 단핵구는 혈관 벽 안 염증반응에 의해 대식세포로 분화되고 foam cell로 변화한 후 강력한 염증 반응을 일으킨다15. 전환된 foam cell이 혈관 내막에 쌓이면서 혈류를 막아 죽상 경화증이 발병하게 된다16.
과루인청혈플러스(TCP)는 瓜蔞仁, 茵蔯蒿, 鬱金, 山楂, 丹蔘 10 g씩으로 구성되었다. 청혈플러스는 대전대학교 한방병원에서 주로 고지질혈증 환자를 대상으로 처방되는 약으로 항산화, 항염증 효과가 밝혀져 있으며7,8 여기에 과루인 추출물(TE)을 추가한 약물이 TCP이다. 과루인은 NO, TNF-α 등 염증반응에 관여하는 물질 생성을 억제한다는 연구11 등이 진행되어 항염증 효능이 꾸준히 밝혀지고 있다. 본 연구에서는 혈관 염증반응을 억제하는 효능이 있는 TE와 이러한 TE 10 g을 청혈플러스에 가감한 TCP를 대상으로 인간 탯줄 정맥 내피 세포(Human umbilical vein endothelial cells, HUVECs)에서 죽상 경화 발생에 관여하는 염증인자 발현 억제에 미치는 영향을 조사하였다.
HUVECs는 제대 정맥 내피세포로 가지 치지 않는 큰 혈관이며 내피 표면이 넓어 내피세포 세포 배양이 수월하고 관 삽입, 세척, 탈락 세포 수집에 있어 다른 혈관에 비해 더 유리하여 많은 질환에 대해 연구하는 실험 세포로 쓰여 왔다17.
혈관 내피세포의 주요 기능은 혈액과 조직 사이의 장벽 형성, 혈관 긴장도 조절, 면역세포 동원, 혈액 응고 및 혈관 신생 조절이 있고 KLF2는 이러한 혈관 내피세포 기능의 모든 과정에 작용한다. 따라서 KLF2 의존 유전자들은 혈액 응고 억제 및 T세포, 대식세포가 혈관 내피와의 응집 억제를 통해 죽상 경화를 예방한다. 그리고 혈관 내피세포에서 KLF2의 활성은 eNOS 발현을 유도하고 혈관 확장 효과를 보이게 한다18.
NO는 심근과 혈관 내피세포를 포함한 대부분 인체 조직에서 NOS와 dioxygenase에 의해 생성되어 혈관 수축, 이완 조절을 통해 혈류 및 말초혈관 저항을 조절하는 신호 전달물질로 작용한다. NOS 이성질체는 nNOS(neural), iNOS(inducible), eNOS (endothelia) 3종류가 있다19. 그 중 eNOS에 의해 적절히 합성된 NO는 혈관을 확장 시키는데 eNOS 생성 저하 시 내피세포 기능 장애를 발생시킬 수 있고 혈관 수축, 염증반응, 혈전 생성 등이 생길 수 있다20.
Chemokine은 펩티드 단백질 일종이고 백혈구의 주화성, 활성화에 영향을 준다. 그 중 CC Chemokine은 단핵구, 림프구, 호염기구 유인 및 침윤을 증가시켜 염증 반응에 관여하고 죽상 경화증 발생에 영향을 미치는 것으로 알려져 있다21. 그리고 혈관 분지처럼 죽상 경화가 일어나기 쉬운 곳에서는 CC chemokine의 한 종류인 MCP-1 발현이 다수 일어난다22. 뿐만 아니라 내피세포, 평활근 세포, 대식세포에서 MCP-1의 mRNA 발현도 확인되었다23. 단핵구는 다양한 염증 반응의 중요 매개체로 인식되고 있고, 단핵구의 기능 조절을 통해 염증반응 조절 가능성도 보고되고 있다. MCP-1에 의한 단핵구의 유주는 염증에 대한 적절한 면역 반응을 위해서도 중요하지만 염증의 진행이라는 측면에서도 중요시된다. 죽상 경화 플라크 형성 및 진행에 있어 단핵구가 영향을 끼친다고 알려져 있기 때문이다. 이에 단핵구 유주 현상 조절을 통해 죽상 경화증 예방, 치료 가능성을 고려해 볼 수 있다24.
ICAM-1은 염증반응 및 죽상 경화에서 중요한 역할을 하는데 죽상 경화 발생 시 세포 밖에서 발현되어 혈중 농도가 상승하고 죽상 경화를 더 진행 시킨다. 고농도의 ICAM-1은 죽상경화성 질환, 특히 관상 동맥 질환에서의 위험인자로 알려져 있다25.
VCAM-1은 Immunoglobulin superfamily에 포함되는 세포부착분자로 염증반응 초기 혈관 내피세포와 백혈구 부착에 관계된 E-selectin보다 조금 늦게 발현되어 VCAM-1 백혈구 수용체가 발현되어 있는 림프구, 단핵구를 혈관 내피세포에 부착시켜 염증반응에 관여한다26.
KLF2, eNOS에서 TE는 100 μg/mL 농도에서 대조군에 비해 유의한 증가가 나타났으며 TCP는 100 μg/mL 이상의 농도에서 농도 의존적이고 대조군에 비해 유의한 증가가 확인되었다. MCP-1에서 TE는 100 μg/mL 농도에서 대조군에 비해 유의적인 변화는 없었고 TCP는 100 μg/mL 이상의 농도에서 농도 의존적이고 대조군에 비해 유의적 감소를 보였다. ICAM-1, VCAM-1에서 TE는 100 μg/mL 농도에서 대조군에 비해 유의적인 감소가 나타났고 TCP는 100 μg/mL 이상의 농도에서 농도 의존적이고 대조군에 비해 유의적인 감소를 확인할 수 있었다. 즉 본 연구에서 KLF2, eNOS의 유전자 발현량 증가, VCAM-1, MCP-1, ICAM-1의 세포 내 유전자 발현량 감소는 TCP 100 μg/mL 이상의 농도에서 혈관내피세포를 대상으로 항염증 작용이 있음을 의미한다. 또한 TE 100 μg/mL 농도에서 MCP-1의 유의적 변화가 없었지만 나머지 KLF2, eNOS, ICAM-1, VCAM-1 수치에서 의미 있는 변화가 있었으므로 TE 역시 단독으로 혈관 내피세포의 항 염증 작용이 있다고 사료된다.
MAPK family는 외부 자극에 의한 세포 성장, 사멸, 분화 등에 관여한다. MAPK는 p38 MAP kinase, JNK, ERK로 이루어져 있고, 전사조절인자들의 인산화로 여러 유전자의 발현을 조절한다27. JNK, p38 MAPK는 산화 스트레스, cytokine, 세포 사멸 유도인자, 방사선 등에 의해 활성화 되어 세포 분화와 자연사, 염증반응 등 다양한 생물, 화학적 반응을 유도한다28,29.
본 연구에서는 HUVEC에 TNF-α를 추가하여 염증반응을 일으킨 후 TE, TCP에서 발현된 단백질 발현량을 측정했다. 유전자 발현과 동일하게 KLF2, eNOS에서 TE는 100 μg/mL 이상의 농도에서 대조군에 비해 유의적인 증가가 있었고 TCP는 100 μg/mL 이상의 농도에서 농도의존적으로 대조군에 비해 유의적인 증가가 있었다. MCP-1 역시 TE는 100 μg/mL 농도에서 대조군에 비해 유의적 변화가 없었고 TCP는 100 μg/mL 이상의 농도에서 농도 의존적이고 대조군에 비해 유의성 있는 감소가 있었다. ICAM-1, VCAM-1, ERK, p38에서 TE는 100 μg/mL 농도에서 유의적 감소가, TCP는 100 μg/mL 이상의 농도에서 농도의존적이고 유의성 있는 감소가 나타났지만 JNK 단백질 인산화 결과 TE, TCP 모두 대조군에 비해 유의적인 변화는 없었다.
또한 HUVEC에 TNF-α를 첨가하여 염증반응 일으킨 후 TE, TCP에서 발현된 세포 외 바이오마커 생성량을 측정했다. TE, TCP에서 세포 외 바이오마커 MCP-1, ICAM-1, VCAM-1 생성량은 유전자, 단백질 발현량과 동일한 경향성을 보였다.
이는 TCP가 JNK 단백질 인산화에는 유의적 변화가 없기는 했지만 다른 수치의 전반적인 변화량을 고려했을 때 혈관내피세포 손상 및 염증반응 억제에 효과가 있음을 시사한다. 또한 TE 단독으로도 MCP-1, JNK 단백질 인산화 결과상 유의한 효과는 없었지만 다른 수치들의 유의한 결과를 고려했을 때 TCP에 비해 덜하지만 혈관내피세포 손상 및 염증반응 억제에 어느 정도 효과가 있다고 사료된다.
본 실험의 결과로 TE 및 TCP의 효능을 다음과 같이 말할 수 있다. TCP는 MAPKs 경로 억제에 관여하여 혈관내피세포의 염증반응을 억제한다. 그리고 혈관 내피세포에 혈관 부착 인자 생성을 저해하여 염증세포의 부착 및 혈관 벽 위에서 염증세포의 이동과정을 막아 침착을 억제한다. 이는 세포독성이 없는 100~400 μg/mL의 범위에서 농도 의존적이다. 또한 TE 단독으로도 혈관 염증반응 억제에 효과가 있지만 TCP만큼의 효능은 아니다.
죽상 경화가 혈관 내피세포에서 발생하는 염증반응으로 발생한다는 사실은 TE와 TCP가 혈관의 염증성 질환 예방 및 치료약물이 될 수 있을 것으로 사료된다. 본 연구가 심뇌혈관 관련 병증 치료제의 개발 가능성을 열어두었다고 생각한다. 추후 동물실험 등 후속 연구가 필요할 것으로 여겨진다.
V. 결 론
TE와 TCP의 이상지질혈증과 연관된 혈관내피세포 염증 인자 발현 억제 효능 확인 차원에서 인간 탯줄 정맥 내피 세포(HUVECs)를 사용하여 실험하였고 그 결과를 다음과 같이 정리할 수 있다.
1. 100 μg/mL 이상 농도의 TCP는 KLF2, eNOS 세포 내 유전자 발현량을 대조군에 비해 농도 의존적으로 유의성 있게 증가시켰고 VCAM-1, MCP-1, ICAM-1 세포내 유전자 발현량을 농도 의존적으로 유의성 있게 감소시켰다.
2. 100 μg/mL 이상 농도의 TCP는 KLF2, eNOS 단백질 발현량을 대조군에 비해 농도 의존적으로 유의하게 증가시켰고 VCAM-1, MCP-1, ICAM-1, ERK, p38 단백질 발현량을 농도 의존적으로 유의성 있게 감소시켰다. 하지만 JNK 단백질 인산화 측정 결과 대조군에 비해 유의적 변화는 없었다.
3. 100 μg/mL 이상 농도의 TCP는 VCAM-1, ICAM-1, MCP-1 세포 외 바이오마커 생성량을 대조군에 비해 농도 의존적으로 유의성 있게 감소시켰다.
4. 100 μg/mL 농도의 TE는 MCP-1의 세포 내 유전자, 단백질, 세포 외 바이마커 생성량을 대조군에 비해 유의적 변화를 나타내지 못했고 JNK 단백질 발현량도 대조군에 비해 유의적 변화를 나타내지 못했다. 그 외 인자의 세포 내 유전자, 단백질, 세포 외 바이오마커 발현에 대해서는 TCP와 동일한 경향성을 보였다.
이상의 결과로 TE, TCP는 HUVEC에서 항염증 효과 즉 염증세포 부착, 이동, 침착 억제 효과가 있어 각종 염증성 혈관 질환을 예방하거나 억제할 수 있음을 실험적으로 확인하였다. 향후 혈관 염증반응 및 합병증 관련 추가적인 in vivo 연구 수행의 필요성이 있는 것으로 사료된다.

