MIA로 유발된 골관절염 동물모델에서 산수유 추출물의 골관절염 개선 효과
Protective Effect of Corni Fructus Extracts on MIA-induced Animal Model of Osteoarthritis: Effect of Corni Fructus Extracts on OA
Article information
Abstract
Objectives
Osteoarthritis (OA) is a chronic and degenerative joint disease characterized by progressive degeneration of articular cartilage. Inflammation is a recognized and important factor of OA progression. The present study was designed to investigate the protective effect of Corni Fructus water extract (CFW) on a monosodium iodoacetate (MIA)-induced rat model of OA.
Methods
Osteoarthritis was induced by injection of MIA (50 µL; 80 mg/mL) into the knee joint cavity of rats. After an adaptation period for seven days, the rats were divided into 4 groups (n=8/group): normal, control, indomethacin-treated (5 mg/kg), and CFW-treated (200 mg/kg) groups. The rats were treated orally for 14 days. Pain was evaluated by determining hind paw weight distribution. For biochemical analyses, we measured the changes in reactive oxygen species (ROS) and peroxynitrite (ONOO-) in the knee joint. The presence of anti-oxidant proteins and inflammatory proteins was determined by western blotting.
Results
The administration of CFW significantly improved the hind paw weight distribution. The ROS and ONOO- levels of knee joint were significantly decreased in the CFW group. CFW inhibited the production of inflammatory mediators, such as COX-2, and inflammatory cytokines, including IL-6 and IL-1β, via the NF-κB signaling pathway. The expression of anti-oxidant enzymes, such as catalase and GPx-1/2 also increased significantly.
Conclusions
The findings indicate that CFW has a therapeutic and protective effect on OA by suppression of inflammation. Therefore, CFW could represent a potential and effective candidate for OA treatment.
Ⅰ. 서 론
골관절염은 관절 주변 및 관절 내 연골의 과다생성, 관절 연골의 파괴, 관절의 변형 등을 특징으로 하는 퇴행성 관절 질환1으로 염증과 통증을 유발하여 운동장애를 초래하고 삶의 질을 저하시킨다. 골관절염의 원인은 잘 알려져 있지는 않지만 연골 합성과 분해의 생리학적 불균형에 따른 항상성의 붕괴로 여겨지고 있으며2 관절에 만성 통증과 기능적 손실을 유발하는 OA의 관절 연골 파괴는 염증성 사이토카인의 과도한 생산을 포함한 다양한 요인에 의해 유발된다고 알려져 있다3,4. 그 외 노화가 골관절염의 발달에 중요한 위험 요인 중 하나로 알려져 있으며 많은 연구에서 나이가 증가함에 따라 손, 엉덩이, 척추 및 무릎 골관절염이 증가하는 것으로 보고되었다5. 2008년 우리나라의 65세 이상의 노인 인구는 약 507만 명이었으나 꾸준히 증가하여 2017년에는 3.8%의 증가세를 보였으며6, 이는 우리나라가 고령화 사회로 진입하고 있음을 보여주는 지표로 파악할 수 있다. 이에 따라 골관절염 유병률은 계속적으로 증가할 것으로 예상되어 노년기 건강 및 삶의 질 개선을 위한 예방관리의 중요성이 대두되고 있다.
골관절염의 일반적인 치료방법으로는 장기적인 약물요법, 물리요법, 수술요법 또는 주사치료 등이 있으나 위장관 장애, 간기능 및 신장 기능 장애의 부작용, 염증 재발 등의 부작용7에 대한 부담과 골관절염으로 인한 사회경제적 비용이 증가되면서8 예방 및 진행 억제를 위한 효과적인 치료방법에 대한 다양한 연구(약재, 한약, 약침 등)가 진행되고 있다9-15.
山茱萸(Cornus officinalis Sieb. et. Zucc.)는 층층나무과(Cornaceae)에 속하는 낙엽소교목인 산수유나무의 성숙한 과실을 건조한 약재이다. 味는 酸澁하고, 性은 微溫하며 補益肝腎, 澀精固脫 등의 효능이 있는 것으로 알려져 있다. 山茱萸의 주요 성분은 triterpene 계열인 saponin, ursolic acid, stearic acid, linolenic acid, palmitic acid, oleic acid, morroniside, loganin, valine, tyrosine 등이 알려져 있으며16, 山茱萸의 생리 활성으로 항염증17, 혈관 이완18, 골다공증 억제19, 체중 감소20, 항산화21, 항당뇨22, 항지질효과23, 인지력향상24 등의 효과가 보고되었다.
한의학에서 골관절염은 痺證의 범주로 인식되며, 病因은 크게 外因인 風, 寒, 濕 邪氣로 인한 경우와 內因인 관절에 직접적인 영양을 제공하는 肝腎의 虛로 인한 경우로 보고되고 있다25. 임상적으로는 祛風寒濕 약물과 補肝腎약물을 겸하여 처방하는 경우가 많고 실제 많은 환자들이 골관절염의 통증관리에 한의학적 치료를 이용하고 있다.
山茱萸는 補益肝腎의 효능이 있어 노인, 만성질환에 빈용되는 약물로 골다공증 억제 효과에 대한 세포 및 동물 모델 연구는 활발히 진행 중이나, 골관절염에 대한 효과는 실험적 연구를 통해 밝혀진 바가 없다. 이에 본 연구는 MIA로 골관절염을 유발한 rat 모델에서 산수유 물추출물을 경구 투여하여 관절 조직의 항산화 및 항염증 효과를 관찰한 후 유의한 결과를 얻었기에 보고하는 바이다.
Ⅱ. 재료 및 방법
1. 실험동물
7주령의 Sprague-Dawley(SD)계 체중 180~220 g의 수컷 흰쥐를 하나바이오테크(경기, 한국)에서 구입하여, 물과 고형사료(조단백질 18% 이상, 칼륨 0.55% 이상, 조지방 5.0% 이상, 조회분 8.0% 이하, 칼슘 1.0% 이상, 인 0.85% 이상, 나트륨 0.25% 이상, 조섬유 5.0% 이하, 마그네슘 0.15% 이상 NIH-41, Zeigler Bros, Inc., USA)를 충분히 공급하며 1주일간 실험실 환경에 적응시킨 후 실험에 사용하였다. 동물 사육실의 조건은 conventional system으로 명암주기는 12시간 주기, 온도 22±2 ℃, 습도 50±5%로 조절하였다. 대구한의대학교 동물 실험 윤리위원회의 승인(DHU2019-048)을 얻어 실험을 시행하였으며 동물관리 규정을 준수하였다.
2. 시료 추출
본 실험에 사용한 山茱萸는 옹기한약국(대구, 한국)에서 구입하여 대구한의대 본초약리학교실에서 정선, 감별하여 사용하였다. 山茱萸 300 g에 10배수의 증류수 3 L를 가하여 열탕 추출기를 사용하여 2시간 열수 추출을 시행하였다. 추출물을 여과하여 여과액을 감압 추출장치로 농축한 후 동결 건조기에서 완전히 건조시켜 77.1 g의 파우더를 얻었으며 수율은 25.7%였다. 얻은 파우더를 냉동 (-80 ℃) 보관하여 실험 직전에 증류수에 희석하여 사용하였으며 이를 CFW(Corni Fructus water extract)라고 하였다.
3. 시 약
본 실험에 사용된 potassium persulfate, phenyl methyl sulfonyl fluoride(PMSF), monosodium iodoacetate(MIA), indomethacin, dithiothreitol(DTT)는 Sigma Aldrich Co., Ltd.(St. Louis, MO, USA)에서, 2’,7’-dichlorofluorescein diacetate(DCF-DA)와 Dihydrorhodamine 123는 Molecular Probes (Eugene, OR, U.S.A.)에서 구입하였다. 1차 항체 nuclear factor-kappa Bp65(NF-κBp65), cyclooxygenase-2 (COX-2), inducible nitric oxide synthase(iNOS), interleukin-6(IL-6), tumor necrosis factor-alpha (TNF-α), interleukin-1β(IL-1β), superoxide dismutase (SOD), catalase, glutathione peroxidase-1/2(GPx-1/2), β-actin, histone 및 2차 항체는 Santa Cruz Biotechnology(Santa Cruz, CA, USA)에서 구입하였다. Protease inhibitor mixture, Ethylene diamine tetra acetic acid(EDTA)는 Wako Pure Chemical Industries, Ltd.(Osaka. Japan)에서 구입하였으며, Nitrocellulose membranes는 Amersham GE Healthcare (Buckinghamshire, UK)에서 구입하였다. 단백질 정량을 위한 BCA protein assay kit는 Thermo Scientific(Waltham, MA, USA)에서 구입하였다.
4. 산수유 추출물의 HPLC 분석 조건 및 결과
메탄올 100 mL에 산수유 2 g를 넣어 환류냉각기를 달고 수욕에서 2시간 가온하여 식힌 다음 여과하고, 잔여물에 다시 메탄올 100 mL를 넣어 환류냉각기를 달고 수욕에서 2시간 가온하여 식힌 다음 여과하였다. 여과한 여액을 전부 합하여 감압 농축한 다음 메탄올을 넣어 50 mL로 정확히 맞춘 후 syringe filter로 다시 여과하여 검액으로 사용하였다. Column은 Waters Xbridge C18 column(4.6 mm×250 mm, 5 μm)을 25 ℃로 유지시켜 사용하였다. 유속은 0.5 mL/min으로 하였고 10 μl를 주입하여 Waters Alliance e2695(Waters Corp., Milford, USA)의 Waters 2489 UV detector 240 nm에서 검출하였다. 이동상은 희석시킨 아세트산(0.1->100), 아세토니트릴, 메탄올(85:10:5)로 혼합하여 사용하였다. 표준품은 식품의약품안전처 Loganin-2006을 사용하였으며, 0.8 mg을 메탄올 4 mL에 녹여 사용하였다. HPLC를 이용한 정량 분석 결과 loganin 함량은 5.7 mg/g으로 나타났다.
5. 골관절염 효능 평가
1) 골관절염 유발
실험동물의 오른쪽 무릎 주변의 털을 깨끗이 제모한 후, 0.9% saline으로 희석한 MIA를 0.3 ml insulin 주사기(BD 31 G Ultra-Fine Ⅱ, USA)를 사용하여 오른쪽 무릎 관절강 내에 50 μl(80 mg/mL)씩 주입하여 골관절염을 유발하였다.
2) 군 분리 및 약물투여
MIA로 유발 7일 후 뒷다리 체중 부하 검사를 통해 골관절염이 유발된 실험동물을 각 군당 8마리씩 4그룹으로 구분하여 실험을 진행하였다. 실험군은 골관절염을 유발하지 않은 정상군(Normal), 골관절염 유발 후 증류수를 투여한 대조군(Control), 골관절염 유발 후 indomethacin을 5 mg/kg로 경구 투여한 양성대조군(INDO), 골관절염 유발 후 CFW를 200 mg/kg로 경구 투여한 CFW군(CFW)으로 약물은 2주간 존대(Zonde)를 이용하여 투여하였다.
3) 체중 측정
실험동물의 체중은 전자체중계로 1회/2일으로 동일 조건에서 측정하였다.
4) 뒷다리 체중 부하 측정
뒷다리 체중 부하는 MIA로 골관절염을 유발하기 7일 전(-1 week), 유발 후 7일(0 week), 14일(1 week), 21일(2 weeks) 총 4번을 측정하였다. Incapacitance tester(Ser No. 01/45/25, Linton instrument Co., UK)를 이용하여 오른쪽, 왼쪽 뒷다리 부하 무게를 측정하였다. 뒷다리 체중 부하 측정 결과는 골관절염이 유발된 오른쪽 뒷다리의 체중 부하량에 정상적인 왼쪽 뒷다리 부하량을 계산하여 체중 부하 비율을 계산하였다. 정상군의 체중 부하 비율에 각 군의 체중 부하 비율을 계산한 후 평균±표준편차로 나타내었으며, 다음의 식을 이용하였다.
∫ 체중부하비율=
∬ 상대적 체중 부하=
5) 관절 조직내 산화적 스트레스 바이오마커 측정
관절조직은 1 mM EDTA-50 mM sodium phosphate buffer(pH 7.4)를 이용하여 분쇄하였다. Ali et al.26 방법을 이용하여 ROS를 측정하였으며 25 mM DCF-DA를 혼합한 후, 형광 광도계를 이용하여 0분부터 매 10분씩 emission wavelength of 530 nm와 excitation wavelength of 486 nm를 이용하여 30분간 측정한 산출 값을 계산하였다. 관절조직의 ONOO- 측정을 위해 Kooy et al.27) 방법을 이용하여 측정하였다.
6) 관절조직 Western blotting
2주간의 약물 투여가 끝난 뒤 오른쪽 무릎 부위를 절단하여 관절조직을 채취한 다음 관절 조직의 세포질 분획을 획득하기 위해 100 mM Tris-HCl (pH 7.4), 2 mM MgCl2, 5 mM Tris-HCl(pH 7.5), 15 mM CaCl2, 1.5 M sucrose, protease inhibitor cocktail, 0.1 M DTT를 첨가시킨 buffer A를 넣은 후 tissue grinder(Bio Spec Product, USA)를 사용해 분쇄한 다음 10% NP-40 용액을 첨가하였다. 아이스 위에서 20분간 방치한 후, 12,000 rpm으로 2분간 원심분리하여 세포질을 함유한 상층액을 분리하였다. 핵 분획을 얻기 위해 10% NP-40가 더해진 buffer A에 두 번 헹구고 100 μl의 buffer C(50 mM HEPES, 50 mM KCl, 0.3 mM NaCl, 0.1 mM EDTA, 1 mM DTT, 0.1 mM PMSF, 10% glycerol)를 첨가해 재부유시킨 후 10분마다 vortex를 3번 하였다. 4 ℃에서 12,000 rpm으로 10분간 원심 분리 한 후 핵을 포함하고 있는 상층액을 얻어 -80 ℃에서 각각 냉동 보관하였다. 세포질 내의 COX-2, iNOS, IL-6, TNF-α, IL-1β, SOD, catalase, GPx-1/2, β-actin의 단백질 발현을 평가하기 위해 8~15% SDS-polyacrylamide gel을 만들어 10 μg의 단백질을 전기영동하고 acrylamide gel을 nitrocellulose membrane으로 이동시켰다. 단백질이 전이된 membrane에 보고자하는 1차 항체를 처리하여 4 ℃에서 overnight 시켰으며, 그 후 PBS-T로 6분마다 5회 헹구고, 1차 항체에 적합한 2차 항체(PBS-T로 1:3000로 희석해서 사용)를 사용하여 상온에서 2시간 반응시킨 후, PBS-T로 6분마다 8회 세척하였다. 그리고 enhanced chemiluminescence(ECL) 용액에 노출시킨 다음, Sensi-Q2000 Chemidoc(Lugen Sci Co., Ltd., 경기도, 한국)에 감광시켜 단백질 발현을 확인한 후, 해당 band를 ATTO Densitograph Software(ATTO Corporation, Tokyo, Japan)프로그램을 사용하여 정량하였다. 각 그룹의 단백질 수준은 정상군의 단백질 수준으로 나누어 상대적 비로 나타내었다.
6. 통계분석
모든 수치는 평균과 표준편차(mean±SD)로 표시하였으며, SPSS(Version 22.0, IBM, Armonk, NY, USA)를 사용하여 one-way analysis of variance (ANOVA) test를 실시한 후 least-significant differences (LSD) test로 사후검증을 실시하여 각 군의 평균차이에 대한 통계적 유의성을 p-value<0.05에서 검증하였다.
Ⅲ. 결 과
1. 체중변화량
골관절염 유발 후 2주간의 약물투여 기간 동안 측정된 체중변화량은 정상군 62.36±6.64 g, 대조군 60.11±7.60 g, Indo군 60.11±7.60 g, CFW군 62.33± 9.75 g으로 각 군간의 유의성은 나타나지 않았다 (Fig. 1, Table 1).
2. 뒷다리 체중 부하 측정 결과
뒷다리 체중 부하는 골관절염을 유발하기 7일 전(-1 week), 유발 후 7일(0 week), 14일(1 week), 21일(2 weeks) 총 4번을 측정하였다. 정상군의 뒷다리 체중 부하 비율을 100으로 하였을 때, 각 군의 상대적 뒷다리 체중 부하의 변화를 측정한 결과. MIA 유발 7일 후에는 대조군 233.05±21.11, INDO군 225.19±18.55, CFW군 227.08±15.72로 각 군 간의 유의한 차이는 없었다. 그러나 MIA 투여 14일 후에는 대조군 203.71±6.98, INDO군 171.08± 15.89(p<0.05), CFW군 165.49±11.80(p<0.05)로 나타나 INDO군과 CFW군에서 뒷다리 체중 부하가 대조군에 비해 유의하게 감소하였다. 21일 후에는 대조군 204.23±12.44, Indo군 142.14±9.86(p<0.01), CFW군 151.95±8.50(p<0.01)로 나타나 INDO군과 CFW군 모두 대조군에 비해 유의하게 감소하였다(Fig. 2, Table 2).
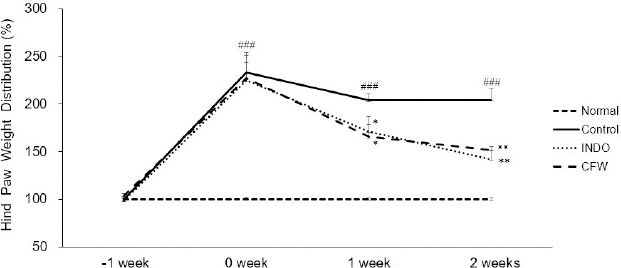
The changes in relative hind paw weight distribution in MIA-induced osteoarthritis rats.
All data are expressed means±SD (n=8).
Significance : *p<0.05, **p<0.01 vs. control group and ###p<0.001 vs. normal group
Normal : normal rats, Control : MIA-induced osteoarthritis rats, INDO : MIA-induced osteoarthritis rats treated with indomethacin 5 mg/kg body weight, CFW : MIA-induced osteoarthritis rats treated with Corni Fructus water extract 200 mg/kg body weight
3. 산화적 스트레스 바이오마커 측정 결과
산화적 스트레스 바이오마커 측정을 위하여 관절조직의 ROS, ONOO-를 측정하였다. ROS (fluorescence/min/mg protein) 생성량 측정 결과, 대조군은 168,978±22,555로 정상군 58,454±16,268에 비하여 유의하게 증가하였다(p<0.001). 양성 대조군인 INDO군은 81,977±17,632, CFW군은 85,939 ±21,286로 대조군에 비하여 유의하게 감소한 것을 확인하였다(p<0.01). ONOO-(fluorescence/mg protein) 생성량을 측정한 결과, 대조군은 37,420±1,280로 정상군 19,751±2,502에 비해 유의하게 증가한 것을 확인할 수 있었다(p<0.001). 양성 대조군인 INDO군 19,678±2,389과 CFW군 17,582±2,927은 대조군에 비하여 유의하게 감소하였다(p<0.001)(Fig. 3).

Oxidative stress biomarker in knee joint.
All data are expressed means±SD (n=8).
Significance : **p<0.01, ***p<0.001 vs. control group and ###p<0.001 vs. normal group
Normal : normal rats, Control : MIA-induced osteoarthritis rats, INDO : MIA-induced osteoarthritis rats treated with indomethacin 5 mg/kg body weight, CFW : MIA-induced osteoarthritis rats treated with Corni Fructus water extract 200 mg/kg body weight
4. 관절조직 내 항산화 단백질 발현량 분석
Western blot으로 관절조직에서 항산화 효소 단백질인 SOD, catalase, GPx-1/2의 발현량을 분석하였다. SOD의 발현량을 측정한 결과, 대조군은 0.87±0.01로 정상군 1.00±0.03에 비하여 유의적으로 낮게 발현하였다(p<0.01). 양성대조군인 INDO군은 0.95±0.05, CFW군 0.97±0.05로 대조군 대비 증가하였다. Catalase 단백질 발현량을 측정한 결과, 대조군 0.62±0.06으로 정상군 1.00±0.08에 비해 유의하게 감소하였다(p<0.01). 양성대조군인 INDO군 0.88±0.06, CFW군 0.78±0.07로 대조군 대비 유의하게 증가하였다(p<0.01, p<0.05). GPx-1/2 단백질 발현량을 측정한 결과, 대조군 0.58±0.04은 정상군 1.00±0.07에 비해 유의하게 감소하였으며(p<0.001), 양성대조군인 INDO군에서는 0.88±0.09, CFW군 0.82±0.10은 대조군에 비해 유의하게 증가하였다(p<0.05)(Fig. 4).
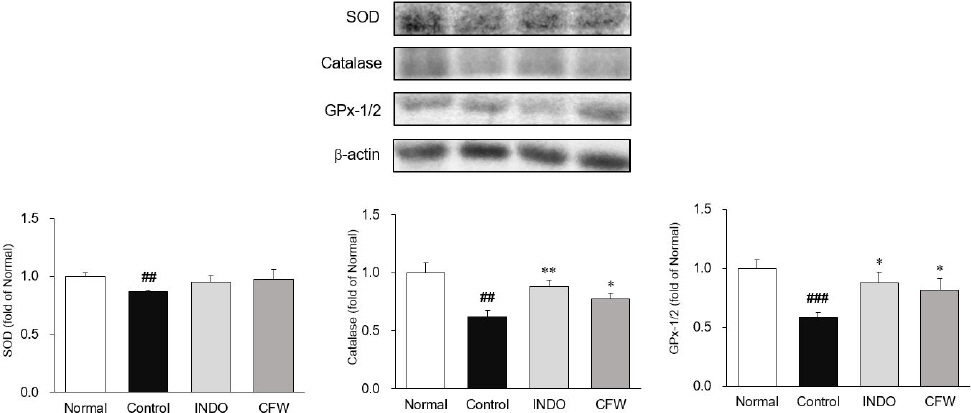
Expression of anti-oxidant related proteins in knee joint.
All data are expressed means±SD(n=8).
Significance : *p<0.05, **p<0.01 vs. control group and ##p<0.01, ###p<0.001 vs. normal group
Normal : normal rats, Control : MIA-induced osteoarthritis rats, INDO : MIA-induced osteoarthritis rats treated with indomethacin 5 mg/kg body weight, CFW : MIA-induced osteoarthritis rats treated with Corni Fructus water extract 200 mg/kg body weight
5. 관절조직 내 염증성 단백질 발현량 분석
Western blot으로 관절조직에서 염증성 단백질인 NF-κBp65, COX-2, iNOS의 발현량을 분석하였다. NF-κBp65 단백질 발현량을 측정한 결과, 대조군 1.16±0.10로 정상군 1.00±0.11에 비해 증가하였다. 양성대조군인 INDO군은 0.93±0.11로 대조군에 비해 감소하였다. 하지만 CFW군은 0.70±0.08로 대조군에 비해 유의하게 감소하였다(p<0.01). COX-2 단백질 발현량을 측정한 결과, 대조군 1.88±0.09로 정상군 1.00±0.11에 비해 유의하게 증가하였다(p< 0.001). 양성대조군인 INDO군은 1.25±0.17, CFW군 1.23±0.13로 대조군에 비해 유의하게 감소하였다 (p<0.01, p<0.001). iNOS 단백질 발현량을 측정한 결과, 대조군 1.33±0.14로 정상군 1.00±0.06에 비해 유의하게 증가하였다(p<0.05). 양성대조군인 INDO군은 0.98±0.08로 대조군에 비해 유의하게 감소하였으며(p<0.05), CFW군 1.09±0.06으로 대조군에 비해 감소하는 경향을 보였다(Fig. 5).

Expression of inflammatory related proteins in knee joint.
All data are expressed means±SD (n=8).
Significance : *p<0.05, **p<0.01, ***p<0.001 vs. control group and #p<0.05, ###p<0.001 vs. normal group
Normal : normal rats, Control : MIA-induced osteoarthritis rats, INDO : MIA-induced osteoarthritis rats treated with indomethacin 5 mg/kg body weight, CFW : MIA-induced osteoarthritis rats treated with Corni Fructus water extract 200 mg/kg body weight
6. 관절조직 내 염증성 사이토카인 발현량 분석
Western blot으로 관절조직에서 염증성 사이토카인 TNF-α, IL-6, IL-1β의 발현량을 측정한 결과, 대조군은 1.52±0.17으로 정상군은 1.00±0.04에 대비하여 유의하게 증가하였다(p<0.05). 양성대조군인 INDO군은 0.99±0.10로 대조군에 비해 유의하게 감소하였다(p<0.05). CFW군은 1.34±0.11로 감소하였으나 유의하지는 않았다. IL-6 발현량을 측정한 결과, 대조군은 1.50±0.09로 정상군 1.00±0.06에 비하여 유의적으로 높게 발현하였다(p<0.001). 양성대조군인 INDO군은 1.04±0.10, CFW군은 1.09±0.10로 대조군에 비하여 유의하게 감소하였다(p<0.01). IL-1β 발현량을 측정한 결과, 대조군은 1.53±0.11로 정상군 1.00±0.09에 비하여 유의하게 증가하였다(p<0.01). 양성대조군인 INDO군은 1.07±0.08로, CFW군은 1.14 ±0.14로 대조군에 비해 유의하게 감소하였다(p<0.01, p<0.05, reps)(Fig. 6).
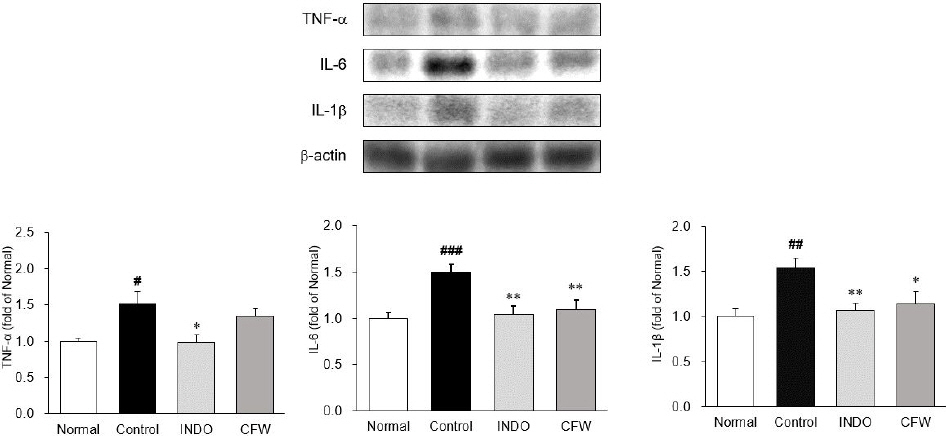
Expression of inflammation-related cytokines in knee joint.
All data are expressed means±SD (n=8).
Significance : *p<0.05, **p<0.01 vs. control group and #p<0.05, ##p<0.01, ###p<0.001 vs. normal group
Normal : normal rats, Control : MIA-induced osteoarthritis rats, INDO : MIA-induced osteoarthritis rats treated with indomethacin 5 mg/kg body weight, CFW : MIA-induced osteoarthritis rats treated with Corni Fructus water extract 200 mg/kg body weight
Ⅳ. 고 찰
골관절염은 연골세포의 소멸과 세포외기질의 손상을 특징으로 하는 퇴행성 질환으로 체중부하가 걸리는 고관절 및 슬관절에 호발하며28, 관절연골의 점진적인 손상, 연골의 변화, 골조직 형성 및 주변 조직의 변화 때문에 만성적인 염증과 통증을 유발한다29. 2008년 국민건강영양조사에 따르면 성인 중 10.7%가 골관절염을 앓고 있으며 연령에 따라 비율이 증가하여 80대에는 34.5%에 이르는 것으로 나타나8 노년층이 골관절염의 주요 환자군을 형성한다. 임상적으로는 비스테로이드성항염제(NSAIDs)의 약물요법과 관절강 내 하이알루론산 등의 주사요법이 흔히 사용되나 약물의 부작용 또는 지속적인 염증성 통증으로 삶의 질이 점차 저하되는 경우가 많고 각종 성인병과 함께 수술 합병증에 대한 부담도 커서 골관절염 치료를 위해 한방 치료를 찾는 환자들이 많은 실정이다. 한의학에서 골관절염은 鶴膝風, 痺證, 歷節風, 脚氣 등의 범주로 보았으며, 그 원인을 風寒濕 등의 外邪로 인하여 氣血運行이 阻閉된 外因과, 노화에 따라 肝腎衰弱하여 傷骨한 內因으로 분류하여 補肝腎陰虛 및 破瘀血을 위주로 치료한다28. 산수유는 노화에 의한 각종 질병 치료 처방에 빈용되는 구성 약재이며 장기 복용할수록 효과가 큰 것으로 알려져 퇴행성질환인 골관절염 예방 및 치료에 효과적일 것으로 판단되었기에 염증성 관절손상 동물모델을 이용하여 산수유 물추출물의 염증 억제 효과를 분석하였다.
먼저 MIA로 골관절염을 유발하여 뒷다리 체중부하를 검사한 결과 관절 손상 후 정상군 대비 3개 그룹에서 모두 유의하게 증가하였다가 약물 투여 2주 후 대조군에 비해 INDO군과 CFW군에서 유의하게 감소되는 것을 확인하였다. 이는 연골 손상으로 인해 하체의 중심이 관절염이 유발되지 않은 건측으로 기울어지는 것을 이용하여 건측 체중부하가 감소함으로써 관절염을 유발한 환측 다리로의 체중 지지가 증가한 것을 관찰하는 방법으로 손상받은 관절의 통증이 완화되었음을 의미한다. 즉, 산수유 물추출물이 골관절염으로 인한 통증을 경감시키는 효과가 있는 것으로 나타났다.
많은 연구에서 산화적 스트레스가 암, 당뇨병, 골관절염, 류마티스성 관절염, 죽상 동맥 경화증 및 만성 염증성 질환을 악화시킨다는 보고가 발표되었다30. 자유 라디칼 또는 활성산소종(Reactive oxygen species, ROS)은 정상적인 세포대사 동안 살아있는 유기체에 필수적인 산화 공정에서 생성되는 매우 불안정한 분자31로 과도하게 생성되거나 제거가 원활하지 못하였을 때 즉 산화제(oxidants)와 산화 방지제(anti-oxidants)의 불균형을 야기하게 되며 이는 산화적 스트레스(oxidative stress)를 유발하게 된다32,33. 활성산소종은 세균감염 시 중요한 살균 작용을 하지만, 과도하게 생산되었을 시 염증을 악화시키고 DNA 및 단백질과 같은 분자를 파괴하여 세포의 사멸을 유도하게 된다34. 또한 노화과정에서 염증반응이 지속적으로 일어나면서 iNOS 유도에 따른 NO의 대량 생성이 ONOO-의 생성을 더욱 증가시켜 세포 및 조직 손상을 가져오게 되며 특히 ONOO-의 독성은 NO와 ·O2-보다 더 강한 것으로 알려져 있다35. 본 연구에서는 골관절염의 증상을 악화시킬 수 있는 산화적 스트레스 바이오마커인 ROS와 ONOO-를 측정하여 항산화 활성에 대한 산수유 물추출물의 효과를 관찰하였다. ROS와 ONOO-는 INDO군과 CFW군 모두에서 유의성 있게 감소하여 산수유 물추출물이 산화적 스트레스를 효과적으로 억제함으로써 세포를 보호하고 관절연골의 염증 및 손상의 진행을 방어하는 것으로 생각된다.
항산화 효과는 항산화 효소의 활성과 깊은 상관 관계가 있다. 항산화 효소는 자유 라디칼을 중화시켜 자유 라디칼에 의한 손상을 최소화하게 된다36. 염증조절 매개인자인 SOD(superoxide dismutase)는 산소 대사에 의하여 생성되는 superoxide radical(O2-)을 hydrogen peroxide(H2O2)로 전환시키며, catalase와 glutathione peroxidase(GPx)에 의하여 hydrogen peroxide는 다시 H2O와 O2로 분해하는 과정을 통해 활성산소를 제거하여 세포 손상을 방지한다37,38. 골관절염을 유발한 관절조직에서 이러한 항산화 효소 단백질을 분석한 결과, INDO군과 CFW군에서 SOD의 발현량이 증가하였으나 유의성은 없었고, catalase와 GPx-1/2는 INDO군과 CFW군에서 모두 유의성 있게 증가하였다. 이는 산수유 추출물이 항산화 단백질의 생성을 증가시켜 산화적 스트레스로 인한 관절 연골의 손상의 진행을 억제하는 효과를 보이는 것으로 판단된다.
Nuclear factor-kappa B(NF-ĸB)는 염증 매개물질의 생성을 조절하는 전사인자로 정상 상태에서는 세포질에서 IĸB-α 단백질과 결합하여 불활성 상태로 세포질에 존재하다가 외부 자극에 의하여 IĸB-α가 인산화되면 p65 단백질이 세포 핵 내로 이동하여 전사가 이루어지게 되고, 이 때, 염증성 매개인자인 cyclooxygenase-2(COX-2)와 inducible nitric oxide synthases(iNOS) 그리고 염증성 cytokine인 TNF-α, IL-1β, IL-6 등을 생성하게 된다. 즉, NF-ĸB는 염증매개 cytokine의 발현에 중요한 역할을 담당하는 경로로 알려져 있으며39,40, NF-ĸB의 활성 억제와 cytokine의 생성 억제는 염증성 관절염 치료와 예방에 있어 중요한 부분이 된다. 본 연구에서는 NF-ĸB의 활성을 억제함으로 인해 염증성 매개인자인 COX-2의 발현을 유의하게 억제시켰으며 염증성 사이토카인인 IL-1β, IL-6의 생성이 산수유 투여에 의해 유의하게 감소하였다. 특히 NF-ĸB의 활성 억제는 INDO군보다 CFW군에서 더 효과적으로 억제되는 것을 확인하였다.
이와 같은 결과를 종합하여 볼 때 산수유 추출물은 NF-ĸB의 활성 억제를 통한 염증성 단백질의 발현을 감소시켜 골관절염의 염증 개선 및 연골 파괴의 진행을 억제하였으며 이는 골관절염의 통증 감소와 회복을 도운 것으로 판단되어지며 또한, 항산화효소 단백질의 증가를 통해 산화적 스트레스를 감소시켜 관절 보호 효과를 발휘하는 것으로 사료된다.
Ⅴ. 결 론
본 연구에서는 산수유의 골관절염에 대한 염증 억제 효과를 과학적으로 검증하기 위하여 MIA로 골관절염을 유발 후 2주 동안 산수유 200 mg/kg/day를 투여한 후 체중부하 측정, 혈액 분석 및 관절 조직 내 단백질 발현량을 분석한 결과, 다음과 같은 결론을 얻었다.
1. 체중부하 측정 시 정상군에 비해 대조군에서 유의하게 상승하였으며, 산수유 투여로 인해 유의하게 감소하였다.
2. 산수유 투여는 관절 조직 내 산화적 스트레스 마커인 ROS와 ONOO-를 대조군에 비해 유의하게 감소시켰다.
3. 산수유 투여군은 Catalase와 GPx-1/2와 같은 항산화 효소 단백질을 유의하게 증가하였다.
4. 산수유 투여는 NF-κB의 활성을 유의하게 억제시켰으며 이는 염증성 매개인자인 COX-2를 유의하게 감소시켰고, IL-6와 IL-1β 같은 염증성 사이토카인을 유의하게 감소시켰다.
이상의 결과들로 보아 산수유는 골관절염 동물 모델에서 산화적 스트레스 및 항산화 효소 단백질을 상승시켜 항산화 효과를 발휘하였으며 NF-κB 비활성을 통한 염증인자들을 억제함으로서 골관절염에서의 관절 보호 효과를 발휘하는 것으로 나타났다. 이는 산수유가 골관절염 치료를 위한 소재로 적극 활용될 수 있음을 시사하고 있다.
감사의 글
본 연구는 2012년 대구한의대학교 교내학술연구비지원(기린연구 과제번호 2012-901-31)에 의해 연구되었습니다.