단삼과 단삼음의 역류성 식도염 억제 효과 및 암세포 이주 억제 효과
Abstract
Purpose:
We examined the effects of Dansam (Salvia miltiorrhiza Bunge, SM) and Dansam-eum (DSE) on gastroesophageal reflux disease (GERD) and reflux esophagitis by comparing the inhibitory effects of SM and DSE with the representative treatment of PPI Omeprazole to determine if the effects of the prescription DSE based on Korean medicine are better than those of a single-use of SM.
Methods:
We performed experiments using both animal models and cancer cells.
Results:
Comparison of SM and DSE with PPI in the animal model tests revealed that the effects were superior for SM and DSE than for PPI in all categories (8-OHdG, p-IκB, PAR2, COX-1, cathelicidin, p-JNK, Caspase 3, ATP6V1B1, GRPR, serotonin, and NPY). In three categories (COX-1, serotonin, and NPY), SM and DSE showed superior results over the Controls. In the animal model tests, DSE was superior to SM in all categories except for serotonin. The anti-cancer effects observed in cancer cell tests revealed that SM and DSE had meaningful results in terms of cytotoxicity and cell movement rate, as well as in cancer cell apoptosis.
Conclusions:
We confirmed that SM and DSE can have effects on reflux esophagitis through the regulation of oxidative stress, inflammation, mucosal protection, apoptosis, proton pumping, and the enteroendocrine system in the stomach and esophagus. We also confirmed that SM and DSE have superior effects to those of PPI on all aspects, especially gastric mucosa protection and enteroendocrine system control. We also confirmed that SM and DSE have anti-cancer effects. Above all, we confirmed that DSE has superior effects on almost all aspects compared to using SM alone.
Keywords: Dansam (Salvia miltiorrhiza Bunge, 丹蔘), Dansam-eum (丹蔘飮), gastroesophageal reflux disease (GERD)
I. 서 론
위식도 역류질환(Gastroesophageal reflux disease, GERD)은 위의 내용물이 식도로 역류하며 증상을 유발하거나, 그로 인한 합병증을 일으키는 질환을 말한다 1. GERD에서 식도 점막이 지속적으로 손상되면 역류성 식도염이 발생하게 되고, 미란성 식도염으로 진행 시 뚜렷한 점막 손상을 보이게 된다. 악화 시 바레트 식도로 진행할 수 있는데, 이는 식도 선암의 주요 위험 요인이다. 식도암은 상대적으로 드물지만 치사율이 매우 높고 예후가 나빠서, 진단 후 5년 생존율이 5% 이하에 불과한 암이다 2. 그러므로 위식도 역류질환을 방치하는 것은 장기적으로 암의 잠재적 위험 인자를 경시하는 것과 같다. 현재 GERD의 대표적 치료 약제는 양성자펌프억제제(Proton Pump Inhibitor, PPI)이다 1. PPI는 위 벽세포의 양자 펌프(proton pump)와 결합하여 이를 불활성화 시킴으로써 산 분비를 적극적으로 억제하는 기전을 가지며, 이를 통해 GERD 치료제로 상용되고 있다 3. 그러나 PPI 치료의 한계점 및 문제점도 다방면에서 존재한다. 식도염 및 바레트 식도를 동반하는 경우에도 PPI를 주로 사용하지만, 산 분비의 억제가 결과적으로 이를 치료하거나 예방하지는 않는다 2. 남녀 모두에서 골다공증성 골절의 위험성도 상승하는데 이는 특히 고령화 사회에서 유의미한 문제점이 될 수 있다 4. 그 외 저마그네슘혈증과 관련된 심혈관계 증상 발생의 위험성 증가, 기억력 손상 및 시청각을 포함한 신경학적 부작용 위험성, 타 약물과 상호 작용 시 독성 유발 위험성과 같은 부작용도 보고되었으며, 국내 불응성 GERD의 비율이 약 26% 이른다 5-8. 그러므로 GERD로 장기 치료가 필요한 경우, 합병증 발생이 우려되는 경우, 불응성 GERD 경우 등을 고려했을 때, PPI를 대체할만한 약물 연구가 기존의 PPI 기전과 다른 방향에서 다각도로 요구된다. 단삼(丹蔘)은 Salvia miltiorrhiza의 뿌리이며, 한의학에서 消腫, 通經, 止痛, 活血 등 효능으로 心腹刺痛을 포함한 병증에서 다양하게 쓰여 왔다. 단삼음(丹蔘飮)은 군약으로 丹蔘, 좌사약으로 檀香, 砂仁을 배합한 처방이며 군약 丹蔘의 活血祛瘀, 調經止痛하는 효능, 檀香의 理氣하고 和胃하는 효능과 砂仁의 溫脾하고 化濕開胃하는 효능을 활용해 3가지를 배합하여 제반 위완부 통증과 심통에 폭넓게 사용해 왔다 9-11. 이러한 단삼과 단삼음의 한의학적 효능 및 활용 증상은 GERD의 대표적 증상인 흉부 작열감과 비전형적 흉부 통증 등에도 적용이 용이하다. 더불어 현대에 여러 연구들에서도 단삼과 단삼음과 관련해 지속적으로 항염증, 항산화, 항암 효과들이 보고되어 왔다 12-17. 따라서 기존 연구들에서 꾸준히 제시된 항염증, 항산화, 항암 효과 등을 기반으로, 단삼과 단삼음이 역류성 식도염 치료와 예방에 있어서 긍정적인 효과를 나타낼 수 있으리라 사료되어 본 연구의 치료 약물로 선정하였다. GERD 및 급만성 역류성 식도염과 관련된 기존의 한의과 연구들을 살펴보면, 특정 처방 또는 단독 및 복합 약재 추출물을 대상으로 꾸준히 실험 연구들이 이뤄져 왔다. 이진탕 18,19, 반하사심탕 20, 좌금환 21과 같은 처방을 비롯해 오수유 22,23, 황련 24, 인진호 25, 진피 26, 대황⋅감초 복합 추출물 27, 빈랑자⋅천련자 복합 추출물 28, 해표초, 와릉자, 모려 29, 유근피 30 등을 대상으로 다양한 연구들에서 그 효과가 보고되어왔다. 단삼과 담삼음이 GERD의 대표적 증상인 흉부 작열감과 비전형적 흉부 통증에 활용될 수 있음에도 불구하고 국내 연구는 항염증, 항산화, 항암 효과에 관련한 연구를 제외하고는 주로 심뇌혈관계에 관련한 연구 31-33가 대부분이고, 소화기 질환 관련 연구로는 소화성 궤양에 관련한 연구 34가 있었으나, GERD 치료에 있어 단삼과 단삼음의 효과를 평가하는 연구는 없었고 하물며 GERD의 대표적인 치료제인 PPI와 비교하면서 동시에, 단삼 단독 약재와 단삼음 처방의 효과를 비교 평가한 연구는 없었다. 본 연구는 역류성식도염 동물 모델 실험을 통해 식도 점막의 손상 방어 효과에 대한 육안적 관찰과 더불어 항산화, 항염증, 점막보호, 세포 사멸(apoptosis) 조절, 산 분비 조절, 내장신경계통 조절을 포함한 총 6가지 효과 항목에서 면역조직화학 검사를 시행하였다. 이를 통해 단삼과 단삼음의 역류성 식도염 억제 효과를 PPI Omeprazole과 비교하여 종합적으로 확인하였고, 무엇보다 한의학 이론에 따라 배합된 단삼음 처방이 단삼만 단독 사용했을 때에 비해 우수한 부분이 있을 것으로 기대하여 단삼과 단삼음의 효과를 비교 평가하였다. 이후 AGS 및 HEp-2 세포주를 이용해 단삼과 단삼음의 암세포 이동률 감소 효과와 세포독성 농도 IC50및 세포 사멸(apoptosis) 효과를 함께 살펴보았다.
II. 실험 재료와 방법
1. 실험 재료
1) 실험동물
중아바이오(JABIO, Korea)에서 분양받은 태령 8주 된 ICR계 수컷 생쥐를 무균사육 장치 내에서 2주일 동안 적응시킨 후 체중 30±2 g 된 생쥐를 선별하여 사용하였다. 어떤 처치도 시행하지 않은 대조군(Ctrl), 역류성 식도염 유발군(GERDE), Omeprazole 투여 후 역류성 식도염 유발군(OMET), 단삼 추출물 투여 후 역류성 식도염 유발군(SMeT), 단삼음 추출물 투여 후 역류성 식도염 유발군(DSEeT)으로 총 5개 군을 나누었으며, 각 군에 각 10마리씩 배정하였다.
실험 기간 동안 식이로는 역류 증상의 빈도를 증가시켜 증상을 심화시키려는 목적으로 고지방식 (fat, 60%; carbohydrate, 20%; protein, 20%; DIO DIET, USA)을 자유 섭식시켰다 35. 본 연구 과정은 세명대학교 IACUC 승인을 받아 시행되었으며(IACUC number: smecae 20-09-02) , 실험실 동물의 관리와 사용에 대해서는 NIH 가이드라인에 따라 시행되었다.
2) 세포주와 세포 배양
실험에 사용한 위암 세포주 AGS cell과 식도암 세포주 HEp-2 cell은 ATCC(American Type Culture Collection, USA)에서 구입하였다. HEp-2 cell(Human Epithelial type 2 cell)은 본래 후두암 기원 세포로, 편평 상피암 세포이며 식도암 또한 대부분 편평 상피암이다. GERD가 만성화되면 원위부 식도에서 위 상피 화생이 발생하는 바레트 식도로 진행할 수 있는데, 이는 식도 선암의 주요 원인이 되고 위선암과 유사하다 2. 그러므로 위선암 세포인 위암 세포주 AGS cell과 편평 상피암 세포주 HEp-2 cell을 이용하여 식도 전반에 발생할 수 있는 암에 대해 단삼과 단삼음의 항암 효과를 살펴보았다. 세포는 37 °C, 5% CO 2 incubator(Sanyo, Japan)에서 10% Fetal Bovine Serum(Sigma, USA)가 함유된 Dulbecco’s modified Eagle’s medium(DMEM, Welgin, Korea)을 사용하여 배양하였다. 오염방지를 위해 항생제로 100 unit/ml penicillin(Sigma, USA), 100 μg/ml streptomycin(Gibco/BRL, USA)을 첨가하였다. 실험과정의 모든 세포는 70-80% 정도의 밀도시 계대배양하여 준비하였다.
3) 치료약물
실험에 사용된 한약재 단삼( Salvia miltiorrhiza Bunge)과 단삼음( Dansam-eum)은 본초마루에서 구입하였다. 단삼음 처방은 時方歌括이 원출전으로 단삼, 단향, 사인으로 구성되어 있으며 이에 의거하였다 10( Table 1).
Table 1
Amount and Composition of Dansam-eum (DSE) Extract
|
Scientific name |
Part used |
Latin name |
Weight (g) |
|
Salvia miltiorrhiza BUNGE
|
Roots |
SalviaeMiltiorrhizae Radix
|
(丹蔘) |
30 |
|
Amomum xanthioides WALLICH
|
Fruit |
Amomi Fructus
|
(砂仁) |
5 |
|
Santalum album L.
|
Lignum |
Santali Albae Lignum
|
(檀香) |
5 |
|
|
Total |
40 |
단삼 120 g을 증류수 1000 ml에 넣고 3시간 동안 전탕한 후 여과하였다. 그 여액을 rotary evaporator를 이용하여 50 ml으로 감압⋅농축한 후 동결 건조하여 28.5 g을 추출하였다(수득률 23.8%). 획득된 단삼 추출물을 GERD 유발 14일 전부터 매일 238 mg/kg량으로 생리식염수에 희석한 후 100 μl를 경구투여 하였다.
단삼음 4첩(160 g, Table 1)을 동일한 방법으로 39.3 g을 추출하였다(수득률 24.5 %). 획득된 단삼음 추출물을 GEDR 유발 14일 전부터 매일 328 mg/kg량으로 생리식염수에 희석한 후 100 μl를 경구투여 하였다. 단삼과 단삼음에 대한 활성 대조 약물로 프로톤펌프억제제 Omeprazole(신일제약, Korea)를 선정하고 GERD 유발 14일 전부터 매일 40 mg/kg씩 구강투여 하였다.
2. 실험 방법
1) 역류성 식도염 동물 모델을 이용한 치료 효과 측정
(1) 치료약물 처리 후 역류성 식도염 유발
치료약물을 GERD 유발하기 14일 전부터 매일 1일 1회 경구투여하였으며, 수술 1시간 전에 마지막 약물 투여를 시행했다. Nakamura 등 36의 방법을 이용해 역류성 식도염을 유발하였는데, 수술은 24시간 전부터 절식시킨 실험 쥐를 sodium pentobarbital로 마취시킨 후 복강을 열고 위의 기저부와 분문부 쪽을 micro-cable tie(대한과학, Korea)로 결찰하였다. 봉합 48시간 후 실험동물을 희생시켜 실험동물의 위식도 연결부(gastroesophageal junction, GEJ)를 절취하여 실험에 이용하였다. 한편 위식도 연결부 주변 외부형태의 변화 관찰을 위해 steroscope (olympus, Japan)을 이용하여 4배율로 촬영하였다. (2) 조직절편 제작
Vascular rinse와 10% 중성 포르말린 용액으로 심장 관류를 고정하였다. 위식도 연결부와 하부 식도를 적출한 후 실온에서 24시간 동안 10% NBF로 고정하였다. 고정된 조직은 통상적인 방법으로 paraffin에 포매한 후 5 μm 두께의 연속 절편으로 제작되었다.
(3) 조직화학검사
위식도 연결부의 위점막과 하부 식도의 조직 손상을 관찰하기 위해 phloxine-tartrazine 염색법을 실시하였다. Mayer’s hematoxylin에 5분간 핵 염색을 한 후 phloxine 용액으로 30분간 반응시켰다. 이후 tartrazine 용액에서 분별 후 광학현미경(BX 60, Olympus, Japan)을 이용하여 100배율로 관찰하였다.
장기투여에 따른 부작용 여부를 관찰하기 위해 위식도 연결부, 하부 식도 그리고 간 조직에 대해 Masson trichrome 염색을 실시하여 조직 구조 변화를 관찰하였다. 또한 약물 투여에 따른 간세포 내 부작용 유발 여부도 Masson trichrome 염색을 통해 이루어졌다.
(4) 면역조직화학검사
특정 부위의 손상 여부와 양상을 확인하기 위해서 면역조직화학 검사들을 시행하였다. 위식도 연결부의 위점막과 하부 식도의 조직 내 면역조직학적 변화를 조사하기 위해 8-OHdG(Abcam, USA), p-IκB(Abcam, USA), PAR2(Abcam, USA), COX-1 (Abcam, USA), Cathelicidin(Abcam, USA), p-JNK (Abcam, USA), Caspase 3(Abcam, USA), ATP6V1B1 (Abcam, USA), GRPR(Abcam, USA), Serotonin (Abcam, USA) 그리고 NPY(Abcam, USA) 등을 이용한 면역조직화학 염색을 실시하였다. 우선 조직 절편을 proteinase K(20 μg/ml)에 5분 동안 proteolysis 과정을 거친 후 blocking serum인 10% normal goat serum에서 2시간 동안 반응시켰다. 그리고 1차 항체에 4 °C humidified chamber에서 72시간 동안 반응시켰다. 그런 다음 2차 항체인 biotinylated goat anti-mouse IgG(1:100, Abcam, USA)에 실온에서 24시간 link 하였고, 그런 다음 avidin biotin complex kit(Vector Lab, USA)에 1시간 동안 실온에서 반응시켰다. 0.05% 3,3’-diaminobenzidine과 0.01% HCl이 포함된 0.05M tris-HCl 완충용액(pH 7.4)에서 발색시킨 후, hematoxylin으로 대조 염색하였다.
2) 암 세포주를 이용한 항암 효과 측정
형태학적으로 항암 효능을 평가할 수 있는 실험을 진행하기 위해 세포독성 평가와 wound healing assay를 선택해 시행하였다. 항암 효능은 일반적으로 암세포의 사멸 또는 세포 이동을 억제하는 농도로 평가한다. 특히 위식도의 염증이나 위식도암 치료에서 상피세포 이동을 억제하는 것이 중요하므로 wound healing assay를 통해 세포 이동률 감소 효과를 분석하였다. 또한 미토콘드리아 형태 분석을 통해 세포 사멸(apoptosis) 가능성을 추정하였고, Hoechst 염색을 통해 핵을 염색하여 관찰함으로써 확실한 apoptosis 소견을 제시하였다.
(1) 세포 생존율에 미치는 영향 분석
암 세포주에 대한 세포독성 평가를 수행하였다. 세포독성 평가를 위해서 96 well에 암세포(1×104/well)를 분주하고 24시간 배양하였다. 배양 후 독성농도를 평가하기 위해 단삼과 단삼음 추출물을 20 mg/mL 이내에서 처리하였다. 24시간 동안 배양된 배양액 위에 20 ul의 WST-1을 처리하여 4시간 동안 배양하고 microplate reader로 450 nm에서 흡광도를 측정하였다. 측정된 흡광도는 무처리군에 대해 상대 정량하여 백분율로 환산하고 세포독성 수치를 평가하였으며, 세포가 50% 사멸되는 농도를 IC50으로 정의하였다.
(2) Scratch wound healing assay
암세포에 미치는 항암 효과 평가를 위해서, 암세포의 scratch wound healing assay를 수행하였다. 단삼과 단삼음의 항암 효능 평가는 cell migration 차단 효과를 확인하기 위해 10% 우태아 혈청(fetal bovine serum, FBS)이 포함된 상태에서 수행하였다. 먼저, 암세포(5×105/well)를 6 well plate에 분주하여 24시간 동안 배양하고, 인산염 완충 용액(PBS)으로 1회 세척 후 200 uL tip으로 scratch wound를 만들었다. 그 다음, 우태아 혈청이 포함되지 않은 배지(untreated, UN), FBS, FBS 배지에 단삼(100, 250, 500, 1000 μg/mL)과 단삼음(100, 250, 500, 1000 μg/mL)을 농도별로 세포에 처리해 나누어 관찰하였다. 현미경에서 0시간과 24시간의 scratch wound를 관찰하고 CCD 카메라(charge-coupled device camera)로 촬영 후 기록하였다. AGS 세포의 scratch wound healing 분석은 세포의 이동 거리를 imageJ 프로그램으로 분석하였고, 0시간으로부터 24시간까지의 세포 이동 거리를 상대적으로 정량화하여 그래프로 나타내었다.
(3) 미토콘드리아 형태 분석과 Hoechst 염색
암 세포의 세포 사멸(apoptosis)을 평가하기 위해서 미토콘드리아 형태 분석과 Hoechst 염색을 수행하였다.
3) 영상분석과 통계
각 군별 10마리의 실험 동물에 대해 검사 항목마다 영상분석을 시행하였다. 영상분석은 Image Pro (Media cybernetics, USA)를 이용해 수치화 되었다. 위의 경우 위식도 연결부 주변부를 100배로 확대하여 촬영 후 20,000,000 pixel cell 영역에서 intensity (80-100) 측정⋅계수하였다. 식도의 경우 하부 식도 주변부도 동일한 방법으로 측정⋅계수하였다.
통계는 SPSS software(SPSS 25, SPSS Inc., USA)를 이용하였으며, one-way ANOVA 분석을 시행하였다. P값이 0.05 미만인 경우를 유의수준으로 설정하였고, 사후 검증은 Tukey HSD를 실시하였다.
III. 결 과
1. 역류성 식도염 동물 모델을 이용한 치료 효과 검증
1) 육안적 관찰 및 조직학적 조사
위 결찰술(gastric ligation) 후 위식도 연결부와 하부 식도 부위에서 육안적 관찰을 위해 steroscope를 이용한 촬영 결과, 출혈성 미란(hemorrhagic erosion) 발생 정도는 역류성 식도염 유발군(GERDE)에서 가장 크게 관찰되었다. GERDE 다음으로 오메프라졸군(OMET), 단삼군(SMeT), 단삼음군(DSEeT) 순으로 손상 정도가 감소하며 관찰되었다.
위식도 연결부와 하부 식도 부위에 phloxine- tartrazine 염색을 통한 조직학적 조사 결과, 심각한 점막 손상(편평상피세포 비후, 점막상피 기저세포 과형성, 세포사이간벽 붕괴, 고유층내 염증관여세포 이주 증가)이 관찰되었다. 손상 정도는 GERDE에서 가장 크게 관찰되었으며, GERDE 다음으로 오메프라졸군, 단삼군, 단삼음군 순으로 손상 정도가 감소하며 관찰되었다( Fig. 1).
Fig. 1
Regulation of oxidative stress in stomach and esophagus by SM and DSE.
Ctrl : no GERD elicited group, GERDE : GERD elicited group, OMET : medicine as omeprazole treat group before GERD elicitation, SMeT : medicine as extraction of Salvia miltiorrhiza Bunge treat group before GERD elicitation, DSEeT : medicine as extraction of Dansam-eum treat group before GERD elicitation, Square Box : hemorrhagic erosion, ESO : Esophagus, STO : stomach, MC : Mucosa, LP : laminar propria, SM : sub mucose, Ext. Morph bar size : 1 mm, P/T bar size : 50 μm, Ext. Morph : external Morphology, P/T : Phloxine-Tartrazine stain

2) 항산화 효과
위식도 연결부와 하부 식도의 육안적 손상 부위에 있어서 산화적 스트레스에 따른 손상 정도를 조사하고 항산화 효과를 살펴보기 위해 8-OHdG 면역조직화학 검사를 시행하였다.
위식도 연결부에서 GERDE는 Ctrl에 비해 8-OHdG 양성반응이 1571% 증가하였다. 약물 처리군에서는 GERDE보다 낮은 증가 양상을 보였는데, Ctrl에 비해 오메프라졸군은 855%, 단삼군은 535%, 단삼음군은 343% 증가하였다.
하부 식도 부위에서 GERDE는 Ctrl에 비해 8-OHdG 양성반응이 577% 증가하였다. 약물 처리군에서는 GERDE보다 낮은 증가 양상을 보였는데, Ctrl에 비해 오메프라졸군은 338%, 단삼군은 278%, 단삼음군은 210% 증가하였다( Table 2).
Table 2
Image Analysis of 8-OHdG in Stomach and Esophagus for Mitigative of GERD by SM and DSE
|
Objective |
Group |
|
|
Ctrl |
GERDE |
OMET |
SMeT |
DSEeT |
|
8-OHdG (Stomach) |
5,512±134 |
92,134±1590 |
52,649±1191*
|
34,980±964*#
|
24,431±1343*#+
|
|
8-OHdG (Esophagus) |
15,270±1078 |
103,437±1579 |
66,873±1040*
|
57,765±1048*#
|
47,392±1127*#+
|
3) 항염증 효과
위식도 연결부와 하부 식도 부위에서 항염증 효과를 조사하기 위해 p-IκB 면역조직화학 검사를 시행하였고, 하부 식도 부위에서 추가로 PAR2 면역조직화학 검사를 시행하였다.
위식도 연결부에서 시행한 p-IκB 면역조직화학 검사 결과, GERDE는 Ctrl에 비해 p-IκB 양성반응이 353% 증가하였다. 약물 처리군에서는 GERDE보다 낮은 증가 양상을 보였는데, Ctrl에 비해 오메프라졸군은 254%, 단삼군은 159%, 단삼음군은 125% 증가하였다.
하부 식도 부위에서 시행한 p-IκB 면역조직화학 검사 결과, GERDE는 Ctrl에 비해 p-IκB 양성반응이 1187% 증가하였다. 약물 처리군에서는 GERDE보다 낮은 증가 양상을 보였는데, Ctrl에 비해 오메프라졸군은 661%, 단삼군은 520%, 단삼음군은 466% 증가하였다.
하부 식도 부위에서 초기 염증 조절을 조사하기 위해 추가로 PAR2 면역조직화학 검사를 시행하였다. 그 결과, GERDE는 Ctrl에 비해 PAR2 양성반응이 417% 증가하였다. 약물 처리군에서는 GERDE보다 낮은 증가 양상을 보였는데, Ctrl에 비해 오메프라졸군은 228%, 단삼군은 160%, 단삼음군은 109% 증가하였다( Table 3).
Table 3
Image Analysis of p-IκB, PAR2 in Stomach and Esophagus for Mitigative of GERD by SM and DSE
|
Objective |
Group |
|
|
Ctrl |
GERDE |
OMET |
SMeT |
DSEeT |
|
p-IκB (Stomach) |
20,088±551 |
91,049±1015 |
71,122±914*
|
52,003±1000*#
|
45,142±786*#+
|
|
p-IκB (Esophagus) |
6,765±190 |
87,042±704 |
51,457±1751*
|
41,975±637*#
|
38,323±703*#+
|
|
PAR2 (Esophagus) |
17,353±770 |
89,593±1483 |
56,862±830*
|
45,152±1064*#
|
36,185±954*#+
|
4) 점막보호 효과
점막보호 효과를 관찰하기 위해 위식도 연결부위에서 COX-1, 하부 식도 부위에서 Cathelicidin 면역조직화학 검사를 시행하였다.
위식도 연결부에서 mucose 분비를 통한 위 점막 장벽 형성 효과를 조사를 위해 시행한 COX-1 면역조직화학 검사 결과, Ctrl에 비해 GERDE와 오메프라졸군에서 양성반응이 각각 27%, 17% 감소하였다. 반면 단삼군과 단삼음군은 Ctrl에 비해 증가하는 양상을 보였는데, 단삼군은 39%, 단삼음군은 67% 증가하였다.
하부 식도 부위에서 외부에 대한 위장관 표면의 면역 방어 효과를 조사하기 위해 시행한 Cathelicidin 면역조직화학 검사 결과, Ctrl에 비해 GERDE에서 양성반응이 71% 감소하였다. 약물 처리군에서는 GERDE보다 높은 방어장벽 형성 양상을 보였는데, Ctrl에 비해 오메프라졸군은 58%, 단삼군은 36%, 단삼음군은 20% 감소하여 GERDE에 비해 낮은 감소 양상을 보였다( Table 4).
Table 4
Image Analysis of COX-1 in Stomach and Cathelicidin in Esophagus for Mitigative of GERD by SM and DSE
|
Objective |
Group |
|
|
Ctrl |
GERDE |
OMET |
SMeT |
DSEeT |
|
COX-1 (Stomach) |
22,948±706 |
16,836±536 |
19,057±375*
|
31,998±538*#
|
38,365±362*#+
|
|
Cathelicidin (Esophagus) |
72,761±1424 |
21,460±850 |
30,452±995*
|
46,619±823*#
|
58,223±591*#+
|
5) 세포 사멸(apoptosis) 조절 효과
위식도 연결부와 하부 식도 부위에서 세포 사멸(apoptosis) 조절 효과를 관찰하기 위해 p-JNK, Caspase 3 면역조직화학 검사를 시행하였다.
위식도 연결부에서 시행한 p-JNK 면역조직화학 결과, GERDE는 Ctrl에 비해 p-JNK 양성반응이 338% 증가하였다. 약물 처리군에서는 GERDE보다 낮은 증가 양상을 보였는데, Ctrl에 비해 오메프라졸군은 192%, 단삼군은 99%, 단삼음군은 77% 증가하였다. 하부 식도 부위에서 시행한 p-JNK 면역조직화학 결과, GERDE는 Ctrl에 비해 p-JNK 양성반응이 382% 증가하였다. 약물 처리군에서는 GERDE보다 낮은 증가 양상을 보였는데, Ctrl에 비해 오메프라졸군은 209%, 단삼군은 119%, 단삼음군은 78% 증가하였다.
위식도 연결부에서 시행한 Casapase 3 면역조직화학 결과, GERDE는 Ctrl에 비해 Caspase 3 양성반응이 480% 증가하였다. 약물 처리군에서는 GERDE보다 낮은 증가 양상을 보였는데, Ctrl에 비해 오메프라졸군은 309%, 단삼군은 206%, 단삼음군은 188% 증가하였다. 하부 식도 부위에서 시행한 Caspase 3 면역조직화학 결과, GERDE는 Ctrl에 비해 Caspase 3 양성반응이 1419% 증가하였다. 약물 처리군에서는 GERDE보다 낮은 증가 양상을 보였는데, Ctrl에 비해 오메프라졸군은 740%, 단삼군은 511%, 단삼음군은 384% 증가하였다( Table 5).
Table 5
Image Analysis of p-JNK, Caspase 3 in Stomach and Esophagus for Mitigative of GERD by SM and DSE
|
Objective |
Group |
|
|
Ctrl |
GERDE |
OMET |
SMeT |
DSEeT |
|
p-JNK (Stomach) |
22,477±489 |
98,473±903 |
65,600±1116*
|
44,781±1137*#
|
39,798±538*#+
|
|
p-JNK (Esophagus) |
21,787±384 |
104,936±1686 |
67,270±751*
|
47,612±1194*#
|
38,820±939*#+
|
|
Caspase 3 (Stomach) |
15,417±756 |
89,423±847 |
63,090±1389*
|
47,186±866*#
|
44,405±773*#+
|
|
Caspase 3 (Esophagus) |
6,046±359 |
91,853±725 |
50,760±923*
|
36,913±731*#
|
29,286±632*#+
|
6) 산 분비 조절 효과
위식도 연결부에서 Proton pump 및 산 분비 조절 효과를 관찰하기 위해 ATP6V1B1, GRPR 면역조직화학 검사를 시행하였다.
그 결과, ATP6V1B1는 Ctrl에 비해 GERDE에서 양성반응이 330% 증가하였다. 약물 처리군에서는 GERDE보다 낮은 증가 양상을 보였는데, Ctrl에 비해 오메프라졸군은 138%, 단삼군은 128%, 단삼음군은 81% 증가하였다.
또한 GRPR은 Ctrl에 비해 GERDE에서 양성반응이 697% 증가하였다. 약물 처리군에서는 GERDE보다 낮은 증가 양상을 보였는데, Ctrl에 비해 오메프라졸군은 224%, 단삼군은 161%, 단삼음군은 158% 증가하였다( Table 6).
Table 6
Image Analysis of ATP6V1B1, GRPR in Stomach for Mitigative of GERD by SM and DSE
|
Objective |
Group |
|
|
Ctrl |
GERDE |
OMET |
SMeT |
DSEeT |
|
ATP6V1B1 |
8,205±157 |
35,321±621 |
19,530±393*
|
18,692±221*#
|
14,863±661*#+
|
|
GRPR |
11,620±808 |
92,641±1130 |
37,700±742*
|
30,319±640*#
|
29,940±565*#+
|
7) 내장신경계통 조절 효과
하부 식도 부위에서 내장신경계통 조절 효과를 조사하기 위해 Serotonin, NPY 면역조직화학 검사를 시행하였다.
그 결과, Serotonin의 경우 Ctrl에 비해 GERDE는 35%, 오메프라졸군은 29% 감소한 반면, 단삼군과 단삼음군은 Ctrl에 비해 증가하여 단삼군은 67%, 단삼음군은 38% 증가한 것으로 관찰되었다.
또한 NPY의 경우도 Ctrl에 비해 GERDE는 59%, 오메프라졸군은 36% 감소한 반면, 단삼군과 단삼음군은 Ctrl에 비해 증가하여 단삼군은 35%, 단삼음군은 73% 증가한 것으로 관찰되었다( Table 7).
Table 7
Image Analysis of Serotonin, NPY in Esophagus for Mitigative of GERD by SM and DSE
|
Objective |
Group |
|
|
Ctrl |
GERDE |
OMET |
SMeT |
DSEeT |
|
Serotonin |
39,067±1109 |
25,481±1098 |
27,802±287*
|
65,284±511*#
|
53,862±616*#+
|
|
NPY |
33,060±821 |
13,474±653 |
21,096±665*
|
44,594±815*#
|
57,067±551*#+
|
2. 암 세포주를 이용한 항암 효과 검증
1) 위암 세포에 대한 항암 효과
(1) AGS 세포 생존율 측정
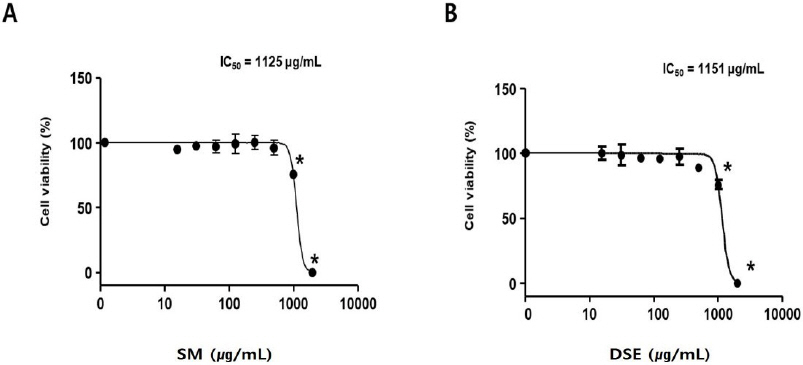
단삼과 단삼음이 위암 세포에 대해 항암 효과가 있는지 확인하기 위해 AGS 세포주에 대한 세포독성 평가를 수행하였다. 세포독성 IC 50은 단삼은 1125 μg/mL, 단삼음은 1151 μg/mL로 나타났다( Fig. 2).
Fig. 2
Effects of SM and DSE on AGS cells.
AGS cells were treated with SM (A) or DSE (B) for 24 h. Cell viability was measured by WST-1 (4-[3- (4-Iodophenyl)-2-(4-nitrophenyl)-2H-5-tetrazolio]-1,3-benzene Disulfonate) assay. These data are expressed as mean percentages relative to the untreated group±standard deviations. * : P<0.05 vs. untreated group.
(2) AGS 세포에 대한 scratch wound healing assay 결과
단삼과 단삼음의 AGS 세포 이동률 감소 효과를 확인하기 위해 scratch wound healing assay를 수행하였다.
단삼 처리 실험에서 UN군에 비해 FBS군의 세포 이동률은 약 234.59±16.27%로 유의성 있게 증가하였다. 반면 FBS에 단삼을 250, 500, 1000 μg/mL의 농도로 처리한 경우, 세포 이동률은 FBS군 대비 각각 47.37±11.75%, 183.46±11.06%, 191.73±0.4%로 유의성 있게 감소하였다( Fig. 3).
Fig. 3
Effects of SM on scratch wound-healing of AGS cells.
(A) The photographs representative the scratch wound healing on stimulated with SM in AGS cells. Cells were treated with SM (100-1000 μg/mL) in DMEM for 24 h, respectively. (0 h) a white lines indicate the initial scratches; (24 h); a white lines indicate the migrated cell position; Magnification×200.
(B) Migration rates of AGS cells relative to the untreated group (%). UN : untreated group. Results are presented as mean±standard deviation. * : P<0.05 verse untreated group, # : P<0.05 verse FBS group.
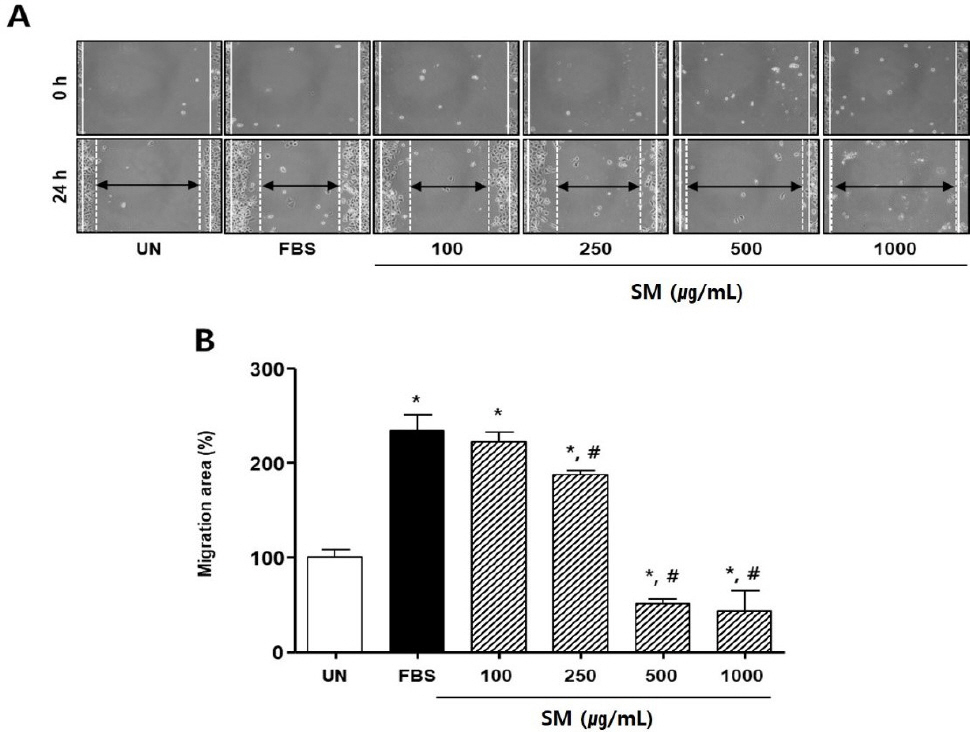
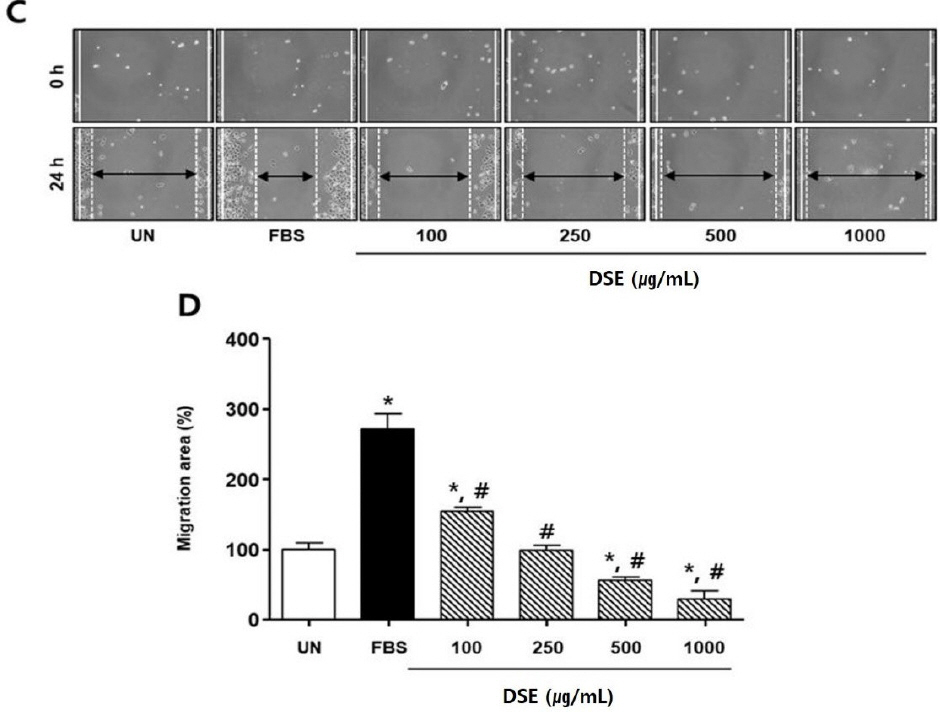
단삼음 처리 실험에서도 FBS군은 유의성 있게 세포 이동률이 증가하였다. 반면 FBS에 단삼음을 100, 250, 500, 1000 μg/mL의 농도로 처리한 경우, 세포 이동률은 FBS군 대비 각각 117.3±16.6%, 172.2±15.3%, 215.0±17.9%, 242.1±10.1%로 유의성 있게 감소하였다( Fig. 4).
Fig. 4
Effects of DSE on scratch wound-healing of AGS cells.
(C) The photographs representative the scratch wound healing on stimulated with DSE (C) in AGS cells. Cells were treated with DSE (100-1000 μg/mL) in DMEM for 24 h, respectively. (0 h) a white lines indicate the initial scratches; (24 h); a white lines indicate the migrated cell position; Magnification×200.
(D) Migration rates of AGS cells relative to the untreated group (%). UN : untreated group. Results are presented as mean±standard deviation. * : P<0.05 verse untreated group, # : P<0.05 verse FBS group.
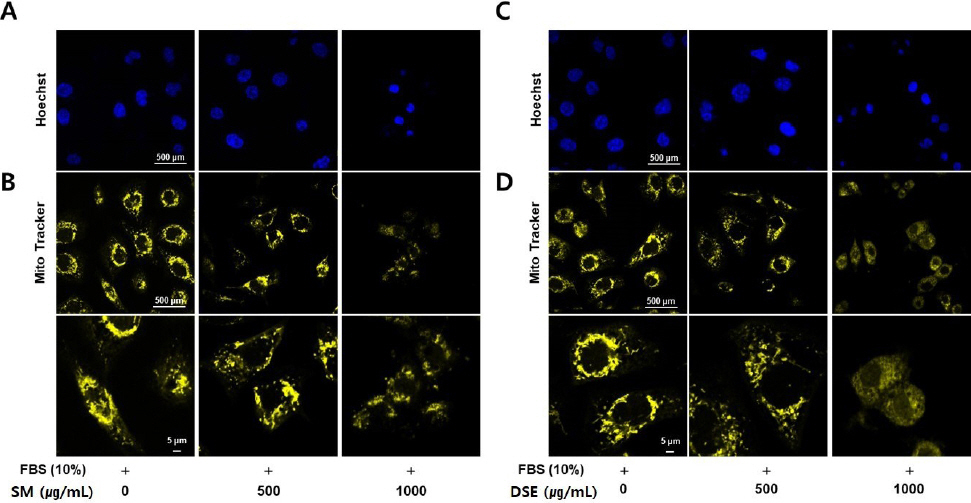
(3) AGS 세포에 대한 미토콘드리아 형태 분석과 Hoechst 염색
단삼과 단삼음이 위암 세포에 미치는 세포 사멸(apoptosis) 효과를 평가를 위해서, AGS 세포의 미토콘드리아 형태 분석과 Hoechst 염색을 수행하였다.
그림과 같이, Hoechst 결과상 무처리군에서는 핵의 응축 형태가 나타나지 않은 반면, 단삼 혹은 단삼음을 처리하였을 때 농도 의존적으로 핵의 응축 형태가 증가하였다. 미토콘드리아는 정상적인 형태일 경우 mito Tracker에서 긴 형태를 유지하는 형광 밝기를 보였으나, 단삼 혹은 단삼음 처리 시 fission 형태인 조각난 형태를 보여주었다( Fig. 5).
Fig. 5
Effects of SM and DSE on apoptosis in AGS cells.
The AGS cells were seeded (1×104 cells/mL) in slide and treated with SM (500 and 1000 μg/mL) or DSE (500 and 1000 μg/mL) for 24 h.
(A and C) Cells were fixed using 4% formaldehyde for 5 min. The nuclear stained with Hoechst (excitation : 361, emission : 497) solution for 10 min at room temperature.
(B and D) The live cells were incubated with Mito Tracker solution (exitation : 581 nm, emission : 644 nm) for 30 min at 37 °C. Fluorescence images were obtained by fluorescence microscopy.
2) 식도암 세포에 대한 항암 효과
(1) HEp-2 세포 생존율 측정
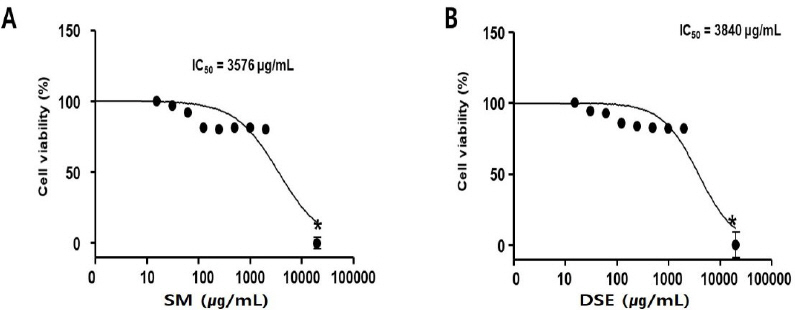
단삼과 단삼음이 식도암 세포에 대해 항암 효과가 있는지 확인하기 위해 HEp-2세포주에 대한 세포독성 평가를 수행하였다. 그 결과, 세포독성 IC 50은 단삼은 3576 μg/mL, 단삼음은 3840 μg/mL로 나타났다( Fig. 6).
Fig. 6
Effects of SM and DSE on HEp-2 cells.
HEp-2 cells were treated with SM (A) or DSE (B) for 24 h. Cell viability was measured by WST-1 (4-[3-(4- Iodophenyl)-2-(4-nitrophenyl)-2H-5-tetrazolio]-1,3-benzene Disulfonate) assay. These data are expressed as mean percentages relative to the untreated group±standard deviations. * : P<0.05 vs. untreated group.
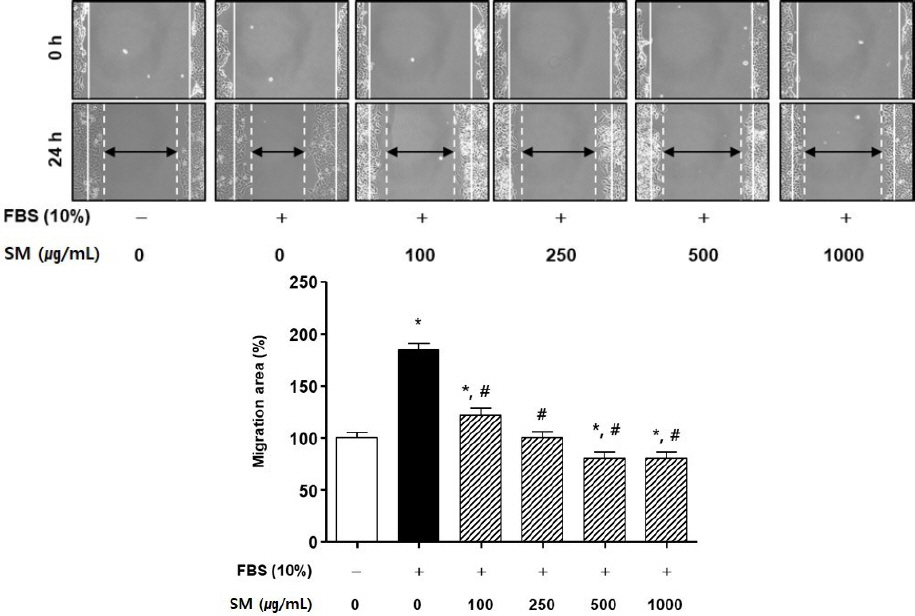
(2) HEp-2세포에 대한 scratch wound healing assay 결과
단삼과 단삼음의 HEp-2 세포 이동률 감소 효과를 확인하기 위해 scratch wound healing assay를 수행하였다.
단삼 처리 실험에서는 UN군에 비해 FBS군의 세포 이동률은 약 184.18±6.85%로 유의성 있게 증가하였다. 반면 FBS에 단삼을 100, 250, 500, 1000 μg/mL의 농도로 처리한 경우, 세포 이동률은 FBS군 대비 각각 62.66±0.1%, 84.18±1.05% 103.80±0.74%, 103.80 ±0.75%로 유의성 있게 감소하였다( Fig. 7).
Fig. 7
Effects of SM on scratch wound-healing of HEp-2 cells.
(A) The photographs representative the scratch wound healing on stimulated with SM in HEp-2 cells. Cells were treated with SM (100-1000 μg/mL) in DMEM for 24 h, respectively. (0 h) a white lines indicate the initial scratches; (24 h); a white lines indicate the migrated cell position; Magnification×200.
(B) Migration rates of HEp-2 cells relative to the untreated group (%). UN : untreated group. Results are presented as mean±standard deviation. * : P<0.05 verse untreated group, # : P<0.05 verse FBS group.
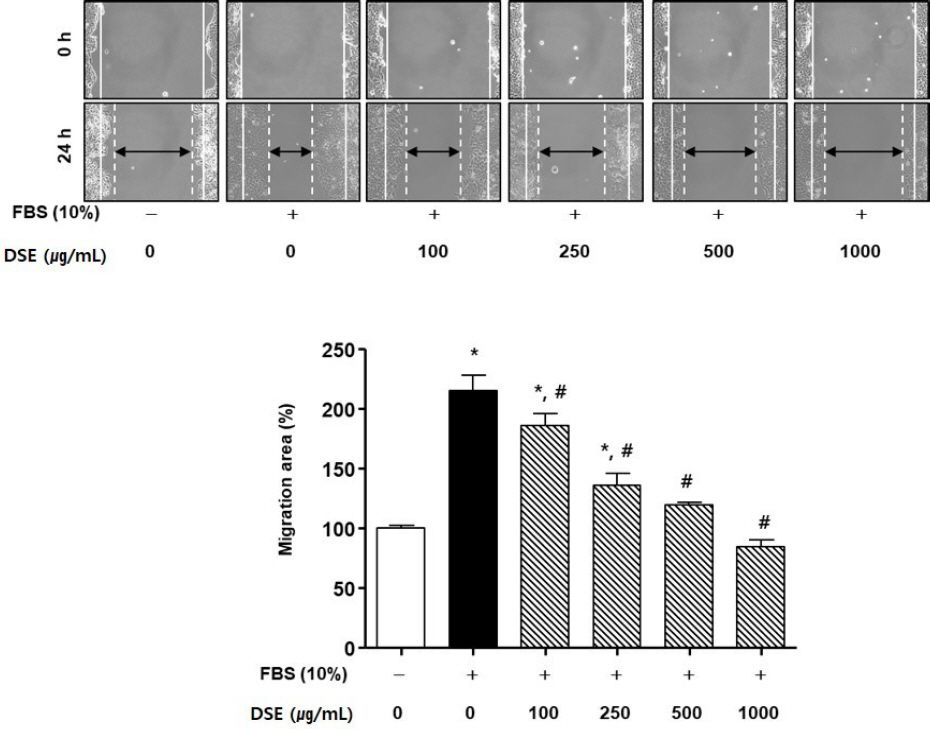
단삼음 처리 실험에서도 FBS군은 유의성 있게 세포 이동률이 증가하였다. 반면 FBS에 단삼음을 100, 250, 500, 1000 ug/mL의 농도로 처리한 경우, 세포 이동률은 FBS군 대비 각각 28.76±2.95%, 79.08± 2.89%, 95.42±10.80%, 130.72±6.88%로 유의성 있게 감소하였다( Fig. 8).
Fig. 8
Effects of DSE on scratch wound-healing of HEp-2 cells.
(C) The photographs representative the scratch wound healing on stimulated with DSE (C) in HEp-2 cells. Cells were treated with DSE (100-1000 μg/mL) in DMEM for 24 h, respectively. (0 h) a white lines indicate the initial scratches; (24 h); a white lines indicate the migrated cell position; Magnification×200.
(D) Migration rates of HEp-2 cells relative to the untreated group (%). UN : untreated group. Results are presented as mean±standard deviation. * : P<0.05 verse untreated group, # : P<0.05 verse FBS group.
(3) HEp-2 세포에 대한 미토콘드리아 형태 분석과 Hoechst 염색
단삼과 단삼음이 식도암 세포에 미치는 세포 사멸(apoptosis) 효과를 평가하기 위해서, HEp-2 세포의 미토콘드리아 형태 분석과 Hoechst 염색을 수행하였다.
그림과 같이, Hoechst 결과상 무처리군에서는 핵의 응축 형태가 나타나지 않은 반면, 단삼 혹은 단삼음을 처리하였을 때 20000 μg/mL에서 핵의 응축 형태가 확인되었다. 미토콘드리아는 정상적인 형태일 경우 mito Tracker에서 긴 형태를 유지하는 형광 밝기를 보였으나, 단삼 혹은 단삼음을 20000 μg/mL 처리 시 fission 형태인 조각난 형태를 보여주었다( Fig. 9).
Fig. 9
Effects of SM and DSE on apoptosis in HEp-2 cells.
The HEp-2 cells were seeded (1×104 cells/mL) in slide and treated with SM (1000 and 20000 μg/mL) or DSE (1000 and 20000 μg/mL) for 24 h.
(A and C) Cells were fixed using 4% formaldehyde for 5 min. The nuclear stained with Hoechst (excitation : 361, emission : 497) solution for 10 min at room temperature.
(B and D) The live cells were incuabted with Mito Tracker solution (exitation : 581 nm, emission : 644 nm) for 30 min at 37 °C. Fluoresscence images were obatined by fluorescnece microscopy.

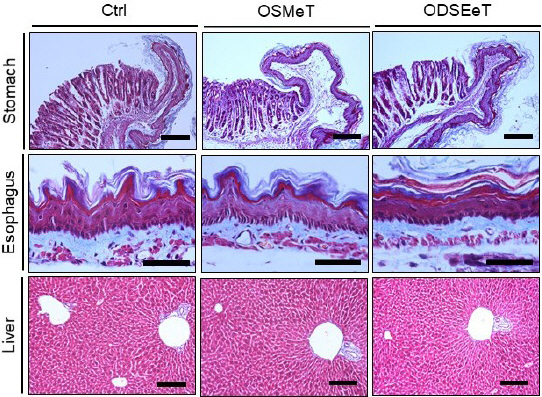
3. 약물 투여에 따른 안전성 평가
Masson trichrome 염색을 통한 조직 구조 변화를 관찰한 결과, 위, 식도 그리고 간에서 모두 병리적 조직은 관찰되지 않았다( Fig. 10).
Fig. 10
No adverse effects in stomach, esophagus and liver by SM and DSE.
Ctrl : no treatment group, OSMeT : medicine as extraction of Salvia miltiorrhiza Bunge treat group, ODSEeT : medicine as extraction of Dansam-eum treat group, bar size : 50 μm.
IV. 고 찰
본 연구에서는 역류성식도염 유발 동물 모델을 이용하여 위식도 연결부와 하부 식도 부위에서 단삼, 단삼음의 치료 효과를 살펴보았다. 식도 점막의 손상 방어 효과에 대한 육안적 관찰과 더불어, 총 6가지 효과 분야(항산화, 항염증, 위산 분비 조절, 점막보호, 세포 사멸(apoptosis) 조절, 내장신경 계통 조절)로 구분해 관찰하고 비교평가 하였다. 또한 위암 및 식도암 세포주를 이용해 단삼과 단삼음의 항암 효과를 살펴봄으로써, 역류성 식도염이 암 발생까지 진행될 때도 상기 약물들이 효과를 가질 수 있는지 관찰하였다. 이를 통해 GERD 및 역류성 식도염의 급만성 상태를 아울러서, 단삼과 단삼음이 기존 치료제인 PPI와 비교했을 때 종합적으로 우수한 효과가 있는지 확인해보았다.
무엇보다도 본 연구는 단삼과 단삼음을 기존 치료제인 PPI와 비교하는 것을 넘어, 단삼과 단삼음 2가지를 비교 평가해보는 것에 중점을 두었다. 이는 한의학적 군신좌사 이론을 바탕으로 배합된 단삼음 처방이 단삼만 단독으로 사용하는 경우보다 상기 효과들에서 우수한 부분을 보일 것으로 기대하였기 때문이다.
1. 역류성 식도염 동물 모델을 이용한 치료 효과 검증
역류성식도염 동물 모델을 이용하여 위식도 연결부와 하부 식도 부위에서 단삼과 단삼음의 치료 효과를 식도 점막의 손상 방어 효과에 대한 육안적 관찰과 함께 총 6가지 분야(항산화, 항염증, 세포 사멸(apoptosis) 조절, 산 분비 점막보호, 산 분비 조절, 내장신경계통 조절)에서 살펴보았다.
먼저 위식도 연결부와 하부 식도 부위에서 육안 상과 phloxine-tartrazine 염색을 통한 조직학적 조사를 통해 손상을 살펴본 결과, 역류성 식도염 유발군(GERDE)은 심각한 출혈성 미란을 보인 반면 약물 처리군은 단삼음군, 단삼군, 오메프라졸군 순으로 낮은 손상 정도를 보였다.
위식도 연결부와 하부 식도 부위에서 항산화 효과는 8-OHdG 면역조직화학 검사를 통해 관찰하였다. 8-OHdG(8-hydroxy-2’-deoxyguanosine)는 산화적 스트레스 손상 정도를 나타내는 중요한 바이오 마커로, 활성 산소종(NOS)은 체세포의 디뉴클레오티드 부위에서 구아닌을 공격하여 8-OHdG를 형성한다 37. 그러므로 8-OHdG 상승을 통해 산화적 손상 정도를 측정할 뿐만 아니라, 암을 포함한 많은 질병의 위험인자 측정에서도 널리 이용되고 있다 38. 검사 결과 GERDE에 비해 약물 처리군은 단삼음군, 단삼군, 오메프라졸군 순으로 낮은 반응 양상을 보였다. 따라서 항산화 효과 정도는 단삼음, 단삼, 오메프라졸 순으로 판단되며, 단삼과 단삼음이 활성 산소로 인한 손상을 방어함으로써 효과를 보였을 것으로 사료 된다. 위식도 연결부와 하부 식도 부위에서 항염증 효과는 p-IκB 면역조직화학 검사를 통해 관찰하였으며, 하부 식도 부위에서 PAR2 면역조직화학 검사를 추가해 관찰하였다. p-IκB(phosphorylated IκB)는 다양한 자극 상황에서 염증반응과 면역체계 등의 조절 과정에서 세포 내 신호전달을 주요하게 담당하는 단백질군인 NF-κB의 활성에 관여하며, 활성 NF-κB의 양을 직접적으로 반영한다 39. PAR2 (proteinase-activated receptor 2)는 다양한 말초의 염증 상황에서 염증과 통증을 유도하며, 만성 염증 매개에서도 중추적인 역할을 한다 40,41. 따라서 GERD의 초기부터 만성까지 주요 손상을 받게 되는 하부 식도 부위에 대해서는 p-IκB 외에도 PAR2를 추가로 검사하였다. 2가지 검사 결과에서 모두 Ctrl에 비해 GERDE의 양성반응은 증가하였는데, 약물 처리군은 GERDE 대비 단삼음군, 단삼군, 오메프라졸군 순으로 낮은 증가 양상을 보였다. 따라서 항염증 효과 정도는 단삼음, 단삼, 오메프라졸 순으로 판단되며, 단삼과 단삼음이 염증 효소 전사 과정뿐만 아니라 만성 염증의 매개 과정 또한 억제함으로써 효과를 보였을 것으로 사료된다. 위식도 연결부에서 점막보호 효과는 COX-1 면역조직화학 검사를 통해 관찰하였다. COX-1 (Cyclooxygenase 1)은 대표적인 위점막 보호 인자로, COX-1 결핍 시 일차적으로 위점막 손상이 발생할 수 있다 42. COX-1은 아라키돈산에서 프로스타글란딘으로 가는 생합성 경로의 중심 효소로, 위점막 내벽의 생성을 촉진하여 위 내부를 보호할 뿐만 아니라 위산과 펩신의 분비를 줄여준다 43. 검사 결과 Ctrl에 비해 GERDE와 오메프라졸군은 양성반응이 감소한 반면 단삼군과 단삼음군에서는 오히려 Ctrl보다 높은 분비 양상을 보였다. Ctrl 대비 단삼음군에서 67%, 단삼군에서 39% 양성반응이 증가해 나타나 오메프라졸군 뿐만 아니라 Ctrl보다도 유의미한 효과를 보인 점이 더욱 주목할 만하다. 하부 식도 부위에서 점막보호 효과는 Cathelicidin 면역조직화학 검사를 통해 관찰하였다. Cathelicidin은 대표적 항균 펩타이드로 호중구에서 기원해 방어체계를 형성하고 위장관 점막 표면 면역력에 중요한 역할을 하기에, 하부 식도 부위에서 외부에 대한 방어장벽 형성 능력을 조사하기 위해 시행하였다 44,45. 검사 결과 Ctrl 대비 GERDE의 양성반응은 감소하였고, 약물 처리군에서는 GERDE 대비 단삼음군, 단삼군, 오메프라졸군 순으로 낮은 감소 양상을 보였다. 따라서 점막보호 효과 정도는 단삼음, 단삼, 오메프라졸 순으로 판단되며, 단삼과 단삼음이 위점막 내벽 생성을 촉진하여 위점막 보호 효과를 높이고 점막 표면의 면역 능력을 향상시킴으로써 효과를 보였을 것으로 사료된다. 위식도 연결부와 하부 식도 부위에서 세포 사멸(apoptosis) 조절 효과는 p-JNK와 Caspase 3 면역조직화학 검사를 통해 관찰하였다. p-JNK(phospho c-Jun N-terminal kinase)는 인산화된 JNK로, JNK는 MAPK 전달계의 주요 구성요소로서 세포 사멸(apoptosis)의 증가와 깊은 연관을 가지며 스트레스 자극에 반응해 세포 사멸(apoptosis) 및 염증반응에 관여한다 46-49. Caspase 3는 많은 핵심 세포 단백질에서 절단을 촉매하며 세포 사멸(apoptosis)의 중요 매개체이자 필수 과정으로, 염증 세포의 apoptosis에도 관여한다 50. 2가지 검사 결과에서 모두 Ctrl에 비해 GERDE의 양성반응은 증가하였고, 약물 처리군은 단삼음군, 단삼군, 오메프라졸군 순으로 낮은 증가 양상을 보였다. 따라서 세포 사멸(apoptosis) 조절 효과 정도는 단삼음, 단삼, 오메프라졸 순으로 판단되며, 단삼과 단삼음이 세포 사멸(apoptosis)을 위한 신호전달 및 중간 매개 과정을 억제함으로써 효과를 보였을 것으로 사료된다. 위식도 연결부에서 산 분비 조절 효과를 ATP6V1B1, GRPR 면역조직화학 검사를 통해 관찰하였다. ATP6V1B1은 양성자 펌프(proton pump; H+ATPase)의 B1 subunit을 전사하는 유전자로, 체내의 산 분비 항상성 유지에 있어 중요한 역할을 한다 51,52. GRPR (Gastrin-releasing peptide receptor)은 가스트린 방출 펩타이드(GRP)의 수용체로 장신경계에서 GRP 방출시 가스트린 국소 농도가 증가해 위산 분비에 영향을 미치며, GRPR은 염증성 병태와도 연관이 깊다 53-55. ATP6V1B1, GRPR 항목 모두에서 GERDE 대비 약물처리군은 단삼음군, 단삼군, 오메프라졸군 순으로 낮은 반응 양상을 보였다. 따라서 효과 정도는 단삼음, 단삼, 오메프라졸 순으로 판단되며, 단삼과 단삼음이 proton pump 기능 및 가스트린 분비 기능 조절을 통해 산 분비를 억제함으로써 효과를 보였을 것으로 사료된다. 하부 식도 부위에서 내장신경계통 조절 효과를 Serotonin, NPY 면역조직화학 검사를 통해 관찰하였다. Serotonin(5-hydroxytryptamine, 5-HT)은 신경전달물질로서 체내 세로토닌의 약 95%는 소화관에 존재하고, 위장관의 분비, 운동, 감각 기능을 포함해 다양한 위장관 기능 조절에 중요한 역할을 한다 56-58. NPY(neuropeptide Y)는 중추 및 말초 신경계의 다양한 과정에 관여하는 신경 펩타이드로, 전체 위장관에 걸쳐 분포된 신경 섬유에 고루 포함되어 있다 59,60. 이와 같이 위장관 신경계통 조절이 원활한 경우 식도로 역류되는 빈도와 정도도 감소할 수 있기에, 하부 식도 부위를 대상으로 상기 항목들을 검사해보았다. 2가지 검사 결과에서 모두 Ctrl에 비해 GERDE와 오메프라졸군의 양성 반응은 감소한 반면, 단삼군과 단삼음군에서는 오히려 Ctrl 대비 증가 양상을 보였다. Serotonin 면역조직화학 결과에서 Ctrl 대비 단삼음군은 38%, 단삼군은 67% 증가하였고, NPY 면역조직화학 결과에서도 Ctrl 대비 단삼음군은 73%, 단삼군은 35% 증가했다. 이와 같이 내장신경계통 조절 효과에 있어 오메프라졸군 뿐만 아니라 Ctrl 보다도 유의미한 효과를 보인 점이 더욱 주목할 만하다. 효과 정도는 Serotonin 항목에서 단삼, 단삼음, 오메프라졸 순으로, NPY 항목에서 단삼음, 단삼, 오메프라졸 순으로 판단된다. 이를 통해 단삼과 단삼음이 위장관 신경계통의 조절을 원활히 하고 위장관의 운동을 포함한 기능을 강화함으로써 효과를 보였으리라 사료된다.
이와 같이 위식도 연결부와 하부 식도 부위에서 단삼과 단삼음은 식도 점막의 손상 방어 효과 및 총 6가지 효과 분야(항산화, 항염증, 점막보호, 세포 사멸(apoptosis) 조절, 산 분비 조절, 내장신경계통 조절)에서 모두 오메프라졸보다 유의미한 수치를 보였다. 특히 점막보호(COX-1)와 내장신경계통 조절(Serotonin, NPY) 효과에서는 오메프라졸군 뿐만 아니라 Ctrl 보다도 유의미한 수치를 나타냈다. 이를 통해 위점막 내벽 생성을 촉진하고 위산으로부터 위점막을 보호하는 기전과 위장관 신경계통의 조절을 원활히 하는 부분에서 특히 단삼과 단삼음의 가능성을 찾아볼 수 있었다. 또한 Serotonin을 제외한 모든 검사 항목에서 단삼음이 단삼보다 유의미한 수치를 보임을 확인할 수 있었다.
2. 암 세포주를 이용한 항암 효과 검증
역류성식도염 동물 실험 후, 암 세포주를 이용하여 단삼과 단삼음의 항암 효과를 전반적으로 관찰해보았다. 암 세포주는 위암 세포주 AGS 세포와 식도암 세포주 HEp-2 세포를 사용하였다. 우선 AGS 세포주에 대해서 단삼, 단삼음의 세포 독성 평가를 시행하였다. IC 50을 항암 효과의 지표로 사용했으며, 이는 50% 억제 농도로 세포 생존율이 50%가 되도록 하는 약물의 농도를 의미한다 61. 해당 항목에서 단삼의 IC 50은 1125 μg/mL, 단삼음은 1151 μg/mL로 단삼의 효과가 단삼음보다 다소 긍정적이었다. 또한 암세포의 이동성 억제 효과를 확인하기 위해 scratch wound healing assay를 시행하였다 62. 해당 항목에서 세포 이동률은 FBS군 대비 단삼 처리군에서 농도 250 μg/mL부터 유의성 있게 감소하였고, 단삼음 처리군에서는 농도 100 μg/mL부터 농도 의존적으로 감소하였다. 결과적으로 두 군 모두 FBS군 대비 유의미한 세포 이동률 감소를 보였고, 특히 단삼 처리군에 비해 단삼음 처리군에서 감소가 더 빠르게 시작되었고 최종적으로도 더 많은 감소율을 보였다. 다음으로 AGS 세포주에서 단삼과 단삼음이 암세포에 미치는 세포 사멸(apoptosis) 효과를 확인하기 위해, Hoechst 염색과 미토콘드리아 형태 분석을 시행하였다. 세포에서 apoptosis가 유발되면 염색체 응축 및 미토콘드리아의 형태학적 변화가 일어나는데, 이를 확인하기 위해 상기 검사들을 수행하였다 63,64. 두 검사 모두에서 무처리군 대비 단삼과 단삼음 처리군은 농도 1000 μg/mL 이하에서 유의미한 핵응축 및 미토콘드리아의 형태 변화가 발생하였고, 이를 통해 연구 약물의 apoptosis 유발 효과를 관찰해볼 수 있었다. 식도암 세포주 HEp-2 세포를 대상으로도 AGS 세포주와 동일하게 검사를 시행하였다. HEp-2 세포주에 대한 단삼, 단삼음의 세포 독성 평가에서 단삼의 IC50은 3576 μg/mL, 단삼음 3840 μg/mL로 단삼의 효과가 단삼음보다 다소 긍정적이었다. scratch wound healing assay 항목에서는 FBS군 대비 단삼과 단삼음 처리군 모두에서 세포 이동률이 농도 100 μg/mL부터 농도 의존적으로 감소하였다. 결과적으로 두 군 모두 FBS군 대비 세포 이동률이 유의성 있게 감소함을 관찰하였다.
HEp-2 세포주에서 대해서도 단삼과 단삼음의 세포 사멸 효과를 관찰하기 위해 Hoechst 염색과 미토콘드리아 형태 분석을 시행하였다. 상기 항목 모두 무처리군 대비 단삼과 단삼음 처리군에서는 농도 20000 μg/mL에서 유의미한 핵응축 및 미토콘드리아 형태 변화를 관찰할 수 있었다. 상기 검사에서 유의미한 결과가 나타난 농도 수치를 고려했을 때, 단삼과 단삼음이 HEp-2 세포주 보다는 AGS 세포주에서 더 긍정적인 효과를 보였음을 알 수 있었다.
마지막으로 단삼과 단삼음 투여의 안전성을 확인을 위해 Masson trhichrome 조직화학 검사를 위, 식도, 간에서 시행하였으며 모두 병리적 조직은 관찰되지 않았다. 이를 통해 부작용이 없음을 확인하였다.
이와 같이 암 세포주 실험에서 AGS 및 HEp-2 세포주에 대해 단삼과 단삼음의 세포 독성과, FBS군 대비 유의미한 세포 이동률 감소를 확인하였다. 따라서 단삼과 단삼음이 암세포에 대해 유의한 독성을 갖고 있을 뿐만 아니라 암세포의 이동 능력을 제어함으로써 전이를 막는 효과가 있다 사료된다. 또한 미토콘드리아 형태 분석 및 Hoechst 염색 결과를 통해, 단삼과 단삼음이 암세포의 apoptosis를 유발하는 기전을 통해 유의미한 항암 효과를 가질 수 있으리라 사료된다.
Ⅴ. 결 론
본 연구에서는 역류성식도염 동물 모델 실험을 통해 단삼과 단삼음의 식도 점막의 손상 방어 효과 및 항산화, 항염증, 점막보호, 세포 사멸(apoptosis) 조절, 산 분비 조절, 내장신경계통 조절 효과를 확인하였고, 암 세포주 실험을 통해 암세포 이동률 억제를 포함한 전반적 항암 효과를 확인하였다.
1. 식도 점막의 손상 방어 효과 육안적 관찰 및 조직학적 조사를 통해 관찰한 결과 단삼음, 단삼, 오메프라졸 순으로 유의성 있는 결과를 확인했다.
2. 항산화 효과 8-OHdG 면역조직화학 검사를 통해 관찰한 결과 단삼음, 단삼, 오메프라졸 순으로 유의성 있는 결과를 확인했다.
3. 항염증 효과 p-IκB, PAR2 면역조직화학 검사를 통해 관찰한 결과 단삼음, 단삼, 오메프라졸 순으로 유의성 있는 결과를 확인했다.
4. 점막보호 효과 COX-1, Cathelicidin 면역조직화학 검사를 통해 관찰한 결과 단삼음, 단삼, 오메프라졸 순으로 유의성 있는 결과를 확인했다.
5. 세포 사멸(apoptosis) 조절 효과 p-JNK, Caspase 3 면역조직화학 검사를 통해 관찰한 결과 단삼음, 단삼, 오메프라졸 순으로 유의성 있는 결과를 확인했다.
6. 산 분비 조절 효과 ATP6V1B1, GRPR 면역조직화학 검사를 통해 관찰한 결과 단삼음, 단삼, 오메프라졸 순으로 유의성 있는 결과를 확인했다.
7. 내장신경계통 조절 효과 Serotonin, NPY 면역조직화학 검사를 통해 관찰한 결과 Serotonin 항목에서 단삼, 단삼음, 오메프라졸 순으로 유의성 있는 결과를 확인하였고, NPY 항목에서 단삼음, 단삼, 오메프라졸 순으로 유의성 있는 결과를 확인했다.
8. 역류성 식도염 동물 모델 실험에서 PPI 오메프라졸과 비교 시 단삼과 단삼음은 모든 항목에서 유의미한 수치를 보였으며, 특히 COX-1, Sertonin, NPY 3가지 항목에서는 GERDE와 오메프라졸군 뿐만 아니라 Ctrl과 비교했을 때도 유의미한 수치를 보였다. 또한 단삼음은 Serotonin을 제외한 모든 항목에서 단삼보다 유의미한 수치를 보였다.
9. 위암, 식도암 세포주에 대한 항암 효과 단삼과 단삼음의 암세포 독성 및 유의성 있는 암세포 이동 억제 효과를 확인하였고, 암세포 apoptosis 유발 검사에서도 유의미한 결과를 확인했다.
참고문헌
1. Jung HK, Hong SJ, Jo YJ, Jeon SW, Cho YK, Lee KJ, et al. Updated Guidelines 2012 for Gastroesophageal Reflux Disease. Korean J Gastroenterol 2012:60(4):195–218.  2. Fauci AS, Braunwald E, Kasper DL, Hauser SL, Longo DL, Jameson JL, et al. Harrison's Principles of Internal Medicine 17th edition. Seoul: MIP: 2010. p. 688–92. 2232-4.
3. Maton PN. Omeprazole. N Engl J Med 1991:324(14):965–75.  4. Kim DH, Lee JE, You SH, Lee HA, Park JH, Jung JH, et al. Proton pump inhibitor use and risk of osteoporotic fracture in Korean adults with peptic ulcer disease and gastroesophageal reflux disease. Seoul:National Evidence-based Healthcare Collaborating Agency 2017:67–70.
5. Cheungpasitporn W, Thongprayoon C, Kittanamongkolchai W, Srivali N, Edmonds PJ, Ungprasert P, et al. Proton pump inhibitors linked to hypomagnesemia:a systematic review and meta-analysis of observational studies. Ren Fail 2015:37(7):1237–41.  6. Park HJ, Park SH, Shim KN, Kim YS, Kim HY, Han JP, et al. The Prevalence and Clinical Features of Non-responsive Gastroesophageal Reflux Disease to Practical Proton Pump Inhibitor Dose in Korea:A Multicenter Study. Korean J Gastroenterol 2016:68(1):16–22.  7. Makunts T, Alpatty S, Lee KC, Atayee RS, Abagyan R. Atayee &Ruben Abagyan. Proton-pump inhibitor use is associated with a broad spectrum of neurological adverse events including impaired hearing, vision, and memory. Scientific Reports 2019:9(1):17280.
8. Bezabeh S, Mackey AC, Kluetz P, Jappar D, Korvick J. Accumulating Evidence for a Drug-Drug Interaction Between Methotrexate and Proton Pump Inhibitors. The Oncologist 2012:17(4):550–4.   9. 黃 度淵. 新增 方藥合編 서울: 永林社: 2010. p. 391.
10. 陳 修園. 醫學全書⋅時方歌括 北京: 中國中醫藥出版社: 2006. p. 956.
11. 전국한의과대학 본초학 교수 공편저. 본초학 Seoul: 永林社: 2011. p. 336–7. 404-5. 458-9.
12. Jeon CM, Min GW, Park JH, Yoon CH, Jeong JC, Kang JJ, et al. Effect of the methanol extract of Dansameum on the ammonia-induced peptic ulcer in rats. Korean J Orient Int Med 2000:21(4):597–604.
13. Lee SE, Cho SI. Anti-inflammatory effects of Salviae Miltiorrhizae Radix extract on RAW264.7 cell. via anti-oxidative activities. Kor J Herbol 2015:30(4):89–94.  14. Shon YH, Cho HJ, Hyeun WC, Son KH, Nam KS. Chemopreventive Potential of Salvia miltiorrhiza Fraction Extracts. Journal of Life Science 2006:16(3):369–74.  15. Choi SM, Choi SH, Ahn KS. Study on Antitumor and Apoptosis - Inducing Effects of Salviae miltiorrhizae Radix. Korean J of Oriental Medical Pathology 2000:14(2):22–47.
16. Lee WYW, Cheung CCM, Liu KWK, Fung KP, Wong J, Lai PBS, et al. Cytotoxic effects of tanshinones from Salvia miltiorrhiza on doxorubicin- resistant human liver cancer cells. J Nat Prod 2010:73(5):854–9.  17. Cha JY, Ha SE, Sim SM, Park JK, Chung YO, Kim HJ, et al. Antimicrobial Effects of Ethanol Extracts of Korea Endemic Herb Plants. Journal of Life Science 2008:18(2):228–33.  18. Lee SK, Lim SW. The Administration of Jeungmiyijin-tang to Rats with Induced Gastro Reflux Esophagitis. J Int Korean Med 2016:37(6):1030–41.   19. Lee ST, Kwak MA. Effects of Individual Herbal Components of Yijintang-gamibang in the Rat Reflux Esophagitis. Korean J Orient Int Med 2013:34(2):165–77.
20. Jang MW, Lim SW. Experimental Study for Effect of Banhasasim-tang on Mice with Reflux Esophagitis. Korean J Orient Int Med 2013:34(4):362–3.
21. Shin MK, Kim ES, Kim TR, Lim HC, Lee YS. Effects of Jwa Kum-Whan on Reflux Esophagitis in Rats. J Int Korean Med 2016:37(3):495–507.
22. Lee JA, Park HJ, Kim SH, Kim MJ, Kim KJ, Shin MR, et al. Evaluation of Evodiae Fructus Extract on the Chronic Acid Reflux Esophagitis in Rats. Kor J Herbol 2019:34(2):15–23.
23. Kim DJ, Roh SS. Effect on Acute reflux Esophagitis by Evodiae Fructus Aquous Extract. Kor J Herbol 2012:27(1):51–8.  24. Kim SH, Roh SS, Lee JA, Shin MR, Lee AR, Koo JS, et al. Improving Effects on Rats with Chronic Acid Reflux Esophagitis Treated of Coptidis Rhizoma Extract. Kor J Herbol 2019:34(1):117–24.
25. Lee JY, Seo BI, Roh SS. Improving effect of Artemisiae Capillaris Herba extract in reflux esophagitis rats. Kor J Herbol 2016:31(6):37–44.  26. Kwon OJ, Lee AR, Roh SS. Improving Effects on Rats with Reflux Esophagitis Treated with Combined Extract of Young persimmon fruit and Citrus peel. Kor J Herbol 2016:31(1):25–31.  27. Kim MY, Shin YO, Lee JY, Lee AR, Shin SH, Kwon OJ, et al. Improving Effect of a Combined Extract of Rhei Rhizoma and Glycyrrhizae Rhizoma through Anti-oxidative Stress in Reflux Esophagitis rats. Kor J Herbol 2015:30(4):37–44.  28. Shin MR, Lee JA, Kim MJ, An HJ, Roh SS. The protective effect of Areca Semen and Toosendan Fructus mixture in a chronic model of reflux esophagitis. Kor J Herbol 2020:35(1):57–68.
29. Song CH, Baek TH. A Comparative Study of Sepiae Os, Arcae Concha, Ostreae Concha and Esomeprazole in a Mouse Model of Reflux Esophagitis. J Korean Med 2018:39(2):92–105.  30. Shin MH, Kim ES, Lee YS. Suppressive Effects of Ulmi Pumilae Cortex Extracts on the Reflux Esophagitis in Rat. J Physiol &Pathol Korean Med 2016:30(4):257–65.  31. Choi MJ, Yang WJ, Lee BH, Cho SI. Basic network pharmacological analysis of Salvia miltiorrhiza root for further application to an animal stroke model. Herbal Formula Science 2021:29(1):19–31.
32. Kim BC, Lee EJ, Park CS, Park CG. The Experimental Study on the Effects of Dansamyeum on Hyperlipidemia. Kor J Orient Int Med 2000:21(1):126–34.
33. Son CS, Kwon KB, Kim SB, Lee HS, Seo EH, Lee HS, et al. Effects of Dansamyeum Water Extract on Heart Beating Rate in Cultured Mouse Myocardial Cells. Korean J Oriental Medical Physiology &Pathology 2001:15(2):241–5.
34. Jeon CM, Min GU, Park JH, Yoon CH, Jeong JC, Kang JJ, et al. Effect of the methanol extract of Dansameum on the ammonia-induced peptic ulcer in rats. Kor J Orient Int Med 2000:21(4):597–604.
35. Shapiro M, Green C, Bautista JM, Dekel R, Risner-Adler S, Whitacre R, et al. Assessment of dietary nutrients that influence perception of intraoesophageal acid reflux events in patients with gastro-esophageal reflux disease. Aliment Pharmacol Ther 2007:25(1):93–101.  36. Nakamura k, Ozawa Y, Furuta Y, Omd Miyazaki H. Effects of sodiumpolyacrylate (PANa) on acute esophagitis by gastric juice in rats. Japan J Pharmacol 1982:32(3):445–56.  37. Zhou X, Zhuang Z, Wang W, He L, Wu H, Cao Y, et al. OGG1 is essential in oxidative stress induced DNA demethylation. Cell Signal 2016:28(9):1163–71.   38. Valavanidis A, Vlachogianni T, Fiotakis C. 8-hydroxy-2'-deoxyguanosine (8-OHdG):A critical biomarker of oxidative stress and carcinogenesis. J Environ Sci Health C Environ Carcinog Ecotoxicol Rev 2009:27(2):120–39.   39. Lazzerini PE, Lorenzini S, Selvi E, Capecchi PL, Chindamo D, Bisogno S, et al. Simvastatin inhibits cytokine production and nuclear factor-κB activation in interleukin 1β-stimulated synoviocytes from rheumatoid arthritis patients. Clinical and Experimental Rheumatology 2007:25(5):696–700.  40. Li M, Yang X, Zhang Y, Chen L, Lu H, Li X, et al. Activation of protease-activated receptor-2 is associated with increased expression of inflammatory factors in the adipose tissues of obese mice. Mol Med Rep 2015:12(4):6227–34.   41. Ferrell WR, Lockhart JC, Kelso EB, Dunning L, Plevin R, Meek SE, et al. Essential role for proteinase-activated receptor-2 in arthritis. J Clin Invest 2003:111(1):35–41.    42. Cryer B, Dubois A. The advent of highly selective inhibitors of cyclooxygenase-a review. Prostaglandins Other Lipid Mediat 1998:56(5-6):341–61.   43. Laine L, Takeuchi K, Tarnawski A. Gastric mucosal defense and cytoprotection:bench to bedside. Gastroenterology 2008:135(1):41–60.   44. Sorenseon O, Cowland JB, Askaa J, Borregaard N. An ELISA for hCAP-18, the cathelicidin present in human neutrophils and plasma. J Immunol Methods 1997:206(1-2):53–9.   46. Ip YT, Davis RJ. Signal transduction by the c-Jun N-terminal kinase (JNK) - from inflammation to development. Current Opinion in Cell Biology 1998:10(2):205–19.   47. Choi BH, Hur EM, Lee JH, Jun DJ, Kim KT. Protein kinase C delta-mediated proteasomal degradation of MAP kinase phosphatase-1 contributes to glutamate-induced neuronal cell death. J Cell Sci 2005:119(Pt 7):1329–40.
48. Oh HL, Seok JY, Kwon CH, Kang SK, Kim YK. Role of MAPK in ceramide-induced cell death in primary cultured astrocytes from mouse embryonic brain. NeuroToxicology 2006:27(1):31–8.   49. Chuang SM, Wang IC, Yang JL. Roles of JNK, p38 and ERK mitogen-activated protein kinases in the growth inhibition and apoptosis induced by cadmium. Carcinogenesis 2000:21(7):1423–32.   50. Porter AG, Jänicke RU. Emerging roles of caspase-3 in apoptosis. Cell Death &Differentiation 1999:6(2):99–104.   51. Stover EH, Borthwick KJ, Bavalia C, Eady N, Fritz DM, Rungroj N, et al. Novel ATP6V1B1 and ATP6V0A4 mutations in autosomal recessive distal renal tubular acidosis with new evidence for hearing loss. J Med Genet 2002:39(11):796–803.    52. Finberg KE, Wagner CA, Bailey MA, Paunescu TG, Breton S, Brown D, et al. The B1-subunit of the H+ATPase is required for maximal urinary acidification. PNAS 2005:102(38):13616–21.    53. Czepielewski RS, Porto BN, Rizzo LB, Roesler R, Abujamra AL, Pinto LG, et al. Gastrin-releasing peptide receptor (GRPR) mediates chemotaxis in neutrophils. PNAS 2012:109(2):547–52.   54. Petronilho F, Danielski LG, Roesler R, Schwartsmann G, Dal-Pizzol F. Gastrin-releasing peptide as a molecular target for inflammatory diseases:an update. Inflamm Allergy Drug Targets 2013:12(3):172–7.   55. Pederson RA, Kwok YN, Coy DH. Gastrin secretion from human antral G cells in culture. Gastroenterology 1990:99(1):36–44.   56. Foxx-Orenstein AE, Kuemmerle JF, Grider JR. Distinct 5-HT receptors mediate the peristaltic reflex induced by mucosal stimuli in human and guinea pig intestine. Gastroenterology 1996:111(5):1281–90.   57. Kim DY, Camilleri M. Serotonin:A mediator of the brain-gut connection. Am J Gastroenterol 2000:95(10):2698–709.   58. Jin JG, Foxx-Orenstein AE, Grider JR. Propulsion in guinea pig colon induced by 5-hydroxytryptamine (HT) via 5-HT4 and 5-HT3 receptors. J Pharmacol Exp Ther 1998:288(1):93–7.
59. Keast JR, Furness JB, Costs M. Distribution of certain peptide YY containing nerve fibers and endocrine cells in the gastrointestinal mucosa in five mammalian species. J Comp Neurol 1985:263(3):403–22.
60. Allen JM, Gu KJ, Adrian TE, Polak JM, Bloom SR. Neuropeptide Y in the guinea pig biliary tract. Experientia 1984:40(7):765–7.    61. Park JG, Hyun JW, Lim KW, Shin JE, Won YJ, Shin KH, et al. Antineoplastic Effect of Extracts from Traditional Medicinal Plants. The Korean Society of Pharmacognosy 1993:24(3):223–30.
62. Nam GH, Jo KJ, Park YS, Kwak HW, Wee JH, Kim JH, et al. Anti-cancer Effect of Cinnamomum camphora Ethanol Extract by Double Induction of Apoptotic and Autophagic Cell Death in HCT 116 and HT-29 Human Colon Cancer Cell through the mTOR Signaling Pathway. Korean Society for Biotechnology and Bioengineering Journal 2019:34(2):114–9.  63. Jin Z, El-Deiry WS. Overview of cell death signaling pathways. Cancer Biol Ther 2005:4(2):147–71.  64. Okada H, Mak TW. Pathways of apoptotic and non-apoptotic death in tumour cells. Nat Rev Cancer 2004:4(8):592–603.   
|
|





















