Ⅰ. 서 론
간섬유증은 간조직의 지속적인 염증으로 인해 간세포가 섬유 조직이 둘러싸고 있는 형태인 재생결절(regenerative nodules) 등의 형태로 변형되면서 간기능이 저하되는 만성 질환으로, 바이러스 감염, 약물, 알코올 및 담즙 정체 등의 병리학적 요인으로 인해 발병된다1. 이 외에도 간섬유증은 염증 세포와 간 성상 세포(Hepatic stellate cell, HSC)의 활성화로 인해 생성되는 세포외기질(extracellular matrix, ECM)의 과도한 축적과 염증성 사이토카인의 방출로 인해 간섬유증이 가속화한다고 알려져 있다2. HSC의 증식, 전이, 콜라겐 축적 및 간 섬유화를 유도하는 원인 중 하나로 산화적 스트레스에 의한 활성산소종(Reactive oxygen species, ROS)이 잘 알려져 있으며, 간섬유증과 산화적 스트레스의 연관성에 대해서 많은 연구가 이루어지고 있는 실정이다3,4.
小柴胡湯(Sosiho-tang, Xiao-chai-hu-tang)은 중국 전통 의학과 일본을 포함한 아시아에서 널리 사용되며, 대표적으로 咽乾, 往來寒熱, 胸脇苦滿 및 目弦을 치료하는 방제로 알려져 있다5. 小柴胡湯은 항산화로 인한 간보호 효과6, 항우울증7, 항종양7, 항바이러스8 및 대장암에 대한 항암 효과9 등의 다양한 약리효능에 대한 연구가 보고되어져 왔다. 반면, 기존 연구들을 통해 H2O2와 CCl4로 유발한 간손상 모델에서 小柴胡湯의 간보호 효능이 알려진 상태지만10,11, 사람의 간경변증과 가장 유사하다고 알려진 TAA를 이용한 연구나 지속적인 간손상으로 인한 간섬유증 마우스 동물 모델에 대한 小柴胡湯의 연구는 이루어지지 않고 있다.
따라서 본 연구에서는 TAA로 유발된 간섬유증 동물 모델에 대해 小柴胡湯이 미치는 효능과 그 작용 기전에 대해 알아보고자 하였으며, 본 연구를 통해 유의한 결과를 얻었으므로 이를 보고하는 바이다.
II. 재료 및 방법
1. 재 료
1) 시 료
본 실험에서 사용한 小柴胡湯의 구성 한약재는 東醫寶鑑에 의거하여 옹기한약국(대구, 한국)에서 구입한 것을 생약규격집에 맞춘 후 관능 검사하였으며 약전규격에 적합한 것만 정선한 후 사용하였다(Table 1). 小柴胡湯 134.9 g을 분쇄한 후 DW 10배수 1,349 mL를 가하여 열탕 추출기에서 2시간 추출하여 감압 추출장치로 농축 후, 동결 건조기를 이용해 건조시켰으며, 21.8 g의 小柴胡湯 파우더(수율, 16.2%)를 얻었다. 이를 -80 ℃에서 냉동 보관하여 실험 직전에 증류수에 녹인 후 사용하였다.
Table 1
Composition of Sosiho-tang
2) 시 약
본 실험에서 potassium persulfate, thioacetamide (TAA), phenylmethylsulfonyl fluoride(PMSF)는 Sigma Aldrich Co., Ltd.(St. Louis, MO, USA)에서 구입하였으며, 1차 항체인 gp91-phox(NOX2), p47phox, p22phox, nuclear factor erythroid 2-related factor 2 (Nrf2), kelch-like ECH-associated protein 1(Keap1), heme oxygenase-1(HO-1), superoxide dismutase(SOD), glutathione peroxidase-1/2(GPx-1/2), phosphorylation of nuclear factor-kappa Bp65(NF-κBp65), inducible nitric oxide synthase(iNOS), cyclooxygenase-2(COX-2), tumor necrosis factor-alpha(TNF-α), interleukin 6 (IL-6), interleukin-1beta(IL-1β), cytochrome P450 7A1(CYP7A1), Na+-taurocholate cotransporting polypeptide(NTCP), alpha-smooth muscle actin(α-SMA), Type Ⅰ collagen(Collagen Ⅰ), β-actin 및 histone은 Santa Cruz Biotechnology(Santa Cruz, CA, USA)에서 구매하였으며, 2차 항체인 mouse lgG antibody와 rabbit lgG antibody는 GeneTex, Inc.(San Antonio, TX, USA)에서 구입하였다. GE Healthcare(Bloomington, IL, USA)에서 ECL western blotting detection reagents를 구입하였고, Wako Pure Chemical Industries, Ltd.(Osaka, Japan)에서 protease inhibitor mixture와 ethylenediaminetetraacetic acid (EDTA)를 구입하였다. 단백질 정량을 위한 bicinchoninic acid(BCA) protein assay kit는 Thermo Scientific (Rockford, IL, USA)에서 구입하여 사용하였다.
3) 실험기기
본 실험에서 열탕추출기(DWT-1800T; Daewoong Pharmaceutical Co., Ltd., Seoul, Korea), 감압 추출장치(Buchi B-480; Buchi AG, Flawil, Switzerland), 동결 건조기(FD5508; Ilshin Biobase Co., Ltd., Yangju, Korea), 냉장고속원심분리기(Mega17R, Hanil Scientific Inc., Seoul, Korea), vortex mixer, deep-freezer (Sanyo Co., Japan), 전자체중계(CAS, Gyeonggi, Korea), rotary vacuum evaporator(Buchi B-480, Switzerland), Microplate reader(Infinite M200 pro, Tecan, Männedorf, Switzerland), tissue grinder (Biospec Product, Bartlesville, OK, USA), Sensi-Q2000 Chemidoc(Lugen Sci Co. Ltd, Seoul, Korea), 광학 디지털 카메라(DSCHX50V, Sony, Tokyo, Japan)를 이용하였다.
4) 실험 동물
5주령(20-25 g)의 C57BL/6 mice 수컷을 대한바이오링크(Eumseong, Korea)에서 구입하여 1주 동안의 적응기를 거친 후 본 실험에 투입되었으며, 온도(22±2 ℃), 습도(50±5%), 명암주기(light:dark cycle)(12/12시간)의 사육실 조건에서 물과 고형사료(Zeigler Bros, Inc., PA, USA)를 자유롭게 공급하였다. 본 실험은 동물실험의 과학적, 윤리적 타당성 검토 및 효율적 관리를 위하여 대구한의대학교 동물 실험 윤리위원회의 승인(DHU2021-048)을 얻어 동물관리 규정을 준수하여 실험을 진행하였다.
2. 방 법
1) 간섬유증 동물 유발
1주간의 적응기를 거친 후 난괴법(randomized complete block design)에 의해서 처치를 하지 않은 정상군(Normal), 대조군(Control), silymarin 50 mg/kg/day 투여군(Silymarin), 小柴胡湯 열수 추출물 200 mg/kg/day 투여군(SSHT)으로 총 4그룹 분류하였으며, 모든 군의 실험동물은 매일 일정한 시간에 1일 1회 체중을 측정하였다. 약물의 용량은 小柴胡湯의 기존 연구를 바탕으로 선정하였다12. 또한, 정상군은 아무런 처치를 하지 않았고, silymarin과 小柴胡湯 열수 추출물은 8주간 1일 1회 경구투여 하였으며, 대조군의 경우 증류수를 경구투여해주었다. 약물투여와 동시에 간섬유증 유발을 위해 정상군을 제외하고 나머지 군은 TAA를 (1주 100 mg/kg, 2-3주 200 mg/kg, 4-8주 400 mg/kg) 농도별로 8주간 주 3회 복강투여 하였다. 8주의 실험 후 부검을 진행하였으며, isoflurane(Troikaa Pharmaceuticals Ltd, Gujarat, India)을 통해 흡입 마취시킨 다음 복대정맥에서 혈액을 채취하였다. 채취한 혈액은 냉장고속원심분리기를 이용해 4,000 rpm, 4 ℃ 및 10분의 조건에서 혈청을 분리하였으며, 혈청과 간 조직은 냉동보관(-80 ℃) 하였다.
2) 간 기능 지표 측정
Aspartate aminotransferase(AST)와 alanine aminotransferase(ALT)는 assay kit(Asanpharm Co., Ltd, Seoul, Korea)의 프로토콜에 따라 측정하였다.
4) 산화적 스트레스 바이오 마커 측정
Myeloperoxidase(MPO) 활성은 MPO colorimetric activity assay kit(BioVision, CA, USA)의 프로토콜에 따라 측정하였다.
5) 간 조직 western blotting
간 조직에 2 mM MgCl2, 5 mM Tris-HCl(pH 7.5), 15 mM CaCl2, 100 mM Tris-HCl(pH 7.4), 0.1 M DTT, 1.5 M sucrose, protease inhibitor cocktail를 첨가한 buffer A를 넣은 후 조직 분쇄기로 분쇄한 뒤 10% NP-40 용액을 첨가하였다. 얼음 위에서 30분간 정치시킨 후 12,000 rpm, 4 ℃ 및 2분 조건에서 원심 분리하여 세포질을 포함한 상층액을 분리하여 보관하였다. 핵을 분리하기 위해 10% NP-40 용액을 첨가한 buffer A로 2회 헹구고 buffer C(50 mM HEPES, 50 mM KCl, 1 mM DTT, 0.3 mM NaCl, 0.1 mM EDTA, 0.1 mM PMSF, 10% glycerol) 100 μL를 넣어 재부유 하였다. 그 다음 vortex를 이용하여 10분 마다 3회 진행하였으며, 12,000 rpm, 4 ℃ 및 10분 조건에서 원심 분리한 후 핵을 포함하고 있는 상층액을 분리하여 각각 냉동 보관(-80 ℃)하였다. 세포질에서의 NOX2, p47phox, p22phox, Keap1, HO-1, SOD, GPx-1/2, iNOS, COX-2, TNF-α, IL-6, IL-1β, CYP7A1, NTCP, α-SMA, Collagen Ⅰ 및 β-actin 단백질과 핵에서의 Nrf2, NF-κBp65 및 histone 단백질 발현 측정을 위해 8%-14% sodium dodecyl sulfate-polyacrylamide gel을 이용하여 8-12 μg의 단백질을 전기영동하였다. 그 후 acrylamide gel의 단백질을 nitrocellulose membrane으로 이동시켰으며 준비한 membrane에 각각의 1차 항체(PBS-T로 1:1000로 희석)를 처리하여 overnight(4 ℃) 시킨 다음 PBS-T로 6분 간격 5회 세척하고, 1차 항체가 처리된 membrane에 적합한 2차 항체(PBS-T로 1:3000로 희석)를 처리하여 상온에서 2시간 반응시킨 후, PBS-T로 6분 간격 5회 세척하였다. 그리고 membrane을 enhanced chemiluminescence(ECL) 용액에 충분히 노출시킨 다음 Sensi-Q2000 Chemidoc에 감광시켜 단백질 발현을 확인하였다. 해당 band는 ATTO Densitograph Software(ATTO Corporation, Tokyo, Japan) 프로그램을 이용하여 정량하였고, 각 군의 단백질 수준은 정상군의 단백질 수준으로 나누어 상대적 비로 나타냈다(represented as 1).
6) 조직학적 관찰
간 조직을 24시간 동안 10% neutral buffered formalin에 고정시킨 다음 등급별 알코올(graded alcohol)로 탈수시켰으며, 파라핀으로 포매한 후 표본을 제작하였고, 3 μm 두께의 조직 절편을 제작하였다. 그 다음 Masson’s trichrome(MT) 염색을 위해 슬라이드를 weigert iron hematoxylin에서 7분 동안 염색 후 세척해주었으며, iebrich scarlet-acid fuchsin에서 2분 동안 염색하였다. 그 후, phosphotungstic- phosphomolybdic acid에서 7분 동안 배양해주었으며 아닐린 블루(aniline blue)로 10분 동안 염색한 다음 1% 아세트산에서 3분 동안 고정시킨 후 광학현미경으로 조직의 병변 유무를 관찰하였다.
III. 결 과
1. 간 기능 지표 분석
AST와 ALT 수치(IU/L)를 측정한 결과, AST는 정상군(9.27±1.45) 대비 대조군(74.21±3.89)에서 유의적으로 증가하였으나(p<0.001), 대조군 대비 SSHT군(47.52±4.33)은 34%(p<0.01) 유의적으로 감소하였다. ALT의 경우, 정상군(6.71±0.46) 대비 대조군(23.42±1.99)에서 유의적으로 증가하였으나(p <0.001), 대조군 대비 SSHT군(13.52±1.61)은 42% (p<0.001) 유의적으로 감소하였다(Fig. 1A, B).
Fig. 1
Levels of AST, ALT, ammonia, and MPO in serum.
Serum AST level : A, Serum ALT level : B, Serum ammonia concentration : C, Serum MPO concentration : D. Normal : normal mice, Control : TAA-induced control mice, Silymarin : TAA-induced with silymarin 50 mg/kg body weight mice, SSHT : TAA-induced with Sosiho-tang water extract 200 mg/kg body weight mice. All data are expressed as means±SD (n=9). Significance : ###p<0.001 vs. Normal mice, **p<0.01, ***p<0.001 vs. Control mice.
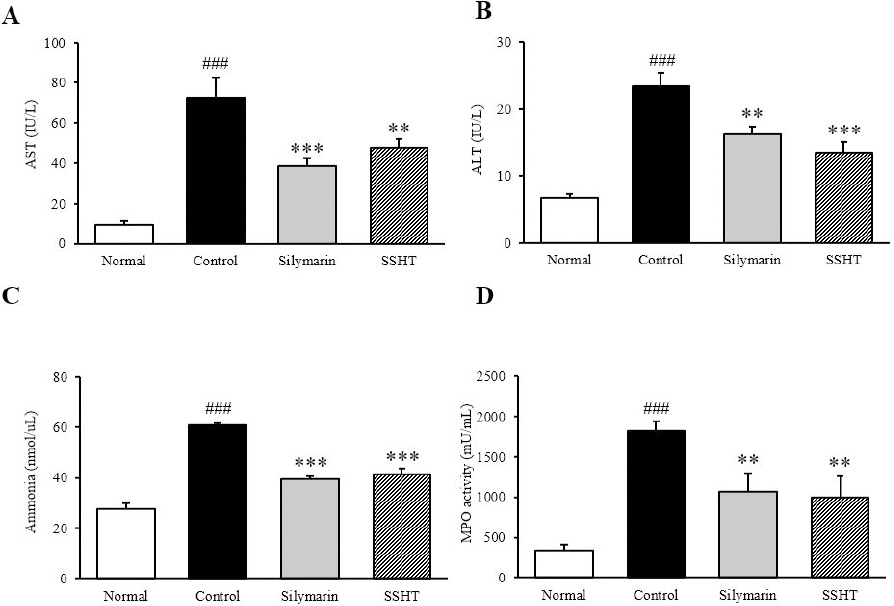
2. 혈중 암모니아 수치 측정
혈중 암모니아 농도(nmol/μL) 측정 결과, 정상군(27.70±2.12) 대비 대조군(61.06±0.62)에서 2.2배 유의적으로 증가하였으나(p<0.001), 대조군 대비 Silymarin군(39.48±1.21)과 SSHT군(41.46±2.17)은 약 35% 유의적으로 감소하였다(p<0.001)(Fig. 1C).
3. 산화적 스트레스 바이오 마커 측정
혈중 MPO 수치(mU/mL)를 측정한 결과, 정상군(344.24±66.65) 대비 대조군(1822±93.28)은 5배가량 유의적으로 증가하였으나(p<0.001), 대조군 대비 SSHT군(1194.84±29.72)은 45% 유의적으로 감소하였다(p<0.01)(Fig. 1D).
4. 간 조직 내 NADPH 산화효소 단백질 발현량 측정
간 조직 내에서 western blot을 통해 NADPH 산화효소 단백질인 NOX2, p47phox와 p22phox의 발현량을 측정한 결과, NOX2의 경우 정상군(1.00± 0.05)에 비하여 대조군(1.55±0.08)은 55% 유의적으로 증가하였으나(p<0.001), 대조군 대비 SSHT군(1.26±0.10)은 18% 유의적으로 감소하였다(p<0.05). p47phox의 경우, 정상군(1.00±0.05)에 비하여 대조군(1.73±0.04)은 73% 유의적으로 증가하였으나(p<0.001), 대조군 대비 SSHT군(1.43±0.14)의 경우 17% 감소하는 경향을 보였다. 또한, p22phox은 정상군(1.00± 0.02)에 비하여 대조군(1.22±0.04)은 22% 유의적으로 증가하였으나(p<0.05), 대조군 대비 SSHT군(1.02 ±0.04)은 28%(p<0.001) 유의하게 증가하여 정상군의 수준과 비슷하였다(Fig. 2).
Fig. 2
Expressions of NADPH oxidase in liver tissue.
Normal : normal mice, Control : TAA-induced control mice, Silymarin : TAA-induced with silymarin 50 mg/kg body weight mice, SSHT : TAA-induced with Sosiho-tang water extract 200 mg/kg body weigh mice. All data are expressed as means±SD (n=9). Significance : #p<0.05, ###p<0.001 vs. Normal mice, *p<0.05, **p<0.01, and ***p<0.001 vs. Control mice.
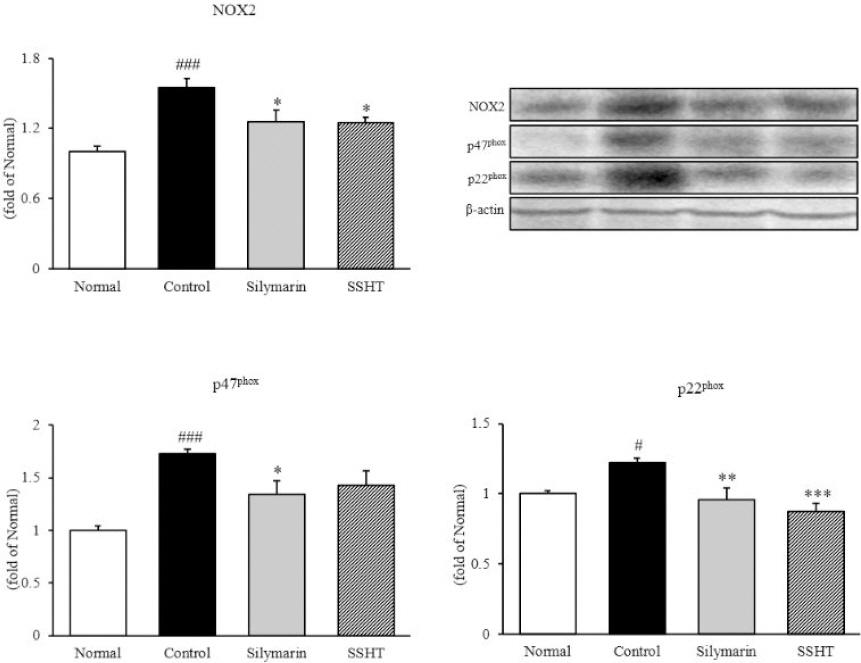
5. 간 조직 내 항산화 관련 단백질 발현량 분석
간 조직 내에서 western blot을 통해 항산화 관련 단백질인 Nrf2, Keap1, HO-1, SOD 및 GPx-1/2의 발현을 확인한 결과, Nrf2의 경우 정상군(1.00± 0.02)에 비하여 대조군(0.89±0.03)은 11% 감소하였으나, 대조군 대비 Silymarin군(1.21±0.07)과 SSHT군(1.21±0.09)은 35% 유의적으로 증가하였다(p<0.01). Keap1의 경우, 정상군(1.00±0.05)에 비하여 대조군(1.38±0.12)은 38% 유의적으로 증가하였으나(p<0.05), 대조군에 대비 Silymarin군(0.94±0.10)과 SSHT군(0.99±0.07)은 약 26% 유의적으로 감소하였다(p<0.01). 또한, SOD와 GPx-1/2는 대조군(0.63±0.07, 0.74± 0.03, resp.)에 비해 SSHT군에서 각각 23%(0.78±0.04), 28%(0.95±0.11)로 증가하였으며, HO-1만 정상군의 수준까지 유의적으로 증가하였다(Fig. 3).
Fig. 3
Expressions of antioxidant proteins in liver tissue.
Normal : normal mice, Control : TAA-induced control mice, Silymarin : TAA-induced with silymarin 50 mg/kg body weight mice, SSHT : TAA-induced with Sosiho-tang water extract 200 mg/kg body weight mice. All data are expressed as means±SD(n=9). Significance : #p<0.05, ##p<0.01, and ###p<0.01 vs. Normal mice, *p<0.05, **p<0.01 vs. Control mice.
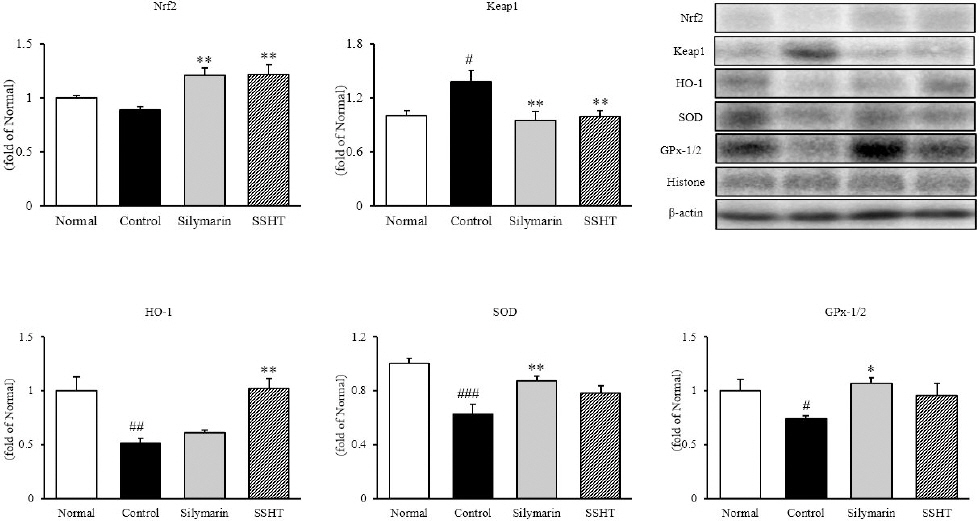
6. 간 조직 내 염증 관련 단백질 발현량 분석
1) 염증성 단백질 발현량 분석
간 조직 내에서 western blot을 통해 염증성 전사인자인 NF-κBp65와 매개인자인 iNOS와 COX-2의 발현을 측정한 결과, NF-κBp65는 정상군(1.00 ±0.05)에 비하여 대조군(1.65±0.07)은 65% 유의적으로 증가하였으나(p<0.001), 대조군 대비 SSHT군(1.05±0.10)은 42% 유의적으로 감소하였다(p<0.001). iNOS와 COX-2의 경우, 정상군에 비하여 대조군은 각각 47%(1.47±0.10), 42%(1.42±0.20) 유의적으로 증가하였으나(p<0.01), 대조군에 비하여 SSHT군은 40%(0.87±0.08), 34%(0.82±0.04)로 유의하게 감소하였다(p<0.001, p<0.01, resp.)(Fig. 4). 이를 통해 SSHT의 투여는 NF-κBp65의 활성에 의해 유도되어지는 매개인자인 iNOS와 COX-2를 유의적으로 감소시키는 것을 보여주었다.
Fig. 4
Expressions of inflammatory proteins in liver tissue.
Normal : normal mice, Control : TAA-induced control mice, Silymarin : TAA-induced with silymarin 50 mg/kg body weight mice, SSHT : TAA-induced with Sosiho-tang water extract 200 mg/kg body weight mice. All data are expressed as means±SD (n=9). Significance : ##p<0.01, ###p<0.001 vs. Normal mice, *p<0.05, **p<0.01, and ***p<0.001 vs. Control mice.
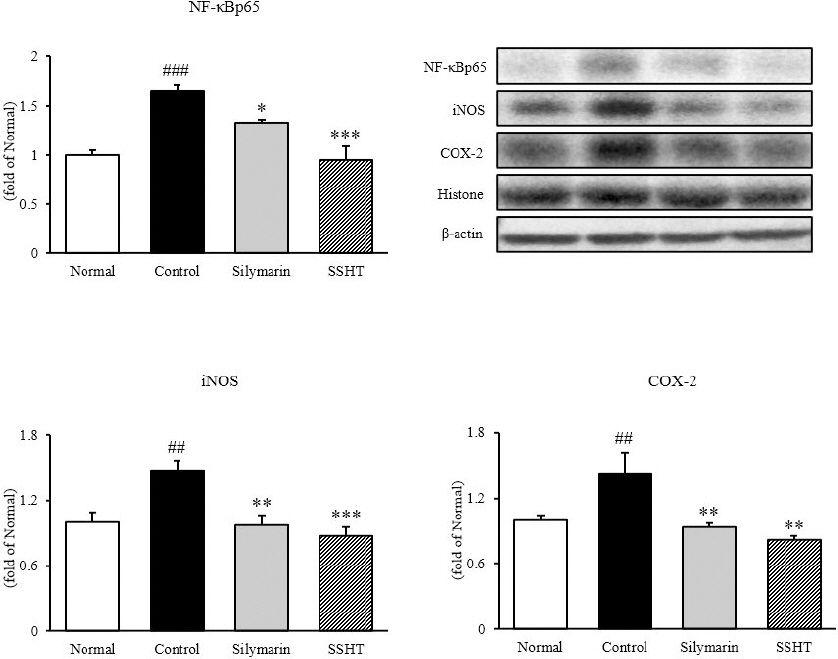
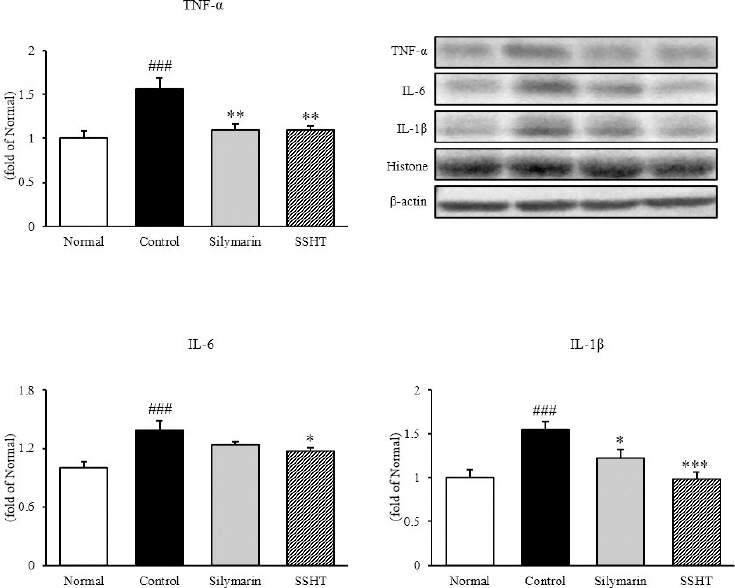
2) 염증성 사이토카인 발현량 분석
간 조직 내에서 western blot을 통해 염증성 사이토카인인 TNF-α, IL-6 및 IL-1β의 발현량을 측정한 결과, TNF-α는 정상군(1.00±0.09)에 비해 대조군(1.57±0.13)에서 57% 유의적으로 증가하였으나(p<0.001), SSHT군(1.09±0.05)은 대조군에 비해서 35% 유의적으로 감소하였다(p<0.01). IL-6와 IL-1β의 경우, 정상군에 비해 대조군에서 각각 39% (1.39±0.10), 55%(1.55±0.10) 유의적으로 증가하였으나(p<0.001), SSHT군은 각각 12%(1.18±0.03), 36% (0.99±0.08) 유의적으로 감소하였다(p<0.05, p<0.001, resp.)(Fig. 5). 이를 통해 SSHT의 투여는 NF-κBp65의 활성에 의해 유도되어지는 염증성 사이토카인인 TNF-α, IL-6 및 IL-1β를 효과적으로 감소시키는 것을 보여주었다.
Fig. 5
Expressions of inflammatory cytokines in liver tissue.
Normal : normal mice, Control : TAA-induced control mice, Silymarin : TAA-induced with silymarin 50 mg/kg body weight mice, SSHT : TAA-induced with Sosiho-tang water extract 200 mg/kg body weight mice. All data are expressed as means±SD (n=9). Significance : ###p<0.001 vs. Normal mice, *p<0.05, **p<0.01, and ***p<0.001 vs. Control mice.
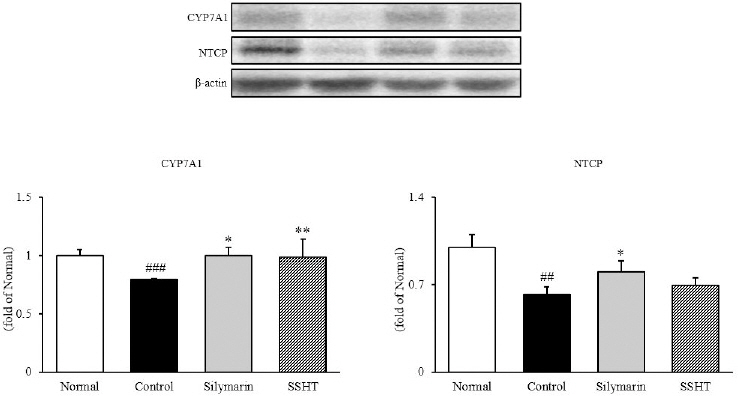
7. 간 조직 내 담즙산 관련 단백질 발현량 측정
간 조직 내에서 western blot을 통해 CYP7A1과 NTCP의 발현을 확인한 결과, CYP7A1은 정상군(1.00±0.05)에 비해 대조군(0.79±0.01)에서 21% 유의적으로 감소하였으나(p<0.001), 대조군 대비 SSHT군(0.99±0.15)은 25%(p<0.05) 증가로 정상군의 수준과 비슷하였다. NTCP의 경우 정상군(1.00±0.10)에 비하여 대조군(0.62±0.06)은 38% 유의적으로 감소하였다(p<0.01). 반면, 대조군 대비 SSHT군(0.70 ±0.06)은 12% 증가하는 경향이 나타났다(Fig. 6).
Fig. 6
Expressions of CYP7A1 and NTCP in liver tissue.
Normal : normal mice, Control : TAA-induced control mice, Silymarin : TAA-induced with silymarin 50 mg/kg body weight mice, SSHT : TAA-induced with Sosiho-tang water extract 200 mg/kg body weight mice. All data are expressed as means±SD (n=9). Significance : ##p<0.01, ###p<0.001 vs. Normal mice, *p<0.05, **p<0.01 vs. Control mice.
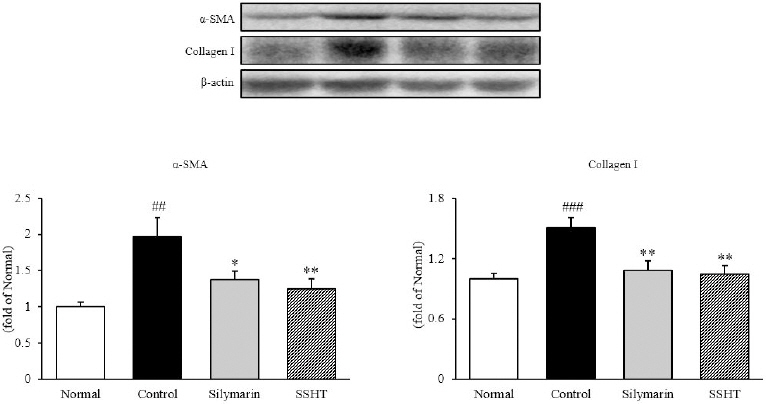
8. 간 조직 내 섬유화 관련 단백질 발현량 측정
간 조직 내에서 western blot을 통해 α-SMA와 Collagen Ⅰ의 발현을 확인한 결과, α-SMA은 정상군(1.00±0.06)에 비해 대조군(1.96±0.27)에서 2배가량 유의하게 증가하였으나(p<0.01), 대조군에 비해 SSHT(1.25±0.14)군은 36%(p<0.01)로 유의하게 감소하였다. Collagen Ⅰ의 경우, 정상군(1.00±0.06)에 비해 대조군(1.50±0.10)은 50% 유의적으로 증가하였으나(p<0.001), 대조군에 비하여 SSHT군(1.05±0.08) 28% 이상으로 유의적으로 감소하였다(p<0.01)(Fig. 7).
Fig. 7
Expressions of α-SMA and Collagen Ⅰ in liver tissue.
Normal : normal mice, Control : TAA-induced control mice, Silymarin : TAA-induced with silymarin 50 mg/kg body weight mice, SSHT : TAA-induced with Sosiho-tang water extract 200 mg/kg body weight mice. All data are expressed as means±SD (n=9). Significance : ##p<0.01, ###p<0.001 vs. Normal mice, *p<0.05, **p<0.01 vs. Control mice.
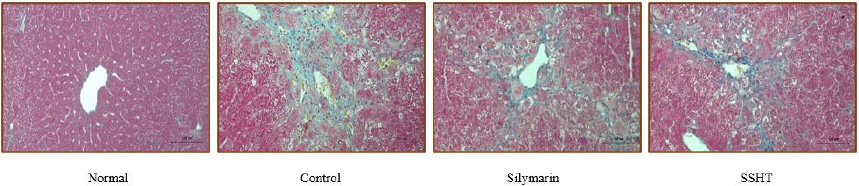
9. 간 조직학적 분석
Masson’s trichrome(MT) 염색법으로 간 조직을 염색한 후 광학 현미경으로 관찰하였다. 그 결과, 정상군과는 달리 TAA를 유발한 대조군의 간 조직에서 콜라겐 침착이 확연히 관찰되었지만, SSHT 투여 후 콜라겐의 침착이 억제된 것을 확인할 수 있었다. 따라서, SSHT의 투여로 TAA로 유발한 간섬유증을 억제한 것으로 사료된다(Fig. 8).
Fig. 8
Histopathological analysis.
Masson’s trichrome (MT) staining. (Original magnification×200, magnification bar=100 μm). Normal : normal mice, Control : TAA-induced control mice, Silymarin : TAA-induced with silymarin 50 mg/kg body weight/day mice, SSHT : TAA-induced with Sosiho-tang water extract 200 mg/kg body weight/day mice.
IV. 고 찰
간은 체내 물질 대사 과정과 해독 작용을 주로 담당하며 간손상으로 인한 간질환은 생명을 위협하는 요인으로 알려져 있다. 지속적인 간손상으로 인한 간섬유증은 간 성상 세포(Hepatic stellate cell, HSC)의 활성화로 인해 생성되는 세포외기질(extracellular matrix, ECM), Ⅰ형 및 III형 콜라겐 단백질의 점진적 축적으로 발생한다13.
이러한 간섬유증을 초기에 치료하지 않을 경우 간염, 간경변 및 간암으로 진행될 수 있으며, 간섬유증을 포함한 여러 간질환 발생으로 인해 삶의 질을 저하시키기 때문에 전 세계적으로 많은 관심이 집중되고 있다. 따라서 증상을 효과적으로 완화시키면서 장기적으로 안전하게 사용할 수 있는 천연 치료제의 개발이 무엇보다 필요한 실정이다.
Thioacetamide(TAA)는 간염, 간경화증 및 암 등의 간질환 동물 실험 모델을 유발하는데 주로 사용되는 간독성 물질로서, 사람의 간경변증과 가장 유사하고 lipopolysaccharide(LPS)와 사염화탄소(carbon tetrachloride, CCl4)로 유발한 동물 모델보다 섬유증이 뚜렷하게 나타난다고 알려져 있다14. 체내에서 TAA는 간 미립체적 혼합 기능 산화 효소(microsomal mixed-function oxidase)에 의해 산화 반응되고, 산화 효소의 작용으로 인해 간독성 화합물로 활성화되며 간손상을 유발한다고 보고되어 있다15,16.
小柴胡湯(Sosiho-tang, Xiao-chai-hu-tang)은 淸熱작용을 가진 시호와 황금을 주 약재로 이루어져 있으며, 시호는 消炎과 解熱작용, 황금은 膽汁排泄과 消炎작용의 효능을 가지는데 이 두 약재를 혼합하여 복용할 시 緊張緩和, 鎭靜 및 利膽작용의 기능을 발휘하는 것으로 보고되어 있다5. 小柴胡湯은 중국과 일본을 비롯한 아시아에서 주로 사용되는 처방으로, 간 보호효과와 관련하여 여러 연구가 진행되고 있다. 이 처방은 동물 실험을 포함하여 임상 연구로도 많이 사용되는데, 만성 B형 간염에 대한 임상 연구에서는 小柴胡湯의 임상효과는 아직 명확하지 않다고 밝혔으며17, 급성 간염에 대한 임상 연구에서는 동아시아에서 주로 사용되는 小柴胡湯 조차도 장기적인 섭취 시 간 손상의 가능성이 있음을 밝혔다18. 반면, 간섬유증에 대한 임상연구를 비롯하여 간섬유증에 대한 명확한 작용 기전에 대해서도 밝혀지지 않았다. 이에 본 연구에서는 간섬유증 개선에 대한 유효한 효과를 나타낼 수 있는 천연 치료제 개발을 위해 진행하였으며 小柴胡湯이 간섬유증 마우스 동물 모델에 미치는 효능을 평가하였다. 간섬유증 동물에게 8주간 小柴胡湯을 경구 투여하여 간 기능 지표 분석, 간 조직을 이용한 western blot을 통해 간 조직 내 항산화, 염증, 담즙산 및 섬유화 관련 인자의 발현을 측정하였다.
NADPH oxidase(NOX)의 주요 공급원으로 알려진 활성산소종(Reactive oxygen species, ROS)은 profibrogenic 매개체의 생산을 자극하고 염증 세포를 순환시켜 HSC를 직접 활성화하여 간섬유화를 유발하게 되며 간염, 간경변 및 간암으로 이어지게 된다. 또한, ROS로 인한 산화적 스트레스는 간질환뿐만 아니라 심혈관, 폐, 신장 등 여러 질환들의 발병 원인이 된다고 알려져 있다19. Western blot을 통해 NOX2, p47phox 및 p22phox의 발현량을 측정한 결과, 대조군에 비해 小柴胡湯을 경구투여한 군에서 유의한 감소를 확인하였다. 이는 小柴胡湯이 효과적으로 산화적 스트레스를 감소시킬 수 있음을 의미한다.
체내에서는 ROS에 의한 손상이나 섬유화 촉진을 억제하기 위한 항산화 체계가 존재한다. 이는 Nrf2-Keap1에 의해 조절되는데, 산화적 스트레스나 염증 세포들로 인한 손상이 진행될 시 HO-1, SOD 및 GPx-1/2와 같은 항산화 효소를 활성화시킴으로써 여러 손상으로부터 세포를 보호한다20. 이에 본 연구에서는 western blot을 통해 Nrf2, Keap1, HO-1, SOD 및 GPx-1/2의 발현을 측정하였으며, 小柴胡湯 경구 투여를 통하여 항산화 효소를 유의하게 증가시켰다. 따라서 小柴胡湯은 항산화 관련 단백질과 효소를 활성화시킴으로써 TAA로 인한 산화적 손상으로부터 보호작용을 할 것으로 판단된다.
Nuclear factor-kappa B p65(NF-κBp65)는 여러 세포에서 염증 반응을 조절하는 염증 전사 인자로서 일반적으로 IκB와의 결합으로 인해 세포질에서 비활성 형태를 유지한다21. 이는 산화적 스트레스 등의 자극과 손상으로 인해 핵으로 이동하여 염증성 매개인자인 iNOS, COX-2와 염증성 사이토카인인 TNF-α, IL-6 및 IL-1β의 발현을 조절하여 염증 반응을 촉진하는 것으로 알려져 있다22. 또한, NF-κBp65, TNF-α 및 IL-6의 상호 작용으로 인해 NO를 생성하는 iNOS의 생성을 증가시키며23, NF-κBp65에 의해 조절되는 염증성 사이토카인의 지속적인 생산은 간섬유증을 더욱 가속화한다는 연구도 보고되어 있다24. 이에 본 연구에서는 western blot을 통해 NF-κBp65, iNOS, COX-2, TNF-α, IL-6 및 IL-1β의 단백질 발현을 측정하였으며, 小柴胡湯 투여를 통해 모든 인자가 유의적인 감소한 것을 확인하였다. 따라서 小柴胡湯의 투여로 염증성 단백질과 염증성 사이토카인의 발현을 감소시킴으로써 간섬유증을 억제시킬 것으로 사료된다.
간섬유증의 요인 중 하나인 담즙 정체(intrahepatic cholestasis, IHC)는 체내 전신 순환 장애와 독성 담즙산의 간 내 축적으로 이루어진다25. 담즙산이 생성되지 못하거나 배설 및 재흡수의 기능 장애로 간 내 축적되면 간손상을 악화시키고 장기간 지속될 시 간섬유증에 이르게 된다26,27. 이에 본 연구에서는 western blot을 통해 담즙산합성효소인 CYP7A1과 담즙산 배설 및 재흡수 관련 단백질인 NTCP의 발현 측정하였으며, 小柴胡湯의 투여를 통해 유의적으로 증가한 것을 확인하였다. 따라서 小柴胡湯은 담즙 정체를 억제하여 간섬유증을 완화시킬 것으로 판단된다.
간섬유증은 HSC의 활성으로 생성되는 콜라겐의 축적으로 유발되며, α-SMA는 HSC의 활성을 확인하는 지표로서 알려져 있다. 또한, Collagen Ⅰ 또한, HSC가 활성화될 시 생성되며 간섬유증의 주 요인으로 알려져 있다28. 이에 본 연구에서는 western blot을 통해 섬유화 관련 단백질인 α-SMA와 Collagen Ⅰ의 발현을 측정하였고, 小柴胡湯의 투여로 유의적인 감소를 확인하였으며 이로써 간섬유화의 진행을 억제시킬 것으로 사료된다.
V. 결 론
본 연구에서는 간섬유증을 유발한 동물 모델에서 小柴胡湯을 8주간 투여한 후, 혈액 내 간 기능지표, 암모니아 및 MPO 수치와 간 조직 내 NADPH 산화 효소, 항산화 관련 인자, 염증 관련 인자, 답즙산 관련 인자 및 섬유화 관련 인자를 측정하였으며, 아래와 같은 결과를 얻었다.
1. 간섬유증 동물 모델에서 간 기능 지표, 혈중 암모니아 및 MPO 분석 결과, 小柴胡湯의 투여로 손상된 간 기능을 개선시킨 것을 확인하였다.
2. 小柴胡湯의 투여는 산화적 스트레스의 발생 요인인 NADPH 산화 효소를 유의적으로 억제하였다.
3. 小柴胡湯의 투여는 Nrf2/Keap1 항산화 경로를 통해 HO-1, SOD 및 GPx-1/2와 같은 항산화 효소의 발현을 유의적으로 증가시켰다.
4. 小柴胡湯의 투여는 NF-κBp65의 불활성으로 염증성 매개인자인 iNOS와 COX-2의 발현을 유의적으로 감소시켰으며 또한, 염증성 사이토카인인 TNF-α, IL-6 및 IL-1β의 단백질 발현을 유의적으로 감소시켰다.
5. 小柴胡湯의 투여는 담즙산 관련 단백질인 CYP7A1과 NTCP의 발현을 증가시키고, 섬유화 단백질인 α-SMA와 Collagen Ⅰ의 단백질 발현을 유의적으로 감소시켰다.
본 연구에서는 小柴胡湯의 투여로 간섬유증 동물 모델의 간 기능 지표, 혈중 암모니아 및 MPO 수치의 호전을 확인하였으며, 간 조직을 이용한 western blot을 실시하여 대부분의 인자에서 유의적인 차이를 확인하였다. 小柴胡湯은 간섬유증으로 인해 증가된 NADPH 산화 효소의 발현을 억제하였으며, Nrf2/Keap1의 항산화 경로를 통해서 항산화 효소의 발현을 증가시켰다. 또한, NF-κBp65 활성을 억제하여 염증성 매개인자와 사이토카인의 발현을 억제시킬 뿐만 아니라 담즙과 섬유화 관련 단백질의 발현을 조절함으로써 小柴胡湯이 간섬유증을 완화시키는 긍정적인 효과를 보인 것으로 판단된다. 따라서, 小柴胡湯은 TAA로 유발한 간섬유증 동물 모델에서 간 보호 효과와 산화적 스트레스 억제를 나타냈으며, 추후 본 연구를 통해 간섬유증 개선을 위한 후보 소재로서의 개발 가능성이 높다고 사료된다.











