파킨슨병 in vivo 모델에서 한약재 및 기능성 식품의 항산화 효과에 대한 고찰
Abstract
Objective:
Parkinson’s disease (PD) is the second most common neurodegenerative disease after Alzheimer’s disease. Antioxidant stress and inflammatory reactions are important causes of neurodegenerative diseases and are major causes of PD. Many animal experiments have been aimed at treating PD using the antioxidant effects of various traditional medicines and dietary supplements. This review reports the research investigating the antioxidant effects of herbs in in vivo PD models.
Methods:
The study consisted of a database search for articles related to PD and herbal treatments using the OASIS, NDSL, KTKP, Korean KISS, PubMed, Science Direct, CNKI, Wanfang, and J-STAGE databases. The search period was limited from the start of the search engine application to November 14, 2019. Studies were selected to confirm the antioxidant effects of herbal medicines in an in vivo PD model.
Results:
Eighty-two studies were summarized for plant species, extracts (or compounds), animal models, neurotoxins, and functional results. The most frequently used herbal materials were Bacopa monnieri, Camellia sinensis, Centella asiatica, and Withania somnifera. MPTP and 6-OHDA were the most commonly used neurotoxins for inducing PD. Most studies confirmed an increased expression and activation of antioxidant enzymes and a decrease in oxidative stress. Herbal materials showed their antioxidant effects regardless of the order of treatment and confirmed their possible use as treatments for the prevention and treatment of neurodegeneration.
Conclusion:
Many herbal medicines have antioxidant effects and are likely to be effective in delaying neurodegenerative damage by inhibiting or reducing oxidative stress by expression of antioxidant enzymes.
Keywords: Parkinson’s disease, antioxidant effect, neurodegenerative disease, Chinese herbal drugs, medicinal plants, herb
Ⅰ. 서 론
파킨슨병(Parkinson’s disease, PD)은 알츠하이머병에 이어 두 번째로 흔한 신경계 퇴행성 질환으로서 진전(tremor), 경직(rigidity), 서동(bradykinesia), 자세불안정(postural instability), 보행장애(gait disturbance) 등을 주 증상으로 한다. 운동 증상뿐만 아니라 자율신경계, 감각, 수면, 인지기능 그리고 정신행동학적 이상을 포함하는 비운동성 증상이 동반될 수 있는 질환이다 1. 파킨슨병의 주요 병리 기전인 뇌 조직의 퇴행성 변성은 산화적 스트레스와 염증에 의해 이루어진다고 알려져 있다. 또한 파킨슨병을 치료하는데 주로 사용되는 약물인 레보도파(levodopa)는 장기 투여 시 도파민 신경세포에 산화적 손상을 유발할 수 있다고 보고되고 있다. 따라서 항산화 및 항염증 물질의 병용 투여가 신경퇴행성 손상을 예방 또는 지연 시킬 수 있는 방법의 하나로 제시되고 있다 2. 현재 행해지는 파킨슨병 치료의 한계로 인하여 보완 의학에 대한 관심도 증가하고 있으며 3, 침 4이나 한약 5 등을 이용한 한의 치료의 효과도 지속적으로 보고되고 있다. 억간산(抑肝散) 6, 소합향원(蘇合香元) 7 등 복합처방의 신경 보호 작용에 대한 연구도 수행되고 있으며, 단일 약재나 기능성 식품(dietary supplements)를 활용한 파킨슨병 동물모델에서 치료 효과 및 신경보호 작용을 확인하는 연구도 다양하게 보고되고 있다 8-10. 이에 한약재와 차(녹차, 홍차), 커피, 과일, 허브류 등을 포함하는 기능성 식품을 대상으로 국내외의 연구 결과를 정리할 필요성이 있다고 사료된다. 이에 본 연구에서는 국내 및 국외 database를 토대로 실험 연구를 분석하여, 파킨슨병 in vivo 모델에서 항산화 작용을 통한 치료 효과가 알려진 연구 결과를 정리하여 다음과 같이 보고하고자 한다.
Ⅱ. 문헌 검색
1. 논문의 검색 및 선별
1) 논문의 검색
국내의 경우 오아시스(Oriental Medicine Advanced Searching Integrated System, OASIS), 국가과학기술정보센터(National Discovery for Science Leaders, NDSL), 한국전통지식포탈(Korean Traditional Knowledge Portal, KTKP), 한국학술정보(Koreanstudies Information Service System, KISS)를 이용하여 검색하였고, 국외의 경우 Pubmed, Science Direct, 中國知識基礎設施工程(China National Knowledge Infrastructure, CNKI), Wanfang, J-STAGE를 이용하여 검색하였다.
검색어는 국내 문헌의 경우 ‘파킨슨병’, ‘파킨슨’, ‘Parkinson’s disease AND herb’로 검색하였고, 영어 검색은 2011년에 발표된 Song 등 8의 연구를 참고하여(“drugs, Chinese herbal”[MeSH Terms] OR “plants, medicinal”[MeSH Terms] OR “phytotherapy” [MeSH Terms] OR “medicine, traditional”[MeSH Terms] OR “plant extracts”[MeSH Terms] OR “plant preparations”[MeSH Terms]) AND (6-OHDA OR MPP+ OR MPTP OR rotenone), (Parkinson’s disease AND herbal)으로 조합하여 검색하였다. 중국어 검색은 ‘帕金森 AND 中药’, 일본어 검색은 ’パーキンソン AND Medicine, Kampo’, ’パーキンソン AND 生薬’을 검색어로 이용하였다. 검색기간은 검색 엔진이 지원하는 개시 시점부터 2019년 11월 14일까지였으며, 언어에 대한 제한은 두지 않았다. 국내외 검색 엔진을 통해 검색된 문헌에 대하여 1단계로 제목과 초록을 검토한 뒤 문헌을 선별하였고, 2단계로 본문을 조사하여 연구방법을 확인하여 재차 선별하였다( Fig. 1).
Fig. 1
Flow chart of study selection process. 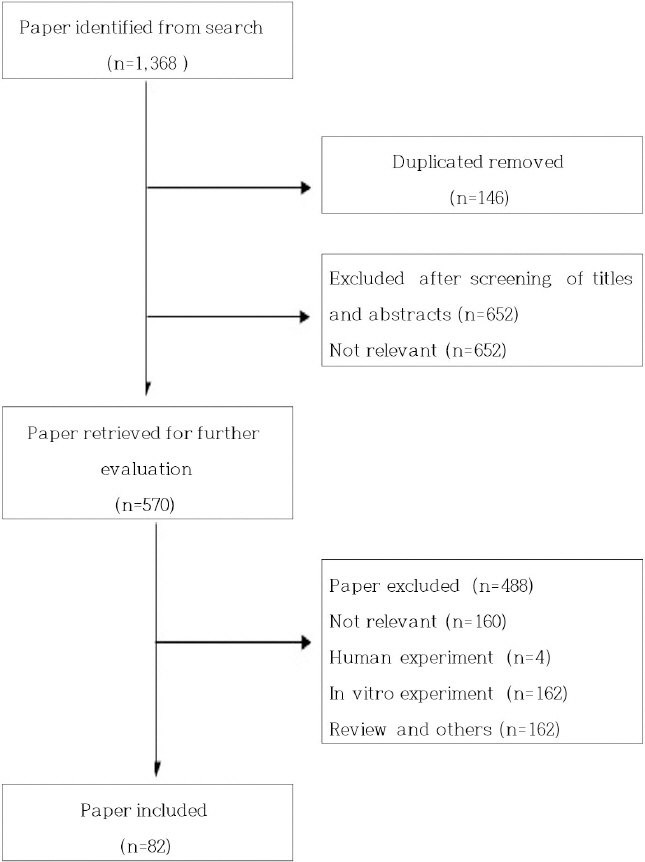
2) 선정기준
다음 기준에 해당하는 문헌을 연구 대상으로 선정하였다.
(1) 파킨슨병 유발 모델을 대상으로 in vivo (ex vivo) 연구
(2) 단일의 한약재(식물) 추출물 또는 단일 식물의 함유 성분을 경구 복용한 연구
(3) 연구 결과에 항산화 효과를 확인한 연구
3) 제외기준
다음 기준에 해당하는 문헌을 연구 대상에서 제외하였다.
(1) 선정 기준 (1)을 제외한 in vitro 연구, 증례보고, 환자-대조군 연구, 문헌고찰연구
(2) 복합처방이나 기타 한의학적 치료가 포함된 연구
(3) 추출물 또는 함유 성분을 복강 주입한 연구
(4) 다양한 질병을 대상으로 한 review 연구
2. 자료의 정리
최종 선정된 82편의 연구를 분석하여 사용된 한약재(식물), 한약재의 처치내용(추출 방법, 성분), 사용된 실험대상, PD 유발약물, 복용 기간, 용량, 결과를 요약하였다( Table 1).
Table 1
The Experimental Studies about Parkinson’s Disease Treated with Herbal Materials
|
Plant species |
Extracts /compounds |
Model |
Neurotoxin |
Treatment period (days) |
Dose |
Functional outcome |
References |
|
|
Increase |
Decrease |
|
Acanthopanax senticosus (刺五加) |
Ethanol ex. |
Mice |
MPTP |
20 |
45.5 mg/kg |
Mitochondrial beta-oxidantion of long chain saturated fatty acids and fatty acid metabolism |
Li XZ11(2013) |
|
|
Ex. |
Mice |
MPTP |
20 |
45.5 mg/kg |
|
MDA, ROS, OXPHOS↓ (p<0.05) |
Liu SM12(2018) |
|
|
Albizia adianthifolia (flat-crown) |
Aqueous ex. |
Rat |
6-OHDA |
21 |
150, 300 mg/kg/day |
CAT, SOD↑ (150; p<0.0001, 300; p<0.001), GSH, GPX↑ (p<0.0001) |
MDA↓ (150, 300; p<0.001) Protein carbonyl↓ (300; p<0.001) |
Beppe GJ13(2015) |
|
|
Apium graveolens (셀러리) |
Methanol ex. |
Mice |
MPTP |
21 |
125, 250, 375* mg/kg/day |
|
GPx, MDA, MAO-A, MAO-B, O2-↓ (p<0.05) |
Chonpathompikunlert P14(2018) |
|
|
Arthrospira platensis (스피루니아) |
Powder-mixed food |
Drosophila. |
Paraquat |
|
5, 10% |
|
SOD↓ (p<0.001) CAT↓ (p>0.1) |
Kumar A15(2017) |
|
|
Aspidosperma pyrifolium (Pereiro) |
Aqueous ex. |
Rat |
6-OHDA |
14 |
100, 200 mg/kg |
|
LPO↓ (p<0.05) |
de Araújo DP16(2018) |
|
|
Astragalus membranaceus (黃芪) |
Astragalan |
C. elegans
|
6-OHDA |
|
2 mg/mL |
CAT, GPx, SOD↑ (p<0.05) |
MDA, ROS↓ (p<0.05) |
Li H17(2016) |
|
|
Bacopa monnieri (워터히솝) |
Alcoholic ex. |
Rat |
6-OHDA |
21 |
20, 40 mg/kg |
GSH, GST, GPx, GR↑ (20; p<0.05, 40; p<0.01) |
TBARS (LPO)↓ (20; p<0.05, 40; p<0.01) |
Shobana C18(2012) |
|
|
|
Ethanol ex. |
Drosophila. |
Rotenone |
7 |
0.1% (unit media; 1 unit =300 ml) |
CAT, GSH, GST, SOD↑ |
TBARS↓ |
Subramanian P19(2014) |
|
|
|
Ethanol ex. |
Mice |
MPTP |
30 |
40 mg/kg/day |
CAT, SOD↑ (p<0.05) |
MDA (LPO), CD↓ (p<0.05) |
Singh B20 (2016) |
|
|
|
Ethanol ex. |
Mice |
MPTP |
30 |
40 mg/kg/day |
CAT, GR, GPx, SOD↑ (p<0.001) |
LPO, MDA↓ (p<0.05) |
Singh B21(2017) |
|
|
|
Ex. |
Mice |
Paraquat |
21 |
200 mg/kg/day |
SDH↑ |
|
Krishna G22 (2019) |
|
|
|
Standardized ex. Brahmi capsule |
Drosophila. |
Rotenone |
7 |
0.05, 0.1*% 250 mg/cap |
GSH↑ (0.1%; p<0.05) |
MDA↓ (0.1%; p<0.05) |
Hosamani R23(2009) |
|
|
|
CAT, GST, SOD - |
|
|
|
Standardized ex. |
Mice |
Paraquat |
28 |
200 mg/kg/day |
|
HP, MDA, ROS↓ (p<0.05) |
Hosamani R24(2016) |
|
|
Buddleja cordata (Tepozan) |
Methanol ex. |
Rat |
MPP+ |
14 |
50, 100 mg/kg/day |
LPO protection (p<0.05) |
Gabriela25(2015) |
|
|
Camellia sinensis (차나무 (綠茶, 紅茶)) |
(Black tea) Aqueous ex. |
Rat |
6-OHDA |
42 |
1.5% (1.5g of BT leaves were suspended in 100 ml of hot water) |
CAT, GSH, SOD↑ (p<0.05) |
LPO↓ (p<0.01) |
Chaturvedi RK26 (2006) |
|
|
EG |
Drosophila.
|
(transgenic) |
24 |
0.25, 0.50, 1.0* μg/mL |
|
LPO↓ (p<0.05) |
Siddique YH27 (2014) |
|
|
EGCG |
Mice |
MPTP |
7 |
25 mg/kg |
protein carbonyl (p>0.05) |
Xu Q28 (2017) |
|
|
|
EGCG |
Mice |
MPTP |
14 |
2, 10 mg/kg/day |
CAT, SOD↑ (p<0.05) |
|
Levites Y29(2001) |
|
|
|
Green tea polyphenols |
Rat |
6-OHDA |
7 |
150, 450 mg/kg/day |
|
TBARS, LPO↓ (p<0.05) |
Guo S30 (2007) |
|
|
Centella asiatica (병풀) |
Aqueous ex. |
Rat |
MPTP |
21 |
300 mg/kg |
CAT, GPx, SOD, TA↑ (p<0.01) |
LPO, XO↓ (p<0.01), PCC↓ (p<0.05) |
Haleagrahara N31 (2010) |
|
|
Asiaticoside |
Rat |
MPTP |
14 |
15, 30, 45* mg/kg/day |
GSH↑ |
MDA↓ (30; p<0.05, 45; p<0.01) |
Xu CL32 (2012) |
|
|
Asiaticoside |
Rat |
Rotenone |
14 |
50 mg/kg/day |
CAT, GPx, GSH, SOD↑ |
LPO↓ |
Margabandhu Gopi33 (2017) |
|
|
|
Ethanol ex. |
Mice |
MPTP |
21 |
40 mg/kg/day |
CAT, GPx, GSH, SOD↑ |
LPO↓ |
Bhatnagar M34 (2017) |
|
|
|
Madecassoside |
Rat |
MPTP |
7 |
15 ,30, 60* mg/kg/day |
GSH↑ (30, 60; p<0.05) |
MDA↓ (30, 60; p<0.05) |
Xu CL35 (2013) |
|
|
Chondrus crispus (아이리쉬모스) |
Methanol ex. |
C. elegans
|
(transgenic) |
9 |
0.5, 1, 2 mg/mL |
oxidative stress tolerance↑ (p<0.05) |
|
Liu J36(2015) |
|
|
Chrysanthemum boreale (山菊) |
Water ex. |
Mice |
MPTP |
28 |
100, 200 mg/kg |
CAT, GPx, SOD↑ (p>0.05) |
LPO, MAO activity↓ (p>0.05) |
Kim SH37(2013) |
|
|
Coffea arabica (커피) |
Eicosanoyl-5- hydroxytryptamide |
Mice |
MPTP |
28 |
12, 120 mg/kg/day |
|
GSH/GSSG ratio↓ (p<0.05) |
Lee KW38(2013) |
|
|
Crocus sativus (샤프란) |
Methanol ex. crocin |
Drosophila.
|
Rotenone |
7 |
ex. (0.05, 0.1%), crocin (10, 25 μM) |
GST, SOD↑ (p<0.05) |
CAT↓(p<0.05) |
Rao SV39(2016) |
|
|
Curcuma longa (Turmeric, 薑黃)
|
Curcuminoids |
mice |
MPTP |
14 |
150 mg/kg |
MAO-B (p>0.05) |
Ojha R P40(2012) |
|
|
Aqueous ex. |
Mice |
MPTP |
90 |
1.65, 3.3 g/kg |
GSH↑ (1.65; p<0.05, 3.3; p<0.001) |
|
Mythri RB41(2011) |
|
|
|
Curcumin |
Rat |
6-OHDA |
56 |
100 mg/kg |
GSH-Px, SOD↑ (p<0.05) |
MDA↓ (p<0.05) |
He YY42(2012) |
|
|
Datura metel (털독말풀) |
Powder |
rat |
6-OHDA |
21 |
0.009, 0.018. 0.036* g/kg |
GSH, GSH-Px, SOD↑ (p<0.05) |
MDA↓ (p<0.05) |
JIN Ze43(2013) |
|
|
Delphinium denudatum (Jadwar, 델피늄) |
Ethanol ex. |
rat |
6-OHDA |
21 |
200, 400, 600 mg/kg |
CAT, SOD↑ (p<0.05) |
TBARS (LPO)↓ (p<0.001) |
Ahmad M44(2006) |
|
|
Dimocarpus longan (龍眼肉) |
Water ex. |
rat |
MPP+ |
8 |
125, 250, 500* mg/kg |
|
LPO↓ (p<0.05) |
Lin AM45(2012) |
|
|
Eplingiella fruticosa (Broad rosemary)
|
Essentioal oil, β-cyclodextrin |
Mice |
Reserpine |
40 |
5 mg/kg |
|
TBARS↓ (p=0.05) |
Jose I.A46(2019) |
|
|
Eucalyptus citriodora (유칼립투스) |
Acetone ex. |
Drosophila.
|
(transgenic) |
21 |
0.25, 0.50, 1 μl/ml |
|
LPO (MDA)↓ (p<0.05) |
Siddique YH47 (2013) |
|
|
Ginkgo biloba (銀杏) |
EGb 761 |
Rat |
6-OHDA |
21 |
50, 100, 150 mg/kg |
CAT, GSH, GST, GR↑ (50; p<0.05, 100; p<0.01, 150; p<0.001) SOD↑ (50,100; p<0.01, 150; p<0.001) |
TBARS↓ (50; p<0.05, 100; p<0.01, 150; p<0.001) |
Ahmad M48(2005) |
|
|
EGb 761 |
Rat |
Reserpine |
21 |
100 mg/kg/day |
GSH, GST↑ (p<0.05) |
MDA↓ (p<0.05) |
El-Ghazaly MA49(2015) |
|
|
Egb 761 |
Mice |
(transgenic) |
21 |
40, 60 mg/kg |
SOD↑ (p<0.05) |
MDA↓ (p<0.05) |
Kuang S50(2018) |
|
|
|
Bilobalide |
Rat |
6-OHDA |
14 |
6, 12 mg/kg |
SOD↑ (p<0.05) |
MDA↓ (p<0.05) |
Ba XH51(2006) |
|
|
Hyoscyamus niger (사리풀) |
Methanol ex. |
Rat |
MPTP |
2 |
125, 250, 500 mg/kg |
|
MAO-B activity↓ (p<0.05) |
Sengupta T52(2011) |
|
|
Hypericum perforatum (서양고추나물, St. Johnswort)
|
Ethanol ex. |
Mice |
MPTP |
7 |
300 mg/kg |
CAT, GPx, GSH, SOD↑ (p<0.05) |
LPO↓ (p<0.05) |
Mohanasundari M53(2006) |
|
|
Methanol ex. |
Mice |
MPTP |
7 |
300 mg/kg |
|
MAO-B activity↓ (p<0.05) |
Mohanasundari M54(2007) |
|
|
|
Hydroalcohol ex. |
Rat |
6-OHDA |
14 |
200 mg/kg/day |
CAT, GSH |
|
Kiasalari Z55 (2016) |
|
|
Juglans sinensis Juglans regia (胡桃) |
Diet rich in walnut |
Mice |
MPTP |
28 |
diet rich in walnut (6%) |
GSH, GPx↑ (p<0.05) |
CAT, SOD↓ (p<0.05) |
Essa MM56(2015) |
|
|
Ligusticum officinale (川芎) |
Tetramethylpy -razine |
Mice |
MPTP |
14 |
20, 40, 80* mg/kg |
GSH, SOD↑ (p<0.05) |
|
Guo B57 (2014) |
|
|
Monascus purpureus (홍국균) |
Ethanol ex. |
Rat |
6-OHDA |
28 |
5.5, 11.0* mg/kg |
CAT, SOD ↑ (p<0.05) GPx↑ (p<0.01) GR↑ (11.0; p<0.01), |
MDA↓ (p<0.01) |
Tseng WT58(2016) |
|
|
Morinda citrifolia (노니) |
Ethyl acetate ex. |
Rat |
Rotenone |
30 |
150 mg/kg |
GPx, GR, GSH, SOD↑ (p<0.05) |
HP, MDA, NO, protein carbonyls↓ (p<0.05) |
Narasimhan KK59(2016) |
|
|
Mucuna pruriens (벨벳빈) |
Cotyledon powder |
Rat |
6-OHDA |
28 |
2.5, 5.0 g/kg/day |
mitochondrial complex-I activity↑ (p<0.05) |
|
Manyam BV60(2004) |
|
|
total MAO =NADH and coenzyme Q-10 were present in signifiant amounts |
|
|
Ethanol ex. |
Mice |
MPTP |
30 |
48 mg/kg/day |
CAT, SOD↑ (p>0.05) |
CD, MDA↓ (p>0.05) |
Singh B20 (2016) |
|
|
|
Ethanol ex. |
Mice |
MPTP |
7 |
100 mg/kg |
GSH↑ (p<0.001) |
MDA↓ (p<0.001) |
Yadav SK61(2014) |
|
|
|
Ethanol ex. |
Mice |
Paraquat |
36 |
100 mg/kg |
|
MDA↓ (p<0.001) |
Yadav SK62(2017) |
|
|
Ocimum sanctum (홀리바질) |
Water ex. |
Drosophila.
|
(transgenic) |
21 |
0.0428×10-4, 0.87×10-4, 1.85×10-4g/mL |
|
LPO↓ (p<0.05) |
Siddique YH63(2014) |
|
|
Olea europaea (올리브) |
Hydro-alcoholic ex. |
Rat |
Rotenone |
30 |
75, 150, 300* mg/kg/day |
CAT, SOD, GPx↑ (p<0.001) |
MDA↓ (p<0.001) |
Sarbishegi M64(2018) |
|
|
Paeonia suffruticosa (牧丹皮) |
Paeonol |
Mice |
MPTP |
21 |
20 mg/kg |
CAT, SOD, GSH↑ (p<0.01) |
|
Shi X65(2016) |
|
|
Panax ginseng (人蔘) |
Ex. |
Mice |
MPTP |
|
37.5, 75, 150* mg/kg |
Nrf2 protein expression↑ |
|
Choi JH66(2018) |
|
|
Pinellia ternate (半夏) |
Total alkaloid |
Rat |
6-OHDA |
60 |
25, 50, 100 μg/mL |
GSH, SOD↑ (p<0.01) |
H2O2 content, MDA, TAPT↓ (p<0.01) |
Duan K67 (2012) |
|
|
Pinus maritime (松節) |
Pycnogenol |
Mice |
MPTP |
7 |
20 mg/kg |
GSH, GPx, GR, SOD↑ (p<0.05) |
TBARS↓ (<0.05) |
Khan MM68 (2013) |
|
|
Piper longum (蓽撥) |
Alkaloids piperine |
Mice |
MPTP |
49 |
30, 60*, 120 mg/kg/day (PLA) 60 mg/kg/day (piperine) |
GSH, SOD↑ (p<0.05) |
LPO(MDA)↓ (p<0.05) |
Bi Y69 (2015) |
|
|
Polygonum cuspidatum (虎杖根) |
Resveratrol |
Rat |
6-OHDA |
14 |
20 mg/kg |
|
ROS↓ (p<0.01) |
Wang Y70 (2011) |
|
|
Rheum palmatum (大黃) |
Water ex. |
Rat |
MPTP |
15 |
100, 200 mg/kg |
|
MDA↓ (p<0.05) |
Kim TE71 (2004) |
|
|
LPO, MAO-B (no significant) |
|
|
Rosmarinus officinalis (로즈마리) |
Carnosic acid |
Rat |
6-OHDA |
21 |
20 mg/kg (3 times each week for 3 weeks) |
GSH↑ (p<0.05) |
LPO↓ (p<0.05) |
Wu CR72 (2015) |
|
|
Carnosic acid |
Rat |
6-OHDA |
21 |
20 mg/kg (3 times each week for 3 weeks) |
|
GST family of proteins GSTP protein↓ (p<0.05) |
Lin CY73 (2014) |
|
|
Scutellaria baicalensis (黃芩) |
Baicalein |
Rat |
Rotenone |
28 63 |
78 mg/kg/day |
LPO = (Baicalin could not inhibit lipid peroxidation generation of brain.) |
Chen X74 (2008) |
|
|
Baicalein |
Mice |
MPTP |
15 |
100 mg/kg |
GSH↑ (p<0.01) |
GSH-Px, MDA↓ (p>0.05) |
Chen X75 (2007) |
|
|
Selaginella delicatula (셀라기넬라) |
Aqueous ex. |
Drosophila.
|
Rotenone |
7 |
0.05, 0.1, 0.2*% |
CAT, GR, GSH, GST, SOD↑ (p<0.05) |
HP, PC, ROS↓ (p<0.05) |
Girish C76 (2012) |
|
|
Aqueous ex. |
Mice |
Rotenone |
21 |
100 mg/kg |
GSH↑ (p>0.05) |
HP, MDA, PC, ROS↓ (p<0.05) |
Chandran G77 (2013) |
|
|
Sesame indicum (참깨) |
Sesame seed oil |
Mice |
6-OHDA |
15 |
20% oil mixed in fat free diet |
CAT, SOD↑ (p<0.05) |
LPO, GSH↓ (p<0.01) |
Ahmad S78 (2012) |
|
|
Sida cordifolia (시다 코르디폴리아) |
Aqueous ex. n-hexane ex. Chloroform ex. |
Rat |
Rotenone |
35 |
50, 100*, 250 mg/kg |
CAT, GSH↑ (p<0.001) |
TBARS↓ (p<0.001) |
Khurana N79(2013) |
|
|
Sophora tomentosa (苦蔘) |
Water ex. |
Mice |
MPTP |
15 |
20, 50, 100* mg/kg |
GSH, GPx, CAT↑ (p<0.05) MDA↑ (p<0.01 SOD, GR↑ (p<0.001) |
|
Chang HC80(2019) |
|
|
Stereospermum suaveolens (Patala) |
Methanol ex. |
Rat |
6-OHDA |
42 |
125, 250, 500* mg/kg |
CAT, SOD↑ (p<0.01), GSH, total thiols↑ (p<0.001) |
LPO↓ (p<0.001) |
Shalavadi MH81(2012) |
|
|
Tinospora cordifolia (구두치) |
Ethanol ex. |
Rat |
6-OHDA |
30 |
200, 400 mg/kg |
complex I activity↑ (p<0.01) |
LPO↓ (p<0.001) |
Kosaraju J82 (2014) |
|
|
Tribulus terrestris (白蒺藜) |
Ex. |
Mice |
Rotenone |
17 |
5, 10* mg/kg |
CAT, GSH, SOD↑ (p<0.05) |
MDA↓ (p<0.05) |
Alzahrani S83(2018) |
|
|
Uncaria sinensis (釣鉤藤) |
Rhynchophylline |
Rat |
6-OHDA |
30 |
30 mg/kg/day |
SOD↑ (p<0.05) |
MDA↓ (p<0.05) |
Wang XM84 (2014) |
|
|
Valeriana wallichii Valeriana officinalis (吉草根) |
Aqueous ex. |
Drosophila.
|
Rotenone |
7 |
10 mg/mL |
SOD, CAT mRNAs was normalized (p<0.05) |
Sudati JH85 (2013) |
|
|
Ex. |
Mice |
MPTP |
14 |
50, 100, 200* mg/kg |
GPx, GR, GST↑ (p<0.01) |
LPO, ROS↓ (p<0.01) |
Sridharan S86 (2015) |
|
|
Withania somnifera (아슈와간다, 인도인삼) |
Ethanol ex. |
Mice |
MPTP |
21 |
40 mg/kg/day |
SOD, CAT, GPx, GSH↑ |
LPO↓ |
Bhatnagar M30(2017) |
|
|
Ethanol ex. |
Mice |
MPTP |
28 |
100 mg/kg |
|
CAT, SOD, TBARS↓ (p<0.05) |
Sankar SR87 (2007) |
|
|
Ethanol ex. |
Rat |
6-OHDA |
21 |
100, 200, 300 mg/kg |
GSH, GST, GPx, GR↑ (p<0.01) |
LPO↓ (100; p<0.05, 200, 300; p<0.01) |
Ahmad M88 (2005) |
|
|
|
Ex. |
Mice |
MPTP |
7 28 |
100 mg/kg |
GSH↑ (p<0.001) GPx↑ (p<0.01) |
|
RajaSankar S89 (2009) |
|
|
|
Powder |
Mice |
Rotenone |
28 |
400 mg/kg/day |
GSH levels↑ |
HP, MDA, ROS↓ |
Manjunath MJ90(2013) |
|
|
Tomato |
Aqueous ex. |
Drosophila.
|
Rotenone |
7 |
0.1, 0.2% |
CAT, GSH, GST, PC, SOD ↑ (p>0.05) |
HP, ROS↓ (p<0.05), |
Krishna G91(2016) |
|
|
Aqueous ex. |
Mice |
Rotenone |
21 |
50, 100* mg/kg |
Hippocampus GSH, MDA, SOD↑ (p<0.05) GPx↑ (100; p<0.05) Striatum GSH, MDA, SOD↑ (100; p<0.05) GPx↑ (p>0.05) |
|
Gokul K92 (2014) |
Ⅲ. 결 과
82편의 논문을 분석한 결과 연구에 가장 많이 사용된 식물은 Bacopa monnieri로 총 7편이 있었고, 그 뒤로 Camellia sinensis, Centella asiatica, Withania somnifera가 각각 5편, Ginkgo biloba, Mucuna pruriens를 사용한 연구가 각각 4편씩 확인되었다.
Table 2
Classification of Herbal Materials
|
Classification |
Herbal materials |
|
Herbal medicines (N=7) |
Ligusticum officinale, Pinellia ternate, Piper longum Rheum palmatum, Sophora tomentosa, Tribulus terrestris, Uncaria sinensis
|
|
|
Food (N=14) |
Apium graveolens, Arthrospira platensis, Centella asiatica, Chondrus crispus, Coffea arabica, Crocus sativus, Hypericum perforatum, Morinda citrifolia, Mucuna pruriens, Ocimum sanctum, Olea europaea, Rosemarinus officinalis, Sesame indicum, Tomato
|
|
|
Food and medicine (N=14) |
Acanthopanax senticosus, Astragalus membranaceus, Camellia sinensis, Chrysanthemum boreale, Curcuma longa, Dimocarpus longan, Ginkgo biloba, Juglans sinensis, Paeonia suffruticosa, Panax ginseng, Pinus maritime, Polygonum cuspidatum, Scutellaria baicalensis, Valeriana wallichii
|
|
|
Others (N=15) |
Albizia adianthifolia, Aspidosperma pyrifolium, Bacopa monnieri, Buddleja cordata, Datura metel, Delphinium denudatum, Eplingiella fruticosa, Eucalyptus citriodora, Hyoscyamus niger, Monascus purpureus, Selaginella delicatula, Sida cordifolia, Stereospermum suaveolens, Tinospora cordifolia, Withania somnifera
|
총 50종의 식물을 대한약전 93 또는 대한약전외한약(생약)규격집 94, 식품공전 95을 기준으로 한약재, 식품, 식약공용, 기타로 분류하였다. 본초 분류 상 보익약(補益藥) 3종, 청열약(淸熱藥) 3종, 활혈거어약(活血祛瘀藥) 2종, 평간약(平肝藥) 2종이 있었고, 발산풍열약(發散風熱藥), 거풍습강근골약(祛風濕强筋骨藥), 온리약(溫裏藥), 공하약(攻下藥), 온화한담약(溫化寒痰藥) 등의 종류가 확인되었다. 식품류로 누구나 쉽게 접근할 수 있는 차(녹차, 홍차), 커피, 바질, 올리브 등을 확인하였다.
2. 약재 사용 방법에 따른 분류(Table 3)
Table 3
Herb Extraction Method or Compounds
|
Method |
Herbs (N) |
Studies (N) |
|
Extract |
Alcoholic extract (water extract) |
3 |
3 |
|
Aqueous extract |
13 |
15 |
|
Ethanol extract |
9 |
15 |
|
Methanol extract |
6 |
6 |
|
|
Powder |
4 |
4 |
|
|
Others |
13 |
15 |
|
Compounds |
16 |
26 |
실험동물에게 항산화 효과가 있는 약재를 추출하거나 함유 성분을 사용하여 복용하게 하였다. 추출방법은 물을 이용하여 추출한 경우는 13종(15편), 에탄올 추출을 한 약물은 9종(15편), 메탄올 추출은 6종(6편)의 약재가 있었고, 그 밖에 가루를 내어 사용하거나 기름을 내어 복용한 경우도 있었다. 약재에 함유된 특정 성분을 복용하게 한 연구는 총 26편이었고, 16종 약물의 19종 성분을 이용하였다. 추출물과 함유 성분을 비교한 연구가 2편 있었고, 3가지의 각기 다른 추출 방법을 이용한 연구가 1편이었다.
3. 파킨슨병 유발 독성에 따른 분류
두 가지 식물을 비교하여 결과를 보고한 2편의 논문 20,30을 포함하여 분석하였을 때, 카테콜아민성 신경만을 선택적으로 파괴하여 파킨슨병 유발하는 MPTP 96를 사용한 연구는 33편이었다. 6-OHDA는 선택적으로 도파민 신경세포사를 유도하는 신경독성물질 97로 23편에서 사용되었다. Neruotoxin 중에 도파민 신경의 퇴행을 유발하는 MPTP, 6-OHDA, rotenone 등이 가장 널리 사용되고 있으며, 그 외에 paraquat 등이 MPP+와 구조적 유사성 때문에 사용되고 있다 98,99. Rotenone은 15편, paraquat는 4편, reserpine는 2편에서 이용되었고, 유전적 변이를 이용하여 파킨슨병을 유발하는 연구는 5편이었다.
4. 처치 그룹에 따른 분류
항산화 효과를 확인하기 위해 대조군 및 치료군의 결과를 비교하여 연구가 진행되었다. 한약재(식물) 단일 용량을 치료군으로 설계한 연구는 38편이고, 용량을 달리하여 효과를 비교한 연구가 43편이었다.
항산화효과 한약재(식물)를 사용한 치료군과 levodopa 또는 L-deprenyl 등 파킨슨병 치료 약제를 사용한 양약 치료군을 설정하여 효과를 비교한 연구가 17편이었다.
약물 추출물의 용량을 달리하여 어떤 용량이 항산화 효과가 더 뛰어난지 비교하였을 때, Table 1의 용량, 결과에 나타낸 것과 같이 대부분의 연구에서 중간용량 및 고용량일 때 최저용량에 비해 효과가 좋은 것으로 보고되었다. 또한, levodopa 등 현재 사용되고 있는 양약 치료군과 비교하였을 때는 양약에 비해 약물 추출물은 많은 용량을 사용해야 했다. 하지만 양약 치료군과 비슷한 수준의 유의한 항산화 효과를 확인할 수 있었다.
Table 4
Period of Taking Herbal Materials
|
Periods (days) |
Herbal Materials (N) |
|
0-5 |
1 |
|
6-10 |
14 |
|
11-15 |
15 |
|
16-20 |
3 |
|
21-25 |
21 |
|
26-30 |
13 |
|
31- |
9 |
약물을 복용하게 한 기간을 살펴보면 0-5일 1편, 6-10일 14편, 11-15일 15편, 16-20일 3편, 21-25일 21편, 26-30일 13편, 31일 이상 9편이었고, 확인 못한 연구 4편이다. 한 연구에서 복용일수를 달리하여 비교한 경우 2편으로 Chen X 72(2008)은 치료군의 경우 4주, 예방군의 경우 9주 복용하였고, RajaSankar S 89(2009) 등의 연구에서는 7일 복용군과 28일 복용군으로 나눠 결과를 확인하였다.
6. 항산화 효과를 가진 한약재의 선후 처치
실험 설계를 확인하였을 때, 항산화 효과의 약물을 먼저 복용시킨 후 파킨슨병 유발 약물을 사용한 연구는 22편이었고, 파킨슨병 유발 약물을 먼저 사용한 후 항산화 효과 약물을 복용 시킨 연구는 30편이었다. 파킨슨병 유발 약물과 항산화 효과 약재를 동시에 사용한 연구는 14편이었고, 항산화 효과 약재 복용 중간에 파킨슨병 유발 약물을 사용한 경우는 13편이었다. 같은 연구에서 항산화 효과의 약재를 선, 후 처치군으로 나눠 비교한 연구는 2편이었다.
7. 항산화 지표
항산화 효과 및 산화 스트레스를 확인하기 위하여 측정한 지표는 총 monoamine oxidase(MAO)의 활성, superoxide dismutase(SOD), catalase(CAT) 및 glutathione peroxidase(GPx)의 활성, 세포내 활성산소종(reactive oxygen species, ROS)과 뇌 조직 중 지질과산화물(Lipid peroxide)함량, thiobarbituric acid reactive substances(TBARS), malondialdehyde (MDA) 등이다.
Ⅳ. 고찰 및 결론
현재 파킨슨병에 사용되는 치료 약재는 근본적인 치료보다는 증상 조절을 목적으로 하고 있다. 일반적으로 레보도파(levodopa) 제제를 이용하며, 그 외에 도파민 작용제, 아만티딘, MAO-B억제제 (Monoamine oxidase B inhibitor), 항콜린제, COMT 억제제(Catechol-O-methyl transferase inhibitors)가 이용된다. 레보도파는 파킨슨병 환자의 뇌 안에 부족해진 도파민을 외부에서 직접 보충해주는 약으로, 파킨슨병 환자에게 주된 치료약으로 쓰인다 100. 하지만 레보도파 치료 중인 환자의 50%에서 5년 안에 운동변동(motor fluctuation), 이상운동(dyskinesia)과 같은 부작용이 나타나며 레보도파의 효과가 지속되지 못하여 나타나는 wearing off phenomenon을 호소하기 시작한다 101. 떨림, 보행장애 등 관련 증상을 호전시키기 위한 한의치료 102, 103가 시행되고 있으나, 대부분의 한약 치료는 주로 증상 및 변증에 따른 처방을 선택하여 사용하고 있다. 항산화, 항염증 효과가 있는 물질들의 병용하는 것이 신경퇴행성 손상을 지연시킬 수 있는 효과적인 방법으로 소개되었고, 파킨슨병 치료의 새로운 처방 개발이나 가감에 활용하기 위하여 한약재(단미제)에 대한 효능⋅효과를 밝힐 필요성이 있다. 동의보감에 수록된 뇌질환 관련 한약제제 중 대부분은 중추신경 억제 효과, 기억력 개선 효과, 항산화 및 항염증 효과가 있는 것으로 알려지고 있다 104. 더불어 국내외에서는 다양한 식물 또는 식품 등을 이용하여 파킨슨병의 치료 효과 및 신경보호 작용을 확인하는 연구가 이루어지고 있다, 2012년 Song 등 8은 2011년까지 수행된 파킨슨병에 대한 단미제 실험 연구 동향을 보고하며, 약초의 활성 화합물을 기록하였다. 2017년 Joo 등 9의 연구에서는 국내에서 발표된 실험 연구를 중심으로 단미제, 복합처방 및 기타 한의학적 치료를 종합적으로 분석하였다. 하지만 국내 학술지에 발표된 단미제 중심의 실험 연구 현황은 총 7편뿐이었다. 2019년 5월에 발표된 Rabiei 등 10의 연구에서는 파킨슨병의 치료에 사용할 수 있는 12가지 식물의 약리성분과 18가지 약초 추출물을 분석하여 보고하였다. 본 연구에서는 국내 및 중국 데이터베이스까지 검색 범위를 늘려 항산화 효과를 통한 신경 보호 효과를 확인한 in vivo 실험을 분석하였다. 최종적으로 총 82편의 연구를 분석하였고, 50종의 식물이 포함되었다. 분석한 논문 중 약재에 함유된 특정 성분을 이용한 연구는 총 26편이었고, 사용된 성분은 19가지로 확인되었다.
단일 약재 중 7편으로 가장 많은 연구가 수행된 Bacopa monnieri(워터히솝)는 항산화 효과뿐만 아니라 알츠하이머 치매의 기억력 저하를 개선시키고, 우울증 동물 모델에 경구복용 시켰을 때 우울증상을 개선시키는 효과도 보고되었다. 또한, 항염증 및 항균효과가 있는 것으로 알려져 있다 105- 108. 이는 기분장애, 자율신경장애, 수면장애와 같은 파킨슨병에 동반되는 비운동성 증상들을 완화시켜 환자들의 삶의 질 개선에도 도움이 될 수 있을 것으로 보인다. 다음으로 많이 검색된 세 종류의 약물은 차(녹차, 홍차), Centella asiatica, Withania somnifera이다. 녹차의 성분인 epigallocatechin-3-gallate(EGCG)는 암, 심혈관계 질환, 자가 면역 질환, 퇴행성 질환 그리고 간질환과 관련하여 지속적인 연구가 수행되고 있다. 그리고 항산화, 항염증, 항암효능과 신경보호효과가 보고되었다 109. 홍차는 녹차와는 다르게 찻잎 발효 과정에서 생성되는 폴리페놀인 theaflavins이 풍부하다는 장점이 있으며, 이는 카테킨 중에서 가장 강력한 항산화제인 것으로 보고되었다 110, 111. 녹차와 홍차는 환자들이 쉽게 섭취할 수 있고, 복용해도 되는지, 얼마나 먹을 수 있는지 내원 시 궁금해 할 수 있는 부분이기에 연구 결과를 살펴 안내하기에 도움이 될 것으로 보인다. Centella asiatica(병풀)는 또한 피부치료제, 상처치료제, 기억력 증강제 및 강장제 등 다양하게 이용되고 있는 약용식물로서 국내에서도 의약품, 기능성 화장품 소재로 사용하기 위한 수요가 증가하고 있다 112. Withania somnifera(인도인삼, 아슈와간다)는 기억력 저하, 우울증, 간질 및 신경 변성을 비롯한 많은 신경학적 질환을 치료하는 데 사용되어왔다 113, 114. 또한 뿌리 추출물에 항산화 효과와 노화 방지 및 항종양 특성을 갖는 것으로 알려져 있다 115. 분석된 실험에 다빈도로 사용된 본초 분류를 보면 보익약(補益藥)과 청열약(淸熱藥)이 3종으로 가장 많았고, 활혈거어약(活血祛瘀藥)과 평간약(平肝藥)이 2종, 발산풍열약(發散風熱藥), 거풍습강근골약(祛風濕强筋骨藥), 온리약(溫裏藥), 공하약(攻下藥), 온화한담약(溫化寒痰藥) 등이 각각 1종씩 연구에 활용되었다. 파킨슨병을 風, 火, 痰, 瘀 및 心肝腎의 虛證의 병리를 바탕으로 간신음허(肝腎陰虛), 기혈양허(氣血兩虛), 담열내조(痰熱內阻), 기체혈어(氣滯血瘀) 등으로 변증을 나눠 보는데 5, 다빈도 본초 분류와의 상관성도 확인할 수 있었다. 파킨슨병의 원인은 아직 정확하게 밝혀지지 않았지만, 환경적 요인과 유전학적 요소들의 상호작용에 의해 발병하는 것으로 보고되고 있다. 또한, 환경독소, 산화적 손상, 미토콘드리아의 기능 이상 및 염증 반응 등과 관련된 다양한 이론이 발표되고 있다 116. 더불어 최근에는 파킨슨병의 발병원인과 도파민 신경 세포의 사멸기전에 관련된 인자들에 대한 연구와 파킨슨병을 예방하고 병의 진행을 완화시킬 수 있는 새로운 치료법 개발을 위한 연구가 이루어지고 있다 117, 118. 과량의 ROS는 다양한 기전을 통해 DNA 손상이나, 지질과산화, 단백질 변성 등을 일으키며 119, 암, 뇌졸중, 노화, 심혈관 질환, 염증 등의 여러 가지 질병과 밀접한 연관을 갖는 것으로 알려져 있다 120. 뇌 조직은 한번 손상되면 기능적인 회복이 어렵기 때문에 산화적 스트레스 상태를 유도하는 ROS 생성을 억제 또는 감소시키는 것은 치료에 중요하다 121. CAT, GPx, SOD 등의 항산화 효소들의 발현 및 활성화 증가를 유도하여 치료에 이용해야 할 것이다. SOD는 superoxide anion을 H 2O 2로 전화시키는 효소이며, CAT는 H 2O 2를 H 2O와 O 2로 분해하여 무독화시켜 체외로 배설시키고, GPx는 CAT와 비슷한 역할을 한다 122, 123. 본 연구에서 분석한 실험 역시 파킨슨병의 산화적 손상에 대한 항산화 효과를 확인하기 위하여 SOD, CAT 및 GPx의 활성, ROS과 뇌 조직 중 LPO 함량 등을 이용하였다. 대다수의 연구에서 한약재 복용 이후 SOD, CAT, GPx의 활성도가 증가하였으며, LPO, TBARS, MDA는 감소함을 확인하였다.
한약재 복용과 파킨슨병 유발 약물 주입의 선후 순서와 상관없이 항산화 효과를 확인할 수 있었다. 한약재를 먼저 복용한 뒤 파킨슨병 유발하였을 때 보인 항산화 효과는 파킨슨병에 대한 예방적 효과로 생각해볼 수 있다. 파킨슨병을 유발한 뒤 한약재를 복용하게 했을 때 유발된 산화스트레스가 감소하고, 항산화 지표(SOD, CAT, GPx 등)가 상승함을 확인하여 파킨슨병에 대한 치료적 측면에서의 효과도 확인하였다. 즉, 확인된 실험 결과는 한약재(식물)가 가진 항산화 효과는 파킨슨병의 신경 퇴행 예방 및 치료에 활용될 가능성을 제시한다.
효과적인 복용 기간과 복용량을 분석한 결과, 한약재 복용 기간은 Table 4에서 확인한 바와 같이 다양하게 설정되어 정확한 기간을 제시하기는 어려웠다. 가장 효과적인 항산화효과를 얻기 위한 용량을 알기 위해서 복용량을 달리하여 결과를 비교한 연구가 43편이었다. 그 중 대부분의 연구에서 낮은 용량일 때보다는 높은 용량일 때 유의한 결과를 얻거나 더 나은 항산화 효과를 확인하였다. 하지만 한약재(식물)마다 동일한 용량을 사용하지 않아, 정확한 투여용량을 제시하기에는 어려움이 있다. 양약과 병용투여 또는 양약과 비교 연구를 통해서도 유의한 항산화 효과가 있음을 알 수 있었다. 신경퇴행성 손상을 지연시킬 수 있는 방법으로 항산화 효과가 있는 물질들의 병용 요법이 하나의 방법으로 소개되고 있는데 본 연구에서도 이를 확인할 수 있었다. 앞으로 실제 치료에 사용하기 위해서는 양약과 한약의 병용투여 시 어떤 결과를 보이는지도 체계적 연구가 필요할 것으로 보인다. 추출 방법 중 물과 에탄올을 이용한 방법이 각각 15편의 연구로 가장 많이 이용되었는데, 활용된 추출 방법을 통해 한약 치료를 하거나 한약제제를 만드는 데에 응용할 수 있을 것이다.
MPTP, 6-OHDA, rotenone 등을 사용하여 파킨슨병 병태를 유발하였고, 그 중 33편의 연구에서 MPTP를 이용하였다. 현재까지 MPTP의 신경독성을 완화시킨다고 알려진 것은 Vitamine E, allopurinol, selenium 등이 있으며, 주로 ROS를 제거하여 도파민성 신경세포 파괴를 완화하거나, 생체 내에서 MAO-B inhibitor로 작용하여 MPTP 대사를 저해시키는 기전으로 파킨슨병 치료에 활용되고 있다 124,255. 본 연구에서 분석한 다양한 실험연구에서 확인했듯이 많은 한약재, 식물이 항산화 효과를 가지고 있으며, 항산화 효소들의 발현하여 ROS 생성을 억제 또는 감소시켜 신경퇴행성 손상을 지연시키는 치료로 충분히 사용가능할 것으로 보인다. 파킨슨병을 유발한 실험모델에 관한 연구의 실험 목적을 산화적 손상에 대한 항산화 효과, 세포에 대한 항염증 효과, 도파민 신경세포 보호효과, 세포 사멸에 대한 신경세포 보호 효과 등으로 분류할 수 있다 9. 이번 연구에서 분석한 논문은 신경 보호 효과를 나타낼 수 있는 평가 지표 중 항산화 효과로 제한하였다. 육계 126, 측백엽 127 등 쉽게 접근 가능한 본초를 이용한 신경보호 효과에 대한 연구도 확인하였으나, 본 연구에서 설정한 기준에 맞지 않아 제외시켰다. 향후 항산화 효과를 비롯한 항염증, 도파민세포보호 효과 등 다방면의 치료 기전을 분석할 필요가 있을 것으로 보인다. 또한, 한약재 뿐 아니라 식품류 등을 포함한 연구가 지속적으로 이루어져 의료진이 치료 및 예방에 유용하게 활용할 수 있고, 파킨슨병 환자에게 실생활에 사용할 수 있는 식이 안내지침서 등의 기초자료를 만들어 파킨슨병의 증상 경감, 진행을 늦추는 치료 한약의 개발 및 임상 연구가 이뤄질 필요가 있다고 생각된다.
참고문헌
1. Fauci A, Braunwald E, Kasper D, Hauser S, Longo D, Jameson J, et al. Harrison's principles of internal medicine 17th Edition. II. New York: Mcgraw-hill Medical: 2008. p. 3063–72.
2. Lee KD, Kim KJ, Park YK. Protective effects of Celastrol, the Triterpenoid component of Celastrus Orbiculatus, on dopaminergic neuronal cells in 1-methyl-4-phenyl-1,2,3,6-tetrahydropyrideine-lesioned Parkinson's disease rats. J Korean Oriental Med 2008:29(4):94–103.
3. Donley S, McGregor S, Wielinski C, Nance M. Use and perceived effectiveness of complementary therapies in Parkinson's disease. Parkinsonism Relat Disord 2019:58:46–9.  4. Park YC, Jang I, Lee YH, Park DS. The study on the effect of acupuncture treatment in patients with idiopathic Parkinson's disease. Journal of Acupuncture Research 2007:24(4):43–54.
5. Lim SY, Kim HR, Chou YS, Lee I. Review of current clinical studies for herbal medicine of Parkinson's disease in traditional Chinese medicine. J Physiol &Pathol Korean Med 2016:30(5):327–37.  6. Doo AR, Kim SN, Park JY, Cho KH, Hong J, Kim EK, et al. Neuroprotective effects of an herbal medicine, Yi-Gan San on MPP+/MPTP -induced cytotoxicity in vitro and in vivo. J Ethnopharmacol 2010:131(2):433–42.
7. Kim IJ, Lee JH, Song KJ, Koo BS, Kim GW. Neuroprotective effects of Sohaphwangwon essential oil in a Parkinson's disease mouse model. J of Oriental Neuropsychiatry 2012:23(1):129–43.  8. Song JX, Sze SC, Ng TB, Lee CK, Leung GP, Shaw PC, et al. Anti-Parkinsonian drug discovery from herbal medicines:What have we got form neurotoxic models? J Ethnopharmacol 2012:139(3):698–711.  9. Joo HS, Yu OC, Yang KJ, Lee SY, Moon HY. A review on experimental studies of Parkinson's disease in Korean medical journals. Journal of Oriental Neuropsychiatry 2017:28(3):145–59.
10. Rabiei Z, Solati K, Amini-Khoei H. Phytotherapy in treatment of Parkinson's disease:a review. Pharm Biol 2019:57(1):355–62.
11. Li XZ, Zhang SN, Lu F, Liu CF, Wang Y, Bai Y, et al. Cerebral metabonomics study on Parkinson's disease mice treated with extract of Acanthopanax senticosus harms. Phytomedicine 2013:20(13):1219–29.  12. Liu SM, Li XZ, Zhang SN, Yang ZM, Wang KX, Lu F, et al. Acanthopanax senticosus protects structure and function of mesencephalic mitochondria in a mouse model of Parkinson's disease. Chin J Integr Med 2018:24(11):835–43.
13. Beppe GJ, Dongmo AB, Foyet HS, Dimo T, Mihasan M, Hritcu L. The aqueous extract of Albizia adianthifolia leaves attenuates 6-hydroxydopamine -induced anxiety, depression and oxidative stress in rat amygdala. BMC Complement Altern Med 2015:15:374.
14. Chonpathompikunlert P, Boonruamkaew P, Sukketsiri W, Hutamekalin P, Sroyraya M. The antioxidant and neurochemical activity of Apium graveolens L. and its ameliorative effect on MPTP-induced Parkinson-like symptoms in mice. BMC Complement Altern Med 2018:18(1):103.
15. Kumar A, Christian PK, Panchal K, Guruprasad BR, Tiwari AK. Supplementation of Spirulina (Arthrospira platensis) improves lifespan and locomotor activity in Paraquat-sensitive DJ-1β(Δ93) flies, a Parkinson's disease model in Drosophila melanogaster. J Diet Suppl 2017:14(5):573–88.
16. Araújo DP, Nogueira PCN, Santos ADC, Costa RO, Lucena JD, Gadelha-Filho CVJ, et al. Aspidosperma pyrifolium Mart:neuroprotective, antioxidant and anti-inflammatory effects in a Parkinson's disease model in rats. J Pharm Pharmacol 2018:70(6):787–96.
17. Li H, Shi R, Ding F, Wang H, Han W, Ma F, et al. Astragalus Polysaccharide suppresses 6-hydroxydopamine-induced neurotoxicity in Caenorhabditis elegans. Oxid Med Cell Longev 2016:2016:4856761.
18. Shobana C, Kumar RR, Sumathi T. Alcoholic extract of Bacopa monniera Linn. protects against 6-hydroxydopamine-induced changes in behavioral and biochemical aspects:a pilot study. Cell Mol Neurobiol 2012:32(7):1099–112.  19. Subramanian P, Prasanna V, Jayapalan JJ, Abdul Rahman PS, Hashim OH. Role of Bacopa monnieri in the temporal regulation of oxidative stress in clock mutant(cryb) of Drosophila melanogaster. J Insect Physiol 2014:65:37–44.  20. Singh B, Pandey S, Verma R, Ansari JA, Mahdi AA. Comparative evaluation of extract of Bacopa monnieri and Mucuna pruriens as neuroprotectant in MPTP model of Parkinson's disease. Indian J Exp Biol 2016:54(11):758–66.
21. Singh B, Pandey S, Yadav SK, Verma R, Singh SP, Mahdi AA. Role of ethanolic extract of Bacopa monnieri against 1-methyl- 4-phenyl-1,2,3,6-tetrahydropyridine (MPTP) induced mice model via inhibition of apoptotic pathways of dopaminergic neurons. Brain Res Bull 2017:135:120–8.
22. Krishna G, Hosamani R, Muralidhara . Bacopa monnieri supplements offset paraquat-induced behavioral phenotype and brain oxidative pathways in mice. Cent Nerv Syst Agents Med Chem 2019:19(1):57–66.  23. Hosamani R, Muralidhara . Neuroprotective efficacy of Bacopa monnieri against rotenone induced oxidative stress and neurotoxicity in Drosophila melanogaster. Neurotoxicology 2009:30(6):977–85.  24. Hosamani R, Krishna G, Muralidhara . Standardized Bacopa monnieri extract ameliorates acute paraquat-induced oxidative stress, and neurotoxicity in prepubertal mice brain. Nutr Neurosci 2016:19(10):434–46.
25. Pérez-Barrón G, Avila-Acevedo JG, García-Bores AM, Montes S, García-Jiménez S, León-Rivera I, et al. Neuroprotective effect of Buddleja cordata methanolic extract in the 1-methyl-4-phenylpyridinium Parkinson's disease rat model. J Nat Med 2015:69(1):86–93.  26. Chaturvedi RK, Shukla S, Seth K, Chauhan S, Sinha C, Shukla Y, et al. Neuroprotective and neurorescue effect of black tea extract in 6-hydroxydopamine-lesioned rat model of Parkinson's disease. Neurobiol Dis 2006:22(2):421–34.  27. Siddique YH, Jyoti S, Naz F. Effect of epicatechin gallate dietary supplementation on transgenic Drosophila model of Parkinson's disease. J Diet Suppl 2014:11(2):121–30.
28. Xu Q, Langley M, Kanthasamy AG, Reddy MB. Epigallocatechin gallate has a neurorescue effect in a mouse model of Parkinson disease. J Nutr 2017:147(10):1926–31.  29. Levites Y, Weinreb O, Maor G, Youdim MB, Mandel S. Green tea polyphenol(-)-epigallocatechin-3-gallate prevents N-methyl-4-phenyl-1,2,3,6 -tetrahydropyridine- induced dopaminergic neurodegeneration. J Neurochem 2001:78(5):1073–82.
30. Guo S, Yan J, Yang T, Yang X, Bezard E, Zhao B. Protective effects of green tea polyphenols in the 6-OHDA rat model of Parkinson's disease through inhibition of ROS-NO pathway. Biol Psychiatry 2007:62(12):1353–62.  31. Haleagrahara N, Ponnusamy K. Neuroprotective effect of Centella asiatica extract (CAE) on experimentally induced parkinsonism in aged Sprague-Dawley rats. J Toxicol Sci 2010:35(1):41–7.
32. Xu CL, Wang QZ, Sun LM, Li XM, Deng JM, Li LF, et al. Asiaticoside:Attenuation of neurotoxicity induced by MPTP in a rat model of Parkinsonism via maintaining redox balance and up-regulating the ratio of Bcl-2/Bax. Pharmacol Biochem Behav 2012:100(3):413–8.
33. Gopi M, Janardhanam VA. Asiaticoside:Attenuation of rotenone induced oxidative burden in a rat model of hemiparkinsonism by maintaining the phosphoinositide-mediated synaptic integrity. Pharmacol Biochem Behav 2017:155:1–15.  34. Bhatnagar M, Goel I, Roy T, Shukla SD, Khurana S. Complete Comparison Display (CCD) evaluation of ethanol extracts of Centella asiatica and Withania somnifera shows that they can non-synergistically ameliorate biochemical and behavioural damages in MPTP induced Parkinson's model of mice. PLoS One 2017:16(12(5)):e0177254.
35. Xu CL, Qu R, Zhang J, Li LF, Ma SP. Neuroprotective effects of madecassoside in early stage of Parkinson's disease induced by MPTP in rats. Fitoterapia 2013:90:112–8.  36. Liu J, Banskota AH, Critchley AT, Hafting J, Prithiviraj B. Neuroprotective effects of the cultivated Chondrus crispus in a C. elegans model of Parkinson's disease. Mar Drugs 2015:13(4):2250–66.
37. Kim SH, Choi JW. Antioxidant activity of water extract of Chrysanthemum boreale against MPTP-induced mice models. Korean J Oriental Physiology &Pathology 2013:27(1):49–56.
38. Lee KW, Im JY, Woo JM, Grosso H, Kim YS, Cristovao AC, et al. Neuroprotective and anti-inflammatory properties of a coffee component in the MPTP model of Parkinson's disease. Neurotherapeutics 2013:10(1):143–53.  39. Rao SV, Muralidhara , Yenisetti SC, Rajini PS. Evidence of neuroprotective effects of saffron and crocin in a Drosophila model of parkinsonism. Neurotoxicology 2016:52:230–42.  40. Ojha RP, Rastogi M, Devi BP, Agrawal A, Dubey GP. Neuroprotective effect of curcuminoids against inflammation-mediated dopaminergic neurodegeneration in the MPTP model of Parkinson's disease. J Neuroimmune Pharmacol 2012:7(3):609–18.  41. Mythri RB, Veena J, Harish G, Rao BSS, Bharath MMS. Chronic dietary supplementation with turmeric protects against 1-methyl-4-phenyl -1,2,3,6-tetrahydropyridine- mediated neurotoxicity in vivo :implications for Parkinson's disease. British J Nutr 2011:106(1):63–72.  42. He YY. Micro PET/CT receptor imaging in experimental research of Chinese herbal medicine in the treatment of curcumin model rat with Parkinson disease. Hubei medical university 2012:
43. Jin Z, Wang YL, Jiang SS, Hou FX, Wang CY, Chen J, et al. Experimental study on the effects of Yangjinhua on striatum tissue SOD, GSH - Px of model rats with Parkinson's Disease. I. nformation on Traditional Chineses Medicine 2013:30(2):87–90.
44. Ahmad M, Yousuf S, Khan MB, Ahmad AS, Saleem S, Hoda MN, et al. Protective effects of ethanolic extract of Delphinium denudatum in a rat model of Parkinson's disease. Hum Exp Toxicol 2006:25(7):361–8.  45. Lin AM, Wu LY, Hung KC, Huang HJ, Lei YP, Lu WC, et al. Neuroprotective effects of longan (Dimocarpus longan Lour.) flower water extract on MPP+-induced neurotoxicity in rat brain. J Agric Food Chem 2012:60(36):9188–94.
46. Beserra-Filho JIA, de Macêdo AM, Leão AHFF, Bispo JMM, Santos JR, de Oliveira-Melo AJ, et al. Eplingiella fruticosa leaf essential oil complexed with β-cyclodextrin produces a superior neuroprotective and behavioral profile in a mice model of Parkinson's disease. Food Chem Toxicol 2019:124:17–29.  47. Siddique YH, Mujtaba SF, Jyoti S, Naz F. GC-MS analysis of Eucalyptus citriodora leaf extract and its role on the dietary supplementation in transgenic Drosophila model of Parkinson's disease. Food Chem Toxicol 2013:55:29–35.  48. Ahmad M, Saleem S, Ahmad AS, Yousuf S, Ansari MA, Khan MB, et al. Ginkgo biloba affords dose-dependent protection against 6-hydroxydopamine-induced parkinsonism in rats:neurobehavioural, neurochemical and immunohistochemical evidences. J Neurochem 2005:93(1):94–104.  49. El-Ghazaly MA, Sadik NA, Rashed ER, Abd-El-Fattah AA. Neuroprotective effect of EGb761®and low-dose whole-body γ-irradiation in a rat model of Parkinson's disease. Toxicol Ind Health 2015:31(12):1128–43.  50. Kuang S, Yang L, Rao Z, Zhong Z, Li J, Zhong H, et al. Effects of Ginkgo Biloba extract on A53T α-synuclein transgenic mouse models of Parkinson's disease. Can J Neurol Sci 2018:45(2):182–7.
51. Ba XH, Liu Y. Effects of ginkgo biloba extract and bilobalide on neuronal injury of substantia nigra of rats with Parkinson disease. Chinese Journal of Clinical Rehabilitation 2006:10(11):39–41.
52. Sengupta T, Vinayagam J, Nagashayana N, Gowda B, Jaisankar P, Mohanakumar KP. Antiparkinsonian effects of aqueous methanolic extract of Hyoscyamus niger seeds result from its monoamine oxidase inhibitory and hydroxyl radical scavenging potency. Neurochem Res 2011:36(1):177–86.  53. Mohanasundari M, Srinivasan MS, Sethupathy S, Sabesan M. Enhanced neuroprotective effect by combination of bromocriptine and Hypericum perforatum extract against MPTP-induced neurotoxicity in mice. J Neurol Sci 2006:249(2):140–4.
54. Mohanasundari M, Sabesan M. Modulating effect of Hypericum perforatum extract on astrocytes in MPTP induced Parkinson's disease in mice. Eur Rev Med Pharmacol Sci 2007:11(1):17–20.
55. Kiasalari Z, Baluchnejadmojarad T, Roghani M. Hypericum Perforatum hydroalcoholic extract mitigates motor dysfunction and is neuroprotective in intrastriatal 6-hydroxydopamine rat model of Parkinson's disease. Cell Mol Neurobiol 2016:36(4):521–30.  56. Essa MM, Subash S, Dhanalakshmi C, Manivasagam T, Al-Adawi S, Guillemin GJ, et al. Dietary supplementation of Walnut partially reverses 1-Methyl-4-phenyl-1,2,3,6-tetrahydropyridine induced neurodegeneration in a mouse model of Parkinson's disease. Neurochem Res 2015:40(6):1283–93.  57. Guo B, Xu D, Duan H, Du J, Zhang Z, Lee SM, et al. Therapeutic effects of multifunctional tetramethylpyrazine nitrone on models of Parkinson's disease in vitro and in vivo. Biol Pharm Bull 2014:37(2):274–85.
58. Tseng WT, Hsub YW, Pan TM. The ameliorative effect of Monascus purpureus NTU 568-fermented rice extracts on 6-hydroxydopamine-induced neurotoxicity in SH-SY5Y cells and the rat model of Parkinson's disease. Food Funct 2016:7(2):752–62.
59. Narasimhan KK, Paul L, Sathyamoorthy YK, Srinivasan A, Chakrapani LN, Singh A, et al. Amelioration of apoptotic events in the skeletal muscle of intra-nigrally rotenone-infused Parkinsonian rats by Morinda citrifolia-up-regulation of Bcl-2 and blockage of cytochrome c release. Food Funct 2016:7(2):922–37.
60. Manyam BV, Dhanasekaran M, Hare TA. Neuroprotective effects of the antiparkinson drug Mucuna pruriens. Phytother Res 2004:18(9):706–12.
61. Yadav SK, Prakash J, Chouhan S, Westfall S, Verma M, Singh TD, et al. Comparison of the neuroprotective potential of Mucuna pruriens seed extract with estrogen in 1-methyl-4-phenyl -1,2,3,6-tetrahydropyridine(MPTP)-induced PD mice model. Neurochem Int 2014:65:1–13.  62. Yadav SK, Rai SN, Singh SP. Mucuna pruriens reduces inducible nitric oxide synthase expression in Parkinsonian mice model. J Chem Neuroanat 2017:80:1–10.  63. Siddique YH, Faisal M, Naz F, Jyoti S, Rahul . Role of Ocimum sanctum leaf extract on dietary supplementation in the transgenic Drosophila model of Parkinson's disease. Chin J Nat Med 2014:12(10):777–81.
64. Sarbishegi M, Charkhat Gorgich EA, Khajavi O, Komeili G, Salimi S. The neuroprotective effects of hydro-alcoholic extract of olive ( Olea europaea L.) leaf on rotenone-induced Parkinson's disease in rat. Metab Brain Dis 2018:33(1):79–88.  65. Shi X, Chen YH, Liu H, Qu HD. Therapeutic effects of paeonol on methyl-4-phenyl-1,2,3,6 -tetrahydropyridine/probenecid-induced Parkinson's disease in mice. Mol Med Rep 2016:14(3):2397–404.
66. Choi JH, Jang M, Nah SY, Oh S, Cho IH. Multitarget effects of Korean Red Ginseng in animal model of Parkinson's disease:antiapoptosis, antioxidant, antiinflammation, and maintenance of blood-brain barrier integrity. Journal of Ginseng Research 2018:42(3):379–88.  67. Duan K. Protective effect of total alkaloids from Pinellia Ternate against Parkinson's disease and explore its mechanism. Hubei University of Chinese medicine 2012:
68. Khan MM, Kempuraj D, Thangavel R, Zaheer A. Protection of MPTP-induced neuroinflammation and neurodegeneration by Pycnogenol. Neurochem Int 2013:62(4):379–88.  69. Bi Y, Qu PC, Wang QS, Zheng L, Liu HL, Luo R, et al. Neuroprotective effects of alkaloids from Piper longum in a MPTP-induced mouse model of Parkinson's disease. Pharm Biol 2015:53(10):1516–24.
70. Wang Y, Xu H, Fu Q, Ma R, Xiang J. Resveratrol derived from rhizoma et radix Polygoni cuspidati and its liposomal form protect nigral cells of Parkinsonian rats. Zhongguo Zhong yao za zhi 2011:36(8):1060–6.
71. Kim TE, Yoon YM, Park YI, Kim YS, Jeon BH, Kim MD. Screening of the biological activity from water extracts of the medicinal plants and the protective effect of R.palmatum on MPTP-induced neurotoxicity. Journal of Physiology &Pathology in Korean Medicine 2004:18(6):1666–85.
72. Wu CR, Tsai CW, Chang SW, Lin CY, Huang LC, Tsai CW. Carnosic acid protects against 6-hydroxydopamine-induced neurotoxicity in vivo and in vitro model of Parkinson's disease:involvement of antioxidative enzymes induction. Chem Biol Interact 2015:225:40–6.
73. Lin CY, Chen JH, Fu RH, Tsai CW. Induction of Pi form of glutathione S-transferase by carnosic acid is mediated through PI3K/Akt/NF-κB pathway and protects against neurotoxicity. Chem Res Toxicol 2014:27(11):1958–66.
74. Chen X, Zhang N, Zhao H, Zou HY, Mu Y, Xue B, et al. The protect effect of Baicalin on the substantial nigra dopaminergic neuron in Parkinson's rats induced by rotenone. Journal of Apoplexy and Nervous Diseases 2008:25(2):174–7.
75. Chen X, Zhang N, Zou HY, Zhao H, Mu Y. Protective effect of baicalin on mouse with Parkinson's disease induced by MPTP. Zhongguo Zhong Xi Yi Jie He Za Zhi 2007:27(11):1010–2.
76. Girish C, Muralidhara . Propensity of Selaginella delicatula aqueous extract to offset rotenone- induced oxidative dysfunctions and neurotoxicity in Drosophila melanogaster:Implications for Parkinson's disease. Neurotoxicology 2012:33(3):444–56.  77. Girish C, Muralidhara . Neuroprotective effect of aqueous extract of Selaginella delicatula as evidenced by abrogation of rotenone-induced motor deficits, oxidative dysfunctions, and neurotoxicity in mice. Cell Mol Neurobiol 2013:33(7):929–42.
78. Ahmad S, Khan MB, Hoda MN, Bhatia K, Haque R, Fazili IS, et al. Neuroprotective effect of sesame seed oil in 6-hydroxydopamine induced neurotoxicity in mice model:cellular, biochemical and neurochemical evidence. Neurochem Res 2012:37(3):516–26.  79. Khurana N, Gajbhiye A. Ameliorative effect of Sida cordifolia in rotenone induced oxidative stress model of Parkinson's disease. Neurotoxicology 2013:39:57–64.  80. Chang HC, Liu KF, Teng CJ, Lai SC, Yang SE, Ching H, et al. Sophora tomentosa extract prevents MPTP-induced Parkinsonism in C57BL/6 mice via the inhibition GSK-3βphosphorylation and oxidative stress. Nutrients 2019:11(2):252.  81. Shalavadi MH, Chandrashekhar VM, Avinash SP, Sowmya C, Ramkishan A. Neuroprotective activity of Stereospermum suaveolens DC against 6-OHDA induced Parkinson's disease model. Indian J Pharmacol 2012:44(6):737–43.  82. Kosaraju J, Chinni S, Roy PD, Kannan E, Antony AS, Kumar MN. Neuroprotective effect of Tinospora cordifolia ethanol extract on 6-hydroxy dopamine induced Parkinsonism. Indian J Pharmacol 2014:46(2):176–80.  83. Alzahrani S, Ezzat W, Elshaer RE, Abd El-Lateef AS, Mohammad HMF, Elkazaz AY, et al. Standarized Tribulus terrestris extract protects against rotenone-induced oxidative damage and nigral dopamine neuronal loss in mice. J Physiol Pharmacol 2018:69(6):979–94.
84. Wang XM, Lu XH. The regulation of Rhynchophylline on the expression levels of dopamine, superoxide dismutase and malondialdehyde in rats with Parkinson disease. Chinese journal of intergrative medicine on cardio/cerebrovascular disease 2014:12(6):730–1.
85. Sudati JH, Vieira FA, Pavin SS, Dias GR, Seeger RL, Golombieski R, et al. Valeriana officinalis attenuates the rotenone-induced toxicity in Drosophila melanogaster. Neurotoxicology 2013:37:118–26.  86. Sridharan S, Mohankumar K, Jeepipalli SP, Sankaramourthy D, Ronsard L, Subramanian K, et al. Neuroprotective effect of Valeriana wallichii rhizome extract against the neurotoxin MPTP in C57BL/6 mice. Neurotoxicology 2015:51:172–83.  87. Sankar SR, Manivasagam T, Krishnamurti A, Ramanathan M. The neuroprotective effect of Withania somnifera root extract in MPTP- intoxicated mice:an analysis of behavioral and biochemical variables. Cell Mol Biol Lett 2007:12(4):473–81.
88. Ahmad M, Saleem S, Ahmad AS, Ansari MA, Yousuf S, Hoda MN, et al. Neuroprotective effects of Withania somnifera on 6-hydroxydopamine induced Parkinsonism in rats. Hum Exp Toxicol 2005:24(3):137–47.  89. RajaSankar S, Manivasagam T, Sankar V, Prakash S, Muthusamy R, Krishnamurti A, et al. Withania somnifera root extract improves catecholamines and physiological abnormalities seen in a Parkinson's disease model mouse. J Ethnopharmacol 2009:125(3):369–73.
90. Manjunath MJ, Muralidhara . Effect of Withania somnifera supplementation on rotenone-induced oxidative damage in cerebellum and striatum of the male mice brain. Cent Nerv Syst Agents Med Chem 2013:13(1):43–56.
91. Krishna G, Muralidhara . Aqueous extract of tomato seeds attenuates rotenone-induced oxidative stress and neurotoxicity in Drosophila melanogaster. J Sci Food Agric 2016:96(5):1745–55.
92. Gokul K, Muralidhara . Oral supplements of aqueous extract of tomato seeds alleviate motor abnormality, oxidative impairments and neurotoxicity induced by rotenone in mice:relevance to Parkinson's disease. Neurochem Res 2014:39(7):1382–94.  93. The Korean pharmacopoeia eleventh edition (Ministry of food and drug safety, 2020)
94. National Standard of Traditional Medicinal (Herbal and Botanical) Materials (Ministry of food and drug safety, 2020)
96. Rock RB, Peterson PK. Microglia as a pharmacological target in infectious and inflammatory diseases of the brain. J Neuroimmune Pharmacol 2006:1(2):117–26.  97. Schober A. Classic toxin-induced animal models of Parkinson's disease:6-OHDA and MPTP. Cell Tissue Res 2004:318(1):215–24.  98. Nicklas WJ, Vyas I, Heikkila RE. Inhibition of NADH-linked oxidation in brain mitochondria by 1-methyl-4-phenylpyridine, a metabolite of the neurotoxin, 1-methyl-4-phenyl-1,2,5,6-tetrahydropyridine. Life Sci 1985:36(26):2503–8.  99. Liu HQ, Zhang WY, Luo XT, Ye Y, Zhu XZ. Paeoniflorin attenuates neuro-inflammation and dopaminergic neurodegeneration in the MPTP model of Parkinson's disease by activation of adenosine A1 receptor. Br J Pharmacol 2006:148(3):314–25.  100. Ahn EY, Chung HA. A Review on Pathophysiology of Parkinson`s Disease. J Occupational Therapy for the Aged and Dementia 2009:3(1):1–9.
101. Pahwa R, Factor SA, Lyons KE, Ondo WG, Gronseth G, Bronte-Stewart H, et al. Practice Parameter:treatment of Parkinson disease with motor fluctuatuins and dyskinesia (an evidence-based review) :report of the quality standards subcommittee of the American academy of neurology. Neurology 2006:66(7):983–95.  102. Oh MK, Kim TY, Kim DJ, Shin HS. A case report of dyskinesia in lower limbs caused by Parkinson's disease diagnosed as Shinjeonghyuson. Korean J Orient Int Med 2007:28(4):919–28.
103. Lee MS, Park YG, Bae NY. A case study of a Taeeumin patient with advanced Parkinson's disease diagnosed as Dry-heat symptomatic pattern. J Sasang Constitut Med 2013:25(4):442–53.  104. Koh DK, Yun JM, Lee TH. Effects of Aconiti Tuber on the change of interleukin-6 and TNF-αlevel induced by LPS I.C.V. injection in mice. The Korean Journal of Oriental Medical Prescription 2004:12(1):195–208.
105. Bhattacharya SK, Bhattacharya A, Kumar A, Ghosal S. Antioxidant activity of Bacopa monniera in rat frontal cortex, striatum and hippocampus. Phytother Res 2000:May;14(3):174–9.
106. Sairam K, Dorababu M, Goel RK, Bhattacharya SK. Antidepressant activity of standardized extract of Bacopa monniera in experimental models of depression in rats. Phytomedicine 2002:9(3):207–11.  107. Channa S, Dar A, Anjum S, Yaqoob M, Atta Ur R. Anti-inflammatory activity of Bacopa monniera in rodents. J Ethnopharmacol 2006:104(1-2):286–9.
108. Chaudhuri PK, Srivastava R, Kumar S, Kumar S. Phytotoxic and antimicrobial constituents of Bacopa monnieri and Holmskioldia sanguinea. Phytother Res 2004:18(2):114–7.
109. Hirsch EC, Hunot S. Neuroinflammation in Parkinson's disease:a target for neuroprotection? Lancet Neurol 2009:8(4):382–97.
110. Dufresne CJ, Farnworth ER. A review of latest research findings on the health promotion properties of tea. J Nutr Biochem 2001:12(7):404–21.  111. Leung LK, Su Y, Chen R, Zhang Z, Huang Y, Chen ZY. Theaflavins in black tea and catechins in green tea are equally effective antioxidants. J Nutr 2001:131(9):2248–51.  112. Xu CL, Wang QZ, Sun LM, Li XM, Deng JM, Li LF, et al. Asiaticoside:Attenuation of neurotoxicity induced by MPTP in a rat model of Parkinsonism via maintaining redox balance and up-regulating the ratio of Bcl-2/Bax. Pharmacol Biochem Behav 2012:100(3):413–8.
113. Manjunath MJ, Muralidhara . Effect of Withania somnifera supplementation on rotenone-induced oxidative damage in cerebellum and striatum of the male mice brain. Cent Nerv Syst Agents Med Chem 2013:13(1):43–56.
114. RajaSankar S, Manivasagam T, Sankar V, Prakash S, Muthusamy R, Krishnamurti A, et al. Withania somnifera root extract improves catecholamines and physiological abnormalities seen in a Parkinson's disease model mouse. J Ethnopharmacol 2009:125(3):369–73.
115. Sankar SR, Manivasagam T, Krishnamurti A, Ramanathan M. The neuroprotective effect of Withania somnifera root extract in MPTP- intoxicated mice:an analysis of behavioral and biochemical variables. Cell Mol Biol Lett 2007:12(4):473–81.
116. Grünblatt E, Mandel S, Maor G, Youdim MB. Gene expression analysis in N-methyl-4-phenyl-1, 2, 3, 6-tetrahydropyridine mice model of Parkinson disease using cDNA microarray. J Neurochem 2001:78(1):1–12.  117. Surmeier DJ, Guzman JN, Sanchez-Padilla J, Goldberg JA. The origins of oxidant stress in Parkinson's disease and therapeutic strategies. Antioxid Redox Signal 2011:14(7):1289–301.  118. Pogarell O, Gasser T, van Hilten JJ, Spieker S, Pollentier S, Meier D, et al. Pramipexole in patients with Parkinson's disease and marked drug resistant tremor:a randomised, double blind, placebo controlled multicentre study. J Neurol Neurosurg Psychiatry 2002:72(6):713–20.
119. Matés JM, Pérez-Gómez C, Núñez de Castro I. Antioxidant enzymes and human disease. Clin Biochem 1999:32(8):595–603.
120. Halliwell B. Reactive oxygen species in living systems:source, biochemistry, and role in human disease. Am J Med 1991:91(3C):14S–22S.
121. Ebadi M, Srinivasan SK, Baxi MD. Oxidative stress and antioxidant therapy in Parkinson's disease. Prog Neurobiol 1996:48(1):1–19.  122. Vozenin-Brotons MC, Sivan V, Gault N, Renard C, Geffrotin C, Delanian S, et al. Antifibrotic action of Cu/Zn SOD is mediated by TGF-beta1 repression and phenotypic reversion of myofibroblasts. Free Radic Biol Med 2001:30(1):30–42.  123. Campana F, Zervoudis S, Perdereau B, Gez E, Fourquet A, Badiu C, et al. Topical superoxide dismutase reduces post-irradiation breast cancer fibrosis. J Cell Mol Med 2004:8(1):109–16.  124. Westm BD, Sheghrue PJ, Vanko AEH, Ransorn RW, Kinney GG. Amphetamine-induced locomotor activity is reduced in mice following MPTP treatment but not following selegiline/MPTP treatment. Pharmacol Biochm Behav 2006:84(1):158–61.  125. Sun L, Xu S, Zhou M, Wang C, Wu Y, Chan P. Effects of cysteamine on MPTP-induced dopaminergic neurodegeneration in mice. Brain Res 2010:1335:74–82.  126. Khasnavis S, Pahan K. Cinnamon treatment upregulates neuroprotective proteins Parkin and DJ-1 and protects dopaminergic neurons in a mouse model of Parkinson's disease. J Neuroimmune Pharmacol 2014:9(4):569–81.  127. Park GH, Kim HG, Ju MS, Kim AJ, Oh MS. Thuja orientalis leaves extract protects dopaminergic neurons |aagainst MPTP-induced neurotoxicity via inhibiting inflammatory action. Kor J Herbology 2014:29(3):27–33.
|
|












