I. 서 론
노령화 사회를 맞이하며 염려되는 질병은 노화, 치매, 신경계질환, 그리고 뇌질환 및 연골 및 골결손 등을 손꼽을 수 있는데, 이러한 질병들은 모두 비만과 연관관계를 가진다1-5. 또한, 2000년부터 세계보건기구(World Health Organization, WHO)는 주요 보건의료 문제 중의 하나로 비만을 지정한 바 있다6. 이중, 골다공증은 삶의 질을 떨어뜨릴 뿐만 아니라, 골다공증 환자의 골절은 생명을 위협할 정도로 심각하다7. 이러한 골다공증은 노화로 인한 골형성과 골감소의 불균형에 의해 초래되며8,9, 지방세포분화와 골아 세포분화의 균형이 깨지면서 골아 세포가 줄어든 곳에 지방세포가 채워짐으로써 질병을 더욱 악화시킬 수 있다10. 이렇듯, 노화과정에서 골아세포의 골분화능을 유지시킬 수 있는 방법에 대한 연구 못지않게 지방세포 분화능을 억제시킬 수 있는 물질 및 기작에 대한 연구가 중요하다. 즉, 지방분화를 억제할 수 있는 천연물 추출물에 대한 연구는 비만 및 골다공증과 같은 노인성 질병치료를 위해 반드시 필요하다.
지방세포의 분화에서 핵심 전사 조절 유전자인 C/EBP(CCAAT/enhancer-binding protein)과 PPARγ (peroxisome proliferator-activated receptor γ)에 대한 연구가 이미 보고된 바 있으며, 이러한 전사인자들의 상호작용에 의해 지방세포생성 및 축적 단백질들로 알려진 FABP4(fatty acid binding protein 4), Leptin, 그리고 Adiponectin의 발현이 조절된다11-15. 또한 지방분화 연구 시, 지방분화 과정 기간 동안 감소하는 유전자들을 관찰할 수 있는데, 예를 들면 CHOP10(C/EBP homologous protein-10), FoxO1 (Forkhead box protein O1), TCF4(Transcription factor 4), GATA2/3(GATA-binding factor 2/3)과 같다. 이들을 과발현 시켜 지방분화를 억제하는 결과를 보여주는 연구들에서, 이러한 유전자들은 지방세포의 분화 자체보다는 더 상위에서 세포의 분화방향을 조절함으로써 과도한 지방형성을 초기에 차단시킬 수 있음을 보여준다16,17. 이렇듯 지방 분화에 관련하는 연구 분야 에서 지방분화 억제작용에 대한 연구는 부작용 없는 약물의 개발에 좀 더 유리할 수 있다.
홍화(紅花, C. tinctorius, Carthamus tinctorius)는 항응혈 효과, 항염 효과 등이 확인된 바 있고, 한의학에서 어혈(blood stasis)을 치료하는 약제로 골재생 효과가 있는 것으로 알려져 이미 골다공증이나 골질환의 치료로 사용되고 있다18. 이전 본연구팀의 연구에서 홍화 및 홍화씨 추출물이 마우스 골수유래 줄기세포의 분화를 촉진시킴을 확인하였고19, 내분비적인 문제로 인한 골다공증과 같은 골질환을 치료하는데 효과가 있다는 보고도 있다20. 또 다른 연구에서는 홍화씨 추출물 유래 세로토닌 유도체에 의해 지방전구세포의 지방분화가 억제됨을 확인 하였고, 또한 홍화씨에 다량 포함된 불포화 지방산인 linoleic acid는 혈중 cholesterol을 감소시켜 죽상동맥경화증에도 유의한 효능이 있다고 보고된바 있다21-23. 하지만 홍화추출물이 골수유래 MSCs 지방세포 분화에 미치는 작용기전에 대한 연구는 아직도 미흡한 실정이다.
따라서, 본 연구의 목적은 생쥐 골수유래 중간엽줄기 세포의 지방세포 분화과정동안 홍화추출물이 분화억제에 미치는 영향을 알아보고자 하였고, 특히, 분화관련 전사인자 및 각종 유전자의 발현에 미치는 영향을 알아봄으로써, 홍화를 지방세포 분화 억제물질로 개발하기 위한 기초자료를 마련하고자 하였다.
II. 재료 및 방법
1. 홍화추출물
홍화는 세명대학교 부속 제천한방병원에서 구입했다. 홍화 물추출물은 95 °C에서 150분간 물과 함께 끓인 뒤, Whatman 종이로 걸렀다. 그리고 에탄올 추출물은 99.5% 에탄올에 홍화를 넣고 30 °C에서 24시간 동안 반응시킨 후, Whatman 종이로 걸렀다. 걸러진 추출액은 55 °C에서 농축시킨 뒤 동결 건조 시켰다.
2. mBMSCs세포의 배양 및 지방분화 유도
실험에 사용된 mBMSCs는 BL6/C57 마우스의 femur로부터 추출하였다. mBMSCs는 기본 배양액 (10% 우태 혈청, 1% antibiotic-antimycotic 용액이 첨가된 Minimum Essential Medium Eagle alpha ((α-MEM), Gibco, Carlsbad, CA)으로 2일에 한 번씩 갈아주며 5% CO2, 37 °C 인큐베이터에서 배양 하였다. 1차 배양된 mBMSCs를 2.5×105 cells/well로 6 well 배양 용기에 첨가하여 12시간 이상 안정화 시킨 후, 초기 2일은 기본 배양액에 1 mg/mL insulin, 1 mM dexamethasone, 그리고 0.5 mM 3-isobutyl-1-methylxanthine이 포함된 지방분화 유도배지를 첨가하였고, 나머지 19일은 기본 배양액에 insulin만 포함된 배지를 2일에 한번 씩 새로이 교체해 주며 분화 유도하였다.
3. 세포 독성 측정
세포에 대한 추출물의 독성은 세포에 추출물을 다양한 농도로 처리 하여 48시간 동안 키우고, 세포의 생존력을 EZ-CYTOX kit(Daeillab, Seoul, Korea)로 측정하였다. 세포를 1×104 cells/well 수로 96 well plate에 분주 후 24시간 동안 배양하고, 홍화 추출물을 각각 다양한 농도(0.1∼200 ng)로 첨가하여 24시간 동안 더 배양하였다. 48시간 배양 후, 배양된 세포에 40 μl EZ-CYTOX를 넣고 37 °C에서 4시간 동안 반응시켰다. 흡광도는 microplate reader에서 450 nm 흡광도 값을 측정하였고, 대조군의 흡광도에 대한 백분율로 세포의 생존력을 나타내었다.
4. Real-time PCR을 이용한 유전자 발현 분석
mBMSCs를(2.5×105/well(6 well 기준)) α-MEM 배지에서 12시간 안정화 시킨 뒤, 각 추출물 100 ng/mL과 함께 5일간 지방분화 배지에서 분화 유도하였다. 추출물과 지방분화배지는 이틀에 한 번씩 새로이 교체해 주었다. RNA는 지방분화 유도된 세포로부터 RNeasy Mini Kit(QIAGENE, Hilden, Germany)를 사용하여 추출하였고, 역전사 중합효소인 ominiscript RT Kit(QIAGENE)를 이용하여 37 °C에서 90분, 95 °C에서 5분 조건으로 cDNA를 합성하였다. 합성된 cDNA 100 ng을 주형으로 사용하여 2× qPCRBIO SyGreen Mix Hi-Rox(PCR Biosystems, London, UK)를 이용하여 StepOne Plus System(ABI, Carlsbad, CA, USA) 기기로 real-time PCR을 수행하였고, 유전자 발현양은 house keeping 유전자인 GAPDH에 대비한 CT값을 계산하여 산출하였다.
5. Western Blot을 이용한 단백질 발현 분석
mBMSCs를(2.5×105/well(6 well 기준)) α-MEM 배지에서 12시간 안정화 시킨 뒤, 각 추출물 100 ng/mL과 함께 5일간 지방분화 배지에서 분화 유도하였다. 추출물과 지방분화배지는 이틀에 한 번씩 새로이 교체해 주었다. 단백질은 지방분화 유도된 세포를 1× Lysis 용액을 이용하여 추출하였고, Bio-Rad protein assay kit(Hercules, CA, USA)를 사용하여 정량하였다. 각 25 ug의 단백질은 10% SDS-PAGE gel에서 120 V로 150분간 전기영동 하였으며, 전기영동으로 분리된 단백질은 70 V로 90분 동안 저온실에서 membrane으로 옮겼다. Blocking은 5% non-fat skim milk solution으로 실온에서 1시간 실시하였고, 일차항체는 1% non-fat skim milk solution에 1:1,000으로 저온실에서 24시간 반응시켰다. 일차 항체와 결합된 membrane을 Tris-Buffered Saline and Tween 20(TBS-T) 용액으로 10분씩 3회 세척하고, 이차항체를 1% non-fat skim milk solution에 1:5,000 비율로 희석하여 실온에서 1시간 반응시켰다. TBS-T 용액으로 10분씩 3회 세척함으로써 비특이적으로 결합된 항체를 세척하였고, ECL detection kit를 이용하여 단백질 밴드를 확인하였다. Pparγ, C/ebpα, 그리고 GAPDH 일차항체는 sc-7273, sc-365318, 그리고 sc-47724(Santa Cruz Biotechnology, Santa Cruz, CA)를 각각 사용하였고 이차 항체는 sc-2031(Santa Cruz Biotechnology)를 사용하였다. 단백질 발현은 house keeping 단백질인 GAPDH에 대비하여 비교 평가하였다.
6. Oil-red O 염색과 탈색
mBMSCs를(2.5×105/well(6 well 기준)) α-MEM 배지에서 12시간 안정화 시킨 뒤, 각 추출물 100 ng/mL과 함께 21일간 지방세포분화 배지에서 지방분화 유도하였다. 21일간 분화 유도된 세포를 phosphate buffered saline(PBS)로 두 차례 세척하고, 10% 포르말린 용액으로 30분간 고정하였다. 고정된 세포를 증류수로 2회 세척, 60% isopropanol 용액으로 5분간 반응시킨 뒤, 0.3% Oil-red O 용액으로 60분간 염색하였다. 다시 증류수로 1회 세척하여 비특이적으로 염색된 부분을 제거하여 건조시킨 후, 위상차 현미경을 이용하여 관찰하였다. 탈색은 100%(w/v) isopropanol 용액으로 실온에서 30분간 염색된 지방구를 용해하였고, 상층액을 96 well microplate에 옮긴 후, 흡광도 500 nm에서 값을 측정하였다.
III. 결 과
1. 추출물 수율
홍화의 물과 에탄올 추출물은 각각 92.0 mg/g, 25.8 mg/g을 얻었으며, 물 추출법에 의한 추출 수율이 에탄올 추출법 보다 약 3.6~2.6배 더 높은 추출 수율을 보였다.
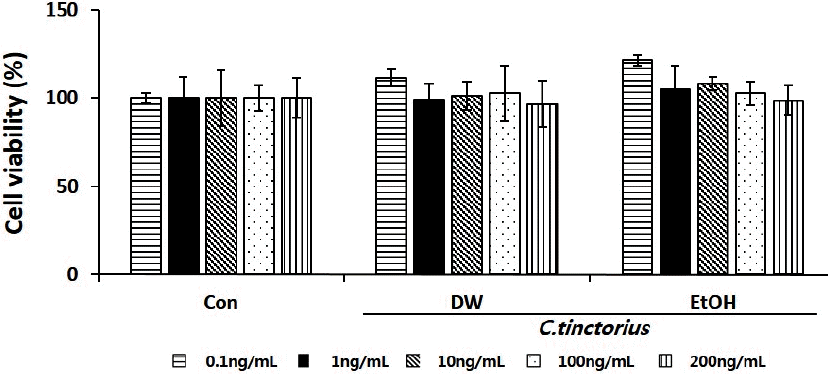
2. 홍화 추출물의 세포독성
세포 독성은 추출물의 처리 농도를 0.1~200 ng/mL 범위로 시행하였고, 그 결과 홍화 추출물의 경우 물과 에탄올 추출물 모두 모든 농도에서 80% 이상의 세포 생존율을 나타내어 세포독성이 없음을 확인하였다. 이런 결과를 토대로 이후 모든 실험에 이용된 추출물의 농도는 100 ng/mL로 정하였다(Fig. 1).
3. 홍화 추출물이 mBMSCs 세포의 지방분화에 미치는 영향
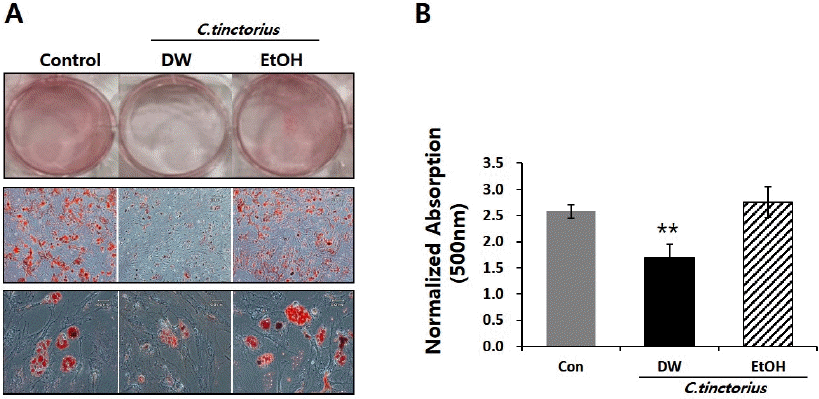
홍화의 추출방법에 따른 지방 분화에 미치는 영향을 알아보기 위한 실험으로, 각각의 추출물을 대조군과 함께 21일간 지방분화 유도 한 뒤, 형성된 lipid droplet을 측정하기 위해 Oil-red O 염색을 수행 하였다. 그 결과, 홍화 물 추출물을 처리한 군의 lipid droplet 형성 및 축적이 대조군에 비해 현저히 감소함을 확인 하였으며, 홍화 에탄올 추출물 처리군의 경우 대조군과 유사하게 세포질 내 lipid droplet 형성이 활발함을 확인하였다(Fig. 2A and 2B).
Fig. 2
Purified C. tinctorius extract by DW inhibits the formation of lipid drop in mBMSC cells.
Cells were induced to differentiation in the presence or absence of purified C. tinctorius extract.
(A) On day 21, cells were subjected to Oil red O staining.
(B) Quantitative data obtained from destained Oil red O in absorbance 500 nm. Data are expressed as mean±standard error in three experiments (n=3). **p<0.01.
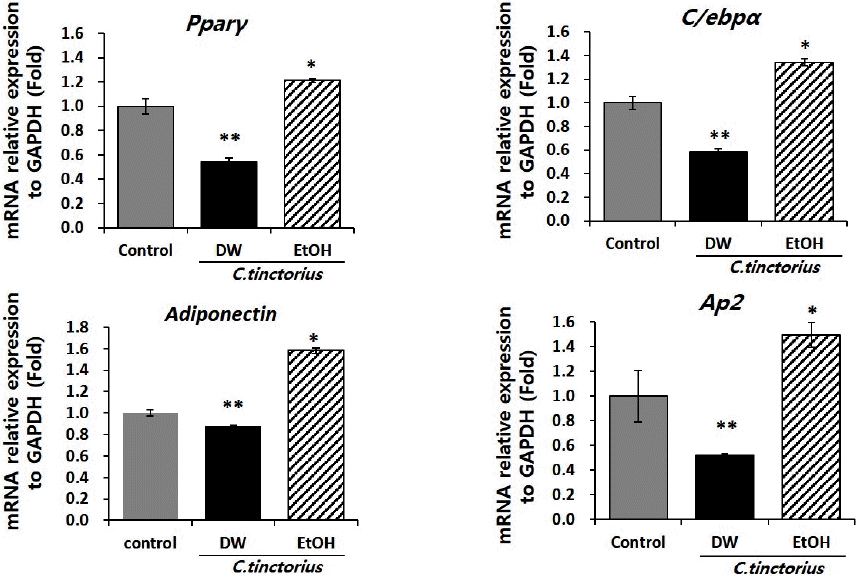
4. 홍화 추출물에 의한 지방세포분화 관련 유전자들의 mRNA 발현
홍화 물추출물에 의해 감소된 지방분화능을 토대로, 각각 추출물에 의한 지방분화 관련 유전자들의 mRNA 발현변화를 알아보고자 하여, real time PCR을 수행하였다. 그 결과, 에탄올 추출물을 처리한 군의 경우, 대조군과 물추출물을 처리한 그룹에 비해 높은 지방세포분화 관련 유전자들의 발현을 확인하였다. 하지만, 이러한 유전자의 발현이 lipid droplet의 축척에 영향을 미칠 정도는 아님을 결과 2에서 알 수 있다. 반면 물 추출물을 처리한 군의 경우, 지방세포분화 전사인자인 Pparγ, C/ebpα 및 lipid droplet 형성 관련 유전자인 Adiponectin과 Ap2(adipocyte protein 2)의 mRNA발현이 대조군에 비해 현저히 감소됨을 확인하였다. 이러한 결과는 증가한 지방세포분화 관련 유전자의 발현 증가가 lipid droplet의 축적을 촉진시킴을 시사하며, oil-red o염색이 증가한 결과와도 일치하는 결과임을 보여준다(Fig. 3).
Fig. 3
Purified C. tinctorius extract by DW inhibits the mRNA expression of adipogenenic marker genes.
Quantitative analysis of the expression of adipocyte-related genes. Cells were extracted on 5 days after induction of adipogenic differentiation. Total RNA was extracted and the expression levels of Pparγ, C/ebpα, Adiponectin and Ap2 were analyzed by real-time PCR. Data are expressed as mean±standard error in three experiments (n=3). *p<0.05, **p<0.01.
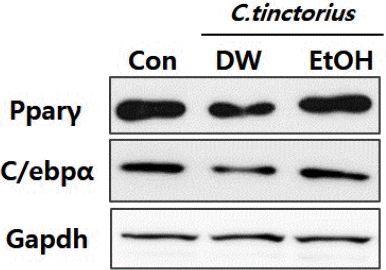
5. 홍화 추출물에 의한 지방세포분화 전사인자의 단백질 발현
홍화 물추출물이 mBMSCs세포의 지방분화능을 감소시킨 결과가 분화기간동안 전사인자인 Pparγ와 C/ebpα의 단백질 발현에 영향을 미친 것인지 확인하기 위해, western blot analysis를 이용하여 Pparγ와 C/ebpα의 단백질 레벨을 확인하였다. 그 결과, mRNA 발현의 결과와는 달리, 에탄올 추출물을 처리한 군의 경우 지방세포 분화전사인자들의 단백질 발현에는 전혀 영향을 주지 않음을 확인하였다. 또한, 홍화 물추출물의 처리군 경우, 전사인자들의 단백질 발현레벨이 약 50% 이상 감소함을 확인하였다(Fig. 4). 이러한 결과는 물 추출물과 에탄올 추출물의 주요 성분이 다름을 간접적으로 예상할 수 있는 결과이다.
IV. 고찰 및 결론
비만은 다양한 질병을 유발하고 특히, 인종, 성별, 그리고 연령에 상관없이 지속적으로 증가하고 있어 고령화 사회에서 인류의 건강을 위협하고 있다. 이러한 비만을 개선하기 위한 사회 전반적인 제도 및 그 원인을 파악하고 예방하기 위한 치료방법들이 다각도로 제시되고 있다. 비만을 유발하는 작용기전에 대한 다양한 실험결과들을 토대로 다양한 비만 치료제들이 시판되고 있으나 그 약물들에 대한 부작용 또한 동반하는 것으로 보고되고 있다. 이러한 이유로 최근에는 천연물로부터 항비만 효과를 나타내는 요소 및 이들의 작용기전에 대한 연구들이 활발하다24.
비만으로 인해 유발되는 심각한 질병중의 하나로 골다공증이 고령화 사회에서 증가하는 추이를 나타내고 있다. 골수내의 골형성 세포와 지방세포의 균형이 깨지면서 발생하는 골다공증은 노인인구에서 매우 흔하지만 그 치료적 효과가 미미하여 불치병에 속하게 된다. 골 대사는 골을 형성하는 세포인 조골세포와 노화된 골을 흡수하는 파골세포의 상호작용에 의해 이루어지며, 이두 세포의 균형 잡힌 상호작용에 의해 골 항상성을 유지한다8,25. 현존하는 골다공증 치료제는 파골세포의 기능을 저해하는 작용기전에 기반을 둔 약제들이며, 조골세포의 기능을 향상시키는 작용기전에 대한 연구가 활발하긴 하나, 뚜렷한 약제는 개발되진 않고 있다. 따라서, 또 하나의 주요세포인 지방세포의 분화를 억제할 수 있는 새로운 요소의 발굴 및 비만치료제의 개발에 대한 연구들이 가속화 되고 있다.
홍화(紅花, C. tinctorius, Carthamus tinctorius)는 항응혈 효과, 항염 효과 등이 검증되었고18, 골 재생효과가 있는 것으로 알려져 실제 한의학에서 골다공증의 치료로 이미 사용되고 있다26. 또한, 골질환에 미치는 영향을 토대로 약학계에서는 홍화를 기반으로 한 신약개발이 활발히 진행 중이며27, 식품영양학계에서도 이미 건강기능식품으로 널리 알려져 있다. 더불어, 본 연구팀에서 홍화 및 홍화씨 추출물이 마우스 조골세포인 MC3T3E1의 골분화를 촉진시킴을 확인하였다. 하지만, 홍화추출물을 이용한 지방분화능 억제에 대한 연구는 극히 미흡한 실정이며, 동시에 홍화추출물이 지방세포분화에 미치는 신호전달 작용기전에 대한 연구는 지극히 필요하다고 할 수 있다. 이에, 홍화 추출물이 mBMSCs 세포의 지방분화에 미치는 영향을 알아본 결과, 홍화 물추출물에 의해 지방세포의 lipid droplet 형성이 현저히 억제됨을 확인하였으며, 지방세포 분화과정에서 핵심 전사인자인 Pparγ, C/ebpα의 mRNA 및 단백질 발현 역시 억제됨을 확인하였다. 이러한 결과는 홍화 물추출물의 어떤 성분이 전사인자들의 발현을 억제하여 mBMSCs 세포의 지방분화를 조절하는 것으로 사료된다.
지방세포 분화는 지방전구세포가 분화과정을 거쳐 성숙한 지방세포가 되는 과정을 말하며, 이러한 과정에서 Pparγ, C/ebpα의 발현은 아주 중요하게 작용한다. PPARγ의 경우, 지방분화를 총괄적으로 조절하는 역할 및 지방세포로 분화된 상태를 유지하는데 필수적인 전사인자이다. 또한, C/ebpα는 지방세포분화의 초기단계에서 Pparγ의 발현을 촉진시켜 분화를 더욱 활발하게 유도하며, 이들은 서로 상호보완작용을 하며 지방세포의 분화말기과정을 촉진 시키는 것으로 알려져 있다13. 본 연구 결과에서는 지방세포에서 반드시 필요한 전사인자들의 발현을 홍화 물추출물이 억제함으로써 lipid droplet의 형성 및 축적을 감소시키며 결국 지방세포로의 분화를 억제시킬 수 있는 것으로 사료된다. 이러한 결과를 검증하기 위해 각 추출물의 성분 비교분석을 통한 정확한 핵심 요소를 밝히는 연구가 진행될 필요가 있으며, 특히, 에탄올 추출물이 지방 분화능에 영향을 주지 않는 결과에 대한 추가적인 보완실험이 필요한 것으로 사료된다.
본 연구는 mBMSCs세포의 지방 분화과정 중 물과 에탄올에 의한 홍화 추출물이 미치는 영향이 다름을 확인하였고, 특히, 마우스 조골세포의 골분화능을 증가시키는 것으로 확인된 홍화 물추출물의 경우, 지방 분화능을 현저히 억제시킴을 확인하였다. 골분화를 촉진시킴과 동시에 지방분화를 억제할 수 있는 천연물의 개발은 한의학계에서 골관련 질환을 타깃으로 한 신약개발을 위한 기초 연구 및 임상적용을 위한 기초적인 자료로 제공 될 수 있을 것이다.