木瓜추출물이 급성 간손상 흰쥐에 미치는 효과
ABSTRACT
Objective
This study was conducted to investigate the effect of Chaenomelis Fructus (CF) water extract on thioacetamide (TAA)-treated rats.
Methods
Rats were divided into five groups: one normal group (n=8) and four with TAA-induced hepatic injury. These treatment groups were administered distilled water (n=8); silymarin 100 mg/kg (n=8); CF 100 mg/kg (n=8); and CF 200 mg/kg (n=8). In the TAA groups, the acute liver injury was induced via IP injection (200 mg/kg), and the silymarin and CF extract were then orally administered for three days. Subsequently, serum levels of GOT, GPT, and ammonia were confirmed as well as protein expressions using liver tissue.
Results
In the liver injury-induced rats, CF administration reduced tissue damage and serum levels of GOT, GPT, and ammonia. In addition, CF increased the anti-oxidant proteins Nrf2, Keap1, HO-1, and catalase and significantly regulated matrix metalloproteinases (MMP-2 and MMP-9) and their tissue inhibitors (TIMP-1 and TIMP-2).
Conclusions
In this animal model of liver injury induced by TAA, CF extract is determined to have a hepatoprotective effect by increasing anti-oxidant proteins that relieve damage and by regulating the expression of matrix metalloproteinases.
Keywords: Chaenomelis Fructus, acute hepatic injury, thioacetamide, anti-oxidant
Ⅰ. 서 론
간(肝, liver)은 세포 내의 생화학적 반응을 통해 여러 물질을 만들어 대사시키는 역할을 하며, 체내에서 대사율이 가장 높은 장기 중 하나이다 1. 간은 조혈(造血) 및 파혈(破血)작용 등의 혈액과 관련된 기능을 가지며, 체내・외에서 생성, 유입된 산물을 배출하는 해독작용을 담당한다 1. 현대인들은 불규칙한 식습관, 과도한 음주, 스트레스, 피로, 환경오염, 흡연 등으로 면역력이 상실되어 있어 체내에 유입된 독성물질을 해독하는 간기능이 소실되어 심하면 간경변 및 만성간염과 같은 간질환으로 발전하는 경유가 빈번하게 일어나고 있으며 2,3, 간세포의 손상으로 인한 체내에 생성되는 자유 유리기(O 2, H 2O 2, OH 등) 또한 단백질 파괴 및 염색체 이상 등 세포기능 저하와 세포괴사를 유발할 수 있다 3,4. 현재 간질환 치료를 위해 간조직의 염증반응을 억제하는 colchicinem, malotilate, glucocorticoid 등과 간성상세포의 활성화를 억제하는 인터페론, retinoic acid 등의 치료제가 국내외적으로 널리 사용되고 있지만 이러한 치료제는 합성 약물로써 부작용이 빈번히 나타나고 있지만 간의 약물 대사에 장애가 일어나는 원인에 대한 지표가 제시되어 있지 않은 실정이다 4,6. 이에 간 보호 약물을 개발하기 위하여 천연 소재를 이용한 많은 연구가 진행되고 있지만 서양엉겅퀴 [Silybum marianum (L.) Gaertn.] 유래 silymarin을 제외하고는 간 보호 효능을 가진 약물의 발굴 및 상업화는 뚜렷하게 이루어지지 못하고 있는 실정이다 7. 모과(木瓜; Chaenomelis Fructus)는 장미과(Rosaceae)에 속한 모과나무의 성숙한 과실을 건조한 것으로써 길이 10-20 cm, 지름 8-15 cm의 반구형 모양의 황색 과실이다 8. 성미(性味)는 온산(溫酸)하고, 청간(淸肝), 제습(除濕), 조혈(造血) 등의 효능이 있는 것으로 알려져 있으며, 간비(肝脾)에 작용하여 간기능을 향상시키는 약물로 알려져 있다 9,10. 이에 본 연구에서는 티오아세트아미드(Thioacetamid; TAA)로 유발한 급성 간 손상 동물 모델에 대한 모과의 간 보호 효과를 확인하기 위하여 혈액 내 간 손상 지표 및 항산화 단백질의 발현을 확인하였으며, 유의한 결과를 얻었기에 그 기전에 대하여 보고하는 바이다.
Ⅱ. 재료 및 방법
1. 재 료
1) 시 료
본 실험에서 사용한 모과(木瓜; Chaenomelis Fructus)는 옹기한약국(대구, 한국)에서 구입하였으며, 생약규격집에 맞추어 관능검사한 후 약전규격에 적합한 것만을 정산하여 사용하였다. 모과 200 g 분쇄하여 증류수 2,000 mL 첨가한 후 열탕 추출기에서 2시간 추출 하였다. 얻어진 추출물은 감압 추출장치로 농축 후, 동결 건조기를 이용해 완전 건조시켰으며, 파우더(CF; yield, 13.3%; water content, 9.1%M)는 -80 ℃에서 보관하였다.
2) 시 약
본 실험에 사용된 thioacetamide(TAA), 2- Diphenyl-1-picrylhydrazyl(DPPH), 7 mM 2,2’- azino-bis(3-ethylbenzothiazoline-6-sulphonic acid)(ABTS), potassium persulfate, gallic acid, Folin-Ciocalteu’s phenol reagent, sodium carbonate, naringin, diethylene glycol, sodium hydroxide, potassium phosphate monobasic, potassium phosphate dibasic은 Sigma-Aldrich Co.(St. Louis, MO, USA)에서 구입하여 사용하였으며, L-(+)-ascorbic acid와 diethylene glycol는 Alfa Aesar(Ward Hill, MA, USA)에서 구입하여 사용하였다. Nitrocellulose membranes는 Amersham GE Healthcare(Little. Chalfont, UK)에서 구입하였고, nuclear factor erythroid 2-related factor 2(Nrf2), kelch-like ECH-associated protein 1(Keap1), heme oxygenase-1(HO-1), Catalase, matrix metalloproteinase-2(MMP-2), matrix metalloproteinase-9 (MMP-9), tissue inhibitor matrix metalloproteinase-1 (TIMP-1), tissue inhibitor matrix metalloproteinase-2 (TIMP-2), histone, β-actin은 Santa Cruz Biotechnology (Dallas, TX, USA)에서 구입하였으며, 2차항체는 GeneTex, Inc.(Irvine, CA, USA)에서 구입하여 사용하였다. 2’, 7’Dichlorofluorescein diacetate(DCFH-DA) 와 dihydrorhodamine 123(DHR123)는 Molecular Probes(Eugene, OR, U.S.A.)에서 구입하여 사용하였고, protease inhibitor mixture, ethylenediaminetetraacetic acid(EDTA)는 Wako Pure Chemical Industries, Ltd.(Osaka. Japan)에서 구입하여 사용하였으며, ECL western blotting detection reagents는 GE Healthcare에서 구입하여 사용하였다. 단백질 정량을 위한 BCA protein assay kit는 Thermo Scientific (Waltham, MA, USA)에서 구입하였다.
3) 실험 동물
6주령 수컷 Sprague-Dawley rat(대한바이오링크, 충북, 한국)를 구입하여 1주일 동안 실험실 환경에 적응시킨 후 실험을 진행하였다. 동물 사육실 조건은 conventional system으로 온도 22±2 ℃, 습도 50±5%, 명암주기(light: dark cycle)는 12시간 주기로 조절하였고, 사료(조단백질 18% 이상, 조지방 5.0% 이상, 조섬유 5.0% 이하, 조회분 8.0% 이하, 칼슘 1.0% 이상, 인 0.85% 이상, 칼륨 0.55% 이상, 나트륨 0.25% 이상, 마그네슘 0.15% 이상, NIH-41, Zeigler Bros, Inc., Gardners, PA, USA)와 물을 충분히 공급하였다. 동물실험의 윤리적, 과학적 타당성 검토 및 효율적인 관리를 위하여 대구한의대학교 동물실험윤리 위원회(Institutional Animal Care and Use Committee: IACUC)의 승인(승인번호: DHU2020-073)을 받았다.
2. 방 법
1) DPPH 자유 유리기 소거 활성 측정
모과추출물의 DPPH 자유 유리기 소거능은 Blosis법 13을 참고하여 측정하였다. 농도별로 희석한 시료 100 μL와 60 μM DPPH 용액 100 μL를 혼합하여 30분간 암소상태로 방치한 후 540 nm에서 흡광도를 측정하였으며, 양성대조군으로 L-ascorbic acid를 사용하였다.
2) ABTS 자유 유리기 소거 활성 측정
모과추출물의 ABTS 자유 유리기 소거능은 Re 등 14의 방법을 참고하여 측정하였다. 7.4 mM ABTS용액과 2.4 mM potassium persulfate를 혼합하여 실온의 암소 상태에서 약 16시간 이상 방치하여 ABTS+을 형성시킨 후 415 nm에서 흡광도 값이 0.70±0.02이 되게 ethanol로 희석하였다. 농도별로 희석한 시료 5 μL와 희석된 ABTS 용액 95 μL를 혼합하여 15분 동안 방치한 후 415 nm에서 흡광도를 측정하였으며, 양성대조군으로 L-ascorbic acid를 사용하였다.
4) 급성 간손상 유발 및 동물 처치
실험군은 정상군(Normal), 대조군(Control), Silymarin 100 mg/kg 투여군(Sily), 모과추출물 100 mg/kg 투여군(CFL), 모과추출물 200 mg/kg 투여군(CFH) 총 5군으로 각 8마리씩 분리하였다. 3일간 매일 일정한 시간에 1회/1일 체중을 측정하였으며, 1회/1일 TAA 200 mg/kg 복강투여를 실시하였고, 복강투여 1시간 30분 후 해당 약물을 경구투여 하였다. 실험종료 후 마취하여 복대정맥에서 혈액을 채취하였으며, 간 조직을 적출하였다.
5) 조직학적 관찰
간 조직을 10% neutral buffered formalin에 고정하고, graded alcohol로 탈수하여 파라핀으로 포매하였으며, block을 제작한 다음 microtome으로 조직 절편하여 hematoxylin & eosin(H&E) 염색을 시행하였다. 그 후, xylene clearing을 거쳐 permount로 처리한 후 광학현미경으로 병변의 유무를 관찰하였다.
6) 혈액분석
복대정맥에서 채혈한 혈액에서 혈청을 분리하여 ammonia, GOT(Glutamic oxaloacetic transaminase) 및 GPT(Glutamic pyruvic transaminase) level을 측정하였다. Ammonia(Abcam, Cambridge, UK)와 GOT, GPT(아산제약, 서울, 한국)는 시약세트를 구입하여 측정하였다.
7) 간 조직 western blotting
간 조직의 세포질을 얻기 위해 100 mM Tris-HCl (pH 7.4), 5 mM Tris-HCl(pH 7.5), 2 mM MgCl2, 15 mM CaCl2, 1.5 M sucrose, 0.1 M DTT, protease inhibitor cocktail을 첨가한 buffer A를 넣고 조직 분쇄기(tissue grinder)(Biospec Product, Bartlesville, OK, USA)로 분쇄한 후 10% NP-40을 첨가하여 아이스 위에서 30분간 정치하였으며, 원심분리(12,000 rpm, 4 ℃, 2 min)하여 세포질을 포함하고 있는 상층액을 분리하였다. 핵을 얻기 위해 10% NP-40가 더해진 buffer A에 두 번 헹구고 100 μL의 buffer C (50 mM HEPES, 50 mM KCl, 0.3 mM NaCl, 0.1 mM EDTA, 1 mM DTT, 0.1 mM PMSF, 10% glycerol)를 첨가해 재부유시킨 후 10분마다 vortex를 3번 하였다. 그 후 원심분리(12,000 rpm, 4 ℃, 10 min)하여 핵을 포함하고 있는 상층액을 얻어 -80 ℃에서 각각 냉동 보관하였다. 간 조직 세포질의 Keap1, HO-1, Catalase, MMP-2, MMP-9, TIMP-1, TIMP-2, β-actin 단백질과 핵에서의 Nrf2, histone 단백질 발현을 측정하기 위하여 12 μg의 단백질을 10-12% SDS polyacrylamide gel을 이용하여 전기연동 후, acrylamide gel을 nitrocellulose membrane으로 이동시켰다. 준비된 membrane에 각각의 1차 antibody (1:1000)를 처리하여 4 ℃에서 overnight 시킨 다음 PBS-T로 6분마다 5회 세척하고, 각각 처리된 1차 antibody에 사용되는 2차 antibody(1:3000)를 사용하여 상온에서 2시간 반응시킨 후, PBS-T로 6분마다 5회 세척하였다. 단백질 발현을 확인하기 위하여 me mbrane을 enhanced chemiluminescence(ECL) 용액에 노출시킨 후, Sensi-Q2000 Chemidoc(Lugen Sci Co., Ltd., Seoul, Korea)에 감광시켜 단백질 발현을 확인한 후, 해당 band를 ATTO Densitograph Software(ATTO Corporation, Tokyo, Japan) 프로그램을 사용하여 정량하였다.
8) 통계분석
In vitro의 수치는 mean±standard error of mean으로, in vivo의 수치는 mean±standard deviation로 표시하였으며, SPSS(Version 25.0, IBM, Armonk, NY, USA)를 사용하여 one-way analysis of variance (ANOVA) test를 실시한 후 least-significant differences (LSD) test로 사후검증을 실시하여 각 군의 평균 차이에 대한 통계적 유의성을 *p<0.05, **p<0.01, ***p<0.001에서 검증하였다.
Ⅲ. 결 과
1. DPPH 및 ABTS 자유 유리기 소거 활성 측정
DPPH 및 ABTS 자유 유리기 소거법을 이용하여 모과추출물의 항산화 활성을 측정하였으며, 실험의 정확성을 확인하기 위하여 양성대조군으로는 L-ascorbic acid을 사용하였다. 모과추출물의 DPPH 자유 유리기 소거 활성을 측정한 결과, IC 50= 17.58±0.05 μg/mL로 나타났으며, ABTS 자유 유리기 소거 활성은 IC 50=88.20±0.75 μg/mL로 높은 항산화 활성을 나타냈다( Table 1).
Table 1
Scavenging Activity of Chaenomelis Fructus on DPPH and ABTS Radical
|
DPPH radical (μg/mL) |
ABTS radical (μg/mL) |
|
L-ascorbic acid |
1.63±0.02 |
3.75±0.03 |
|
Evodiae Fructus |
17.58±0.05 |
88.20±0.75 |
2. 조직학적 관찰
간 조직에 H&E염색을 실시하여 염증세포 및 간세포의 침윤을 확인하였다. 그 결과, Normal군에서는 간세포의 침윤 및 손상을 확인하지 못했으나 Control군에서 세포의 침윤 및 간의 병변을 확인하였으며, CFL군에서는 세포의 침윤이 크게 감소하였고, CFH군에서 또한 세포의 침윤이 크게 감소하여 간 손상이 완화된 것을 확인하였다( Fig. 1).
Fig. 1
Histopathological analysis.
Liver tissues were stained with hematoxyling and Eosin (Original magnification×200). Normal group; Normal, TAA-induced with distilled water group; Control, TAA-induced with silymarin 100 mg/kg group; Sily, TAA-induced with Chaenomelis Fructus 100 mg/kg group; CFL, TAA-induced with Chaenomelis Fructus 200 mg/kg group; CFH

3. 몸무게 및 간 무게 변화
실험기간동안 체중 변화를 확인한 결과, Normal군(12.2±0.6 g)은 체중이 증가한 반면 Control군(-30.0±3.6 g)에서는 감소하였으며, CFL군(-25.3±1.5 g)과 CFH군(-23.6±1.3 g)에서 또한 감소하였지만 Control에 비하여 CFH군에서는 체중 감소가 유의하게 낮게 나타났다. 간 무게를 확인한 결과, Normal군(8.4±0.15 g)에 비하여 Control군(9.9±0.23 g)에서 유의하게 증가하였으며, Control 대비 CHL군(9.9± 0.38 g)에서는 차이가 나타나지 않았고, CFH군(9.5± 0.22 g)에서 감소하는 경향이 나타났다( Fig. 2).
Fig. 2
Body weight change and liver weight.
Body weight change; (A), liver weight; (B). All date are expressed mean±standard deviation (n=8). Normal group; Normal, TAA-induced with distilled water group; Control, TAA-induced with silymarin 100 mg/kg group; Sily, TAA-induced with Chaenomelis Fructus 100 mg/kg group; CFL, TAA-induced with Chaenomelis Fructus 200 mg/kg group; CFH. Significance: ###p<0.001 vs. Normal group, *p<0.05, **p<0.01 vs. Control group

4. 혈액분석
혈액에서 분리한 혈청을 이용하여 GOT, GPT 및 ammonia의 수치를 확인하였다. GOT 및 GPT 확인 결과, Normal군 대비 Control군에서 GOT는 3배 이상 증가하였고, GPT는 2배 이상 크게 증가하였으며, Control군 대비 CFL군과 CFH군에서 GOT, GPT 모두 유의하게 낮게 나타났다. 또한, ammonia 수치를 확인한 결과, Normal군 대비 Control군에서 유의하게 높게 나타났으며, Control군 대비 CFL군과 CFH군에서 유의하게 낮게 나타났다( Table 2).
Table 2
GOT, GPT, and Ammonia Level in Serum
|
GOT (IU/L) |
GPT (IU/L) |
Ammonia (nmol/μL) |
|
Normal |
16.36±1.06 |
10.09±0.35 |
18.22±0.63 |
|
Control |
58.81±2.63###
|
20.71±1.10###
|
27.46±2.39###
|
|
Sily |
50.80±2.04 |
16.97±0.98 |
24.05±1.51 |
|
CFL |
44.87±6.13**
|
16.03±2.22*
|
19.70±1.08**
|
|
CFH |
44.09±5.28**
|
15.39±2.54*
|
17.95±1.36***
|
6. 간 조직 western blotting
1) 간 조직 내 항산화 단백질 발현량 분석
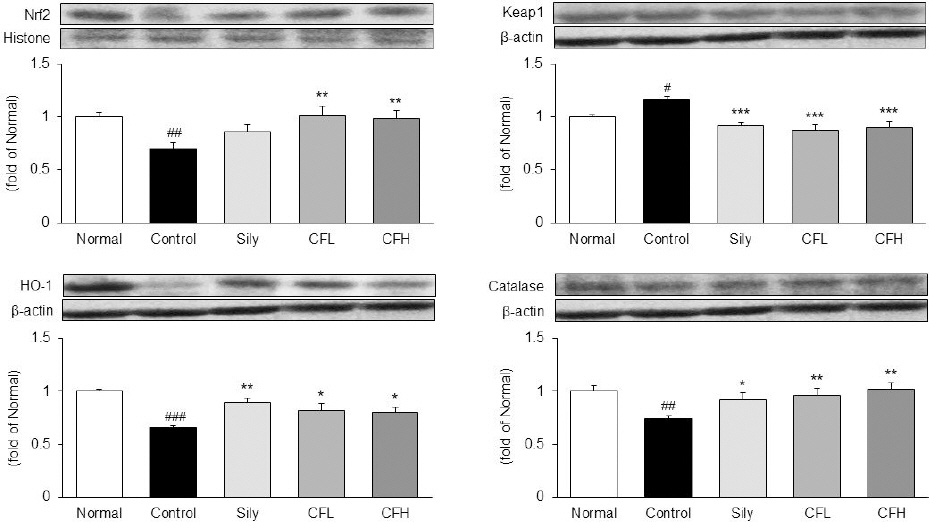
간 조직 내에서 항산화 단백질 Nrf2, Keap1, HO-1 및 Catalase의 발현을 확인하였다. 항산화 전사인자인 Nrf2는 Normal군 대비 Control군에서 30% 유의하게 낮게 나타났으며, Keap1의 발현은 Normal군 대비 Contro군에서 16% 유의하게 높게 나타났다. 반면 모과추출물을 투여한 CFL군과 CFH군의 Nrf2와 Keap1의 발현은 Normal군과 비슷한 수치까지 유의하게 조절되었다. 또한, HO-1과 Catalase의 발현은 Normal군 대비 Control군에서 각각 34%, 24% 유의하게 낮게 나타났으며, CFL군과 CFH군은 Control군 대비 유의하게 높게 나타났으며, 특히 Catalase의 발현은 Normal군과 비슷한 수치를 나타냈다( Fig. 3).
Fig. 3
Expression of antioxidant-related protein in liver tissue.
Nuclear factor erythroid 2-related factor 2; Nrf2, kelch-like ECH-associated protein 1; Keap1, heme oxygenase-1; HO-1. All date are expressed mean±standard deviation (n=8). Normal group; Normal, TAA-induced with distilled water group; Control, TAA-induced with silymarin 100 mg/kg group; Sily, TAA-induced with Chaenomelis Fructus 100 mg/kg group; CFL, TAA-induced with Chaenomelis Fructus 200 mg/kg group; CFH. Significance: #p<0.05, ##p<0.01, ###p<0.001 vs. Normal group, *p<0.05, **p<0.01, ***p<0.001 vs. Control group.
2) 간 조직 내 MMPs 및 TIMPs 발현량 분석
간 조직 내에서 기질 금속단백분해효소 MMP-2, MMP-9과 기질 금속단백분해효소 억제인자인 TIMP-1, TIMP-2의 발현을 확인하였다. MMP-2와 MMP-9의 발현은 Normal군 대비 Control군에서 유의하게 높게 나타났고, Control군 대비 모과추출물 투여군에서 감소하는 것을 확인하였으며, 특히 CFH군에서 유의하게 낮게 나타난 것을 확인하였다. TIMP-1과 TIMP-2의 발현은 Normal군 대비 Control군에서 유의하게 낮게 나타났고, Control군 대비 모과추출물을 투여한 CFL군과 CFH군에서 유의하게 낮게 나타났다( Fig. 4).
Fig. 4
Expression of MMPs and TIMPs protein in liver tissue.
Matrix metalloproteinase-2; MMP-2, matrix metalloproteinase-9; MMP-9, tissue inhibitor matrix metalloproteinase-1; TIMP-1, tissue inhibitor matrix metalloproteinase-2; TIMP-2. All date are expressed mean±standard deviation (n=8). Normal group; Normal, TAA-induced with distilled water group; Control, TAA-induced with silymarin 100 mg/kg group; Sily, TAA-induced with Chaenomelis Fructus 100 mg/kg group; CFL, TAA-induced with Chaenomelis Fructus 200 mg/kg group; CFH. Significance: ##p<0.01, ###p<0.001 vs. Normal group, *p<0.05, **p<0.01, ***p<0.001 vs. Control group.

Ⅳ. 고 찰
현대인들은 급속한 경제성장에 따라 스트레스, 과도한 음주, 불규칙한 식습관 등으로 인한 산화적 스트레스, 알콜성 등의 원인으로 간손상, 간암, 간경병증 등의 간질환으로 인한 사망율은 전체 8위에 해당하며, 간질환 환자가 증가하고 있다 11. 또한, 건강에 대한 관심이 높아짐에 따라 다양한 약물의 복용이 증가하고 있으며, 약물 부작용으로 인한 독성 간손상의 빈도가 증가되고 있다 12. 본 실험에서 사용한 모과는 항염증 8, 항응혈 13, 항산화 14, 항비만 15 등이 알려져 있으며, 모과가 4주간 35% 알코올에 의해 유발된 간독성에서 모과 에탄올 추출물 항산화 효과를 나타냄으로써 손상된 간조직을 보호한다는 연구 결과가 밝혀져 있다 16. 이에 본 연구에서는 간(肝)에 작용하여 간기능을 향상시키는 약물로 알려져 있는 모과가 TAA로 3일간 급성으로 유발된 간손상 동물모델에 어떠한 기전으로 간 보호 효과 나타내는지 확인하고자 하였다. 모과의 과실에는 탄닌, 플라보노이드 등 항산화 성분이 함유되어 있는 것으로 알려져 있으며, 사포닌, 비타민C 등의 성분이 함유되어 있어 피로회복 및 신진대사를 돕는 것으로 알려져 있다 17. 우선 In vitro 실험을 통해 모과추출물의 항산화 활성을 측정한 결과, 모과추출물의 DPPH 자유 유리기 소거 활성은 IC 50=17.58±0.05 μg/mL, ABTS 자유 유리기 소거 활성은 IC 50=88.20±0.75 μg/mL로 뛰어난 항산화 활성을 나타냈다( Fig. 1). 이를 토대로 TAA로 유발한 간손상 동물모델을 이용하여 모과추출물의 간 보호 효과를 확인하였다. TAA는 급성 및 만성 간손상을 유발하는 간독성 물질로써 간손상 동물 모델 유발에 사용되어지고 있으며, 대사적 손상을 유발하며 및 최종적으로 간세포 증식, 간경변, 실질 세포괴사 등을 초래하는 물질로 알려져 있다 11,18. SD rat에게 3일간 1회/1일 TAA 200 mg/kg 복강투여하여 간손상을 유발하였으며, 투여 종료 후 부검하여 혈액 및 간 조직을 적출하였다. 간 조직을 H&E 염색법으로 염색하여 염증세포 및 간세포의 침윤을 확인한 결과, Control군에서 세포의 침윤 및 간의 병변을 확인하였으며, 모과추출물 투여군에서는 세포의 침윤이 크게 감소하여 간 손상이 완화된 것을 확인하였다( Fig. 1). TAA로 인해 간세포가 손상되면 혈청 중의 GOT 및 GPT 등과 같은 혈청 효소들이 상승하는 것으로 알려져 있다 19. 또한, ammonia는 질소 대사의 주요 부산물로써 간질환 환자의 경우 혈중 ammonia 농도가 증가한다고 알려져 있으며, 혈중 ammonia의 상승은 여러 대사 장애를 유발한다 20,21. 혈청 내 GOT, GPT 및 ammonia의 수치를 확인한 결과. Normal군 대비 Control군에서 유의하게 높게 나타났으며, Control군 대비 모과추출물을 투여한 CFL군과 CFH군에서 유의하게 낮게 나타났다( Table 2). 부검 후 얻은 간 조직을 이용하여 항산화 인자 및 기질 금속단백분해효소의 발현을 확인하였다. 항산화 인자인 Nrf는 산화적 스트레스로부터 세포를 보호하는 전사인자로써 Keap1과 복합체를 형성하다가 산화적 스트레스로 인해 분리되어 HO-1, Catalase와 같은 항산화 인자의 발현을 촉진하는 것으로 알려져 있으며 22, 특히 HO-1은 일차적으로 전사단계에서 조절되어 사포사멸 억제 및 항산화 등 다양한 질병의 타깃으로 주목을 받고 있다 23. 본 실험에서 항산화 관련 인자인 Nrf2, Keap1, HO-1 및 Catalase의 발현을 확인한 결과, Normal군 대비 Control군에서 유의하게 낮게 나타났으며, Control군 대비 모과추출물 투여군에서 유의하게 높아져 Normal군과 비슷한 수치를 나타냈다( Fig. 3). MMPs는 세포외기질 분해와 재형성을 일으키는 효소로써 질병 과정에서 생성된다. TIMPs는 MMPs 억제인자로써 MMPs의 활성을 조절하며, 이 중에서도 TIMP-1은 MMP-9을 억제하고, TIMP-2는 MMP-2를 억제한다고 알려져 있다 24. 본 실험에서 MMP-2, MMP-9과 TIMP-1, TIMP-2의 발현을 확인한 결과, 모과추출물 투여군에서 MMPs와 TIMPs의 발현의 유의하게 조절된 것을 확인하였다( Fig. 4). 이러한 결과는 모과추출물이 TAA로 유발한 간손상 동물 모델에서 항산화 인자를 조절하여 간손상을 완화시킬 뿐 아니라 기질 단백분해효소의 발현을 조절함으로써 간 보호 효과를 나타내는 것으로 사료된다.
Ⅴ. 결 론
본 연구에서는 모과추출물의 항산화 활성을 확인하였으며, 이를 토대로 TAA로 유발한 간손상 동물모델을 이용하여 모과 추출물의 간 보호 효과를 확인하였으며, 다음과 같은 결과를 얻었다.
1. 모과추출물의 DPPH 자유 유리기 소거 활성은 IC50=17.58±0.05 μg/mL, ABTS 자유 유리기 소거 활성은 IC50=88.20±0.75 μg/mL로 뛰어난 항산화 활성을 나타냈다. 2. H&E 염색을 통해 염증세포 및 간세포의 침윤을 확인한 결과, 모과추출물 투여군에서는 세포의 침윤이 크게 감소하여 간 손상이 완화된 것을 확인하였다. 3. 혈청 내 GOT, GPT 및 ammonia의 수치를 확인한 결과, Normal군 대비 Control군에서 유의하게 높게 나타났으며, Control군 대비 모과추출물을 투여군에서 유의하게 낮게 나타났다. 4. 항산화 관련 인자인 Nrf2, Keap1, HO-1 및 Catalase의 발현을 확인한 결과, 모과추출물 투여군에서 유의하게 높아져 Normal군과 비슷한 수치를 나타냈다. 5. 모과추출물 투여군에서 MMPs(MMP-2, MMP-9)와 TIMPs(TIMP-1, TIMP-2)의 발현이 유의하게 조절되었다.
이러한 결과는 TAA로 유발된 간손상 동물 모델에서 모과추출물은 항산화 인자를 조절하여 손상을 완화시킬 뿐 아니라 기질 단백분해효소의 발현을 조절함으로써 간 보호 효과를 나타내는 것으로 사료된다.
감사의 글
본 연구는 2021년도 정부(과학기술정보통신부)의 재원으로 한국연구재단(No. 2018R1A5A2025272)의 지원에 의해 수행되었습니다.
참고문헌
1. 全國韓醫科大學肝系內科學교수 공저. 肝系內 科學 서울: 東洋醫科學硏究院: 1992. p. 164–76.
2. Campos R, Garrido A, Guerra R, Valenzuela A. Silybin dihemisuccinate protects against glutathione depletion and lipid peroxidation indeced by acetaminophen on rat liver. Planta Medica 1989:55(5):417–9.  3. Junqueira VB, Simizu K, Videla LA, Barros SB. Dose-dependent study of the effects of acute lindane administration on rat liver superoxide anion production, antioxidant enzyme activities and lipid peroxidation. Toxicology 1986:41(2):193–204.   4. Moody CS, Hassan HM. Mutagenicity of oxygen free radicals. Proc Natl Acad Sci USA 1982:79(9):2855–9.   5. Murakami T, Kim T, Nakamura H. Hepatitis, cirrhosis, and hepatoma. J Magn Reson Imaging 1998:8(2):346–58.  6. Reichen J. Assessment of hepatic function with xenobiotics. Semin Liver Dis 1995:15(3):189–201.   7. Aratani Y. Myeloperoxidase:Its role for host defense, inflammation, and neutrophil function. Arch Biochem Biophys 2018:640:47–52.   8. Ryu HW, Kim YS, Lim EM. The Antiinflammatory Effects of Chaenomelis Fructus Herba Water Extract on Mouse RAW 264.7 Cell. J Korean Obstet Gynecol 2012:25(3):1–15.
9. Kim JE, Jo YJ, Leem JY. The Acetylcholinesterase Inhibitory Activity of the EtOH Extract of Chaenomelis Fructus and its effects on the Metabolism of Amyloid Precursor Protein in Neuroblastoma Cells. Kor J Pharmacogn 2015:46(4):327–33.
10. Kang SY, Hyun SY, Kwon YD, Park YK, Jung HW. Effects of Chaenomelis Fructus Extract on the regulation of myoblasts differentiation and the expression of biogenetic factors in C2C12 myotubes. Kor J Herbol 2019:34(6):99–107.
11. Kim YM, Hwang DS, Kwak BM, Kim EH. Protective Effect of Herbal Mixture Including Lycii Fructus on Hepatotoxicity Induced by Thioacetamide in Mice. Korean J Acupuncture 2019:36(4):221–9.  12. Kim JB, Sohn JH, Lee HL, Kim JP, Han DS, Hahm JS, et al. Clinical Characcteristics of Acute Toxic Liver Injury. The Korean J Hepatol 2004:10(2):125–34.  13. Yoo JH, Han SH, Kil GJ. Active Effect of Anticoagulant Effects in Chaenomelis Fructus Water Extract. Kor J Herbol 2009:24(2):7–11.
14. Lee YM, Shin HD, Lee JJ, Lee MY. Antioxidative Effect of Chaenomelis Fructus Ethanol Extract. Korean J Food Preserv 2007:14(2):177–82.
15. Kim DH, Kwon BR, Kim SJ, Kim HJ, Jeong SI, Yu KY, Kim SY. Anti-obese Effects and Signaling Mechanisms of Chaenomeles sinensis extracts in 3T3-L1 Preadipocytes and Obese Mice Fed a High-fat Diet. Herbal Formula Science 2017:25(4):457–69.
16. Lee YM, Lee JJ, Shim HD, Lee MY. Protective Effects of Chaenomeles sinensis Koehne Extract on Ethanol-induced Liver Damage in Rat. J Korean Soc Food Sci Nutr 2006:35(10):1336–42.  17. Lee DH, Kim JH, Kim NM, Choi JS, Lee JS. Physiological functionality of chinese quince wine and liqors. Korean J Biiotechnol Bioeng 2002:17(3):266–70.
18. Fitzhugh OG, Nelson AA. Liver Tumors in Rats Fed Thiourea or Thioacetamide. Science 1948:108(2814):626–8.   19. Kim SY, Kim HP, Lee MK, Byun SJ, Kim SH, Han HM, et al. The effect of betaine on the CC14-induced hepatoxicity in rats. Yakhak hoeji 1993:37(5):538–43.
20. Germoush MO, Othman SI, Al-Qaraawi MA, Al-Harbi HM, Hussein OE, Al-Basher G, et al. Umbelliferone prevents oxidative stress, inflammation and hematological alterations, and modulates glutamate-nitric oxide-cGMP signaling in hyperammonemic rats. Biomed Pharmacother 2018:102:392–402.   21. Kim KJ, Shin MR, Kim SH, Kim SJ, Lee AR, Kwon OJ, et al. Protective effect of Tongyuhwalhyeol-tang on liver injury in thioacetamide-induced rat. Kor J Herbol 2018:33(1):37–46.
22. He HJ, Wang GY, Gao Y, Ling WH, Yu ZW, Jin TR. Curcumin attenuates Nrf2 signaling defect, oxidative stress in muscle and glucose intolerance in high fat diet-fed mice. World J Diabetes 2012:3(5):94–104.    23. Lee MS, Lee J, Kwon DY, Kim MS. Ondamtanggamibang protects neurons from oxidative stress with induction of heme oxygenase-1. J Ethnopharmacol 2016:108(2):294–8.  24. Kim SE, Jung SA, Shim KN, Jung HK, Kim TH, Yoo K. Expression of Matrix Metallopreoteinases and Tissue Inhibitors of Metalloproteinases in Ulcerative Colitis. Intest Res 2009:7(1):32–40.
|
|















