I. 서 론
만성폐쇄성폐질환(Chronic Obstructive Pulmonary Disease)은 일반적으로 유해한 입자나 가스에 노출되어 발생하는 기도 또는 폐 실질의 이상에 의해 지속적인 호흡기 증상과 기류제한이 나타나는 만성 폐질환이다1. 특히 만성염증으로 인한 소기도의 협착과 폐포의 손상으로 인한 탄성반도압의 감소로 인하여 발생하는 비가역적 기류제한은 COPD의 핵심적인 특징이다2. 이러한 병리변화의 원인 중 흡연은 가장 중요한 위험인자로 흡연자는 호흡기 증상이 더 흔하게 동반되고, 연간 1초간 노력성 호기량(forced expiratory volume in 1 second, FEV1) 감소 정도도 더 심하며, 사망률도 비흡연자에 비해 높다3.
COPD의 약물치료는 Global Initiative for Chronic Obstructive Lung Disease(GOLD) 기준에서 베타-2 작용제, 항콜린제, 메틸잔틴 등의 기관지확장제를 중심으로 처방이 권고되고 있으나1, 위 약제들이 비가역적인 기류제한의 진행을 막거나 소기도 혹는 폐실질의 염증을 효과적으로 억제하지는 못하는 것으로 알려져 있다4. 따라서 COPD 환자의 예후가 악화되는 것을 억제하면서 증상을 장기적으로 조절할 수 있는 효과적이고 안전한 제제 개발의 필요성이 지속적으로 요구되고 있다.
COPD에 대한 한의치료 효과를 평가한 기존의 연구로는 소청룡탕5,6, 맥문동탕7, 생맥청폐음8, 청상보하탕에서 유래한 PM0149, 사간탕10, 과루행련환에서 유래한 GHX0211 등이 있었다. SGX01은 성제총록(聖濟總錄)12에 기재되어 上氣喘息 如水鷄聲에 사용하는 사간탕(射干湯)에 맥문동, 황기, 숙지황을 더하여 구성된 처방으로 COPD를 비롯한 만성폐질환에 활용되고 있다.
본 연구에서는 COPD에 대한 SGX01의 효과를 평가하기 위하여 L929 세포를 이용한 in vitro 실험을 진행하여 세포독성 및 항염증 효과를 평가하고자 하였으며, lipopolysaccharide(LPS)와 표준담배추출물(Cigarette Smoke Solution)로 유발한 COPD 동물모델13을 이용하여 neutrophil 분화수준과, 염증 cytokine의 생성수준 및 연관 유전자의 발현 정도를 측정하고, lung biopsy로 폐조직 손상 억제 작용을 확인하고자 하였다. 본 실험결과 염증 관련 세포 및 cytokine의 발현을 억제하고 폐조직 손상을 감소시키는 SGX01의 효과를 확인하였기에 보고하는 바이다
II. 재료 및 방법
1. 재 료
1) 약재구성 및 추출
SGX01의 구성 약물은 ㈜휴먼허브(Gyeongbuk, Korea)에서 지원을 받았으며, 처방 내용과 1첩 당 용량은 Table 1과 같다. SGX01 36 g에 10배의 증류수를 가하여 환류 추출기에서 얻은 액을 여과하고, 여과액을 감압 증류장치(Buchi B-480, Switzerland)를 사용하여 농축한 뒤, 동결 건조기(Eyela FDU-540, Japan)로 완전히 건조하고 냉동(-84 ℃) 보관하여 사용하였다. 최종적으로 SGX01은 초기 약재 36 g으로부터 11.87 g의 추출물을 얻어 32.97%의 수율을 나타냈다.
Table 1
The Composition of Sagan-tang-gamibang (SGX01)
2. 방 법
1) In vitro 실험
(1) 세포 배양
In vitro 실험에 사용한 L929 세포는 한국세포주 은행(Seoul, Korea)에서 분양받아 사용하였고, 세포배양에는 10% FBS와 1% penicillin-streptomycin이 포함된 DMEM(Dulbecco’s Modified Eagle Medium)배지를 사용하였다. 세포는 온도 37 ℃, CO2 공급 5% 조건에서 배양하였다.
(2) 세포 독성
SGX01의 세포를 대상으로 하는 독성 측정은 MTT(3-(4,5-dimethylthiazol-2-yl)-2,5-diphenyl tetrazolium bromide, Sigma, USA) 측정으로 분석하였다. 우선 96 well plate에 5×104 cells/well이 되도록 L929 세포를 분주하고 SGX01 추출물을 농도별로(10, 30, 50, 100, 300 및 500 μg/ml) 48시간 동안 처리하였다. 각각의 well 당 50 μl의 MTT용액을 가하고 CO2 5%, 온도 37 ℃ 조건의 배양기에서 4시간 동안 반응시킨 뒤, microplate reader(VERSAmax, Molecular Devices, USA)를 사용해 570 nm의 파장에서 흡광도를 측정하여 세포를 넣지 않고 배지만을 배양한 대조군에 대한 백분율로 세포생존율을 표시하였다.
(3) 항염증 분석
SGX01 추출물이 LPS로 처리한 L929 세포에서 Nitric oxide(NO), TNF-α 및 IL-6의 발현에 대한 영향을 측정하고자 Enzyme-Linked Immunosorbent Assay(ELISA)를 수행하였다. 전 처리로 각 농도의(10, 30, 50, 100, 300 및 500 μg/ml) SGX01 추출물을 농도 별로 3 well씩 60분간 처리하였고 이어 LPS(400 ng/ml)를 24시간 동안 처리하였다. 반응을 종결시키고 450 nm의 파장에서 흡광도를 측정하였다.
2) COPD 동물모델 실험
(1) 동 물
실험에 사용된 동물은 C57BL/6 계열의 7주령 수컷 생쥐(오리엔트바이오, Korea)로 제약 없이 물과 고형 사료를 섭취하도록 하였고, 50±10%의 습도와 22~24 ℃의 온도가 유지되며, 밤낮 주기(12시간 주/야)가 조절되는 조명이 갖추어진 실험실 환경에서 사육하였다. 실험동물의 평균 체중은 24±4 g으로 측정되었다. 본 실험은 대전대학교 동물실험윤리위원회의 승인(승인번호: DJUARB2016-008)을 얻어 실험을 시행하였으며 동물관리 규정을 준수하였다.
(2) CSS의 제조
① 표준담배 연기 포집 및 추출
표준담배 Coresta Monitering Cigarette 7(CM7, Heinr Borgwaldt, Germany) 연기 포집은 ISO3402 규정에 따라 실시하였으며, ISO3308 규정에 따른 자동흡연장치(RM20/CS, Heinr Borgwaldt, Germany)를 사용하여 tip paper 길이 + 3 mm(overwrap + 3 mm)의 꽁초길이, 35.0±0.3 ml의 흡연부피, 2.00±0.02초의 흡연시간, 60±0.5초의 흡연주기를 조건으로 ISO 표준 흡연 방법으로 궐련담배를 연소시켰고, 92 mm cambridge filter(ISO3308 규격품, USA)를 사용하여 연기응축물을 포집하였다. Cigarette holder (RM20, Heinr Borgwaldt, Germany)에서 표준담배 연기응축물을 포집한 cambridge filter를 분리한 뒤, 실온에서 8시간 이상을 방치한 후 추출하였고, 추출 후 여과한 뒤에 감압여과 농축기 및 질소 가스를 사용하여 완전 농축하였다. 표준담배 주류연(主流煙)에서의 Total Particulate Matter(TPM) 함량을 계산하였다.
(3) COPD 모델 제작
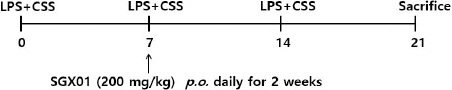
7주령의 C57BL/6 계열 수컷 생쥐를 대상으로 LPS 100 μg/ml와 표준담배 추출물(Cigarette smoking solution, CSS) 4 mg/ml을 1:1로 섞어 주 1회 간격으로 3주간 코와 입을 통하여 50 μl씩 흡인시켜 COPD를 유발시켰다13(Fig. 1). 실험군은 유발물질을 처리하지 않은 정상군(Normal), LPS와 표준담배 추출물을 처리한 대조군(Control), LPS와 표준담배 추출물을 처리 후 dexamethasone(3 mg/㎏, p.o.)을 투여한 양성대조군(Dexa), LPS와 표준담배 추출물을 처리 후 SGX01 추출물(200 mg/㎏, p.o)의 투여군(SGX01)으로 나누었다. 약물을 투여하는 각 실험군은 2주간 매일 경구로 투약 하였으며, 실험이 끝난 뒤 각 군의 생쥐의 기관지폐포 세척액 (Bronchoalveolar lavage fluid, BALF) 및 폐조직을 분리하였다.
Fig. 1
Experimental plan of repeated LPS+CSS exposure.
LPS+CSS : intranasal instillation of LPS 100 mg/ml and cigarette smoke solution 4 mg/ml, SGX01 : SGX01 extract 200 mg/kg per oral
(4) 기관지폐포 세척액(BALF) 분리
실험동물을 실험 최종일에 ethyl ether로 마취시켜 채혈한 뒤, 개흉하여 기도를 노출시킨 후, 주사기를 기도 내로 삽입하여 끈으로 묶어 고정시킨 다음, FBS가 함유되어있지 않은 1 ml의 DMEM 배지를 3회 순환시켜 기관지폐포 세척액(BALF)을 얻었다.
(5) 기관지폐포 세척액(BALF) 내 총 호중구 세포수 측정
BALF 내 호중구(neutrophil) 세포 수 측정을 위하여 cytospin의 시행으로 침전된 혈구를 분리한 다음, Diff-Quick staining(Romanowsky stain)을 3회 시행하고 PBS로 세척한 후, 광학현미경(Light microscope, Nikon, Japan)을 사용하여 400배율에서 계수하였다.
(6) 기관지폐포 세척액(BALF) 내 면역형광세포 염색
BALF내 호중구(neutrophil) 세포수를 측정하기 위하여 BALF에서 분리한 세포에서 면역형광염색(immunofluorescence staining)을 실시하고 anti-Gr-1-PE, anti-CD11b-FITC를 넣어 4 ℃에서 30분간 반응시켰다. 반응 후에 인산완충 생리식염수로 2회 이상 세척한 뒤, flow cytometer의 Cell Quest 프로그램을 이용하여 CD11b+/Gr-1+/CD69+ 세포수를 백분율(%)로 분석하였다.
(7) Enzyme-Linked Immunosorbent Assay (ELISA)
BALF 내의 IL-17A, TNF-α, MIP2, CXCL-1의 양을 측정하기 위해 ELISA를 수행하였다. Coating buffer에 capture antibody를 혼합한 뒤, well 당 assay diluent를 넣고 blicking 한 다음, 실험군을 반응시켰다. Detection antibody 반응을 거친 후, streptavidin-HRP solution와 substrate solution을 처리하여 반응시킨 다음, stop solution을 처리하여 반응을 종결시킨 후, 450 nm 파장에서 흡광도를 측정하였다.
(8) Real-time Polymerase chain reaction(PCR) 분석
폐조직에서 TNF-α, IL-1β, IL-6, IL-10 mRNA 발현을 측정하고자 real-time PCR을 수행하였다. Applied Biosystems 7500 real-time PCR system (Applied Biosystems, USA)을 사용하여 합성한 cDNA의 real-time PCR을 수행하였다. TNF-α, IL-6, IL-1β, IL-10 primer는 Power SYBR Green PCR Master Mix(ABi, USA)를 사용하였으며, 대조군에서는 생쥐 glyceraldehyde-3-phosphate dehydrogenase(G3PDH) probe(Applied Biosystems, USA)를 사용하였다. Probe의 sequence와 primer는 Table 2에 기재하였으며, Taqman PCR Master mix를 반응액으로 사용하고, probe 최종농도가 200 nM가 되도록 반응시켰다. SGX01 투여군과 대조군의 internal standard로는 G3PDH를 사용하였고 RQ(relative quantitative) 측정은 target group의 Quantitative PCRy=x(1+e)n, y=yield, x=starting quantity, e=efficiency, n=number of cycles로 계산하였다.
Table 2
Sequence of Mouse Real-time PCR Oligonucleotide
(9) Hematoxylin & Eosin과 Masson’s trichrome 염색
폐손상의 정도를 측정하기 위해 폐조직을 10% neutral buffered formalin에 24시간 동안 고정 시킨 뒤, graded alcohol로 탈수시키고 파라핀에 포매하여 block을 제작한 뒤, microtome을 이용하여 4 μm 두께로 조직 절편을 얻어 hematoxylin & eosin (H&E) 염색과 Masson’s trichrome(M-T) 염색을 실시한 다음 광학현미경(Light microscope, Nikon, Japan) 200배율에서 관찰하였다.
III. 결 과
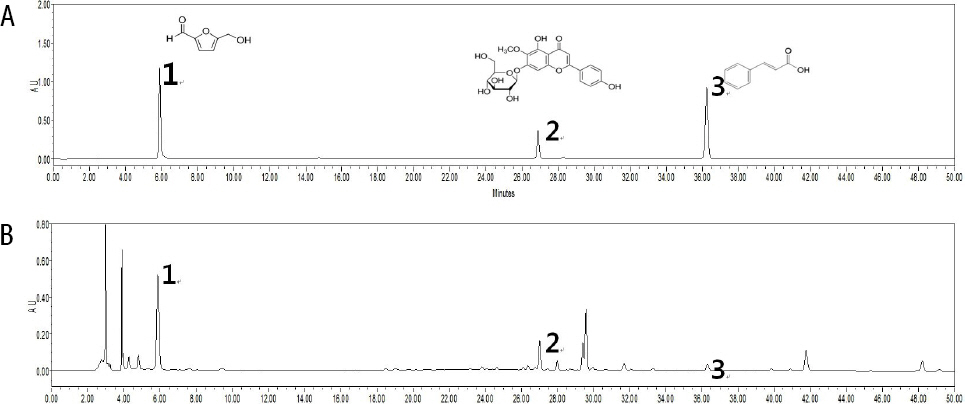
1. HLPC 분석
2. In vitro
1) 세포독성
생쥐의 fibroblast 세포인 L929 세포에 SGX01 추출물을 10~500 μg/ml 농도범위에서 처리하여 세포생존을 평가한 결과, 모든 농도에서 정상군에 비하여 80~100%의 생존율을 보여 세포독성을 나타내지 않았다(Fig. 3).
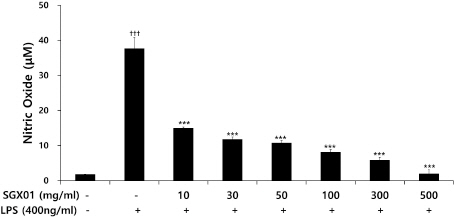
2) NO 생성에 미치는 영향
L929 세포에서 LPS로 유도된 대조군의 NO는 37.65±3.15 μM로 나타나 정상군의 1.76±0.07 μM 보다 유의하게 증가하였다. 대조군에 비해 SGX01을 투여한 실험군은 10, 30, 50, 100, 300, 500 μg/ml의 농도에서 각각 14.97±032, 11.76±0.68, 10.70±0.74, 8.10± 0.80, 5.82±0.84, 1.95±1.15 μM로 나타나 모든 농도에서 유의성 있게 감소하였다(Fig. 4).
Fig. 4
Effects of SGX01 on NO production of LPS induced L929 cells.
L929 cells were administrated LPS (Control, 400 ng/ml), and treated with various concentration of SGX01 (Independent sample t-test, n=3). All values are mean±SE. †: Significant difference with the non-treated group (†††p<0.001). * : Significant difference with the LPS-stimulated group (* p<0.05, *** p<0.001).
3) TNF-α 생성에 미치는 영향
L929 세포에서 LPS로 유도된 대조군의 TNF-α는 46.70±4.66 pg/ml로 나타나 정상군의 3.00±1.13 pg/ml보다 유의하게 증가하였다. 대조군에 비해 SGX01을 투여한 실험군은 10, 30, 50, 100, 300, 500 μg/ml의 농도에서 각각 55.32±0.96, 52.83±0.19, 38.12±0.02, 32.64±0.01, 21.02±1.19, 13.61±0.51 pg/ml로 나타나 50 μg/ml 이상의 농도에서 유의성 있게 감소하였다(Fig. 5).
Fig. 5
Effects of SGX01 on (A) TNF-α and (B) IL-6 production of LPS induced L929 cells.
L929 cells were administrated LPS (Control, 400 ng/ml), and treated with various concentration of SGX01. Level of TNF-α and IL-6 was determined using ELISA (Independent sample t-test, n=3). All values are presented as mean±SE. †: Significant difference with the non-treated group (†††p<0.001). * : Significant difference with the LPS-stimulated group (* p<0.05, ** p<0.01, *** p<0.001).

4) IL-6 생성에 미치는 영향
L929 세포에서 LPS로 유도된 대조군의 IL-6는 35.73±3.82 pg/ml로 나타나 정상군의 1.00±0.57 pg/ml보다 유의하게 증가하였다. 대조군에 비해 SGX01을 투여한 실험군은 10, 30, 50, 100, 300, 500 μg/ml의 농도에서 각각 33.95±0.25, 30.32±0.56, 23.13±0.74, 21.10±1.11, 11.89±0.31, 5.44±0.29 pg/ml로 나타나 50 μg/ml 이상의 농도에서 유의성 있게 감소하였다(Fig. 5).
3. COPD 동물모델에 대한 영향
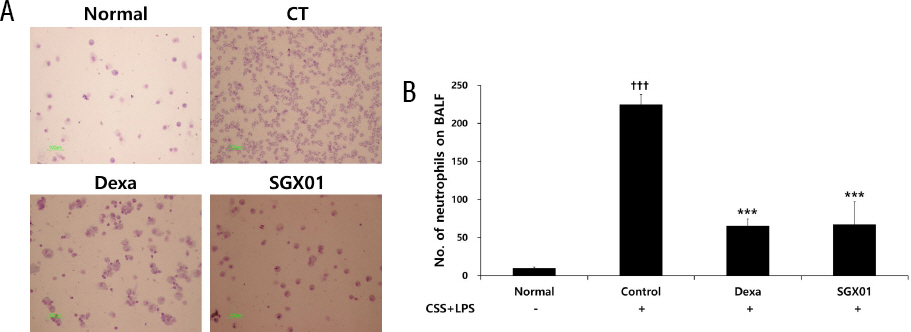
1) BALF 내 neutrophil의 증가에 미치는 영향
COPD를 유발한 대조군에서 neutrophil은 224.71± 13.19개로 나타나 정상군의 9.85±1.53개보다 유의하게 증가하였으며, 양성대조군은 65.43±8.82, SGX01을 투여한 실험군은 67.33±29.50개로 나타나 대조군에 비해 유의성 있는 감소를 보였다(Fig. 6).
Fig. 6
Effect of SGX01 on (A) cytospin image and (B) neutrophils count of BALF in COPD mice.
Mice were challenged by aspiration of LPS+CSS (Control), and then treated with Dexa (dexamethasone 3 mg/kg) and SGX01 (200 mg/kg) for 21 days (one-way ANOVA, n=4). All values are presented as mean±SE. A : Cytospin images of BALF, B : No. of neutrophils.
2) 폐조직 및 BALF 내 면역세포 활성에 미치는 영향
COPD 동물모델에서 폐조직 및 BALF의 면역세포 활성에 대하여 fluorescence activated cell sorting(FACS) 분석 시행 결과, 폐의 CD4+/CD3+, CD8+/CD3+, CD69+/CD4+, Gr-1+/CD11b+ 세포와 BALF의 CD4+/CD3+, CD8+/CD3+, CD69+/CD4+는 정상군에 비하여 대조군에서 증가하였으며 양성대조군과 실험군 모두에서 대조군보다 감소하였고, 특히 SGX01을 투여한 실험군에서 BALF의 CD8+/ CD3+세포가 유의성 있게 감소하였다(Table 3
Table 3
Quantification of Immune Cell Subtypes in the Lungs and BALF of Mice by FACS Analysis
3) BALF 내 cytokines 생성에 미치는 영향
(1) TNF-α 생성에 미치는 영향
COPD 유발 대조군에서 TNF-α는 74.23±5.97 pg/ml로 나타나 정상군의 78.78±7.80 pg/ml보다 유의한 증가를 보였으며, 양성대조군은 111.82±14.05 pg/ml, SGX01을 투여한 실험군은 130.16±41.02 pg/ml로 나타나 대조군에 비해 유의한 감소를 나타내였다(Fig. 7).
Fig. 7
Effect of SGX01 on (A) TNF-α (B) IL-17A (C) MIP2 (D) CXCL-1 production of BALF in COPD mice.
Mice were challenged by an aspiration of LPS+CSS (Control), and treated with Dexa (dexamethasone 3 mg/kg) and SGX01 (200 mg/kg) for 21 days (one-way ANOVA, n=4). Level of TNF-α, IL-17A, MIP2, CXCL-1 was determined using ELISA. All values are presented as mean±SE. †: Significant difference with the non-treated group (†††p<0.001), * : Significant difference with the Control (* p<0.05, *** p<0.001).

(2) IL-17A 생성에 미치는 영향
대조군의 IL-17A는 73.80±4.87 pg/ml로 나타나 정상군의 13.06±1.10 pg/ml보다 유의한 증가를 나타냈으며, 양성대조군은 14.93±2.17 pg/ml, SGX01을 투여한 실험군은 10.11±1.47 pg/ml로 나타나 대조군에 비해 유의한 감소를 나타내었다(Fig. 7).
(3) MIP2 생성에 미치는 영향
대조군에서 MIP2는 287.28±27.38 pg/ml로 나타나 정상군의 105.46±11.48 pg/ml보다 유의하게 증가하였으며, 양성대조군은 122.83±7.17 pg/ml, SGX01을 투여한 실험군은 148.84±32.62 pg/ml로 나타나 대조군에 비해 유의한 감소를 보였다(Fig. 7).
(4) CXCL-1 생성에 미치는 영향
대조군에서 CXCL-1는 160.54±6.83 pg/ml로 나타나 정상군의 83.90±3.53 pg/ml보다 유의하게 증가하였으며, 양성대조군은 43.66±8.10 pg/ml, SGX01을 투여한 실험군은 40.46±17.43 pg/ml로 나타나 대조군에 비하여 유의한 감소를 보였다(Fig. 7).
4) 폐조직 내 관련 단백질 mRNA 발현에 미치는 영향
(1) TNF-α 생성에 미치는 영향
대조군에서 TNF-α mRNA Relative Quantitive (RQ)는 5.48±0.44로 나타나 정상군의 0.84±0.14보다 유의하게 증가하였으며, 양성대조군은 1.36±0.26, SGX01을 투여한 실험군은 0.42±0.12로 나타나 대조군에 비해 유의한 감소를 보였다(Fig. 8).
Fig. 8
Effect of SGX01 on (A) TNF-α (B) IL-1β (C) IL-6 (D) IL-10 mRNA expression in lung tissue in COPD mice.
Mice were challenged by an aspiration of LPS+CSS (Control), and treated with Dexa (dexamethasone 3 mg/kg) and SGX01 (200 mg/kg) for 21 days (one-way ANOVA, n=4). Level of TNF-α, IL-1β, IL-6, IL-10 was determined using real time PCR. All values are presented as mean±SE. †: Significant difference with the non-treated group (†††p<0.001), * : Significant difference with the Control (*** p<0.001
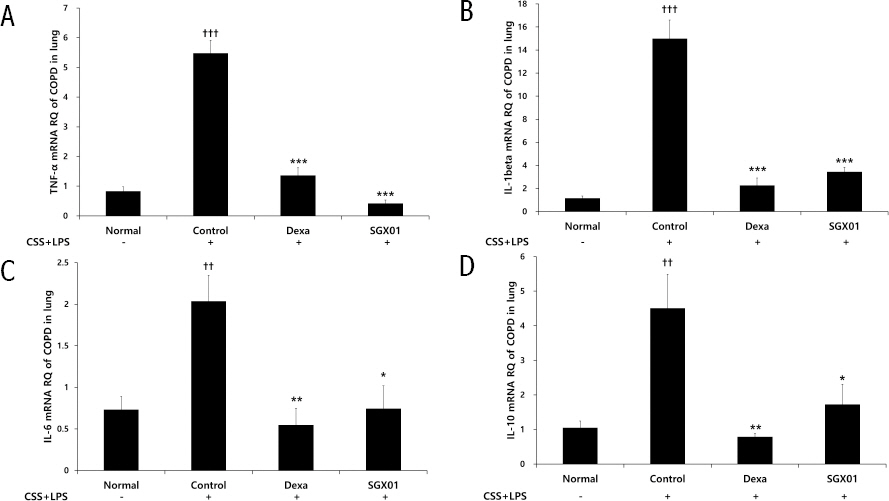
(2) IL-1β 생성에 미치는 영향
대조군에서 IL-1β mRNA Relative Quantitive (RQ)는 14.99±1.60으로 나타나 정상군의 1.15±0.19보다 유의하게 증가하였으며, 양성대조군은 2.27±0.62, SGX01을 투여한 실험군은 3.44±0.40로 나타나 대조군에 비해 유의한 감소를 보였다(Fig. 8).
(3) IL-6 생성에 미치는 영향
대조군에서 IL-6 mRNA Relative Quantitive (RQ)는 2.04±0.31로 나타나 정상군의 0.73±0.16보다 유의하게 증가하였으며, 양성대조군은 0.55±0.20, SGX01을 투여한 실험군에서 0.74±0.27로 나타나 대조군에 비하여 유의한 감소를 보였다(Fig. 8).
(4) IL-10 생성에 미치는 영향
대조군에서 IL-10 mRNA Relative Quantitive (RQ)는 4.51±0.98로 나타나 정상군의 1.05±0.19보다 증가하였으며, 양성대조군은 0.79±0.10, SGX01을 투여한 실험군은 1.73±0.58로 나타나 대조군에 비해 유의한 감소를 보였다(Fig. 8
5) 폐조직 손상에 미치는 영향
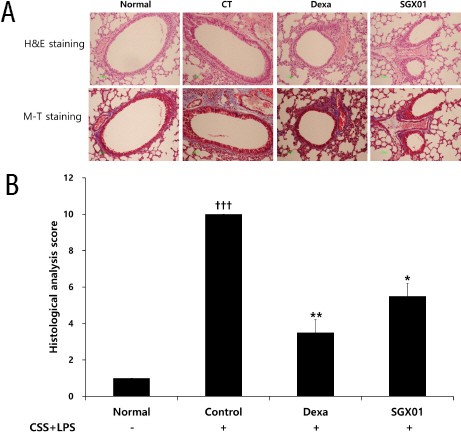
H&E 염색으로 폐조직 단면을 검사하여 염증 양상을 확인하고 M-T 염색으로 교원 섬유의 양을 측정하였다. 대조군에서는 폐포의 불규칙 확장, 소기도 주변의 세포 침윤 및 기도벽이 두꺼워지는 현상이 관찰되었다. Dexamethasone을 처리한 양성대조군에서는 비교적 폐포 확장, 세포 침윤 및 기도벽 비후가 감소하였고, SGX01을 투여한 실험군에서는 소기도 주변으로 세포 침착 현상은 보였으나 대조군에 비하여 상대적으로 폐포 확장과 기도벽 비후가 감소하는 것이 관찰되었다(Fig. 8A). 소기도 및 폐포의 구조 변화, 염증세포의 침윤 및 교원 섬유의 증가 정도를 정량화하여 평가한 결과, 대조군은 10.00±0.00으로 나타나 정상군의 1.00±0.00보다 증가하였으며, 양성대조군은 3.50±0.50, SGX01을 투여한 실험군은 5.50±0.50로 나타나 대조군에 비해 유의한 감소를 보였다(Fig. 9B).
Fig. 9
Effect of SGX01 on histopathological changes and histology scores in the lung of COPD mice.
Mice were challenged by an aspiration of LPS+CSS (Control), and treated with Dexa (dexamethasone 3 mg/kg) and SGX01 (200 mg/kg) for 21 days (one-way ANOVA, n=4). (A) Representative sections from each treatment group are shown (Light microscope at 100×magnification). (B) Quantitative analysis if the degree of lung tissue damage in the sections. All values are presented as mean±SE. †: Significant difference with the non-treated group (†††p<0.001), * : Significant difference with the Control (* p<0.05, ** p<0.01, *** p<0.001).
IV. 고 찰
COPD는 전 세계적으로 높은 유병률 및 사망률을 나타내는 질환으로 커다란 사회 경제적 부담을 초래하며 계속 증가하고 있다. WHO는 2007년을 기준으로 전 세계적으로 약 2억 천만 명이 COPD에 이환되었을 것으로 추정하고 있으나 Global Burden of Disease(GBD) 연구에 따르면 2015년을 기준으로 약 2억 5천 100만 명이 COPD를 앓고 있는 것으로 추정된다14. 우리나라의 경우 2015년 국민건강영양조사에서 폐활량측정에 따른 기도폐쇄 비율이 13.4%였으며 70세 이상에서는 여성 13.6%, 남성 51.7%로 남성과 고령에서 COPD 유병률이 높았다15.
흡연은 COPD의 발생과 진행에 영향을 끼치는 가장 중요한 위험인자이며, 20갑년 이상의 흡연자의 경우 비흡연자에 비해 COPD의 유병률이 1.97배에 달한다고 알려져 있다3. 따라서 흡연을 시작하는 연령이 낮을수록 흡연량이 많아져 COPD의 발생가능성이 높아진다. 우리나라의 경우 2016년 청소년의 흡연 최초연령이 12.6세로 조사되어16 COPD 환자가 지속적으로 증가할 것을 예측할 수 있다. 이러한 증가는 사회 경제적 부담으로 이어져 우리나라에서 COPD의 장애보정 생존년(Disability adjusted life year, DALY)은 지속적으로 증가하여 2016년 10만 명당 461년으로 국내 전체 질병으로 인한 DALY의 1.96%에 해당하였고, 남녀를 모두 포함해서 3위에 해당하는 것으로 조사되어15 COPD로 인한 장애의 영향이 심각함을 알 수 있다.
COPD의 병리학적 변화가 주로 분포하는 부위는 근위부의 중심성 기도와 원위부의 소기도, 폐실질 및 폐혈관 등으로 이에 따라 만성기관지염, 소기도 질환, 폐기종 등의 형태로 나타나며, 만성적인 염증과 손상에 이어지는 폐실질의 파괴가 특징이다2. 즉 COPD의 발병과 진행이 일어나는 과정에서 만성 염증이 핵심적인 역할을 하며, 특히 흡연이 호흡기의 만성 염증을 유발하는 데 가장 크게 작용하는 것으로 보고되고 있다3. 담배연기와 같은 외부의 유해물질이 호흡기로 유입되면 즉각적인 반응으로 대식세포의 탐식작용이 활성화되고, CXCL-1, MIP2와 같은 chemokine의 화학주성으로 인하여 neutrophil이 유도되며, MMP 같은 단백분해효소의 분비가 증가하여 폐실질의 파괴가 일어난다17. 유해물질들로 인하여 손상된 기도상피세포가 정상 상피세포 Toll-like receptors(TLRs)의 ligand로 작용하여 cytokine과 chemokine의 생산이 유발되어 innate inflammation이 시작되고, 이로 인하여 세포외기질(extracellular matrix)이 파괴되어 TLR 자극이 더 증폭되어 항원물질 생성이 증가되고 염증이 반복되어 심해진다18. TNF-α 및 IL-6는 염증 cytokine으로 기도와 폐실질의 염증반응을 증가시키고 IL-6는 regulatory T 세포(Treg)의 신호를 억제함으로써19 COPD의 염증 반응을 더욱 악화시킨다. 다음으로 적응성 면역반응 획득을 통해 자가면역이 형성되는 단계로 CD4+, CD8+, Treg, IgG-producing B 세포가 관여하여 심한 폐손상이 초래되어 심한 폐기능 장애를 동반하게 된다20.
본 실험에서 평가된 SGX01은 淸熱解毒, 消痰, 利咽하는 射干21, 燥濕化痰, 消痞散結하는 半夏21, 助陽化氣하여 痰飮과 蓄水를 치료하는 桂枝21, 溫肺止咳하고 咳嗽痰多를 치료하는 生薑21으로 구성된 사간탕10에 養陰潤肺하는 麥門冬21, 益衛固表하는 黃芪21, 滋陰補血하는 熟地黃21을 더한 처방으로 風寒, 風熱, 痰濁의 實喘과 肺虛, 脾虛, 腎虛의 虛喘을 포괄하여 사용할 수 있도록 구성되었다. 이러한 구성은 LPS 유도 폐손상에 보호효과가 있는 것으로 알려진 麥門冬22, MKP-1 활성화와 p38 및 Erk의 억제로 항염효과를 나타내는 黃芪23, apoptosis를 억제하여 산화적 손상에 보호작용을 나타내는 것으로 알려진 熟地黃24을 추가한 것으로써 기존의 사간탕의 효과를 보완할 수 있을 것으로 기대하였다. 또한, HPLC 분석 결과, SGX01 추출물에서 5-HMF, tectoridin 및 trans-cinnamic acid을 확인하였다.
기존의 한약제제효과 연구를 위한 동물모델에서 폐손상의 유발은 LPS8,9, elastase6,7, 담배연기 흡입25 등 다양한 방법이 시도되어왔다. 본 실험에서는 이 등10,11 및 Mizutani 등13의 연구에서 사용한 방법을 응용하여 C57BL/6 생쥐의 기도 내로 LPS와 CSS를 흡인시켜 COPD를 유발함으로써 COPD의 가장 중요한 위험인자인 흡연을 정량적으로 반영하는 동물모델을 이용하여 실험약물의 효과를 평가하고자 하였다. 본 모델은 COPD의 조직학적 변화인 폐포의 팽창과 폐의 과팽창 소견 및 잔기량(RV)과 기능잔기용량(FRC)의 증가와 같은 폐기능의 변화를 반영한다.
생쥐의 섬유아세포인 L929 세포를 사용한 ELISA 분석 결과, LPS를 사용하여 자극한 대조군의 NO는 유의한 증가를 보였고, SGX01을 투여한 실험군은 모든 농도에서 농도의존적으로 유의성 있게 감소시켰다. 흡연으로 시작된 산화스트레스는 elastin 등 조직성분의 손상을 가져오며 이들의 합성과 복구에도 장애를 유발하는 것으로 알려져 있어 산화 스트레스가 폐기종을 유발할 수 있음을 시사한다2. 또한 소기도 섬유화의 증가는 COPD의 질병 경과에서 매우 중요한 기전으로 섬유화는 섬유아세포의 활성화를 통해 이루어지게 되므로26 이러한 결과는 COPD에서 소기도 병변의 진행을 감소시킬 가능성을 보여준다고 생각된다. TNF-α와 IL-6는 담배연기나 biomass 연료의 연기로 자극받은 상피세포로부터 염증 매개체로서 분비되어 소기도의 국소적 섬유화 유발에 관여한다27. ELISA 분석에서 LPS로 자극한 대조군의 TNF-α와 IL-6는 정상군보다 유의하게 증가하였고, SGX01이 농도 의존적으로 이를 감소시키는 결과를 보여 SGX01이 산화물질의 분비억제와 염증 cytokine의 억제효과를 통해 전반적인 염증 조절작용을 할 것으로 기대된다.
COPD 동물모델 BALF의 cytospin 분석 결과, 대조군에서 정상군보다 neutrophil이 유의하게 증가하였고, COPD를 유발한 다음 SGX01을 투여한 실험군에서 대조군에 비해 유의한 감소를 보였다. 대조군의 neutrophil 증가는 기존의 실험들5,10과 일치하는 결과를 보이는 것으로 흡연자와 COPD 환자에서 활성화된 neutrophil의 증가는 기류제한 및 폐기능 감소의 진행속도와 밀접한 연관이 있으며28, COPD의 만성염증 관련 병리기전에서 중요한 역할을 한다고 알려져 있다2. SGX01이 neutrophil의 증가를 억제하는 것으로 나타나 COPD 병리기전의 주요 관련 세포인 neutrophil 증가를 조절하는 작용을 보이는 것으로 생각된다.
CD8+ 세포는 COPD 환자의 중심기도, 소기도, 폐실질에 널리 분포하며 그 숫자가 많을수록 기류폐쇄와 폐기종의 중증도가 심해지는 것으로 알려져 있어 조직 손상에 관여하는 중요한 세포로 인식되고 있으며 세포사멸(apoptosis)에 관련되는 것으로 알려져 있다29. BALF의 FACS 분석에서 SGX01이 CD8+ 세포의 증가를 유의하게 감소시키는 결과는 SGX01이 세포사멸을 통한 COPD 진행을 억제하는 작용을 보일 수 있음을 시사한다고 생각된다.
COPD를 동물모델 BALF의 ELISA 분석 결과, 대조군의 TNF-α 및 IL-17A는 정상군보다 유의하게 증가하였으며, SGX01을 투여한 실험군에서는 대조군에 비해 유의한 감소를 나타내었다. TNF-α는 COPD 환자의 객담에서 증가가 관찰되고30, 악액질을 동반한 COPD 환자의 혈청에서 증가 양상을 보이며31, IL-17A는 neutrophil의 생존 기간을 연장시키고32, 장기 흡연자의 말초기도에서의 neutrophil이 축적되는데 기여하는 것으로 보고되고 있다33. 따라서 SGX01은 이러한 염증 cytokine들을 감소시키는 작용을 통해 neutrophil이 관련 염증에 억제효과를 나타낼 것으로 생각된다.
COPD 동물모델 BALF의 ELISA 분석 결과, 대조군의 CXCL-1과 MIP2는 정상군보다 유의성 있는 증가를 보였고, SGX01을 투여한 실험군에서는 대조군에 비하여 유의하게 감소하였다. CXCL-1는 COPD 환자의 객담에서 증가가 관찰되며34 CXCL-1, MIP2는 chemokine으로 작용하여 주로 macrophage로부터 분비가 되어 neutrophil 등의 염증세포들이 병소로 모이도록 하는 것으로 알려져 있어35 이와 같은 결과는 SGX01이 이들 chemokine의 발현을 억제시켜 염증세포가 기도내로 유입되는 것을 억제할 가능성을 제시한다.
COPD 동물모델 폐조직의 real-time PCR 분석 결과, TNF-α, IL-1β, IL-6 및 IL-10 mRNA RQ는 정상군보다 유의한 증가를 보였으며, SGX01을 투여한 실험군에서는 대조군에 비하여 유의한 감소를 나타냈다. TNF-α 및 IL-1β는 주요 염증전구 cytokine으로 COPD 환자에서 macrophage를 활성화시켜 MMP9와 같은 chemokines를 분비하게 하는 것으로 알려져 있다36. TNF-α, IL-1β 및 IL-6는 상피세포에서 염증전구 cytokine으로 분비되어 기도 섬유화에 관여하고27, IL-10은 macrophage 및 Treg에서 생성되며 COPD 및 천식환자에서 과다발현된다17. 따라서 SGX01이 이러한 억제 작용을 통하여 macrophage 활성을 억제함으로써 COPD의 염증을 조절할 수 있을 가능성이 있음을 시사한다.
COPD 동물모델 폐조직 염색과 조직 손상의 정량적 분석에서 정상군에 비하여 대조군에서 나타난 폐포의 불규칙 확장, 기도벽 비후, 소기도 주변 염증세포 침윤이 양성대조군 및 SGX01을 투여한 실험군에서 감소하였다. COPD에서 기류제한이 발생하는 주된 위치는 2 mm 이하의 소기도이며 병기가 진행할수록 염증세포의 침윤으로 인한 소기도 평활근과 결합조직의 증가, 소기도 주변의 섬유화 등 비가역적인 소기도 내경의 감소가 나타나고 종말 세기관지 이하 공기공간의 비정상적인 영구적 확장이 발생한다2. 따러서 이러한 병리변화의 억제를 통해 SGX01이 폐조직 손상에의 보호 효과가 있음을 확인할 수 있었다.
결과를 종합하면 SGX01은 neutrophil 및 염증 cytokine의 증가를 억제하고 폐조직의 손상을 감소시키는 폐손상 보호효과를 통해 COPD에 대한 치료 효과를 나타낼 것으로 사료된다.
V. 결 론
SGX01의 COPD에 대한 효능을 평가하기 위하여 L929 세포에서의 항염증 효과와 LPS와 표준담배 추출물(CSS)로 유도한 COPD 생쥐 모델에서 관련 cytokine 및 면역세포와 폐손상과 연관된 단백질 변화를 연구한 결과 다음과 같은 결론을 얻었다.