간암 한약제제 임상시험 가이드라인 개발을 위한 한약제제 무작위배정 대조군 임상시험 고찰
Abstract
Objective
This study aimed to ascertain what should be considered in the “Guideline for Clinical Trials with Herbal Medicinal Products for Liver Cancer,” by analyzing existing guidelines and clinical trials.
Methods
Committee for the development of a guideline, consisting of 6 Korean medicine doctors, reviewed guidelines and clinical trials on using herbal medicine for treating liver cancer. The trials were analyzed in terms of inclusion and exclusion of participants, intervention, comparators, outcomes, and trial design. We then compared the results of our analysis with the guidelines to identify issues we must to consider when following the “Guideline for Clinical Trials with Herbal Medicinal Products for Liver Cancer.” Several guidelines for antitumor agents and clinical trials on herbal medicine were obtained from the Ministry of Food and Drug Safety homepage, etc. The search terms were as follows: “liver neoplasms”; “herbal medicine”; “medicine, Korean traditional”; and “medicine, Chinese Traditional.”.
Results
Ten articles were obtained from pubmed and Embase. There was no guideline for clinical trials on using herbal medicine for treating liver cancer. All the participants in the reviewed articles had primary liver cancer, and the type of intervention varied (e.g., decoction, patches, and capsules. The comparators included placebos and conventional treatments such as chemotherapy. The outcome assessment methods were tumor response, quality of life, survival, and liver function tests. Adverse events occuring during the trial were also evaluated.
Conclusion
Findings were derived by reviewing existing guidelines and comparing them with clinical trials on liver cancer and herbal medicinal products. These results will be utilized in the development of the “Guideline for Clinical Trials with Herbal Medicinal Products for Liver Cancer.”
Keywords: liver neoplasms, hepatocellular carcinoma, herbal medicinal product, clinical trial, guideline
I. 서 론
원발성 간암은 병리학적으로 간세포암종 외에도 담관암, 혈관육종 및 간모세포암 등이 포함되지만, 흔히 간암이라 함은 성인의 원발성 간암의 85% 이상을 차지하는 간세포암종을 일컫는다 1. 2018년 전 세계적으로 새롭게 발생한 간암환자는 약 84만 명으로, 폐, 유방, 결장직장, 전립선, 위암에 이어 6번째로 많이 발생하였으며, 간암으로 인한 사망자 수는 78만 여명으로 세 번째로 많았다. 간암은 전 세계 발생과 사망의 70% 이상이 아시아에서 일어났으며, 특히 우라나라가 속한 동아시아에서 50% 이상이 발생하였는데, 만성 B형 간염 바이러스(HBV) 감염이 중요한 요인으로 작용하였다 2,3. 우리나라 국가 암 정보센터 통계에 따르면 2016년 한 해 동안 간암의 발생은 갑상선암을 제외하고 남자에서 5위, 여자에서 6위로, 남녀를 합했을 때 5위였으며, 사망자 수는 폐암에 이어 두 번째로 많았다 4. 또한 남녀 성비를 보면 여성보다 남성에게서 세계적으로는 2배 이상, 국내에서는 3배 이상 많이 발생하였다 2,4. 갑상선과 전립선암을 제외한 모든 암의 5년 상대 생존율이 62.8%인데 반해, 간암의 5년 상대 생존율은 34.6%로 췌장암, 폐암, 담낭 및 담도암에 이어 4번째로 낮아 예후가 불량하다 5. 이렇게 예후가 불량한 이유는 첫째, 간세포암의 빠른 성장속도와 조기에 혈관 침습을 일으키는 생물학적 특징, 둘째, 만성 간염이나 간경변을 동반하여 적극적인 암 치료가 어려운 점, 셋째, 특이적 증상이 없어 주기적 검사를 시행하지 않으면 조기 발견이 어려워 발견 당시 상당히 진행된 경우가 많은 점 등이다 6. 간암의 표준치료는 병기와 Child-Pugh 등급 등에 따라 수술(간절제 혹은 간이식), 국소치료(고주파열치료술, 에탄올 주입술 등), 경동맥 화학 색전술, 체외 방사선치료, 전신치료(세포독성화학요법제, 분자표적치료제, 면역관문억제제) 등이 행해지고 있다 7,8. 간암은 조기에 발견하여 수술을 하더라도 5년 재발률이 43.7~77% 정도이며 이들 중 80~95%가 간 내에서 재발된다 9. 발견 당시에도 근치적 수술이 불가능한 환자가 많고, 수술을 하더라도 재발이 많으므로 실제 임상에서는 간세포 암종의 1차 치료법으로 경동맥 화학 색전술(transarterial chemoembolization, TACE)이 10 가장 많이 선택되고 있는 시술이다. 그러나 이 시술 후에 60-80%의 환자에서 발열, 복통, 오심, 구토, aspartate aminotransferase(AST), alanine aminotransferase(ALT), gamma glutamyl transferase (GGT) 상승 등을 동반하는 색전술 후 증후군이 나타난다고 보고되었다 11. 또 간세포암은 진단 당시 40%의 환자가 이미 병이 상당히 진행된 상태로 전신치료가 유일한 치료방법인 경우가 대부분이지만 12, 약제 내성 유전자의 발현 빈도가 높고, 만성 간염 또는 간경변 등의 동반으로 간기능이 감소되어 있는 환자가 많다. 따라서 약물의 전달과정이 방해받아 충분한 항암제의 투여가 불가능하므로 확실히 효과가 있는 전신치료법을 찾기 위한 시도가 계속 되고 있다 13. 그 예로, 분자표적치료제인 sorafenib은 2007년 허가를 받고 미국과 유럽 그리고 아시아에서 2건의 3차 임상시험을 거친 후 14,15, 거의 10년간 진행성 간세포암 치료제로 유일하게 허가받은 표준 1차 전신치료제로 사용되어 왔다 16,17. 하지만 환자에 대한 sorafenib의 반응 예측을 위한 상당수의 연구에도 불구하고 아직 명확한 결론은 내려지지 않은 상태이며 18-20, 설사, 손발피부반응(hand-foot skin reaction), 식욕부진, 탈모, 음성의 변화, 원인 불명의 복통과 같은 부작용이 발생한다 14,15. 그 이후 2017년 분자표적치료제인 regorafenib과 면역관문억제제인 nivolumab이 진행성 간세포암의 2차 치료제로 허가를 받았다 21,22. 하지만 sorafenib에 내약성이 있는 환자가 regorafenib에 잘 반응할지 여부는 아직 확실치 않은 상태이고, 앞으로 간세포암 치료를 이끌어 갈 것으로 기대되는 nivolumab을 포함한 면역관문 억제제들은 기존 세포독성 항암제나 표적항암제와는 다른 양상으로 면역체계에 영향을 미쳐 면역매개 이상반응을 일으킬 수 있는데 23, 즉각적인 조치를 취하지 않으면 생명을 위협할 수준에 이르는 경우도 있으며, 약물중단 이후에도 면역매개 이상반응이 발생할 수 있으므로 주의가 필요하다 24,25. 위와 같이 암의 표준치료가 안고 있는 한계들로 인해 국내외 암환자들의 보완 대체 의학 사용이 증가하고 있으며, 특히 한약제제가 암환자들에게 널리 이용되고 있고 26,27, 그와 관련해 효과를 입증하기 위한 많은 실험과 연구들이 이루어지고 있다 28. 하지만 발표된 거의 대부분의 기초 실험이 임상연구로 연결되지 못하고 있다. 임상 논문들 또한 대부분이 근거중심의학에서 근거가 낮은 편에 속하는 증례보고라는 한계가 있으며 29, 근거 수준이 높은 잘 설계된 간암 관련 한의약 임상시험은 본격적으로 수행되고 있지 않다. 또한 국내의 임상시험 가이드라인 부분에서도 서양의학에서 사용하는 항암제에 초점을 맞춘 임상시험 가이드라인 외에 간암의 한약제제 임상시험과 관련된 가이드라인은 존재하지 않는다. 이에 저자는 추후 간암 환자를 대상으로 하는 한약제제 임상시험을 설계, 수행하고 이의 근거가 될 수 있는 가이드라인 개발을 위한 사전 작업을 다음과 같이 진행하고자 한다. 첫째, 국내의 현존하는 한약제제 관련 가이드라인과 암/간암관련 가이드라인을 검색하여 한의약 임상시험에 적용할 수 있는 부분을 분석하고, 보완해야 하는 부분을 탐색한다. 두 번째로, 최근 수행된 간암환자를 대상으로 한 한약임상시험의 방법론을 고찰하여, 향후 임상시험 수행 시 필요한 임상시험계획서의 고려사항을 제시하고자 하는 바이다.
II. 연구방법 및 절차
1. 개발예정인 임상시험 가이드라인의 목적
본 연구의 결과를 바탕으로 개발하고자 하는 가이드라인의 목적은 환자군에서 치료적 유효성을 탐색하여 가능한 용량과 투여기간 설정을 위한 다양한 정보수집을 목적으로 하는 제 2상 임상시험(치료적 탐색 임상시험 등)과 한약제제의 안전성과 유효성을 확증하기 위한 제 3상 임상시험(치료적 확증 임상시험 등)을 위한 것으로, 일반적인 임상시험 가이드라인에서 다뤄지는 내용들 외에, 한약제제를 이용한 간암 임상시험에 특수하게 적용해야 하는 고려사항을 다루는 것이며, 또한 이것을 통해 실제 임상시험 계획과 수행 시 참고할 수 있도록 하는 것이다. 구체적인 목적은 다음과 같다.
1) 한의학의 특수성과 임상실제를 반영하는 한약제제를 이용한 간암 임상시험의 구현
2) 한약제제를 이용한 간암 임상시험의 표준화 도모 및 질 제고
3) 한약제제를 이용한 간암 임상시험의 안전성, 유효성, 윤리성 확보
2. 가이드라인 관련 문헌검색 및 분석
1) 간암 한약제제 임상시험 가이드라인 개발팀 구성
간암 한약제제 임상시험 가이드라인 개발팀이 구성되었으며, 본격적인 개발 전의 사전 작업을 진행하였다. 개발팀은 총 6명으로, 임상시험 수행 경험과 임상시험 가이드라인 개발 경험이 있는 암 전문 한방병원 연구소 소속 연구원 2인, 간암치료 경험이 있는 암 전문 한방병원 소속 임상의 3인, 한방내과전문의로서 임상연구 가이드라인 제작경험이 있는 한의약임상연구 전공자 1인으로 구성되었다.
3. 기존 임상시험 관련 문헌검색 및 분석
1) 문헌검색
(1) 해외 DB로는 PubMed, Embase에서 간암, 한의학, 한약에 해당하는 검색어를 이용해 무작위배정 대조군 임상시험을 검색하였다. 자세한 검색어는 Table 1에 제시하였다( Table 1).
Table 1
|
Pubmed |
|
|
Disease of interest |
(“liver Neoplasms”[MH] OR “liver cancer" OR “cancer, liver" OR “hepatic cancer" OR “liver cancer" OR “liver primary cancer" OR “primary liver cancer" OR “liver tumor" OR “hepatic tumor" OR “hepatic tumour" OR “liver cell tumor" OR “liver cell tumour" OR “liver neoplasm" OR “liver neoplasma" OR “liver neoplasms" OR “liver tumor" OR “liver tumour" OR “tumor, liver" OR “tumour, liver" OR “liver cell carcinoma" OR “carcinoma, hepatic cell" OR “carcinoma, hepatocellular" OR “carcinoma, liver" OR “carcinoma, liver cell" OR “hepatic carcinoma" OR “hepatic cell carcinoma" OR “hepatocarcinoma" OR “hepatocellular carcinoma" OR “hepatoma" OR “liver carcinoma" OR “liver carcinoma rupture" OR “liver cell carcinoma" OR “malignant hepatoma" OR “primary liver carcinoma") |
|
|
Intervention |
(“Medicine, Korean Traditional”[MH] OR “Medicine, Chinese Traditional”[MH] OR “Medicine, East Asian Medicine”[MH] OR “Medicine, Kampo”[MH] OR “Integrative medicine”[MH] OR “complementary therapies”[MH] OR “traditional japan medicine”[TW] OR “alternative medicine”[TW] OR “Herbal Medicine”[MH] OR “Herb*”[TW] OR “tang”[TW] OR “san”[TW] OR “decoction”[ALL]) |
|
|
Outcome measures |
None |
|
|
Filter |
Full text available AND Published in the last 10 years AND Humans |
|
|
Embase |
|
|
|
Disease of interest |
(‘liver cancer’/exp OR ‘cancer, liver’ OR ‘hepatic cancer’ OR ‘liver cancer’ OR ‘liver primary cancer’ OR ‘primary liver cancer’ OR ‘liver tumor’/exp OR ‘hepatic tumor’ OR ‘hepatic tumour’ OR ‘liver cell tumor’ OR ‘liver cell tumour’ OR ‘liver neoplasm’ OR ‘liver neoplasma’ OR ‘liver neoplasms’ OR ‘liver tumor’ OR ‘liver tumour’ OR ‘tumor, liver’ OR ‘tumour, liver’ OR ‘liver cell carcinoma’/exp OR ‘carcinoma, hepatic cell’ OR ‘carcinoma, hepatocellular’ OR ‘carcinoma, liver’ OR ‘carcinoma, liver cell’ OR ‘hepatic carcinoma’ OR ‘hepatic cell carcinoma’ OR ‘hepatocarcinoma’ OR ‘hepatocellular carcinoma’ OR ‘hepatoma’ OR ‘liver carcinoma’ OR ‘liver carcinoma rupture’ OR ‘liver cell carcinoma’ OR ‘malignant hepatoma’ OR ‘primary liver carcinoma’) |
|
|
Intervention |
(‘herbal medicine’/exp OR ‘herbal medicine’ OR ‘medicine, herbal’ OR ‘chinese medicine’/exp OR ‘chinese medicine’ OR ‘medicine, chinese traditional’ OR ‘traditional chinese medicine’ OR ‘korean medicine’/exp OR ‘korean medicine’ OR ‘korean traditional medicine’ OR ‘medicine, korean traditional’ OR ‘traditional korean medicine’ OR ‘kampo medicine (drug)’/exp OR ‘japanese traditional kampo medicine (drug)’ OR ‘japanese traditional kanpo medicine (drug)’ OR ‘japanese traditional medicine (drug)’ OR ‘kampo’ OR ‘kampo agent’ OR ‘kampo drug’ OR ‘kampo formula’ OR ‘kampo formulae’ OR ‘kampo formulation’ OR ‘kampo medication’ OR ‘kampo medicinal product’ OR ‘kampo medicine (drug)’ OR ‘kampo medicines’ OR ‘kampo preparation’ OR ‘kampo product’ OR ‘kampo remedy’ OR ‘kanpo agent’ OR ‘kanpo drug’ OR ‘kanpo formula’ OR ‘kanpo formulae’ OR ‘kanpo formulation’ OR ‘kanpo medicinal product’ OR ‘kanpo medicine (drug)’ OR ‘kanpo medicines’ OR ‘kanpo preparation’ OR ‘kanpo product’OR ‘kanpo remedy’ OR ‘traditional japanese kampo medicine (drug)’ OR ‘traditional japanese kanpo medicine (drug)’ OR ‘traditional japanese medicine (drug)’ OR ‘complementary and alternative medicine’/exp OR ‘decoction’/exp OR ‘east asian medicine’OR ‘integrative medicine’/exp OR ‘integrative medicine’ OR ‘alternative medicine’/exp OR ‘alternative medicine’ OR ‘alternative therapies’ OR ‘alternative therapy’ OR ‘anthroposophy’ OR ‘complementary medicine’ OR ‘complementary therapies’ OR ‘diet fads’ OR ‘eclecticism, historical’ OR ‘medicine, alternative’ OR ‘medicine, unani’ OR ‘mental healing’ OR ‘mind body technique’ OR ‘mind body therapies’ OR ‘mind body therapy’ OR ‘mind-body relations (metaphysics)’ OR ‘mind-body relations, metaphysical’ OR ‘mind-body therapies’ OR ‘naturopathy’ OR ‘polarity therapy’ OR ‘radiesthesia’ OR ‘reflexotherapy’ OR ‘spiritual therapies’ OR ‘therapeutic cults’ OR ‘therapeutic touch’) |
|
|
Outcome measures |
none |
|
|
Filter |
‘randomized controlled trial’/exp AND [2009-2019] |
(2) 국내 DB로는 전통의학정보포털( https://oasis.kiom.re.kr), 한국전통지식포털( http://www.koreantk.com), 한국학술정보포털( http://kiss.kstudy.com), 과학기술학회마을( http://society.kisti.re.kr), 한국교육학술정보원 학술연구정보서비스( http://www.riss.kr), 국가과학기술정보센터( http://www.ndsl.kr)에서는 ‘간암’, ‘한의’, ‘임상시험’으로 검색하였다. 검색한 문헌 중 질환이 간암에 해당하지 않는 것, 한약 외에 다른 중재(침, 약침 등)가 사용된 것, 무작위배정 대조군 임상시험이 아닌 것은 제외하였다.
2) 선정된 임상시험 분석
임상시험 설계 시 필수적인 요소인 P(Participants), I(Intervention), C(Comparator), O(Outcome)를 중심으로 분석하였으며, 그 외 임상시험설계에 대해서도 비교하였다.
III. 결 과
1. 가이드라인 관련 문헌검색 및 분석
1) 가이드라인 관련 문헌검색결과
국내 가이드라인 검색 결과는 Table 2와 아래에 기술하였다. 간암 치료를 위한 한약제제 임상시험 가이드라인 및 침구 임상시험가이드라인은 존재하지 않았다. 한약제제임상시험 관련 가이드라인 검색결과 중 암이 아닌 기타 개별 질환에 대한 가이드라인은 제외하였다( Table 2).
Table 2
The List of Searched Guidelines Related to Liver Cancer
|
Publisher year |
Title |
Characteristics |
|
Hong SH, 2015 |
Clinical Practice Guidelines of Korean Medicine for Hepatocellular Carcinoma30
|
1. clinical practice guideline of Korean medicine
2. related to hepatocellular carcinoma
3. a research report |
|
|
The Korean Liver Cancer Association and National Cancer Center, 2018 |
Practice Guidelines for Management of Hepatocellular Carcinoma6
|
1. clinical practice guidelines of conventional medicine
2. related to hepatocellular carcinoma
3. multidisciplinary clinical guidelines in Korea |
|
|
SH Kim, 2006 |
Study on development of assessment guideline and endpoints for clinical trial with antitumor natural product31
|
1. specific to assessment tool for clinical trial
2. related to antitumor natural product
3. a research report |
|
|
Korea Food & Drug Administration, 2006 |
Guideline for evaluation of clinical trial of anticancer drug32
|
1. related to anticancer agents which have toxicity against cancer cell or function of inhibition of cancer cell growth |
|
|
Korea Food & Drug Administration, 2010 |
Guidelines for the review of nonclinical test data for approval of anti-cancer drug’s clinical trial plan and item authorization33
|
1. description of the minimum considerations for clinical testing of anticancer drugs aimed at treating progressive cancer patients based on the type and timing of nonclinical studies |
|
|
National Institute of food and drug safety evaluation, 2015 |
Guidelines for clinical trial of anti-cancer drugs34
|
1. related to anticancer agents which have toxicity against cancer cell or function of inhibition of cancer cell growth |
|
|
National Institute of food and drug safety evaluation, 2015 |
Guidelines for non-clinical trial of anti-cancer drugs35
|
1. recommendations for nonclinical evaluation to support clinical trials in the development of anticancer drugs |
|
|
National Institute of food and drug safety evaluation, 2015 |
Guidelines for exemption of anti-cancer drug data in Korean population36
|
1. guidelines for exemption from submission of clinical trial data about Koreans |
|
|
Ministry of Food and Drug Safety, 2018 |
Guideline for the use of clinical trial medicines for therapeutic purposes37
|
1. guideline for the use of clinical trial medicines to patients with life-threatening conditions without other treatment |
|
|
Korean Association for the Study of the Liver and National Cancer Center, 2001 |
Recommendations for Early Screening of Liver Cancer38
|
1. guideline for hepatocellular carcinoma surveillance in Korea |
|
|
Korea Institute of Oriental Medicine, 2005 |
A study on the clinical trial guidelines of herbal medicinal drug39
|
1. related to general herbal medicinal drug
2. a research report |
|
|
Korea Institute of Oriental Medicine, 2005 |
A study on the clinical trial guideline of herbal medical drug (Ⅱ)40
|
1. analysis of guidelines for clinical research of new medication in Chinese medicine
2. related to general herbal medicinal drug |
|
|
Industry-Academia Collaboration Foundation, Kyung Hee University, 2006 |
Research on outcome indicators for clinical trials of herbal medicinal products41
|
1. related to assessment tool
2. related to cough, phlegm, asthma
3. a research report |
|
|
Korea Food & Drug Administration, 2007 |
General considerations for clinical trials in herbal medicine42
|
1. related to general herbal medicine
2. general principles and methods of clinical trials
3. a research report |
|
|
National Institute of food and drug safety evaluation, 2017 |
Quality guidelines of herbal medicine for clinical trial43
|
1. recommendations for chemistry, manufacturing and control information on herbal medicines used in clinical trials |
|
|
Japan Society of Hepatology, 2013 |
Evidence-based Clinical Practice Guidelines for Hepatocellular Carcinoma: The Japan Society of Hepatology44(3rd JSH-HCC Guidelines) |
1. guidelines for hepatocellular carcinoma prevention, diagnosis and treatment in Japan |
|
|
Asian Pacific Association for the Study of the Liver, 2017 |
Asia–Pacific clinical practice guidelines on the management of hepatocellular carcinoma45
|
1. guidelines for evidence-based management of hepatocellular carcinoma in Asia-Pacific region |
|
|
Lim HS, 2014 |
Malignant tumor Chinese medicine treatment guide46
|
1. clinical practice guidelines of Chinese medicine
2. related to neoplasms |
|
|
Zhou J, 2017 |
Guidelines for Diagnosis and Treatment of Primary Liver Cancer in China47
|
1. guidelines of surveillance, diagnosis, staging and treatment for hepatocellular carcinoma occurring in China |
|
|
European Association for the Study of the Liver (EASL), 2018 |
EASL Clinical Practice Guidelines: Management of hepatocellular carcinoma48
|
1. recommendations of surveillance, diagnosis and therapeutic strategies for patients with hepatocellular carcinoma in Europe |
|
|
European Society for Medical Oncology -European Society of Digestive Oncology (ESMO-ESDO), 2012 |
Hepatocellular carcinoma: ESMO-ESDO Clinical Practice Guidelines for diagnosis, treatment and follow-up49
|
1. Clinical Practice Guidelines for diagnosis, treatment and follow-up of hepatocellular carcinoma patients in Europe |
|
|
National Comprehensive Cancer Network, 2019 |
National Comprehensive Cancer Network [NCCN Clinical Practice Guidelines in Oncology (NCCN Guidelines®) Hepatobiliary Cancers]7
|
1. Guidelines for diagnosis and treatment of Hepatobiliary cancers
2. Hepatobiliary cancers are including hepatocellular carcinoma, gallbladder cancer and cholangiocarcinomas. |
|
|
American Association for the Study of Liver Disease (AASLD), 2018 |
AASLD Guidelines for the Treatment of Hepatocellular Carcinoma50
|
1. official recommendations of AASLD on the surveillance, diagnosis, and treatment of hepatocellular carcinoma occurring in the setting of adults with cirrhosis |
|
|
American College of Gastroenterology (ACG), 2014 |
ACG clinical guideline: the diagnosis and management of focal liver lesions51
|
1. guidelines for evidence-based approach to the diagnosis and management of focal liver lesions (FLL)
2. FLL includes malignant liver lesions and benign solid and cystic liver lesions. |
(1) 암/간암 임상시험 관련 국내 가이드라인
① 천연물 항암제제 임상시험 평가지표 개발연구 31
③ 항암제임상시험계획(IND) 및 품목허가(NDA) 승인을 위한 비임상시험 자료 심사 지침 33
⑥ 항암제 가교자료 면제를 위한 가이드라인 개정판 36
⑦ 임상시험용의약품의 치료 목적 사용을 위한 가이드라인 37
(2) 한약제제 임상시험 관련 국내 가이드라인
① 천연물신약⋅한약제제 임상시험 가이드라인 연구 39
② 한약제제 등의 임상시험 가이드라인 제정연구(II) 40
③ 한약제제의 임상시험 평가지표개발에 관한 연구 41
④ 생약한약제제 임상시험의 일반적 고려사항 42
⑤ 임상시험용 한약(생약)제제의 품질 가이드라인 43
(3) 국내외 간암 임상지침
① 간세포암종 치료에 대한 한의 임상 가이드라인 30
④ Evidence-based Clinical Practice Guidelines for Hepatocellular Carcinoma: The Japan Society of Hepatology 44
⑤ Asia-Pacific clinical practice guidelines on the management of hepatocellular carcinoma 45
⑦ Guidelines for Diagnosis and Treatment of Primary Liver Cancer in China 47
⑧ EASL(European Association for the Study of the Liver) Clinical Practice Guidelines: Management of hepatocellular carcinoma 48
⑨ Hepatocellular carcinoma: ESMO-ESDO (European Society for Medical Oncology-European Society of Digestive Oncology) Clinical Practice Guidelines for diagnosis, treatment and follow-up 49
⑩ NCCN(National Comprehensive Cancer Network) Clinical Practice Guidelines: Hepatobiliary Cancers 7
⑪ AASLD(American Association for the Study of Liver Disease) Guidelines for the Treatment of Hepatocellular Carcinoma 50
⑫ ACG(American College of Gastroenterology) clinical guideline: the diagnosis and management of focal liver lesions 51
2) 검색된 가이드라인 분석 및 한의약 임상시험에의 적용은 고찰부분에서 논의하였다.
2. 기존 임상시험 관련 문헌검색 및 분석
1) 문헌 검색 결과
PubMed에서 630건, Embase에거 70건, 오아시스 0건, Korean TK 1건, KISTI 6건, KISS 0건, RISS 4건, NDSL 0건이 검색되어 총 712건의 문헌을 검토하였다. 526편중 중복된 논문 9편을 제거하고, 703건의 논문 가운데 증례보고, 세포실험, 동물실험, 관찰연구, 고찰논문 등의 이유로 693건이 제외되고 9편의 논문이 선정되었다. 거기에 Embase 검색결과 가운데 간암 RCT poster가 있어 해당 논문을 검색하여 1건을 추가해 최종 10편의 논문을 분석하였다( Fig. 1).
Fig. 1
Flow chart of the study selection process. 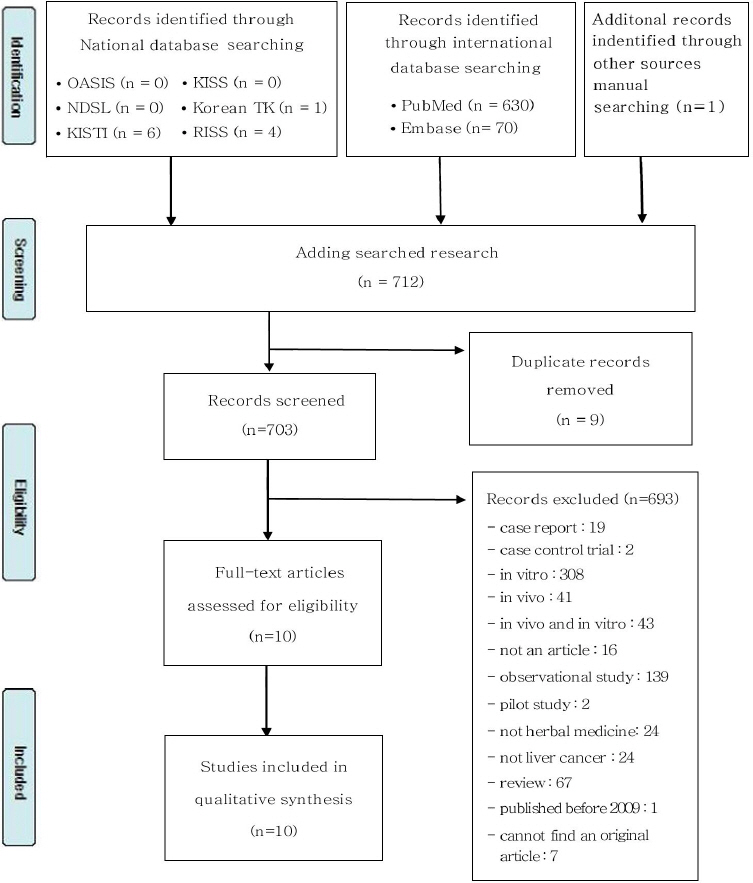
2) 문헌 분석
(1) 임상시험 개요 및 설계
최근 10년 이내 싱가폴, 일본, 중국에서 수행된 임상시험이 각 1건 52, 1건 56, 8 53-55,57,58-61건이었고, 한국에서 수행된 간암관련 한약제제 임상시험은 존재하지 않았다. 단일기관 임상시험은 6건 52,54,55,57,58,61, 다기관 임상시험은 4건 53,57,59,60으로, 다기관 임상시험 중 3건 53,59,60은 중국에서, 나머지 1건 55은 일본에서 수행되었다. 이중 맹검을 시행한 논문은 3편 53,54,58이었고, 위약을 사용한 연구는 총 6편 52-55,57,58이었다. 포함된 연구논문들의 기본적인 특성은 Table 3에 제시하였다( Table 3).
Table 3
The Characteristics of Included Study
|
Title |
Author |
Journal, year |
Nation |
Design |
Group |
|
Coriolus versicolor (Yunzhi) Use as Therapy in Advanced Hepatocellular Carcinoma Patients with Poor Liver Function or Who Are Unfit for Standard Therapy52
|
Chay WY |
J Altern Complement Med, 2017 |
Singapore |
Randomized, placebo-controlled trial |
A : Corioulus versicolr (Yunzhi)
B : Placebo |
|
|
A Multicenter, Randomized, Double-Blind, Placebo-Controlled Trial of ShuangbaiSan for Treating Primary Liver Cancer Patients With Cancer Pain53
|
Ye X |
J Pain Symptom Manage, 2016 |
China |
Multicenter, randomized, double-blinded, placebo-controlled trial |
A : Shuangbai San (external application)
B : placebo treatment of the same color, shape, and odor as Shuangbai San (external application) |
|
|
Jian Pi Li Qi Decoction Alleviated Postembolization Syndrome Following Transcatheter Arterial Chemoembolization for Hepatocellular Carcinoma: A Randomized, Double-Blind, Placebo-Controlled Trial.54
|
Xu L |
Integr Cancer Ther, 2016 |
China |
Randomized, Double-Blind, Placebo-Controlled Trial |
A : neither herbal medicine nor placebo administration
B : placebo treatment C : JPLQdecoctiontreatment |
|
|
Clinical study of hepatectomy combined with Jianpi Huayu Therapy for hepatocellular carcinoma.55
|
Zhong C |
Asian Pac J Cancer Prev, 2014 |
China |
Randomized Controlled Trial |
A : Hepatectomy+‘Jianpi Huayu Therapy’
B : Hepatectomy |
|
|
Effect of TU-100, a traditional Japanese medicine, administered after hepatic resection in patients with liver cancer: a multi-center, phase III trial (JFMC40-1001)56. |
Shimada M |
Int J Clin Oncol, 2015 |
Japan |
Multi-center, randomized, 2 armed, placebo-controlled, phase III trial |
A : daikenchuto (TU-100)
B : placebo |
|
|
Treatment of middle/late stage primary hepatic carcinoma by Chinese medicine comprehensive therapy: A prospective randomized controlled study.57
|
Tian HQ |
Chin J Integr Med, 2010 |
China |
Randomized placebo-controlled trial |
A : oral intake of Ganji Decoction (肝积方)+external application of Ailitong (癌理通)
B : chemotherapeutic agents, including MMC (10 mg/m2), THP (50 mg/m2) and 5-Fu (600 mg/m2)+placebo (similar figure, color and excipient of Ailitong) |
|
|
A new way : alleviating postembolization syndrome following transcatheter arterial chemoembolization.58
|
Yinglu F |
J Altern Complement Med, 2009 |
China |
Randomized, double-blinded placebo-controlled trial |
A : Placebo
B : dexamethasone
C : ginsenosides
D : dexamethasone+ginsenosides |
|
|
Traditional Herbal Medicine Prevents Postoperative Recurrence of Small Hepatocellular Carcinoma: A Randomized Controlled Study.59
|
Zhai XF |
Cancer, 2018 |
China |
Multi-center, randomized, controlled trial |
A : traditional herbal medicine (THM)
B : transarterial chemoembolization (TACE) |
|
|
Effect of Huaier granule on recurrence after curative resection of HCC: a multicenter, randomized clinical trial.60
|
Chen Q |
Gut, 2018 |
China |
Multicenter, randomised, parallel-group controlled, phase Ⅳ trial |
A : Huaier granule
B : no treatment |
|
|
Short-term Effect of Combined Therapy with Jinlong Capsule (金龙胶囊) and Transcatheter Arterial Chemoembolization on Patients with Primary Hepatic Carcinoma and Its Influence on Serum Osteopontin Expression.61
|
Wu GL |
Chin J Integr Med, 2010 |
China |
Randomized, controlled trial |
A : Chinese medicine (CM) group- treated with transcatheter arterial chemoembolization (TACE) and Jinlong Capsule (金龙胶囊, JLC)
B : intervention group-treated with TACE only
C : control group (healthy people) |
(2) 임상시험대상자(Participants)
① 연령의 경우 평균은 40대에서 60대였다. 시험대상자수는 15명에서 1044명까지 다양했다.
② 임상시험대상자는 간암으로 인해 수술기 주위 기간(perioperational)의 환자들을 대상으로 한 문헌이 3편 55,56,60이었고, TACE 시술 전후의 환자들을 대상으로 한 문헌이 3편 54,57,58, TACE와 동시에 한약 처방 개입을 한 문헌이 2편 59,61이었다. 수술여부에 대한 언급이 없는 문헌은 2편이었다. 자세한 임상시험대상자의 특성은 Table 4에 나타내었다 ( Table 4).
Table 4
The Characteristics of Participants in the Included Studies
|
Study |
Age |
Sample size |
Patients |
|
Chay WY, 2017 |
A : 64
B : 58.5 48-74 |
A : 9
B : 6 |
Hepatocellular Carcinoma Patients with Poor Liver Function or Who Are Unfit for Standard Therapy |
|
|
Ye X, 2016 |
A : 56.8±10.8
B : 57.7±13.0 |
A : 67
B : 67 |
Primary liver cancer patients with Cancer Pain |
|
|
Xu L, 2016 |
A : 54.7
B : 55.3
C : 55.8 |
A : 55
B : 44
C : 52 |
Patients with HCC after TACE. |
|
|
Zhong C, 2014 |
A : 46.7±10.4
B : 48.1±11.1 |
A : 60
B : 60 |
HCC patients undergoing operation |
|
|
Shimada M, 2015 |
A : 68 (36-87)
B : 69 (31-84) |
A : 108
B : 101 |
Patients, who underwent the hepatic resection at 26 Japanese centers |
|
|
Tian HQ, 2010 |
A : 51.44±10.5
B : 52.37±10.81 |
A : 49
B : 48 |
Primary liver cancer patients undergoing TACE |
|
|
Yinglu F, 2009 |
A : 56.21±12.42
B : 51.45±10.23
C : 53.71±11.92
D : 5 (It appears to be an error) |
A : 30
B : 30
C : 30
D : 30 |
Primary liver cancer patients undergoing TACE |
|
|
Zhai XF, 2018 |
A : 85.56%<60 14.44%≥60
B : 80.43%<60 19.57%≥60 |
A : 180
B : 184 |
Patients underwent radical surgery within 3 months and were pathologically diagnosed as having primary HCC |
|
|
Chen Q, 2018 |
A : 85.53%<65 16.47%≥65
B : 87.03<65 12.97%≥65 |
A : 686
B : 316 |
Patients who recovered after curative hepatocellular carcinoma (HCC) resection |
|
|
Wu GL, 2010 |
A : 51.31 (36-70)
B : 53.19 (40-70)
C : 46.87 (28-68) |
A : 53
B : 45
C : 40 |
Patients with primary hepatic carcinoma (PHC) |
③ 선정기준
암의 병기 측면에서는 1-3기를 대상으로 한 연구 1편 55, 2기 혹인 3기를 대상으로 한 연구 1편 57이었다. 병기 진단 근거는 Union for Cancer Control (UICC)를 기준으로 한 문헌 1편 55이었다. 또한 Wu의 연구61에서는 Barcelona Clinic Liver Cancer Staging System상 A 또는 B에 해당하는 환자를 대상으로 하였다. 그 외 문헌에서는 병기에 대한 언급은 없었다. 간기능을 측정하는 Child-Pugh Class를 기준으로 한 연구가 3건 52,54,57이 있었다. Child-Pugh Class A-B를 대상으로 한 연구는 2편 54,57이었고 Chay WY의 연구 52에서는 Child-Pugh Class C와 표준치료에 실패하였거나 적합하지 않은 Child-Pugh Class A-B의 환자를 기준에 포함시켰다. Eastern Cooperative Oncology Group performance status(ECOG PS)로 평가한 논문은 3건 54,57,59이었다. Xu의 연구 54에서는 ECOG 0에서 1사이의 환자, Shimada M 57는 ECOG 0에서 2사이의 환자, Zhai의 연구 59에서는 3미만의 환자를 대상으로 하였다. Tian의 연구 57에서는 Karnofsky Performance Status scale(KPS)가 60점인 환자를 대상으로 하였으며, Wu의 연구 61에서는 60점 이상인 환자를 대상으로 하였다. 특이한 선정기준을 제시한 몇 개의 연구가 있었는데, Ye의 연구 53에서는 간암 환자 중 특정부위, 상복부 통증을 호소하는 환자를 대상으로 하였고 그 정도로는 Numeric rating score(NRS) 1-3에 해당하는 환자를 기준으로 삼았다. 한편, 동의서에 자발적으로 서명한 자를 선정기준에 포함시킨 논문은 4편이었다 54-56,61. 자세한 선정기준은 Table 5에 제시하였다( Table 5).
Table 5
The Inclusion and Exclusion Criteria of the Selected Studies
|
Study |
Inclusion criteria |
Exclusion criteria |
|
Chay WY, 2017 |
1. In operable HCC and Child-Pugh Class C liver cirrhosis; and HCC patients with Child-Pugh A or B liver cirrhosis who have failed or were unfit for standard therapy.
2. HCC was diagnosed either histologically or by imaging evidence of a space-occupying lesion in the liver together with a serum alphafeto protein (AFP) concentration >200 mg/L (subjects with chronic hepatitis B or C infection) or >400 mg/L (with out chronic hepatitis B or C infection). |
None |
|
|
Ye X, 2016 |
Primary liver cancer patients with local or upper abdominal pain, an NRS score of 1-3, using either nonopioid analgesics or no analgesics and aged 18-85 years old. |
None |
|
|
Xu L, 2016 |
1. Patients with histologically or cytologically documented or radiographically diagnosed unresectable primary HCC who were candidates for TACE were included. Radiographic diagnosis needed typical findings of HCC by a radiographic method-that is, on multidimensional dynamic CT, CT hepatic arteriography/CT arterial portography, or MRI.
2. Patients should not have received any herbal medicine and systemic treatment in the past 2 weeks.
3. The Eastern Cooperative Oncology Group Performance Status score had to be from 0 to 1.
4. Patients had to have compensated liver function (Child-Pugh class of A or B).
5. Patients had to have a life expectancy of at least 3 months.
6. Patients had to sign the informed consent form |
1. Those not meeting the inclusion criteria above were excluded.
2. Patients who received combinations of medications that could potentially affect the indices for observation of evaluation during the trial were also excluded. |
|
|
Zhong C, 2014 |
1. patients aged from 18 to 70 years;
2. performance status (PS) 2 or less;
3. based on 2010 UICC TNM staging criteria, patients staged with I-III A;
4. preoperative clinical diagnosed with HCC, and the consensus of patient is available for radical resection;
5. in accordance with TCM, ‘Pi Xu Gan Yu’ and ‘Qi Zhi Xue Yu’. |
1. Diagnosed with other malignant tumor or with severe heart disease or serious infections, etc
2. Pregnant or lactating women |
|
|
Shimada M, 2015 |
Patients with primary and metastatic liver cancer who:
1. were planning open or laparoscopy-assisted hepatic resection of laparotomy;
2. had an Eastern Cooperative Oncology Group performance status of 0-2;
3. were capable of orally taking test reagents;
4. were aged over 20
5. had no history of prior chemotherapy or radiotherapy within 4weeks before surgery;
6. had sufficient vital or ganfunctions (bone marrow, heart, liver, kidney, lung, etc.);
7. were in a satisfactory general condition for hepatectomy;
8. showed serum C-reactive protein (CRP) leves of 2.0 mg per deciliter;
9. were in patients during the study period; and
10. provided their written informed consent. |
None |
|
|
Tian HQ, 2010 |
The patients of PHC, who
1. with the diagnosis fitting to the diagnostic and staging standards in “Norms for diagnosis and treatment of commonly encountered malignant tumor in China” (1);
2. in stage Ⅱ or III and be fitting to take intervention therapy;
3. with liver function of grade A or B (Childpugh classifi cation); and
4. Karnofsky scores 60. |
The patients
1. aged below 18 years or over 70 years; or women in pregnant/lactation period;
2. being allergic to the testing drugs;
3. the cases died or dropped out in 1 week after intervention;
4. the size of lesions accounting for 70% of whole liver;
5. with cancerous thrombus blocking in trunk of portal vein;
6. complicated by serious primary cardio- vascular, renal, hemopoietic, immune or mental diseases, which could influence the efficacy or safety evaluation of the treatment; and
7. unwilling to participate the trial. |
|
|
Yinglu F, 2009 |
1. suffuse or multiple nodular liver cancer,
2. total bilirubin level 50 mmo+L8l L1,
3. no tumor thrombi in portal vein,
4. ratio of liver tumor volume to entire volume 70%, and
5. no upper gastrointestinal bleeding in the past 6 months. |
1. not meeting the inclusion criteria above;
2. PT time exceeding normal control value beyond 5 seconds,
3. noncontrollable ascites,
4. leukocyte count <3.0⋅109 and platelet count <30⋅109.
5. Child-Pugh C stage,
6. extrahepatic metastasis,
7. arteriovenous fistula,
8. use of glucocorticoids (GCs) or GS in the past 3 months,
9. combined medication that affected the indices observed during the trial, and
10. patients who were not treated according to regulations in the setting of informed consent so that efficacy was difficult to assess and patients whose information was not complete and the judgment of efficacy was affected. |
|
|
Zhai XF, 2018 |
1. patients aged between 18 and 75 years who underwent radical surgery within 3 months and were pathologically diagnosed as having primary HCC
2. solitary HCC measuring <5 cm
3. Eastern Cooperative Oncology Group performance status (ECOG PS)<3 |
1. Child-Pugh grade C liver function
2. intrahepatic disease recurrence, or extrahepatic metastasis
3. who had received TACE or other antitumor therapy before surgery
4. who had received antitumor therapy postoperatively
5. who were treated with antivirals for active hepatitis |
|
|
Chen Q, 2018 |
1. patients age between 18 and 75 years with a confirmed first diagnosis of HCC suitable for curative resection treatment according to clinical guidelines
2. CT or MRI of chest, abdomen and pelvis performed before surgical resection;
3. the absence of postresection residual tumour confirmed by CT or MRI taken in the first visit during follow-up period
4. evidence of a histological cancer-free resection margin
5. Barcelona Clinic Liver Cancer Staging System stage A or B
6. adequate liver and renal function assessed by laboratory tests done with samples taken within 14 days before randomisation |
1. patients with extrahepatic metastases who underwent hepatic resection even though those metastases were radically resected
2. tumour metastases or portal invasion or macrovascular invasion confirmed by postoperational histology
3. Child-Pugh liver function class C
4. history of abnormal bleeding tendency
5. known HIV infection
6. patients with severe acute or chronic disease, including myocardial infarction, stroke, congestive heart failure within 3 months prior to the study, gastrointestinal bleeding within 1 year prior to the study, diabetes and uncontrolled infection prior to the study
7. history of drug abuse or psychiatric disorders;
8. receiving other investigational or antitumour medications within 4 weeks prior to the study
9. women who were pregnant or breast feeding |
|
|
Wu GL, 2010 |
1. diagnosed in clinic by CT and (or) MRI and meet a criterion laid down by the Hepatoma Board of Chinese Anti-cancer Association
2. who cannot receive operation and have no contraindication of TACE.
3. patients’ ages varied from 18 to 70
4. Karnofsky score (KPS) was 60, who had no else tumor, angiocardiopathy, cerebrovascular disease, incretopathy, etc.
5. must sign an informed consent |
1 severe heart, lung, kidney, blood diseases and abnormity of function in bone marrow
2. pregnant women or women during the breast-feeding period
3. intolerable serious adverse reactions during chemotherapy period
4. who got worse when they were observed and can not be treated in sequence. |
④ 제외기준
Tian의 연구 57에서는 시험에 참여하지 않으려는 자를 제외기준으로 삼았다. 전이된 경우를 제외한 논문은 1건 58이었으며, Child-Pugh Class C 환자를 제외한 논문이 2건 59,60이었고, 정신질환, 신장질환을 제외한 논문도 있었다 57. 그 외 제외 기준으로는 다음과 같은 것을 제시하였다. ▲ 연구에 영향을 줄 수 있는 약물처치를 받는 자, ▲ 다른 종양이 또는 심각한 심혈관 질환이나 감염이 있는 자, ▲ 임산부 혹인 수유기 여성, ▲ 시험약에 알레르기 반응이 있는 자, ▲ 참가 1주 이내에 사망한자, ▲ 병변이 전체 간의 70%이상인자, ▲ 암성 혈전이 간문맥을 막고 있는 자, ▲ 조절 되지 않는 부종이 있는 자. 자세한 제외기준은 Table 5에 제시하였다( Table 5). (3) 시험약(Intervention)
일본에서 출판된 논문은 Tsumura제약에서 제조된 상품을 사용하였는데, TU-100(대건중탕)을 시험약으로 하였고 56, 싱가포르에서 출판된 논문은 Coriolus versicolor(운지버섯)을 시험약으로 하였다 52. 중국에서 출판된 논문은 Shuangbai San(쌍백산) 외용제(1편) 53, Jian Pi Li Qi Decoction(건비익신탕)(1편) 54, Jianpi Huayu Decoction(건비화어탕) (1편) 55, Ganji Decoction(肝积方)와 Ailitong(癌理通) 외용제 57 등을 사용하였으며, Yinglu의 연구 58에서는 Chongqing Dongya Medicine Co. Ltd에서 제조한 인삼에서 추출한 Ginsenoside capsule을 사용하였다. 변증에 따라 처방된 한약을 사용한 논문은 없었다. 투약기간의 범위는 3일에서부터 1년까지 다양했다. 수술기주위 기간(perioperational)에 있는 환자를 대상으로 한 연구는 수술 시작 3일 전에 대건중탕을 복용시켰고 57, TACE 시술을 받는 환자를 대상으로 한 연구는 1주일 전, 3일전 혹은 시술 당일부터 복용시켰다 54,57,58( Table 6).
Table 6
The Characteristics of Intervention in the Included Studies
|
Study |
Intervention |
Content & dose |
Period |
|
Chay WY, 2017 |
Coriolus versicolor (Yunzhi) |
CV was given as a standard continuous daily dose of 2.4 g. |
Median treatment duration was 1.5 cycles (5.9 weeks) and 3 cycles (12.1 weeks) for placebo and CV, respectively. |
|
|
Ye X, 2016 |
Shuangbai San (external application) |
Two hundred grams of Shuangbai San or placebo compound was mixed with 200 mL water and 20 g honey to make a paste, which was heated in a microwave for three minutes. The mixture was spread evenly on a prepared transparent film (approximately 5-10 mm thick) and was applied and kept in place around the liver or upper abdomen once it had cooled to approximately 45 ℃-50 ℃ (for six hours every day over seven days of treatment). The patients who had used nonopioid analgesics before the trial were required to stop for 12 hours as a drug washout period. All patients were treated with intramuscular tramadol (0.1 g) when breakthrough pain occurred. |
1 weeks |
|
|
Xu L, 2016 |
TACE + Jian Pi Li Qi Decoction |
Patients in groups A, B, and C were medicated as follows: with no herbal medicine taken, 200 mL decoction of raw hawthorn taken twice daily as placebo; or 200 mL of JPLQ decoction with twice daily administration, respectively. The JPLQ decoction is composed of Poria cocos 20 g, Atractylodes macrocephala 10 g, Codonopsis pilosula 20 g, Fructus aurantii 10 g, raw hawthorn 20 g, five leaf akebia fruit 30 g, citrus chirocarpus 20 g. All herbal medicines were soaked for half an hour with clean cold water and simmered for half an hour with gentle heat after boiling. The herbal medicine was initially administered on the day of the performance of TACE and continued for 3 days. |
3 days |
|
|
Zhong C, 2014 |
Hepatectomy + ‘Jianpi Huayu Therapy’ |
Ginseng 20 g, atractylodes 15 g, Tuckahoe 15 g, licorice root 6 g, radix bupleuri 15 g, yam 12 g, cortex moutan 10 g, salvia miltiorrhiza 15 g, turmeric 10 g, rhizoma zedoariae 10 g. Jianpi Huayu Therapy could be started three days after the finish of operation in the treatment group. The above dose could be modified according to clinical symptoms of patient, one dose daily, for 1 year. |
1 year |
|
|
Shimada M, 2015 |
hepatic resection + daikenchuto (TU-100) |
15 g/day, three times a day |
2 weeks |
|
|
Tian HQ, 2010 |
TACE + oral intake of Ganji Decoction (肝积方) + external application of Ailitong (癌理通) |
1. Ganji Decoction (Radix Codonopsis, Rhizoma Atractylodes alba, Radix Bupleuri, Radix Paeoniae Alba, Rhizoma Smilacis Glabrae, Eupolyphaga seu Steleophaga, Rhizoma Curcumae, Hirudo, portulaca grandifloral, Concha Ostreae and Herba Hedyotis diffusae) one dose every day, starting from 1 week before intervention, and lasting for 4 weeks as one therapeutic course.
2. Ailitong, a Chinese medical padshaped plaster preparation (composed of white paste, Venenum Bufonis, Semen Strychni, Radix Cynanchi Paniculati, Moschus, Borneolum syntheticum, etc.), was externally applied to patients in the test group twice a day for 10 days totally, by washing clean the skin in advance, pasting the heatedly softened plaster on the painful position, and putting mild massage manipulation on it for 3-5 min. |
5 weeks |
|
|
Yinglu F, 2009 |
TACE + Medication |
A : Patients were treated with oral placebo capsule (essential component was starch) 2/times 2/d.
B : times patients were treated with one Dex capsule (2.25 mg Dex per pill) and one placebo capsule 2/d.
C : patients were treated with one GS capsule (200 mg GS per pill) and one placebo capsule 2/d. Group
D : patients were treated with one Dex capsule and one GS capsule 2/d. The drugs were given after breakfast and after supper, respectively. The Department of Chinese Drugs Preparation in Chinghai Hospital of the Second Military Medical University supplied placebo capsule. |
1 weeks |
|
|
Zhai XF, 2018 |
Traditional herbal medicine, TACE |
A : THM included cinobufacini and Jiedu granule. Cinobufacini at a dose of 50 mL was administered by intravenous drip (Anhui Jinchan Pharmaceutical Company, Huaibei, China) once daily. Jiedu granule at a dose of 4.5 g (Jiangyin Tianjiang Pharmaceutical Company, Jiangsu, China) (Mao-ren-shen granule, Shi-jian-chuan granule, Shan-ci-gu granule, and Ji-nei-jin granule were mixed in a ratio of 3:3:1:1) was taken orally twice daily.
B : Femoral arterial puncture and encheiresis were performed using the Seldinger technique. The physician inserted the catheter into the common hepatic artery. Highly selective embolization was targeted at the proper hepatic artery. The chemotherapy drugs, including pirarubicin at a dose of 10 mg, mitomycin at a dose of 10 mg, and iodipin at a dose of 2 to 5 mL, were infused with ultra-liquefied lipiodol emulsion for embolization. |
A : 10 days with cinobufacini administered intravenously, course of 3 months, for a total of 4 courses (duration of 12 months), Jiedu granule for 6 months
B : TACE was performed once. |
|
|
Chen Q, 2018 |
Huaier granule |
Huaier granule was obtained from Qidong Gaitianli Pharmaceutical, Jiangsu, China. Huaier granule packet contained 20 g Huaier extract, which was mixed with 100 mL of water for oral ingestion. take orally, 3 times a day |
maxium of 96 weeks |
|
|
Wu GL, 2010 |
Jinlong capsule (JLC), TACE |
Jinlong capsule : JLC (manufactured by Beijing Jiansheng Pharmaceutical Limited Company, composed of fresh gecko, fresh multibanded krait and fresh long-nosed pit viper, crude drug: 0.25 g per capsule, batch No. Z10980041) orally taken, 1 g each time, three times a day TACE : through punctures in the right femoral artery to permit the insertion of a hepatic artery catheter using the Seldinger technique, and then, the catheter was introduced into the hepatic inherent arteries to map the tumor vessels.
All patients received through angiography catheter oxaliplatin 130 mg/m2, hydroxycamptothecin (OPT) 20 mg, pirarubicin 20 mg/m2, dexamethasone 10 mg and ultra-iodized oil 10-30 mL. At the same time the patients took the tablets of compound glycyrrhizin to protect liver. |
3 months (JSC : one course of treatment was 1 month, and 3 courses of treatment were observed, TACE : at least 3 times, and the interval between two treatments should be one month) |
(4) 대조군(Comparator)
위약을 사용한 연구는 총 6편으로 운지버섯, 쌍백산 외용, 건비익신탕, 대건중탕, Ganji Decoction (肝积方)과 Ailitong(癌理通) 외용 57, Ginsenoside capsule을 사용한 논문 58이었다. 운지버섯 위약은 그 특징이나 제조과정에 대한 언급이 없었다. 그 외 연구에서는 위약에 대한 구체적인 내용이 언급되었는데, 쌍백산 위약은 치료약과 색깔, 모양, 향이 같은 것을 사용하였고, 건비익신탕 위약으로는 산사나무 끓인 물이 사용되었다. 대건중탕 위약은 Tsmura 제약에서 제조한 것이 사용되었고, Ailitong 위약은 모양, 색깔, 첨가제를 치료제와 동일하게 하여 사용하였다. ginsenoside 캡슐 위약은 The Department of Chinese Drugs Preparation in Chinghai Hospital of the Second Military Medical University에서 제공받았으며 녹말이 주성분이었다. 한편, 항암화학요법을 대조군으로 둔 문헌은 1편 57이었으며, Dexamethasone복용을 대조군으로 둔 연구 58도 있었다. 대조군에 대한 구체적인 내용은 Table 7에 제시하였다( Table 7).
Table 7
The Characteristics of Comparator in the Included Studies
|
Study |
Comparator |
|
Chay WY, 2017 |
Placebo - no information |
|
|
Ye X, 2016 |
same color, shape and odor as Shuangbai San |
|
|
Xu L, 2016 |
with no herbal medicine taken, 200 mL decoction of raw hawthorn taken twice daily as placebo |
|
|
Zhong C, 2014 |
None |
|
|
Shimada M, 2015 |
TU-100 and placebo control were manufactured by TSUMURA & CO. (Tokyo, Japan). |
|
|
Tian HQ, 2010 |
1. chemotherapeutic agents, including MMC (10 mg/m2), THP (50 mg/m2) and 5-Fu (600 mg/m2)
2. placebo with similar figure, color and excipient of Ailitong |
|
|
Yinglu F, 2009 |
A : Placebo
B : dexamethasone
C : ginsenosides
D : dexamethasone+ginsenosides |
|
|
Zhai XF, 2018 |
B : transarterial chemoembolization (TACE) group |
|
|
Chen Q, 2018 |
B : no further treatment after curative hepatocellular carcinoma resection |
|
|
Wu GL, 2010 |
B : patients who were treated TACE only
C : healthy people who didn’t take any treatment |
Table 8
The Characteristics of Outcomes in the Included Studies
|
Study |
Outcomes |
|
Chay WY, 2017 |
1. the median time to progression (TTP)
2. response rates
3. toxicity
4. quality of life (QOL) using the FACT HEP and EORTC QLQ-C30 questionnaires
5. progression-free survival (PFS)
6. overall survival (OS) |
|
|
Ye X, 2016 |
1. NRS Scroes
2. QOL Scores - EORTC QLQ-C30
3. Safety Indicators - in the hemanalysis results (white blood cells, neutrophils, red blood cells, hemoglobin, platelets) and in the liver and kidney function (alanine aminotransferase, aspartate aminotransferase, urea nitrogen, creatinine) |
|
|
Xu L, 2016 |
1. QOL - MD Anderson Symptom Inventory-Gastrointestinal module (MDASI-GI),
2. Armpit temperature
3. Liver function, including total bilirubin (TB) level, the ratio of glutamic oxalacetic transaminase (ALT) to glutamic pyruvic transaminase (AST), and alkaline phosphatase (AKP) level |
|
|
Zhong C, 2014 |
1. performance status (PS)
2. Disease-free survival (DFS), overall survival (OS) |
|
|
Shimada M, 2015 |
1. gastrointestinal dysmotility
2. serum CRP levels
3. adverse reaction |
|
|
Tian HQ, 2010 |
1. The immediate and long-term efficacy - Response Evaluation Criteria in Solid Tumors (RECIST), thrombocytopenia, hemorrhage, nausea, vomiting, constipation, fever and pain
2. adverse reaction
3. Liver Function
4. pain relieving initial time (PRIT) and pain-relieving sustained time (PRST) of the treatment
5. patients’ quality of life (QOL) - Karnofsky scoring |
|
|
Yinglu F, 2009 |
1. Degrees of adverse effects after TACE
2. Lasting time of clinical symptoms and signs after TACE
3. Liver function before and after TACE |
|
|
Zhai XF, 2018 |
1. long term recurrence-free survival (RFS)
2. long term overall survival (OS) |
|
|
Chen Q, 2018 |
1. recurrence-free survival (RFS) and rate of RFS
2. overall survival
3. extrahepatic recurrence rate
4. safety : adverse events (AEs) and drug related AEs, as shown in Medical Dictionary for Regulatory Activities (MedDRA) V.12.0, classified serious or non-serious in accordance with definition adopted by the International Conference on Harmonisation. |
|
|
Wu GL, 2010 |
1. evaluation short-term clinical efficacy according to the criteria established by WHO for short-term therapeutic effect of solid tumor
2. QoL using Karnofsky score (KPS)
3. level of serum osteopontin (OPN) |
① 종양반응
종양자체의 반응을 평가한 논문이 2편 있었는데, 그 기준은 Tian의 연구 57에서는 Response Evaluation Criteria in Solid Tumors(RECIST)를, Wu의 연구에서는 61 the criteria established by WHO for short-term therapeutic effect of solid tumor를 사용하였다. ② 삶의 질
삶의 질은 5편 52-54,57,60의 연구에서 평가되어, 가장 높은 비율을 차지한 유효성 평가 지표였다. 삶의 질 측정 도구는 다양했는데 Karnofsky performance stauts scale(2편) 57,60, MD Anderson Symptom Inventory-Gastrointestinal module(MDASI-GI)(1편) 54, European Organisation for Research and Treatment of Cancer Quality of Life Questionnaire - Cancer 30 (EORTC QLQ-C30)(2편) 52,53이었으며, Chay WY의 연구 52에서는 EORTC QLQ-C30와 동시에 Functional Assessment of Cancer Therapy - Hepatobiliary cancer(liver, bile duct and pancreas) (FACT-HEP)도 함께 사용하였다. ③ 혈액학적 검사
다양한 혈액학적 검사가 시행되었다. Ye의 연구 53에서는 백혈구, 호중구, 적혈구, 혈색소, 혈소판과 ALT, AST, urea nitrogen, creatinine과 같은 간, 신장 기능 지표를 측정하였으며, Shimada M의 연구 56에서는 serum C-reactive protein(CRP) 수치를 측정하였으며, Xu L의 연구 54와 Tian HQ의 연구 56 그리고 Yinglu F의 연구 58에서는 모두 간기능 지표를 측정하였다. ④ 증상 점수
Ye의 연구 53에서는 통증 척도를 NRS로 평가하였고, Tian의 연구 57에서는 혈구감소증, 출혈, 오심, 구토, 변비, 열, 통증 등의 증상을 0~4의 점수로 평가하였다. ⑤ 생존기간, 생존율
progression-free survival(PFS)와 overall survival (OS)은 1편의 논문 52에서 분석하였고, Zhong의 연구 47에서는 Disease-free survival(DFS), OS를, Zhai의 연구 59와 Chen의 연구 60에서는 recurrence-free survival (RFS)과 overall survival(OS)을 측정하였다. ⑥ 위장관 기능
수술 후 장관폐색 발생과 발생 시기를 측정한 연구는 1건 48이었다. (6) 안전성 평가 지표
① 이상반응
이상반응은 총 3개 논문에서 평가되었다. Tian의 연구 57에서는 WHO의 standard for grading toxic-side effects of commonly used anti-tumor drugs를 기준으로 삼아 백혈구 감소증, 저혈소판증, 출혈, 오심, 구토, 설사 등의 항암제 부작용에 대한 증상점수를 평가하였고, Shimada M의 연구 56에서는 대건중탕을 복용한 환자군에서 발생한 고빌리루빈혈증, 마비성 장폐색증, 설사, 상부위장관출혈 등을 National Cancer Institute(NCI) Common Terminology Criteria for Adverse Events(CTCAE, version 3.0)를 이용해 관찰하였다. Chen의 연구 60에서는 Medical Dictionary for Regulatory Activities(MedDRA) V.12.0에 나오는 부작용들의 심각성을 International Conference on Harmonisation의 정의에 따라 평가하였다.
IV. 고 찰
상술한대로 현재 한약제제를 이용한 간암 임상시험 수행 시 참고할만한 가이드라인은 없다. 따라서 본 연구는 간암 한약제제 임상시험 가이드라인 개발을 위한 예비 연구의 성격으로 기존 가이드라인과 최근 10년 이내 임상 시험 검색⋅분석이라는 두 부분으로 나누어 진행하였다.
우선 가이드라인을 검색한 결과, 간암과 관련된 것으로는 ‘간세포암종 치료에 대한 한의 임상 가이드라인’, ‘천연물 항암제제 임상시험 평가지표 개발연구’, ‘항암제 임상시험 평가지침’, ‘항암제 임상시험계획(IND) 및 품목허가(NDA) 승인을 위한 비임상시험자료 심사 지침’, ‘항암제 임상시험 가이드라인’, ‘항암제 비임상시험 가이드라인’, ‘항암제 가교자료 면제를 위한 가이드라인 개정판’, ‘임상시험용의약품의 치료 목적 사용을 위한 가이드라인’, ‘2018 간세포암종 진료 가이드라인’, ‘간암 조기검진 권고안’이 검색되었다. 한약제제 임상시험 관련 가이드라인으로는 ‘천연물신약⋅한약제제 임상시험가이드라인 연구’, ‘한약제제 등의 임상시험 가이드라인 제정연구(II)’, ‘한약제제의 임상시험 평가지표개발에 관한 연구’, ‘생약한약제제 임상시험의 일반적 고려사항’, ‘임상시험용 한약(생약)제제의 품질 가이드라인’ 등이 검색되었다.
먼저, 간암의 임상 가이드라인 중에서 한의학 관련 가이드라인으로는 ‘간세포암종 치료에 대한 한의임상 가이드라인’이 1편 있었다. 이는 저자가 대한간암연구회와 국립암센터가 공동으로 제정, 발표한 ‘간세포암종 진료 가이드라인’과 중국중서의결합학회 종류전업위원회(中國中西醫結合學會 腫瘤專業委員會)와 중국항암협회 종양전통의학전업위원회(中國抗癌協會 腫瘤傳統醫學專業委員會)가 발표한 ‘악성종류중의진료지남’(惡性腫瘤中醫診療指南)을 근간으로 하여, 한의임상현실을 반영한 진료가이드라인을 제언한 것이었다. 저자는 병인병기, 진단, 병기체계, 변증진단, 치료, 치료 후 반응평가 등에 대해 기술하고 있으며, 특히 치료 부분에서 간절제술 후, 항암화학요법 후, 방사선 치료 후의 변증치료와 추천 한약제제까지 기술하여 임상 적용성을 높이고자 하였다. 또 국내 한의계의 상황이 중국과 다른 점을 언급하며, 우리나라 현실에 맞는 한의진료가이드라인이 필요함을 역설하였다. 또 다른 1편은 대한간학회에서 발표한 ‘간암 조기검진 권고안’으로, 간암 검진은 고위험군에서 간암 사망위험률을 낮추는 효과가 있어 권고된다는 일치된 의견을 확인하였다. 그 외에도 일본, 유럽, 미국, 중국에서 출판된 간암 임상 가이드라인들이 있었으나 이들은 모두 간암의 진료를 위해 제안한 것으로 임상시험을 위한 가이드라인은 아니었다.
한약제제 임상시험 가이드라인으로는 중 본 연구에서 적용해볼만한 것은 2005년 발표된 ‘한약제제 임상시험 가이드라인 제정연구(II)’, ‘천연물신약⋅한약제제 임상시험가이드라인 연구’와 2006년에 수행된 ‘한약제제의 임상시험 평가지표개발에 관한 연구’, ‘천연물 항암제제 임상시험 평가지표 개발연구’였다. ‘천연물신약⋅한약제제 임상시험가이드라인 연구’와 ‘천연물 항암제제 임상시험 평가지표 개발연구’는 ‘천연물’이라는 용어가 법령에서 삭제된 현 상황에 부합하지 않는 면이 있지만, 한약제제와 평가지표 측면에서 잘 연구되어 있어 분석에 포함시켰다.
‘천연물신약⋅한약제제 임상시험가이드라인 연구’에서는 중국과 대만의 중약신약 임상시험에 대한 내용을 소개하면서 한약제제 임상시험 실시원칙(안)을 제시하였다. ‘천연물 항암제제 임상시험 평가 지표 개발 연구’에서는 평가지표 선정 시 활용할 수 있는 내용들이 많았는데, 일반적인 평가지표마련 시 고려해야 할 사항 외에도 천연물제제(한약)로서의 특징을 잘 드러낼 수 있는 평가 지표를 개발하고자 하였다. 이러한 의미로 한의변증진단표준을 제시하였고, 추후 임상적 검증이 필요함을 기술하였다. 또한 원발성 간암 임상시험의 변증 및 임상시험 평가지표에 대해 제시하였는데, 서의진단표준, 한의변증진단표준(간울기체증, 혈어증, 비허증, 습열증, 음허증), 원발성 간암의 평가지표 및 점수, 시험환자 선택원칙, 배제원칙, 임상시험 관측표준, 시험방법 요점, 치료기간 판정, 삶의 질 평가(EORTC QLQ-C30)에 대해 기술하였다. 구체적으로 보면, 선정기준과 같은 경우 ‘시험약이 항암성 제제일 경우 시험이전 1개월 전에 아직 항암화학요법치료를 받지 않은 병례를 선택한다’, ‘시험약이 화학과 방사보조약물에 속하는 것은 화학과 방사요법에 적응증인 병례를 선택한다’, ‘생존기간 3개월 이상인 병례를 예상하여 계산한다’ 등의 내용이 있었다. 또 평가지표로 안전성과 치료효과부분을 모두 제시하였다. 안전성 지표로는 일반성 체검항목, 혈액검사, 소변검사, 심장, 간기능, 신기능, 약물의 불량반응관측을 제시하였고, 치료효과 지표는 중요상관증상과 체증, 영상의학적 관측, α-fetoprotein (AFP), 간기능 및 coenzyme, 흉부 X선, 심전도, 간동맥 조영 등을 제시하였다. 상술한 내용들은 추후 변증을 적용한 간암 임상시험 시 참고할 수 있겠다.
한편, ‘한약제제 임상시험 가이드라인 제정연구(II)’에서는 향후 임상시험가이드라인이 필요한 질환은 한약제제의 장점을 잘 살릴 수 있는 것으로 선정해야 한다고 역설하였다. 질환선정방법으로 제시한 것은 주요 사망원인별 통계, 건강보험 심사 평가 통계 등을 통하여 목표질병을 삼는 것이었다. 실례로, 각종 통계를 고찰하여 중풍, 종양(위암, 폐암, 간암, 대장암, 유방암, 자궁경부암), 당뇨, 고혈압, 요통 등을 1위군으로 설정하였다. 임상시험 시에는 목표질병을 설정함과 동시에 사용되는 한약제제의 주된 치료 목표를 명확히 해야 한다. 암 한의치료 수요는 표준치료와는 다른 면이 있는데, 일반적으로 삶의 질 개선, 각종 표준치료 부작용 증상 개선이 종양 크기의 감소, 생존기간 연장의 목적보다 더 부각된다. 표준치료의 부작용 증상 완화를 목적으로 하는 경우와 종양을 억제하는 목적으로 하는 경우는 시험대상자 선정에서부터 평가지표에 이르기까지 매우 달라지므로, 각 목적에 적합한 임상시험을 설계할 수 있도록 가이드라인에서 제시해주어야 한다. 또한 질병명, 진단기준, 임상시험대상자의 선정 및 제외기준, 관찰 및 예후지표, 치료효과 판정기준, 이상반응의 평가 기준 및 방법 등을 언급하였다. 눈여겨볼만한 것은 한의학적 관찰지표⋅평가항목 및 측정 부분에서 기술된 ‘기성 한의서 등 기존의 한의학 문헌에는 기재되어 있지 않으므로 한방의료기관에서의 축적된 임상정보와 논문 등 연구발표자료를 통해 그 증상들을 채집하고 한의학적으로 해석하여 지표로 활용할 수 있다’라는 내용이다. 이를 미루어 볼 때, 다양한 임상정보 및 논문 등의 근거수집이 필요하므로, 앞으로도 간암에 대한 증례보고, 관찰연구, 임상시험 등이 활발하게 이루어져야 하겠다. 그 외에 의학적 지표 부분에서 ‘임상증후의 치료효과판정지표’나 ‘일상생활능력의 변화에 대한 판정지표’ 등은 거의 한의학적인 지표와 일치할 것으로 여겨진다.’라는 내용이 있었다. 이는 행위상황 혹은 삶의 질과 관련된 내용으로 볼 수 있는데, ECOG 혹은 FACT-Hep과 같은 척도를 활용해보는 것으로 적용할 수 있겠다.
가이드라인 검색결과 눈에 띄는 점은 가이드라인의 대부분이 개별질환을 중심으로 하지 않고, 항암제에 초점을 맞춘 것이었다. 물론, 항암제에 대한 일반적인 사항들을 제시하기 위함이겠지만, 한약제제 가이드라인의 경우에는 개별 암종에 초점을 맞추는 것이 의미가 있다고 생각한다. 그 이유로는 오장육부의 개별 장기의 각각의 특성을 중시하는 한의학의 특징 때문인데, 실례로, 한의 임상에서는 암종별로 각각 관련된 한약재를 추가하여 사용한다. 두 번째 이유로는, 간암환자가 한의의료기관을 방문하는 이유가 양방의료기관을 찾는 이유와는 다르기 때문이다. 환자들은 주로 표준치료 이후 전이재발방지 혹은 표준치료의 부작용으로 나타나는 증상을 관리하며, 삶의 질을 향상시키기 위해 한의의료기관을 방문한다 62. 암에 따라 표준치료는 각기 다르고, 그에 따른 부작용도 달라질 수밖에 없다. 자연적으로 부작용으로 인해 나타나는 삶의 질 저하 양상도 다르다. 실례로, Functional Assessment of Chronic Illness Therapy(FACIT)에서 제공하는 삶의 질 평가 도구인 FACT에서는 암종별로 각기 다른 도구로 삶의 질을 평가하기를 권고하고 있다. 따라서 간암 환자가 호소하는 증상에 대한 한약제제 임상시험을 수행하기 위해서는 간암 특이적인 가이드라인이 필요하다. 또한 변증은 한의진단의 핵심도구로서 환자개인의 호소 증상을 종합적으로 살핀 후 치료를 결정하는 과정이다. 앞서 고찰한 기존 가이드라인과 같이 이러한 변증내용을 포함시킨다면, 암종별 가이드라인의 의미가 더 강화될 것이다. 이상으로, 기 개발된 가이드라인 내용을 참고하여 추후 가이드라인 제정 시 활용할 수 있겠다. 다음으로, 최근 10년 이내에 수행된 간암 한약제제 임상 시험을 검색 및 분석하여 도출된 내용을 기존 가이드라인에 비추어 고찰하고자 한다. 문헌 검색 결과, 최종 선정된 총 10편의 논문은 싱가폴, 일본, 중국에서 수행된 임상시험이었고, 중국에서 출판된 것이 8편으로 가장 많았다. 최근 10년 내 한국에서 수행된 간암에 대한 한약제제 임상시험은 존재하지 않았다.
임상시험 설계면에서 보면, 모두 무작위배정 대조군 임상시험으로, 그 중 이중 맹검을 시행한 논문은 3편이었고, 위약을 사용한 연구는 총 6편이었다. ‘한약제제 임상시험 가이드라인 제정연구(II)’에서는 임상시험 설계에 대해 ‘이중 맹검 시험을 기본원칙으로 한다. 단, 시험여건이 되지 않을 경우에는 단일 맹검의 진행이 가능하나 이 경우에는 단일 맹검을 시행할 수밖에 없었던 이유를 임상시험 Protocol에 명시해야만 한다. 대조군과 시험군 사이에는 시험약물의 투여여부를 제외하고는 양자의 구조적인 차이가 존재해서는 안 된다.’는 실시원칙을 제시하고 있다. 이는 추후 간암 한약제제 임상시험 설계 및 가이드라인 제정 시에도 고려해야 할 사항이다.
임상시험대상자(P), 중재군(I), 대조군(C), 결과(O)는 근거중심의학을 실행하기 위한 구체적이고 답변 가능한 임상질문의 핵심적 요소이므로, 본 연구에서 선정된 문헌을 P, I, C, O 항목별로 분석하고, 기존 가이드라인과 비교하여 추후 제정될 가이드라인에 반영할 점을 살펴보고자 한다.
먼저 시험대상자를 살펴보면, 10편 연구의 시험대상자들은 40대에서 60대였으며, 모두 원발성 간암이었고, 전이성 간암환자를 같이 포함시킨 연구도 있었다. 원발성 간암 중에서 간세포암을 명시한 논문은 5편이었다. 간암으로 인해 수술기 주위 기간의 환자들을 대상으로 한 문헌이 3편이었고, TACE 시술 전후 혹은 TACE와 동시에 처방 개입을 한 문헌이 5편이었다. 수술여부에 대한 언급이 없는 문헌도 2편 있었다. 간절제술은 간세포암종 환자에게서 가장 우선으로 고려해야 할 치료법으로, 일반적으로 간경변증이 없거나 간경변증이 있는 경우에도 잔존 간기능이 충분하다면 시행한다 63. 따라서 수술을 받거나 받을 예정인 간암환자의 비율이 높다고 볼 수 있으며, 실제 임상에서 간암 수술 전후 관리를 위해 내원하는 환자가 많으므로 관련된 임상시험을 수행하려면 수술여부 및 그 기준을 명확히 기입하는 것이 필요하다. 한편, TACE는 간 내에 다발성 종양이 있거나, 문맥 내 침습이 존재하거나, 간기능이 저하된 상태로 인해 간절제술이 시행이 어려운 경우 차선책으로 고려되는 치료법이다 64. 그러나 이 TACE 시술 후 60-80%의 환자에서는 오심, 구토, 발열, 복통, AST, ALT, GGT 상승 등의 증상이 나타나는 색전 후 증후군(postembolization syndrome)이 나타난다 65. 선정된 논문 중 3편도 색전 후 증후군에 대한 한약치료 방법을 모색한 임상시험이었다. 설계는 TACE를 시작하기 1주일 전, 3일 전 혹은 시작하는 날부터 3일간 한약을 복용하는 설계였다. 이는 나타날 부작용 발생을 예방하는 의미가 있다. 이러한 설계는 치미병(治未病)을 강조하는 한의학의 원리와 일치하며, 이 과정에서 한약제제가 도움을 줄 수 있다면 실제 환자들의 수요에 부합하는 것이라 할 수 있겠다. 간세포암종의 간문맥침범은 우리나라 초진환자의 약 30%를 차지할 정도로 흔한 경우이므로 TACE 치료를 받는 경우가 많다 66. 그러므로 국내에서도 한약제제 임상시험을 통해 TACE의 부작용을 감소시키는데 도움이 되는 방안을 마련해야 하겠다. 시험대상자의 질병명은 ‘한약제제 임상시험 가이드라인연구(II)’에서 제시했듯 ICD-10(WHO)으로 정하며, 부수적으로 ICD-10 질병명과 연관되는 한의학병명을 목표질병으로 설정하게끔 해야 한다. 간암은 ICD-10에서 C22(Malignant neoplasm of liver and intrahepatic bile ducts)해서 해당되는 분류를 사용할 수 있으며, 제자리신생물의 경우에는 D01.5(Liver, gallbladder and bile ducts)에서 해당되는 분류를 적용할 수 있겠다. 한편, 한의학에서는 간암이라는 용어가 직접적으로 기술된 바는 없으나, 증상 및 예후가 유사한 것으로 “肝積”, “癥瘕”, “積聚” “肥氣”, “岩”, “黃疸”, “鼓脹”, “脇痛”, “腹痛”, “膽脹”, “痞滿”, “痞氣” 등을 참고할 수 있겠다 67. 기입할 수 있는 한방 질병명으로는 U64-U65 (간병증) 중 관련 증상을 나타내는 것을 고려해볼 수 있을 것이다. 시험대상자의 병기는 1-3기를 대상으로 한 연구 1편, 2기 혹은 3기를 대상으로 한 연구가 1편, A또는 B stage 환자를 대상으로 한 연구가 1편이었다. 병기 진단 근거를 제시한 문헌은 2편으로, 그 기준은 Union for Cancer Control(UICC)와 Barcelona Clinic Liver Cancer(BCLC) System 이었다. 그 외 문헌에서는 병기에 대한 언급을 찾아볼 수 없었다. 병기를 판정하는 것은 환자의 예후 및 치료방법을 결정하기 위해 필수불가결하며, 그 가치는 이미 여러 연구에 의해 입증된 바 있다 68. 이렇게 예후를 판단하는데 중요한 역할을 하게 되므로, 평가지표의 결과를 판단할 때 병기를 꼭 참고해야 한다. 따라서 가이드라인 제정 시 대한간암학회에서 권고하고 한의임상 가이드라인 초안에서도 언급한 modified UICC 따라 병기를 명확히 기술하도록 지침을 제시해야 하겠다 8. 또한, 간기능을 평가하기 위한 Child-Pugh Class를 선정기준으로 포함시킨 연구들도 있었다. 간암은 다른 암과 달리 Tumor-Node -Metastasis 병기 외에도 간기능을 고려하여 치료방침을 결정하는데, 그 이유는 암의 병기가 낮아도 간 기능이 나쁘면 치료에 많은 제약이 있기 때문이다. 현재 국내에서 간 기능 평가 방법으로 가장 흔히 사용하는 방법은 Child-Pugh class이다 69. 이로 미루어 볼 때, 간기능 평가 항목 또한 가이드라인의 제안 사항에 포함시켜야 하겠다. 그 외 시험대상자 선정기준으로 Eastern Cooperative Oncology Group performance status가 사용된 논문이 3편, Karnofsky Performance Status가 사용된 논문이 2편이 있었는데, 이들은 행동 및 수행능력을 측정하는 것으로 삶의 질과도 관련이 있는 지표이다. 삶의 질은 암 임상시험에서 중요한 평가항목이며 70, 한의 암 진료 및 연구에서 주목 받는 지표이기도 하다 71. 이들을 선정기준과 평가지표로 활용하는 것을 지침에 제시하도록 해야 하겠다. 한편, 동의서에 자발적으로 서명한 자를 선정기준에 포함시킨 논문은 4편이었다. 임상시험은 아직 유효성과 안전성이 검증되지 않은 약을 사용하는 것이므로, 이에 참여 시 인간의 존엄성과 선택을 위한 자기결정권이 존중되어야 한다. 약사법 제34조 3항에서는 연구자가 임상시험의 내용과 시험 중 대상자 건강에 발생할 수 있는 피해에 대한 보상내용, 절차 등을 설명해야 하고 동의를 받아야 함을 규정하고 있다. 또 의약품임상시험관리기준 제2호 호목에서는 ‘대상자 동의(informed consent)’에 대해 규정하고 있는데, 대상자는 참여유무 결정 전에 시험대상자설명서를 통해 모든 관련된 정보를 제공 받고, 문서를 통해 본인이 자발적으로 임상시험에 참여함을 확인해야 한다고 하였다 72. 이와 같은 중요성에도 불구하고, 동의에 대한 내용을 선정기준에 언급한 문헌은 4편뿐이었으므로 가이드라인 제정 시에는 동의를 포함한 시험대상자의 권리 존중에 대한 부분이 반드시 명시되어야 한다. 제외기준으로는 다음과 같은 항목이 제시되었다. ▲ 시험에 참여하지 않으려는 자, ▲ 전이된 경우를, ▲ 정신질환, ▲ 연구에 영향을 줄 수 있는 약물처치를 받는 자, ▲ 다른 종양이 또는 심각한 심혈관질환이나 감염이 있는 자, ▲ 임산부 혹인 수유기 여성, ▲ 시험약에 알레르기 반응이 있는 자, ▲ 병변이 전체 간의 70%이상인자, ▲ 암성 혈전이 간문맥을 막고 있는 자, ▲ 조절 되지 않는 부종이 있는 자. 이러한 내용을 참고로 하여, 임상시험 결과에 영향을 줄 수 있는 질환 및 간암과 유사한 증상을 발생시키는 기타 질환은 제외하여야 한다.
중재군은 표준치료와 한약제제를 병행한 연구도 있었지만, 한약제제를 단독으로 투여한 경우도 많았다. 표준치료와의 병행 여부는 임상시험의 목적에 따라 명확히 정해야 한다. 중재약으로 사용된 한약제제로는 대건중탕, 운지버섯, 쌍백산, 건비익신탕, 건비화어탕, Ganji Decoction(肝积方)와 Ailitong (癌理通), Ginsenoside 캡술, cinobufacini(섬수의 주성분)와 Jiedu granule(해독과립, 묘인삼과립+석견천 과립+산자고 과립+계내금 과립, 3:3:1:1), Huaier granule(괴이버섯 추출물), Jinlong Capsule이 있었다. 탕제, 외용제, 캡슐, 정맥주사 등 그 제형이 다양했고, 대부분 성분과 용량이 잘 기술되어 있었다. 임상시험에 사용되는 한약제제의 성분 및 그 용량은 반드시 명시되어야 하며, 가능한 한 제조방법과 제조사까지 자세히 기술해야 한다. 한편, 변증에 따라 처방된 한약이 사용된 연구는 없었지만 실제 임상에서는 진료 및 처방 시 변증이라는 과정이 수반된다. 그러므로 이러한 상황을 반영하려면 변증에 따른 한약을 사용하는 경우와 같은 실용적 설계(pragmatic design)를 위한 지침도 마련해야 한다. 또한 변증과정을 임상시험 내에 삽입하려고 한다면, 변증도구 확립에서부터 연구자를 대상으로 한 변증도구 교육, 그리고 연구자간의 변증 진단 일치도 제고가 선행되어야겠다. 투약기간의 경우 3일에서부터 1년까지 다양했는데, 장기 복용의 경우에는 안전성을 반드시 평가해야 하며, 투약기간은 효과가 충분히 발휘되면서도 안전성이 보장될 수 있도록 설정해야 한다.
대조군을 살펴보면, 위약을 사용한 연구는 총 6편이었고, 항암화학요법, Dexamethasone을 사용한 연구도 있었다. 위약의 구성이나 제조과정에 대한 설명이 없는 연구도 있었는데, 명확히 기술해주는 것이 필요하다. 또한 임상시험 시 표준치료를 받으면 치료가 될 수 있는 환자가 위약 대조군에 배정됨으로 인해 그 기회가 박탈되는 것은 윤리적 문제를 야기할 수 있다. 따라서, 상술한 바와 같이 참여에 대한 동의 취득이 필요하고, 임상시험에 대한 상세한 설명이 필요할 것이다. 가이드라인 제정 시에도 이런 부분에 대한 명확한 지침을 제시해주어야 한다.
유효성 평가지표로는 종양반응, 삶의 질, 혈액학적 검사, 증상, 생존기간, 생존율, 위장관 기능,혈청 osteopontin 수준 등이 사용되었다. 종양반응은 2편에서 평가되었는데 그 기준으로는 RECIST와 WHO의 short-term therapeutic effect of solid tumor가 사용되었다. RECIST는 종양반응평가 시 계측과정을 단순화시킨 것으로, 의미 있는 비교를 가능하게 하는 기준이라고 보고되었다 73. 따라서 종양반응 평가지표로는 RECIST를 적용하도록 제안하는 것이 좋겠다. 삶의 질은 5편의 연구에서 평가되었다. 상술한 바와 같이, 삶의 질은 최근 암 치료 및 연구에 있어 화두가 되고 있다. 실제로, 한의의료기관에 내원하는 환자들은 종양크기의 축소 혹은 생존기간 증가를 위해서 내원한다기보다는 생존기간 동안 삶의 질을 높이기 위해 내원하는 환자들이 많으므로, 삶의 질은 현실을 잘 반영하는 지표로서 활용할 수 있다. 이를 고려할 때, FACT-Hep과 같은 간암 특이적인 삶의 질 평가도구를 포함시키는 것이 권고된다. 한편, 다양한 혈액학적 검사가 시행되었는데, 간기능 혈액검사와 CRP 등이었다. 타 암종 임상시험에서는 간기능 혈액검사가 안전성 지표로 많이 활용되는데, 간암의 경우는 그 특성상 유효성 지표로 활용된다. 이러한 특수성을 지침에도 제시해야 하겠다. 생존기간으로는 PFS, OS, DFS, RFS 등이 사용되었다. 장기 추적관찰 실행 가능성과 같은 현실적인 면도 고려하여 본 지표들을 적용해 볼 수 있겠다. 그 외에 혈소판 감소증, 통증, 오심, 구토, 출혈, 변비 등의 증상을 점수로 평가한 것도 있었다. 안전성은 7개 중 3편의 연구에서만 평가되었다. 이상반응 평가는 NCI-CTCAE를 기준으로 삼은 것 1편, WHO의 standard for grading toxic-side effects of commonly used anti-tumor drugs를 사용한 것 1편이었다. 안전성은 대상자의 안전과 권익 보호를 위해 필수적으로 평가해야 한다 74. 이상반응 평가뿐만 아니라, 혈액검사, 심전도와 같은 진단검사 방법도 활용하여 자료를 확보해야 하겠다. 이상반응 평가 시에는 국제적인 통용기준을 사용하도록 권고해야 한다. 연구자는 이상반응에 대해 추적관찰하며, 필요 시 유관기관에 신속히 보고할 의무가 있으므로, 이를 가이드라인에 제시해 주는 것이 필요하다. 이상의 고찰을 통해 예상할 수 있는 가이드라인의 주요 구성으로는 (1) 간암의 증상, 진단, 역학, 치료 부분을 개괄적으로 설명한 일반적 사항, (2) 임상시험 설계, (3) 시험 대상자 선정 및 제외 기준, (4) 시험약과 대조약에 대한 사항, (5) 유효성 평가 방법, (6) 유효성 평가 기준, (7) 안전성 평가, (8) 간암 치료에서의 병용요법, (9) 변증 등의 한의학적 고려 사항으로 구성될 수 있겠다.
본 연구의 의의는 다음과 같다. 첫째, 국내의 기존 간암관련 진료가이드라인 및 한약제제 임상시험가이드라인을 분석하여 임상시험에 적용할 점을 고찰하고, 더 나아가 기존 무작위배정대조군 임상시험과도 비교하여 고찰한 첫 번째 연구이다. 둘째, 간암 진료 경험이 있는 임상 한의사와 임상시험 수행 경험이 있는 연구자, 가이드라인 제작 경험이 있는 전문가들의 논의를 거친 과정과 그 결과가 반영된 연구이다. 전문가들이 논의하여 진행한 도출한 본 연구와 같은 사전 분석 작업은 반드시 필요한데, 그 이유는 간암 한약제제 임상시험 설계와 수행 시 암이라는 질환과 한약제제라는 중재군의 특수성을 모두 고려해야 하는 어려움 때문이다. 추후 간암 한약제제 임상시험 가이드라인 제정을 위해서는 상술한 기존 가이드라인을 토대로 하여 한의학의 특수성과 최신 지견을 반영하는 것이 필요하다. 본 연구 결과를 근거로 하여, 안전성, 유효성과 더불어 윤리성까지 확보한 간암 한약제제 임상시험 가이드라인이 제정되어야 한다. 더불어, 그 가이드라인을 기준으로 하여 활발한 임상시험이 수행되어야 할 것이다.
참고문헌
1. Lee HS, Lee JH, Seo KS, Lim HY. In : Park JG, Bang YJ, Ha SH, editors. Oncology 2012. Revised edition. Seoul: Iljogak: p. 339.
3. Wallace MC, Preen D, Jeffery GP, Adams LA. The evolving epidemiology of hepatocellular carcinoma:a global perspective. Expert Rev Gastroenterol Hepatol 2015:Jun;9(6):765–79.   4. National Center Information Cancer [Internet] Goyang-si, Republic of Korea: Ministry of Health and Welfare: [cited 2019 Feb 28]. Available from: https://www.cancer.go.kr. 6. Park JW. National project for Early screening of Liver cancer. Clin Mol Hepatol 2002:8(3):16–9.
8. Committee of Korean Clinical Practice Guideline for Hepatocellular carcinoma. Practice Guidelines for Management of Hepatocellular Carcinoma 2018. Seoul: The Korean Liver Cancer Association and National Cancer Center, Korea:
9. Minagawa M, Makuuchi M, Takayama T, Kokudo N. Selection criteria for repeat hepatectomy in patients with recurrent hepatocellular carcinoma. Ann Surg 2003:238(5):703–10.    10. Park JW, Chen M, Colombo M, Roberts LR, Schwartz M, Chen PJ, et al. Global patterns of hepatocellular carcinoma management from diagnosis to death:the BRIDGE Study. Liver Int 2015:35(9):2155–66.    11. Yoo SH, Bae SH. Complications Associated with Transcatheter Arterial Chemoembolization in Patients with Hepatocellular Carcinoma. Korean J of liver cancer study group 2011:11(2):144–8.
12. Llovet JM, Di Bisceglie AM, Bruix J, Kramer BS, Lencioni R, Zhu AX, et al. Design and endpoints of clinical trials in hepatocellular carcinoma. J Natl Cancer Inst 2008:100(10):698–711.    13. Thomas MB. Systemic therapy for hepatocellular carcinoma. Cancer Journal 2008:14(2):123–7.  14. Llovet JM, Ricci S, Mazzaferro V, Hilgard P, Gane E, Blanc JF, et al. Sorafenib in advanced hepatocellular carcinoma. N Engl J Med 2008:359(4):378–90.   15. Cheng AL, Kang YK, Chen Z, Tsao CJ, Qin S, Kim JS, et al. Efficacy and safety of sorafenib in patients in the Asia-Pacific region with advanced hepatocellular carcinoma:a phase III randomised, double-blind, placebo-controlled trial. Lancet Oncol 2009:10(1):25–34.   16. Cheng AL, Kang YK, Lin DY, Park JW, Kudo M, Qin S, et al. Sunitinib versus sorafenib in advanced hepatocellular cancer:results of a randomized phase III trial. J Clin Oncol 2013:31(32):4067–75.   17. Cainap C, Qin S, Huang WT, Chung IJ, Pan H, Cheng Y, et al. Linifanib versus Sorafenib in patients with advanced hepatocellular carcinoma:results of a randomized phase III trial. J Clin Oncol 2015:33(2):172–9.   18. Bruix J, Raoul JL, Sherman M, Mazzaferro V, Bolondi L, Craxi A, et al. Efficacy and safety of sorafenib in patients with advanced hepatocellular carcinoma:subanalyses of a phase III trial. J Hepatol 2012:57(4):821–9.   19. Raoul JL, Bruix J, Greten TF, Sherman M, Mazzaferro V, Hilgard P, et al. Relationship between baseline hepatic status and outcome, and effect of sorafenib on liver function:SHARP trial subanalyses. J Hepatol 2012:56(5):1080–8.   20. Llovet JM, Pe CE, Lathia CD, Shan M, Meinhardt G, Bruix J, et al. Plasma biomarkers as predictors of outcome in patients with advanced hepatocellular carcinoma. Clin Cancer Res 2012:18(8):2290–300.   21. Bruix J, Qin S, Merle P, Granito A, Huang YH, Bodoky G, et al. Regorafenib for patients with hepatocellular carcinoma who progressed on sorafenib treatment (RESORCE):a randomised, double blind, placebo-controlled, phase 3 trial. Lancet 2017:389(10064):56–66.   22. El-Khoueiry AB, Sangro B, Yau T, Crocenzi TS, Kudo M, Hsu C, et al. Nivolumab in patients with advanced hepatocellular carcinoma (CheckMate 040):an open-label, non-comparative, phase 1/2 dose escalation and expansion trial. Lancet 2017:389(10088):2492–502.   23. Kim BH, Park JW. Systemic Therapy for Advanced Hepatocellular Carcinoma:Targeted Therapy and Immunotherapy. J Liver Cancer 2018:18(1):17–22.  24. Michot JM, Bigenwald C, Champiat S, Collins M, Carbonnel F, Postel-Vinay S, et al. Immune- related adverse events with immune checkpoint blockade:a comprehensive review. Eur J Cancer 2016:Feb;54:139–48.   25. Bourke JM, O'Sullivan M, Khattak MA. Management of adverse events related to new cancer immunotherapy (immune checkpoint inhibitors). Med J Aust 2016:Nov 7; 205(9):418–24.   26. Wang S, Long S, Wu WY. Application of Traditional Chinese Medicines as personalized therapy in human cancers. Am J Chin Med 2018:46(5):953–70.   27. Han GJ, Seong S, Kim SS, Kim JS, Park JW. Analysis of Existing Guidelines and Randomized, Controlled, Clinical Trials for Development of [Guideline of Clinical Trial with Herbal Medicinal Product for gastric cancer]. J Korean Med 2017:38(3):124–42.   28. Ruan WJ, Lai MD, Zhou JG. Anticancer effects of Chinese herbal medicine, science or myth? J Zhejiang Univ Sci B 2006:7(12):1006–14.    29. Kim KS, Kim SH, Eo WK, Cheon SH, Eo SK, Jo HJ. Clinical research methodology for traditional Korean medicine treatment of lung cancer :Evidence based approach. J Oriental Medical Classics 2010:23(4):39–62.
30. Hong SH, Son HY. Clinical Practice Guidelines of Korean Medicine for Hepatocellular Carcinoma. J of Kor Traditional Oncology 2015:20(1):55–79.  31. Kim SH, Namgung MA, Chang YS, Jeong SK, Kim JS, Yoon SW, et al. Study on Development of Assessment Guideline and Endpoints for Clinical Trial with Antitumor Natural Products. J Physiol &Pathol Korean Med 2006:20(6):1678–727.
32. Ministry of Food and Drug Safety. Guideline for evaluation of clinical trial of anticancer drugs
33. National Institute of Food and Drug Safety Evaluation. Guidelines for clinical testing of anti-cancer drugs and non-clinical test data for approval of items 2010:11.
34. National Institute of Food and Drug Safety Evaluation. Guidelines for clinical trial of anti-cancer drugs 2015:12.
35. National Institute of Food and Drug Safety Evaluation. Guidelines for non-clinical trial of anti-cancer drugs 2015:12.
36. National Institute of Food and Drug Safety Evaluation. Guidelines for Exemption of Anticancer Drug Data in Bridging Study 2015:07.
37. Ministry of Food and Drug Safety. Guideline for the use of clinical trial medicines for therapeutic purposes 2018:04.
38. Kim CM. Recommendations for Early Screening of Liver Cancer 2001. Seoul: Korean Association for the Study of the Liver and National Cancer Center, Korea:
39. Korean Institution of Oriental Medicine. A study on the clinical trial guidelines of herbal medicinal drug Seoul: Ministry of Food and Drug Safety: 2005. p. 01.
40. Korean Institution of Oriental Medicine. A Study on the clinical trial guideline of herbal medical drug(II) Seoul: Ministry of Food and Drug Safety: 2005. p. 11.
41. Industry-Academia Collaboration Foundation, KyungHee University. Research on outcome indicators for clinical trials of herbal medicinal products 2006. Seoul: Ministry of Food and Drug Safety:
42. Ministry of Food and Drug Safety. General considerations in clinical trials of herbal medicine preparations 2007. Seoul: Ministry of Food and Drug Safety:
43. National Institute of Food and Drug Safety Evaluation. Quality guidelines of herbal medicine for clinical trial 2017:12.
44. Kokudo N, Hasegawa K, Akahane M, Igaki H, Izumi N, Ichida T, et al. Evidence-based Clinical Practice Guidelines for Hepatocellular Carcinoma:The Japan Society of Hepatology 2013 update (3rd JSH-HCC Guidelines). Hepatol Res 2015:45:123–7.  46. Lim HS. Malignant tumor Chinese medicine treatment guide 2014. Beijing: People's medical publishing house: p. 371–99.
47. Zhou J, Sun HC, Wang Z, Cong WM, Wang JH, Zeng MS, et al. Guidelines for Diagnosis and Treatment of Primary Liver Cancer in China. Liver Cancer 2018:7(3):235–60.   48. European Association for the Study of the Liver. EASL Clinical Practice Guidelines:Management of hepatocellular carcinoma. J of Hepatol 2018:69(1):182–236.
49. Verslype C, Rosmorduc O, Rougier P; ESMO Guidelines Working Group. Hepatocellular carcinoma:ESMO-ESDO Clinical Practice Guidelines for diagnosis, treatment and follow-up. Ann Oncol 2012:23(Suppl 7):vii41–vii48.    50. Heimbach JK, Kulik LM, Finn RS, Sirlin CB, Abecassis MM, Roberts LR, et al. AASLD Guidelines for the Treatment of Hepatocellular Carcinoma. Hepatology 2018:67(1):358–80.   51. Marrero JA, Ahn J, Rajender Reddy K; Americal College of Gastroenterology. ACG clinical guideline:the diagnosis and management of focal liver lesions. Am J Gastroenterol 2014:109(9):1328–47.    52. Chay WY, Tham CK, Toh HC, Lim HY, Tan CK, Lim C, et al. Coriolus versicolor (Yunzhi) Use as Therapy in Advanced Hepatocellular Carcinoma Patients with Poor Liver Function or Who Are Unfit for Standard Therapy. J Altern Complement Med 2017:23(8):648–52.   53. Ye X, Lu D, Chen X, Li S, Chen Y, Deng L. A Multicenter, Randomized, Double-Blind, Placebo-Controlled Trial of Shuangbai San for Treating Primary Liver Cancer Patients With Cancer Pain. J Pain Symptom Manage 2016:51(6):979–86.   54. Xu L, Wang S, Zhuang L, Lin J, Chen H, Zhu X, et al. Jian Pi Li Qi Decoction Alleviated Postembolization Syndrome Following Transcatheter Arterial Chemoembolization for Hepatocellular Carcinoma:A Randomized, Double-Blind, Placebo- Controlled Trial. Integr Cancer Ther 2016:15(3):349–57.   55. Zhong C, Li HD, Liu DY, Xu FB, Wu J, Lin XM, Guo RP. Clinical study of hepatectomy combined with Jianpi Huayu Therapy for hepatocellular carcinoma. Asian Pac J Cancer Prev 2014:15(4):5951–7.    56. Shimada M, Morine Y, Nagano H, Hatano E, Kaiho T, Miyazaki M, et al. Effect of TU-100, a traditional Japanese medicine, administered after hepatic resection in patients with liver cancer:a multi-center, phase III trial (JFMC40-1001). Int J Clin Oncol 2015:20(1):95–104.   57. Tian HQ, Li HL, Wang B, Liang GW, Huang XQ, Huang ZQ, Lang JM, Zhang YP, Chen XZ, Chen YS. Treatment of middle/late stage primary hepatic carcinoma by Chinese medicine comprehensive therapy:A prospective randomized controlled study. Chin J Integr Med 2010:16(2):102–8.   58. Yinglu F, Changquan L, Xiaofeng Z, Bai L, Dezeng Z, Zhe C. A new way:alleviating postembolization syndrome following transcatheter arterial chemoembolization. J Altern Complement Med 2009:15(2):175–81.   59. Zhai XF, Liu XL, Shen F, Fan J, Ling CQ. Traditional Herbal Medicine Prevents Postoperative Recurrence of Small Hepatocellular Carcinoma:A Randomized Controlled Study. Cancer 2018:124(10):2161–8.   60. Chen Q, Shu C, Laurence AD, Chen Y, Peng BG, Zhen ZJ, et al. Effect of Huaier granule on recurrence after curative resection of HCC:a multicenter, randomized clinical trial. Gut 2018:67(11):2006–16.   61. Wu GL, Zhang L, Li TY, Chen J, Yu GY, Li JP. Short-term Effect of Combined Therapy with Jinlong Capsule(金龙胶囊) and Transcatheter Arterial Chemoembolization on Patients with Primary Hepatic Carcinoma and Its Influence on Serum Osteopontin Expression. Chin J Integr Med 2010:16(2):109–13.   62. Jeong TY, Lee YW, Cho JG, Yoo HS. Analysis of Clinical Characteristics for 899 Cancer Patients Treated at an Oriental Hospital. Korean J Orient Int Med 2010:31(1):102–12.
63. Capussotti L, Muratore A, Massucco P, Ferrero A, Polastri R, Bouzari H. Major liver resections for hepatocellular carcinoma on cirrhosis:early and long-term outcomes. Liver Transpl 2004:10(2 Suppl 1):S64–8.   64. Lai EC, Fan ST, Lo CM, Chu KM, Liu CL, Wong J. Hepatic resection for hepatocellular carcinoma. An audit of 343 patients. Ann Surg 1995:221(3):291–8.    65. Yoo SH, Bae SH. Complications Associated with Transcatheter Arterial Chemoembolization in Patients with Hepatocellular Carcinoma. Korean J of liver cancer study group 2011:11(2):144–8.
66. Kwak HW, Park JW, Nam BH, Yu A, Woo SM, Kim TH, et al. Clinical outcomes of a cohort series of patients with hepatocellular carcinoma in a hepatitis B virus-endemic area. J Gastroenterol Hepatol 2014:29(4):820–9.    67. Yan JU, Yao SK. Syndrome Differentiation and Treatment of Primary Hepatocellular Carcinoma in Traditional Chinese Medicine. Chinese Journal of Integrated Traditional and Western Medicine 2010:20(3):189–91.
68. Brierley J, Gospodarowicz M, O'Sullivan B. The principles of cancer staging. Ecancermedicalscience 2016:10:ed61.    70. Montazeri A, Milroy R, Hole D, McEwen J, Gillis CR. How quality of life data contribute to our understanding of cancer patients'experiences?A study of patients with lung cancer. Quality of Life Research 2003:12(2):157–66.    71. Cho JH, Son CG, Lee YW, Yoo HS, Seong JH, Kim SY. Current Status of Studies on Cancer-Related Quality of Life Instruments. Korean J Orient Int Med 2006:27(1):84–91.   72. Choi IS, Yong CS, Lee IH. Readability of Patient Information Leaflets in Clinical Trials. Korean J Clin Pharm 2016:26(1):33–9.   73. Caillet P, Canoui-Poitrine F, Vouriot J, Berle M, Reinald N, Krypciak S, et al. Comprehensive geriatric assessment in the decision-making process in elderly patients with cancer. ELCAPA study. J Clin Oncol 2011:29(27):3636–42.   74. Ministry of Food and Drug Safety. Evaluation of the safety information of the client requesting pharmaceutical clinical trials and considerations for reporting 2017:8.
|
|












