I. 서 론
인간을 비롯한 포유동물은 노화가 진행됨에 따라 호르몬 분비 조절능이 변화하여 다양한 신체적 활성 변화가 나타난다. 당뇨병, 골다공증, 고혈압과 고지혈증, 관절염, 비만 등으로 대표되는 노인성 질환은 호르몬 균형을 유지시키는 경우 상당한 수준으로 회복될 수 있다. 그러나, 대부분의 노인성 질환은 만성적으로 진행되기 때문에 꾸준한 관심이 부족하고, 호르몬 요법 같이 사용에 제한점이 있는 경우 적절한 치료가 이루어지기 어렵다1.
뼈가 약해지는 골다공증은 갑상선 결절이나 전립선 비대증과 마찬가지로 나이가 증가함에 따라 유병률이 높아지는 대표적인 노인성 질환으로, 노인 사망의 주요한 원인이 되는 골절을 유발하는 요인으로 알려져 있다2. 골의 약화는 사람과 동물에서 공통적으로 보행과 운동 능력의 상실을 가져오며, 이차적으로 또 다른 노인성 질환을 발생시키거나 악화시키는 작용을 통해 수명을 단축시킨다. 따라서, 노년기의 건강을 유지하기 위해서는 뼈를 강화하여 골 관련 질환을 예방하거나 치료하는 것이 필수적이다.
포유동물에서 뼈의 건강은 골 조직을 생성하는 조골세포와 골 조직을 파괴하는 파골세포가 뼈에서의 칼슘대사 과정을 조절하여 유지된다. 건강한 뼈는 두 과정이 균형을 이루어 골 조직이 유지되고 있지만, 파골세포의 기능이 조골세포 기능보다 우세하게 나타나면 골 손실을 수반하는 골다공증이 유발된다3. 따라서, 골 조직을 건강한 상태로 유지하기 위해서는 파골세포의 분화를 비롯하여 분화된 파골세포의 기능을 억제하는 과정이 필요하다.
파골세포의 분화는 조골세포 기능이 활성화될 때 분비되는 Receptor activator of NFkappaB Ligand(RANKL)라는 사이토카인이 파골전구세포에 존재하는 RANK와 복합체를 형성하면서 시작된다4. TNF receptor associated factors(TRAF)의 활성화를 통해 extracellular signal-regulated kinase (ERK), c-Jun N-terminal kinase(JNK)와 p38 등에 신호가 전달되고, PU-1, Fra-1, nuclear factor of activated T cell cytoplasmic 1(NFATc1)이나 nuclear factor-kappa B(NF-kB) 등과 같은 전사조절인자에 전달된 신호가 파골세포분화 과정을 조절한다5. 이러한 분화 과정을 포함하여 dendritic cell-specific transmembrane protein(DC-STAMP), osteoclast-stimulatory transmembrane protein (OC-STAMP) 등의 작용으로 파골세포의 성숙, 이동, 융합 및 apoptosis 억제 기전을 통하여 세포의 생존능이 증가한다6. 이러한 일련의 작용을 통하여 분화된 파골세포는 골흡수 단백질인 TRAP, cathepsin K, MMP-9 등의 생합성을 발현시켜 골 흡수 기능을 나타낸다7. 또한, 골 흡수로 인한 골 조직 손상은 염증관련 인자의 활성화를 통한 파골세포 기능 활성화와 관련성이 관련이 있을 것으로 보고되었다8. 따라서, 파골세포 분화 및 기능 억제를 통한 골 흡수 억제와 골 강화에 많은 연구들이 진행되어 왔다.
본 연구자들은 뼈를 강화하여 노화로 인해 감소한 활력을 증진시키기 위하여 파골세포 기능을 억제하여 골을 강화시키는 한약재를 개발하고자 하였다. 식용개구리 등을 포함한 새로운 처방을 구성하여 한수대보원이라 명명하였으며, 이를 이용한 파골세포 형성 및 골 흡수에 미치는 영향을 평가하고자 하였다. 이를 위해 동물 모델에서 LPS 처리로 인한 골 손실에 미치는 영향과 인공 골조직에 파골세포를 첨가하여 나타나는 골 흡수에 미치는 영향을 측정하였다. 또한, RANKL 로 자극한 RAW264.7 cell에서 TRAP(+) 형성능을 측정하고, 파골세포 분화와 관련된 유전자인 cathepsin K, tartrate-resistant acid phosphatase(TRAP), matrix metalloprotease-9(MMP-9), NFATc1 등의 유전자 발현에 미치는 영향을 규명하였다.
II. 방 법
1. 재 료
1) 한약재 추출 및 검액 제조
한약재는 나눔제약(서울, 한국)에서 구입하여 분말로 만들어 플라스크에 넣은 후, 약 30배의 증류수를 가하고 6시간 이상 가열하면서 환류 추출하였다. 여과지를 사용하여 여과한 여액을 evaporator (EYELA, Japan)를 이용하여 감압 농축하고, 농축액을 동결 건조기를 이용하여 건조시켜 실험시 까지 냉동보관 하였다. 수율은 17.6%였다. 실험 시에는 추출물(이하 HDW라 함)을 세포 배양액에 녹인 후, pore size 0.45 μm의 여과지로 여과하여 사용하였다. 본 연구에 사용된 새로운 처방인 한수대보원의 한약재 구성은 Table 1에 표시하였다.
Table 1
Composition of HDW
2. 실험 방법
1) 동물 모델에서의 골 손실 평가
동물은 5주령의 ICR 마우스를 사육장 환경에 3일간 적응시킨 후 사용하였다. 실험 기간 동안 식이는 자유롭게 섭취하도록 하였다. 실험 동물은 정상군(N), 골다공증 대조군(LPS), 골다공증 유발 시료 투여군(HDW)으로 나누었다. 각군당 개체수는 3마리였다. 정상군과 골다공증 대조군에는 생리식염수를 투여하고, 시료 투여군에는 한수대보원 추출물(HDW)을 300 mg/kg 용량으로 하루 한번 경구 투여하였다. 투여 시작하고 4일, 7일째 날에 LPS(5 mg/kg)를 골다공증 대조군과 HDW 군에 9일간 복강 투여하였다. 10일째 되는 날 마우스를 희생시키고 대퇴부를 적출하였다. 분리한 대퇴부를 4% formaldehyde에 고정시키고 난 후, micro-CT (Bruker, Kartuizersweg 3B, 2550 Kontich, Belgium, Skyscan 1172)를 사용하여 이미지를 촬영하였다.
2) RAW 264.7 Cell 배양
DMEM(Dulbecco’s modified eagle medium)/10% FBS(Fetal bovine serum)/PC-SM 배지에 RAW 264.7 cell을 96 well plate에 5×103/well가 되도록 맞춘 후, CO2 세포 배양기를 이용하여 배양하였다. 24시간 동안 배양한 후 세포 배지를 제거한 다음, 다시 50 ng/ml RANKL, 10% FBS, 1 ng/ml TGFβ가 첨가된 α-MEM 배지로 바꾸어 세포 배양하였다. 배양액에는 농도별로 HDW가 함유되도록 유지하면서 배양하였다. 계속하여 동일한 배지인 α-MEM 용액을 이틀에 한 번씩 교환해 주면서 총 6일간 배양하였다.
3) 세포에 대한 약물처리
실험군은 RANKL이 함유되지 않은 배양군(Normal), RANKL이 함유된 배양군(Control), RANKL과 35μg/ml의 HDW 추출물이 함유된 배양군(HDW 35), RANKL과 75 μg/ml의 HDW 추출물이 함유된 배양군(HDW 75), RANKL과 150 μg/ml의 HDW 추출물이 함유된 배양군(HDW 150)으로 나누어 실험하였다.
4) 파골세포 생성 측정
파골세포 분화는 RAW 264.7 cell에 RANKL을 처리하여 유도시켰으며, 분화한 파골세포에서 발현되는 분화 marker로 tartarate-resistant acid phosphatase (TRAP)를 염색하고 발색되는 TRAP-positive 다핵세포(TRAP(+) MNC)를 확인하여 평가하였다. 분화시킨 세포는 PBS(Phosphate buffered saline)로 2번 세척하였으며, 이후 3.7% formaldehyde- citrate-acetone 용액으로 10분 동안 고정시킨 다음, 다시 증류수를 이용하여 2번 세척하였다. 이 후에 2% TRAP fast garnet GBC base 용액과 NaNO3 용액을 각각 동일한 양을 넣어 만든 혼합용액을 고정시킨 세포에 처리한 다음, 다시 고정된 세포에 5% naphtha AS-BI phosphoric acid, 2% 주석산, 4% 초산이 포함된 용액을 처리하고 30분 동안 상온에 방치하였다. 파골세포 생성 여부는 광학현미경을 이용하여 계수하였으며, 3개 이상의 핵이 관찰된 다핵세포(TRAP(+) MNCs)를 파골세포로 분화한 것으로 판정하였다.
5) 파골세포 유전자 발현 측정
(1) Total RNA 분리
RNA 분리는 실험군 별로 배양세포의 배지를 완전히 제거한 plate를 4 ℃ PBS로 3번 세척한 세포를 시용하였다. 각 plate에서 세포를 떼어내어 모은 다음, 750×g에서 10분간 원심 분리하여 침전된 세포를 냉각된 PBS로 2번 더 세척하였다. 상층액을 버리고 침전된 세포에 lysis buffer를 가하고 흔들어 용해시킨 다음, 12,000×g에서 10분간 다시 원심 분리하고 상층액을 얻었다. 얻어진 용액을 1 M sucrose가 함유되도록 제조한 tris buffer 윗부분에 조심스럽게 loading한 다음, 36,000 rpm으로 160분 동안 원심분리기로 분리하였다. 침전물을 SDS buffer에 녹인 후, 37 ℃ 배양기에 30분간 incubation하였다. 여기에 Sod. Acetate buffer를 가하고 phenol/CsKl3 용액을 사용하여 추출하였다. 최종농도가 0.2 M이 되도록 NaCl를 첨가하여 만들고, EtOH를 가하여 -20 ℃ 냉장고에 12시간 방치하고 얻어진 침전물을 75% Ethanol 용액으로 2번 세척하고 건조시켰다. 유전자 발현 실험에 필요한 mRNA 양을 각 실험군 별로 동일하게 맞춘 후, 전기영동으로 확인하고 사용하였다.
(2) cDNA 제조
각각의 실험군으로 부터 분리한 total RNA액 10 μl(10 μg RNA 함유)에 oligo dT 1 μl(2 μg/μl)를 가한 후 조심하면서 혼합한 후, 90 ℃에서 5분간 가온하였다. Primer의 annealing을 위해 약 10분간 실온에서 방치한 후, 아래 시약을 가하는 동안에는 얼음 상에서 작업하였다. 5×cyscript buffer 4 μl, 0.1 M DTT 2 μl, dUTP nucleotide mix 1 μl, dUTP Cydye-labelled nucleotide 0.1 μl, Cyscript reverse transcriptase 1 μl, H2O 0.9 μl를 첨가하여 총 20 μl로 한 후, tipping 하는 방법으로 조심스럽게 혼합하였다. 이 후, 42 ℃에서 90분간 가온한 다음, 얼음 상에 다시 방치하였다. 여기에 2.5 M NaOH을 2 μl씩 가한 후 37 ℃로 15분 동안 유지시켰으며, 2 M 농도의 HEPES buffer 10 μl를 첨가하여 중화시켰다. 사용된 시약은 Amersham Bioscience에서 구매하였다.
(3) Real time PCR
각각의 optical tube(MicroAmp® Optical 96-Well Reaction Plate with Barcode and Optical Adhesive Films, Applied Biosystems, Cat.No. 4314320)에 3배의 SybrGreen Mix 2.5 μl(Sigma-Aldrich, Cat.No. S9430), (2)에서 만든 cDNA 1 μl, 10 pmol/μl primer pair mix 1 μl, 각각 2.5 mM의 dNTP 2 μl, 10×Tag polymerase buffer 2.5 μl, Tag Polymerase 0.3 μl와 14.7 μl H2O를 가했다. 이후 95 ℃에서 5분 1 cycle, 95 ℃에서 30초, 45 ℃에서 30초, 72 ℃에서 60초 40 cycles, 95 ℃에서 20분 1 cycle로 증폭시켰다. PCR 반응에 사용한 primer는 Table 2에 표시하였다. PCR을 수행한 후 증폭기에서 tube를 꺼내고, 반응액 5 μl를 사용하여 3% agarose gel 상에서 PCR specificity를 측정하였다. ABI PRISM® 7000 Sequence Detection System(Applied Biosystems, Cat.No. 4349157)를 사용하여 Real time PCR 결과를 분석하였다.
Table 2
Primer
6) Bone resorption Assay
파골세포로 분화하여 작용한 결과 나타나는 골 흡수에 미치는 영향을 평가하기 위하여, plate 상에 calcium-collagen을 코팅하여 제조한 인공 뼈 모델을 사용하여 측정하였다. collagen이 코팅된 plate를 phenol-red-free MEM 배지로 세척해 준 다음, 파골세포 전구세포가 1×103 cells/well이 되도록 분주하고 24시간 배양한 후, 100 ng/ml 농도의 RANKL로 처리하였다. 1시간 지난 후 HDW 추출물을 농도별로 가한 다음 10일 동안 배양하였다. 배지는 2일 간격으로 교체해 주었다. 배양을 마친 plate는 5% sodium hypochlorite를 이용하여 파골세포를 제거하고 증류수로 세척하였다. 건조한 다음 역상현미경으로 400배 확대하여 골 흡수로 인해 형성되는 pit를 관찰하였고 사진을 촬영하였다.
III. 결 과
1. 파골세포 분화와 TRAP(+) MNC 생성에 미치는 영향
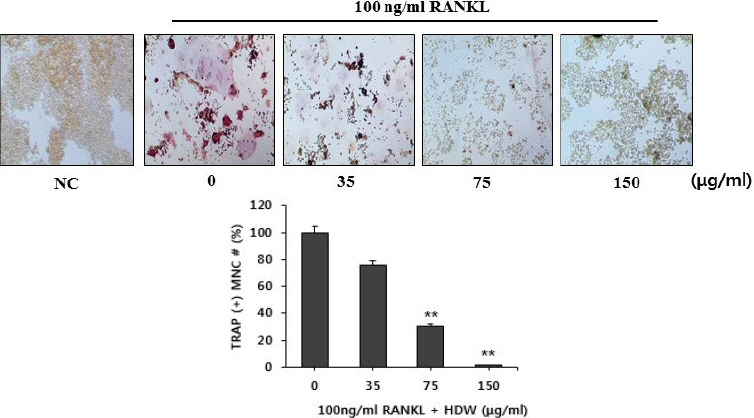
실험한 결과, RANKL을 처리하지 않은 정상군에서는 파골세포로의 분화가 거의 일어나지 않았으며, RANKL을 처리한 대조군은 TRAP(+) MNC의 형성 빈도가 정상군에 비해 현저한 증가가 관찰되어 파골세포로 분화 유도가 확인되었다. HDW는 35 μg/ml의 농도에서 대조군에 비해 TRAP(+) MNC가 감소(약 22.9%) 하였으나 유의성은 인정되지 않았으나, 75 μg/ml의 농도와 150 μg/ml의 농도에서는 RANKL 처리한 대조군의 TRAP(+) MNC 형성에 비해 유의성(p<0.001)있게 감소(약 64.6%, 98.2%) 하였다(Fig. 1).
Fig. 1
Effects of HDW on the formation of TRAP (+) MNCs in RANKL stimulated osteoclast.
NC : normal control
0 (control) : RANKL (100 ng/ml)
35 : RANKL (100 ng/ml)+35 μg/ml of HDW
75 : RANKL (100 ng/ml)+75 μg/ml of HDW
150 : RANKL (100 ng/ml)+150 μg/ml of HDW
Each bar represents Mean±SD of 5 tests.
** : p<0.05 vs control
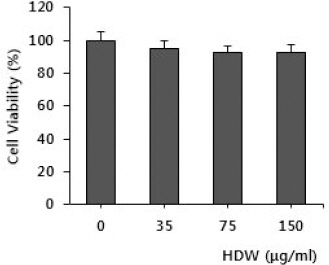
2. Cell viability에 미치는 영향
HDW를 RAW 564.7 세포에 전처리하여 7일간 배양한 결과, 실험한 농도인 150 μg/ml의 이하에서는 세포독성이 없었다(Fig. 2).
3. TRAP 유전자 발현에 미치는 영향
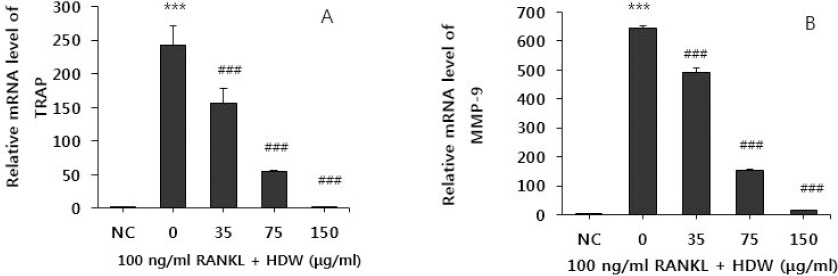
실험한 결과, RANKL을 처리되지 않은 정상군에서는 TRAP 발현이 거의 일어나지 않았으나, RANKL을 처리한 대조군은 파골세포 분화의 유력한 증거인 TRAP 발현이 정상군에 비해 현저히 증가되는 것이 관찰되었다. HDW를 처리한 경우 대조군에서 증가된 TRAP 발현을 35 μg/ml의 농도에서는 약 32.4%, 75 μg/ml의 농도에서는 약 76.1%. 150 μg/ml의 농도에서는 약 98.7% TRAP 발현을 억제하는 효과를 나타내었다(Fig. 3(A)).
Fig. 3
Effects of HDW on the expressions of TRAP (A) and MMP-9 (B) in RANKL stimulated osteoclast.
Normal : vehicle
0 (control) : RANKL (100 ng/ml)
35 : RANKL (100 ng/ml)+35 μg/ml of HDW
75 : RANKL (100 ng/ml)+75 μg/ml of HDW
150 : RANKL (100 ng/ml)+150 μg/ml of HDW
Each bar represents Mean±SD of 5 tests.
*** : p<0.001 vs NC
### : p<0.01 vs control
## : p<0.05 vs control
4. MMP-9 발현에 미치는 영향
실험한 결과, RANKL을 처리하지 않은 정상군에서는 MMP-9 발현이 거의 일어나지 않았으나, RANKL만을 처리한 대조군은 파골세포로 분화하는 과정에서 나타나는 MMP-9 발현이 정상군에 비해 현저히 증가하는 것이 관찰되었다. HDW를 처리한 경우, 대조군에서 증가된 MMP-9 발현을 35 μg/ml의 농도에서는 약 23.8%, 75 μg/ml의 농도에서는 약 75.8%. 150 μg/ml의 농도에서 약 97.06% 억제하는 것으로 나타났다(Fig. 3(B)).
5. NFATc1 발현에 미치는 영향
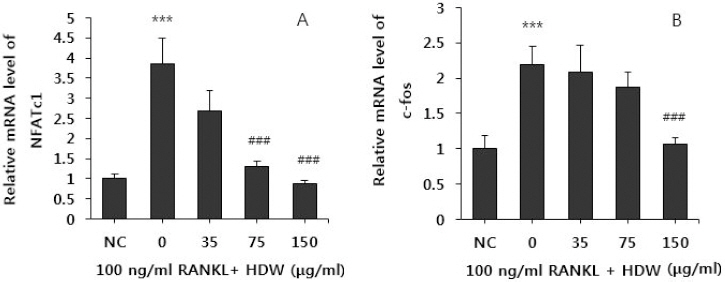
실험한 결과, RANKL을 처리하지 않은 정상군에서는 NFATc1 발현이 거의 일어나지 않았으나, RANKL 만을 처리한 대조군은 파골세포로 분화하는 과정에서 나타나는 NFATc1 발현이 정상군에 비해 현저히 증가하는 것이 관찰되었다. HDW 처리한 경우, 대조군에서 증가된 NFATc1 발현을 35 μg/ml의 농도에서 대조군에 비해 감소(약 27.1%) 시켰으나 유의성은 없었고, HDW 75 μg/ml의 농도에서는 약 67.6%, 150 μg/ml의 농도에서는 약 78.4% NFATc1 발현을 억제하는 효과를 나타내었다(Fig. 4(A)).
Fig. 4
Effects of HDW on the expressions of NFATc1 (A), c-Fos (B) in RANKL stimulated osteoclast.
Normal : vehicle
0 (control) : RANKL (100 ng/ml)
35 : RANKL (100 ng/ml)+35 μg/ml of HDW
75 : RANKL (100 ng/ml)+75 μg/ml of HDW
150 : RANKL (100 ng/ml)+150 μg/ml of HDW
Each bar represents Mean±SD of 5 tests.
*** : p<0.001 vs NC
### : p<0.01 vs control
6. c-Fos 발현에 미치는 영향
실험한 결과, RANKL을 처리하지 않은 정상군에서는 c-Fos 발현이 거의 일어나지 않았으나, RANKL만을 처리한 대조군은 파골세포로 분화시 나타나는 c-Fos 발현이 정상군에 비해 현저히 증가하는 것이 관찰되었다. HDW를 처리한 경우, 대조군에서 증가한 c-Fos 발현을 35 μg/ml, 75 μg/ml 농도에서 대조군에 비해 각각 9.7%, 21.8% 감소하였으나 유의성은 없었고, 150 μg/ml의 농도에서는 c-Fos 발현이 약 53.2% 억제되는 효과를 나타내었다(Fig. 4(B)).
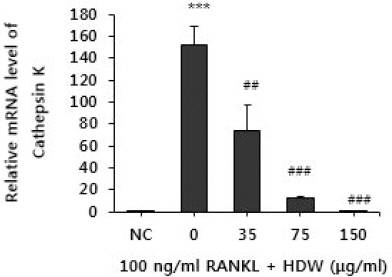
7. Cathepsin K 발현에 미치는 영향
실험한 결과, RANKL을 처리하지 않은 정상군은 Cathepsin K 발현이 거의 일어나지 않았으나, RANKL 만을 처리한 대조군은 파골세포로의 분화시 나타나는 Cathepsin K 발현이 정상군에 비해 현저히 증가하는 것이 관찰되었다. HDW를 처리한 경우, 대조군에서 증가한 Cathepsin K 발현을 35 μg/ml의 농도에서는 약 50.7%, 750 μg/ml의 농도에서는 약 92%, 150 μg/ml의 농도에서는 약 99.9% 억제 효과를 나타내었다(Fig. 5).
Fig. 5
Effects of HDW on the expressions of cathepsin K in RANKL stimulated osteoclast.
Normal : vehicle
0 (control) : RANKL (100 ng/ml)
35 : RANKL (100 ng/ml)+35 μg/ml of HDW
75 : RANKL (100 ng/ml)+75 μg/ml of HDW
150 : RANKL (100 ng/ml)+150 μg/ml of HDW
Each bar represents Mean±SD of 5 tests.
*** : p<0.001 vs NC
### : p<0.01 vs control
## : p<0.05 vs control
8. 뼈의 골흡수에 미치는 영향
실험한 결과, HDW는 75 μg/ml, 150 μg/ml 농도에서 파골세포를 얹은 인공 뼈에서의 pit 형성을 억제하여 골 흡수가 억제되는 것이 관찰되었다(Fig. 6).
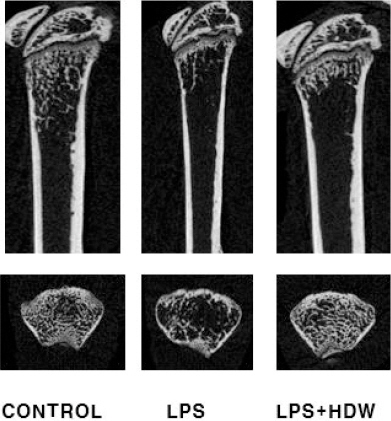
9. 마우스의 대퇴부 골 손실에 미치는 영향
실험한 결과, LPS(5 mg/kg)를 투여한 대조군은 정상군에 비해 심각한 골 손실이 유발되었으며, HDW를 300 mg/kg 투여한 처리군에서는 LPS로 유발된 대조군에 비해 골 손실 억제가 관찰되었다 (Fig. 7) 결과 그림은 약물 처리한 후 대퇴골을 적출한 다음 포르말린 처리한 후 microCT를 촬영하여 얻었다.
Fig. 7
Effect of HDW on LPS-induced bone loss in mammal model.
Mice received i.p injection of LPS or saline on day 4 and 7. HDW was orally administrated everyday for 9 days. The mice were killed 10 days after the first injection of HDW and femurs were collected. The femurs were imaged with a micro-CT machine.
IV. 고 찰
뼈가 약한 노인층에서 빈발하는 골절은 주요한 사망 원인으로 노화가 진행됨에 따라 증가하는 것으로 알려져 있다. 이러한 뼈의 약화는 체내 내분비 호르몬의 분비 조절 이상, 운동 부족, 영양분 섭취의 불균형, 약물의 부작용, 유전 인자의 결핍 등에 의해서 증가할 수 있다. 뼈가 약화하는 대표적 질환인 골다공증은 다양한 원인으로 뼈를 구성하는 기질물질이 빠르게 손상되는 현상으로, 뼈 안의 결체 조직을 파괴하는 파골세포의 기능이 이상적으로 활성화되어 뼈로부터 칼슘의 유리가 촉진되어 나타난 결과이다. 보통의 경우 파골세포 활성이 뼈를 강화하는 조골세포 보다 우세하면 골다공증 같이 뼈가 약화되는 증상이 나타난다3.
본 연구에 사용된 한수대보원(HDW)은 식용개구리를 비롯한 보혈 보기 효능이 있는 숙지황, 황기, 백출과 강근골의 효능이 있는 홍화자, 오가피, 두충, 독활, 보양 보신의 사상자, 토사자, 계지, 사인, 감초로 처방을 구성하였다. 식용개구리는 청열해독, 이수소종 작용뿐 아니라 자음보허하는 효능이 있어서 예로부터 한방 임상에서 허약체질, 성장부족 어린이에게 강근골 및 대보원기의 목적으로 사용되었다10.
본 연구는 한수대보원(HDW)의 RANKL 처리한 파골세포 전구세포로부터 파골세포로 분화 억제 효과를 확인하고, 분화와 관련된 인자들의 발현과 포유동물 모델에서 골 손실에 미치는 영향을 측정한 결과이다. 실험에서 RANKL을 RAW 564.7 세포에 전처리한 경우 tartrate-resistant acid phosphatase (TRAP) 양성인 다핵성 세포(TRAP(+) MNCs)가 생성되는 것이 확인되었다. RANKL 자극으로 분화하여 성숙한 파골세포에서 주로 생성되는 효소인 TRAP은 파골세포 분화 여부를 평가하는 유력한 기준 지표물질이 될 수 있다9. 실험 결과, 연구 대상 물질인 HDW는 RANKL에 의한 TRAP(+) MNCs 생성을 억제하여 파골세포 분화를 억제하는 것으로 나타났다(Fig. 1). TRAP은 acid phosphatase 5로 불리며 당화된 포유동물의 metalloprotein 효소로 phosphate ester를 bone matrix phosphoprotein인 osteopontin의 탈인산화 반응을 촉진시켜 파골세포를 골에 부착시켜 골 흡수를 촉진하는 것으로 알려져 있다10. 또한, 파골세포에서 생성되는 TRAP은 NADPH-oxidase의 작용으로 생성되는 superoxide (O2−)와 같은 reactive oxygen species(ROS) 생성에 관여하여 골기질 물질을 분해하고 골 흡수를 유발한다13. TRAP의 실질적인 발현과 생성 조절이 골 흡수 기능 활성화에 미치는 영향은 real time PCR을 이용하여 mRNA 유전자 생성에 미치는 영향을 측정하여 평가하였다. 실험 결과, RANKL은 파골세포에서 TRAP mRNA 유전자 발현을 증가시켰으며, HDW는 RANKL 자극으로 발현이 증가된 TRAP의 유전자 발현을 유의성(p<0.001) 있게 억제하는 것으로 나타나 HDW가 파골세포의 골 흡수 작용을 억제할 수 있음을 나타내었다(Fig. 3(A)). 이러한 HDW의 효과로 추정할 때, HDW는 파골세포 골 흡수에 관여하는 다른 인자들인 Cathepsin K, MMP-9 발현에도 영향을 줄 것으로 판단하였다. MMP-9은 type IV collagenase 또는 gelatinase B으로 알려진 효소로 주로 세포외 기질 물질의 분해를 담당한다14. 파골세포가 활성화되어 MMP-9 생성이 증가하면 골 기질 물질의 주성분인 콜라겐을 분해하여 칼슘이 유리되어 결과적으로 골 흡수를 유발한다. 실험한 결과, HDW는 TRAP과 같은 양상으로 Cathepsin K, MMP-9 발현을 억제하여 파골세포의 활성화와 골 흡수를 억제할 수 있을 것으로 추정되었다(Fig. 3(B), Fig. 5).
파골세포 활성 억제 작용은 실질적으로 MMP-9, OSCAR, TRAP, cathepsin K와 같이 파골세포 특이 단백질의 작용 억제를 통해서 나타난다15. 따라서, HDW는 파골세포 기능을 담당하는 단백질 생성을 억제하므로, 파골세포로 분화되는 과정에 작동되는 신호전달체계에 대한 영향과 파골세포 분화과정에 관여하는 전사인자들의 발현도 조절할 것으로 판단되었다. 이들의 발현을 조절하는 파골세포 분화 신호 전달 경로에서 중요한 역할을 하는 유전자 전사 인자로 NFATc1, c-fos, MITF 등이 작용한다11,16. 이 중 NFATc1는 RANKL이 세포막 수용체에 결합 후 활성화되는 TNF receptor associated factors(TRAF)를 거쳐 신호를 전달받은 c-Fos에 의해 활성화되는 경로와 Calmodulin activated kinases (CaMKs) 경로의 신호전달과정을 거쳐 활성화 되는데, NFATc1이 결핍되는 경우 RANKL 유도한 파골세포 생성 과정에서 파골 세포 분화가 유도되지 못한다17. 따라서, 파골세포 분화에 가장 필수적인 만능 조절자로 알려져 있다. 이러한 NFATc1 활성은 serine/threonine phosphatase calcineurin에 의해서도 조절되는데 핵내로 이동되기 위한 NFATc1의 탈인산화 효소 역할을 한다18. 핵내로 이동된 NFATc1는 파골세포 분화와 관련된 인자들의 발현을 조절하여 파골세포를 성숙시키며, 또한 파골세포 분화과정에서 “master fusion gene”이라 불리는 dendritic cell-specific transmembrane protein(DC-STAMP) 활성도 조절하여 파골세포를 성숙한 세포로 안정화시킨다14. 실험 결과, HDW는 NFATc1 유전자 발현을 억제하여(Fig. 4(A)) 파골세포 분화과정에 관여하는 신호전달 물질의 발현이 억제될 것으로 추측되었다. 이러한 결과는 Fig.1에서 나타난 결과와 밀접한 상관성이 있는 것으로 해석된다. 또한, HDW가 NFATc1에 의해 발현이 조절되는 MMP-9과 cathepsin K 발현을 억제하는 결과(Fig. 3(B), Fig. 5)를 나타냈으므로 신호전달 과정의 가장 핵심적인 인자인 NFATc1 발현이 억제될 것이라고 추정한 실험 결과와 부합된다. 이와 함께, NFATc1에 신호를 전달하는 c-fos의 발현도 RANKL 자극으로 파골세포에서 증가하였으며 HDW는 이를 억제하였다(Fig. 4(B)). 한편, 파골세포의 이동, 부착, 세포 융합 등에 관여하는 osteoclast-stimulatory transmembrane protein(OC-STAMP), dendritic cell-specific transmembrane protein(DC-STAMP), calcitonin receptor(CTR) 등의 발현도 NFATc1에 의해 조절되기 때문에12 HDW은 이러한 인자들의 발현도 조절할 것으로 판단되었다.
이상의 결과는 HDW가 골의 흡수를 억제할 뿐만 아니라 골 흡수 억제를 통한 골 손실 억제에도 효과가 있을 가능성을 강하게 나타내고 있다. 파골세포 기능 억제를 통한 골 흡수 억제 효과는 인공적으로 만든 골 절편에 분화하는 파골세포를 얹은 후 배양하는 pit formation assay 결과로 확인할 수 있다19. 사용되는 인공 뼈는 콜라겐과 칼슘으로 구성되어 있으며 파골세포의 작용으로 골 조직이 파괴되면 골 절편 상에 움푹 패인 pit가 형성되어 나타난다. 실험 결과, HDW는 골 절편에 골 흡수 결과 나타나는 흔적인 pit 형성을 억제하는 결과를 나타내었다(Fig. 6). 또한, LPS 투여로 유도한 마우스의 골 손실 모델을 이용하여 HDW 투여가 골 손실을 억제하는지 관찰하였다. 마우스로부터 적출한 대퇴골에 대한 micro-CT 촬영한 실험 결과, HDW는 골 손실이 유발된 동물의 대퇴골에서 골 손실을 억제하는 효과를 나타내었다(Fig. 7).
결론적으로, 한수대보원 추출물(HDW)은 RANKL 유도되는 파골세포의 분화와 골흡수 과정에 관여하는 다양한 인자의 유전자의 발현을 조절하여 골 흡수를 억제하고, 실험 동물에서 유발된 골 손실을 억제하는 것으로 나타났다. 본 연구 결과를 토대로 골다공증 치료제를 개발하기 위해서 인체를 대상으로 추가적인 임상연구를 수행할 필요성이 있는 것으로 사료된다.
V. 결 론
한수대보원추출물(HDW)이 동물 모델에서의 골손실을 억제를 통해 골 약화를 억제하는지 평가하기 위하여 파골세포에 의한 골흡수 억제와 파골세포 분화와 세포활성을 억제하는지를 측정하였다. 이를 위해, RANKL로 유도되는 파골세포 분화와 관련 유전자의 발현, 골의 pit 형성에 미치는 영향을 측정였다.
1. HDW는 LPS로 유도한 마우스 대퇴골의 골 손실을 억제하였다.
2. HDW는 RANKL 유도한 파골세포의 TRAP(+) MNCs 생성을 억제하였다.
3. HDW는 RANKL 유도 파골세포에서 TRAP, MMP-9, cathepsin K의 발현을 억제하였다.
4. HDW는 RANKL 유도 파골세포에서 NFATc1, c-Fos의 발현을 억제하였다.
5. HDW는 파골세포에 의한 뼈에서의 골 흡수를 억제하였다.
결론적으로, HDW는 RANKL로 유도되는 파골세포에서 분화를 조절하는 인자들의 발현을 조절하고, 파골세포의 골흡수 활성을 조절하는 유전자들의 발현 조절을 통하여 골흡수를 억제하고 LPS 로 유발되는 골 손실을 억제하는 것으로 나타났다. 따라서, 한수대보원이 골 손실 억제를 통해 골을 강화하는 효과가 있는 것으로 사료되었다.